维生素D对骨髓基质干细胞成骨分化的分子调控研究进展
张 尧,李晓莉,张 岩
(1.上海理工大学系统生物医学研究中心,上海 200093;2.上海中医药大学附属龙华医院,上海 200032)
维生素D对骨髓基质干细胞成骨分化的分子调控研究进展
张尧1,李晓莉1,张岩2
(1.上海理工大学系统生物医学研究中心,上海200093;2.上海中医药大学附属龙华医院,上海200032)
骨髓基质干细胞(MSCs)是骨髓基质的组成成分,在骨骼的发育和代谢平衡中起重要作用。该文总结并综述了维生素D及其活性形式1,25二羟基维生素D3[1,25(OH)2D3]通过Wnt信号通路、Wnt5a/ROR2轴、BMP/TGF-β/Samd信号通路、ROS/ERK信号通路对MSCs成骨分化的分子调控,阐明了维生素D对MSCs代谢调控的分子信号通路。
维生素D;1,25(OH)2D3;骨髓基质干细胞;分子调控;信号通路;成骨分化
1 引言
MSCs是一种易于扩增、具有分化为各种不同细胞潜能的干细胞,也是一种优良的种子细胞。它可分化为:脂肪细胞、成骨细胞、成软骨细胞、生肌细胞、甚至神经细胞等[1]。维生素D,目前认为它是一种前类固醇激素。作为激素分子的作用机制是[2]:1,25(OH)2D3从血清维生素D结合蛋白或其他转运蛋白中分离出来,进入细胞内,与维生素D受体(vitamin D receptor, VDR)结合后,通过基因调节的方式发挥防治骨质疏松症、儿童佝偻病、成人软骨症、关节痛等作用。作为体内MSCs分化的重要调节因子[3-5],本文综述了维生素D通过Wnt信号通路、Wnt5a/ROR2轴、BMP/TGF-β/Samd信号通路、ROS/ERK信号通路调控MSCs成骨分化的分子作用。
2 维生素D通过Wnt信号通路促进MSCs成骨分化
Wnt蛋白最早是由Nusse在1982年通过果蝇基因与小鼠的INT-1基因组合而来。Wnt蛋白家族富含L-半胱氨酸,在进化中高度保守[6-7]。目前已经知道细胞膜外Wnt蛋白共有19个成员,其中Wnt1、Wnt3a、Wnt4、Wnt7a、Wnt7b等参与Wnt/β-catenin信号途径,又称Wnt经典途径,这些蛋白与LRP/FZD结合而发挥协同作用,激活Wnt/β-catenin经典通路[8]。Wnt4、Wnt5a、Wnt5b、Wnt11等参与Wnt/Ca2+和Wnt/PCP通路,又称非经典Wnt途径,这些信号分子能与Frizzled结合而激活异源三聚体G-蛋白,提高细胞内钙水平和建立细胞极性、骨架重排等作用[9]。
2.1维生素D通过Wnt经典途径促进MSCs成骨分化临床与分子生物学研究资料已经证实VDR在维生素D生物学作用中具有极其重要的意义,活性维生素D主要是通过与VDR结合发挥其生物学作用[10]。在肾脏中,1,25(OH)2D3作为VDR的配体,激素-受体复合物对钙磷代谢产生影响,导致矿物质在骨中沉积和重塑。在骨组织中,1,25(OH)2D3通过Wnt经典途径促进MSCs成骨分化[11]。近年来,许多科学家利用VDR(-/-)小鼠来研究维生素D对MSCs分化的影响。有研究显示[12-14],1,25(OH)2D3与VDR结合后释放的因子使Wnt信号通路的抑制因子DKK1、SFRP2活性降低,Wnt受体LRP5表达量增高,同时MSCs分化为成骨细胞的能力恢复正常。另外,Cianferotti等[12]发现相比于野生型小鼠,VDR(-/-)小鼠MSCs分化为脂肪细胞的数量增加,抑制因子DKK1和SFRP2活性增加,LRP5表达量降低。DKKs、SFRPs可以阻碍Wnt蛋白与其受体LRP结合[15],运用基因工程的手段使编码DKK1的一个等位基因突变,另一个等位基因正常表达,进而使DKK1表达降低,低表达的DKK1增加了骨形成,然而在大鼠颅骨成骨细胞中的DKK1过表达会增加脂肪细胞的分化。因此1,25(OH)2D3可能通过降低DKK1和SFRP2的活性,上调LRP5来激活Wnt信号通路,促进MSCs的成骨分化。
2.2维生素D通过Wnt5a/ROR2轴促进MSCs成骨分化Wnt5a是Wnt家族成员之一。Wong等[16]根据Wnt家族成员对小鼠细胞C57MG转化能力的高低将Wnt分为2组,其中高转化能力组Wnt可激活β-catentin依赖性通路;弱或无转化功能的Wnt包括Wnt5a等,不依赖β-catentin介导的转录激活,Wnt5a和FZD2可调节细胞内Ca2+的浓度和流向,从而激活Ca2+依赖性的一些通路,在某些特定情况下,Wnt5a也可以激活经典信号通路,调节骨代谢[17]。有研究发现[18],1,25(OH)2D3可以干扰Wnt5a/ROR2轴,促进MSCs分化为成骨细胞。Wnt5a与不同的受体结合后,激活或抑制Wnt经典信号通路。Wnt5a与ROR2结合会通过非GSK3依赖途径阻碍β-catentin的表达,从而抑制Wnt通路,阻滞MSCs向成骨细胞分化[19]。Wnt5a激活经典途径还是非经典途径,不是由Wnt5a本身决定,而是在某种细胞的背景下,由相应受体的表达情况决定[20]。Tornero-Esteban等[21-22]通过对人的MSC细胞培养实验发现,1,25(OH)2D3可以与Wnt5a竞争性结合ROR2,迅速上调PKC,CaMKII活性。活化的PKC,CaMKII会激活Wnt5a与FZD4或FZD2、FZD5结合,产生活化因子,激活Wnt信号通路,促进MSCs向成骨细胞分化。
3 维生素D通过BMP/TGF-β/Samd信号通路促进MSCs成骨分化
TGF-β家族的受体有Ⅰ、Ⅱ型2种,为受体丝氨酸/苏氨酸激酶形成的异源二聚体。与之相对应的信号通路也有2种,一种称之为TGF-β信号通路,另一种称之为BMP信号通路。这两条信号通路的配体分别与细胞膜上的Ⅰ、Ⅱ型受体结合,然后再通过Samds向细胞核内传递信号[23-24]。其中I型受体又被称为激活素受体样激酶(activin receptor -like kinase, ALKs),包括了ALK1和ALK5等7个激活素受体样激酶,在Ⅱ型受体(TβRⅡ、BMPRⅡ等)下游发挥作用[25]。
3.1维生素D通过BMP/Samd信号通路促进MSCs分化为成骨细胞在MSCs成骨分化过程中,异三聚复合物P-Smad1/5/8-Smad4、Runx2、Osx[26-27]被认为是重要的调控因子。研究发现[28],在体外培养的SLE病人的MSC中加入维生素D类似物(EB1089)后,MSCs成骨分化能力增强。众所周知,Smad信号通路是介导TGF-β从细胞表面到细胞核的关键,而EB1089可以上调P-Smad1/5/8活性,引起P-Smad1/5/8-Smad4表达增强,P-Smad1/5/8-Smad4转位到细胞核与靶基因上的增强子序列结合,上调Runx2和Osx活性,进而促进MSC成骨分化。另有研究发现[29],体外诱导MSCs分化时,1,25(OH)2D3能明显上调MSC成骨分化的特异性标志物Ocn表达和ALP活性。Honda等[29]用TB、m4T5、m8T11等不同的混合培养液对小鼠骨髓的MSCs进行体外培养后发现,含有100 μg·L-1BMP-2的TB、12.5 μg·L-1BMP-2的m4T5和1,25(OH)2D3的m8T11均能上调Ocn与ALP活性,促进MSCs向成骨细胞分化。但当分别加入抑制剂Noggin(阻碍BMPs与受体的结合),Dorsomorphin(抑制BMP介导的Smad活性)对小鼠骨髓的MSCs进行培养后发现,在都含有Noggin的TB和m4T5中,MSCs向成骨细胞分化的程度降低,而在含有Noggin的m8T11中,Ocn、Runx2、Osx和ALP活性仍较高,MSCs向成骨细胞分化明显;在都含有Dorsomorphin的TB、m4T5和m8T11中,MSCs向成骨细胞分化的程度明显降低。因此1,25(OH)2D3可能会激活BMP-2或与BMP-2在BMP/Samd信号通路中有相似作用。
3.2维生素D通过TGF-β/Samd信号通路促进MSCs分化为成骨细胞组蛋白H3K9ac和H3K9me2也是MSCs成骨分化的重要调控因子。Tan等[30]运用全基因组表达启动子微阵列芯片技术发现,在人的髂骨骨髓MSCs成骨分化过程中,H3K9ac减少,H3K9me2增加。随后又对人的髂骨骨髓MSCs进行成骨诱导体外培养,通过基因芯片技术分析后发现,VDR在H3K9ac和H3K9me2影响MSCs成骨分化过程中起着反式抑制作用,1,25(OH)2D3与VDR结合可以促进蛋白的甲基化靶点(H3K9)的脱乙酰作用和二甲基化作用,脱乙酰基和二甲基化的H3K9,下调H3K9ac,上调H3K9me2,进而下调TGF-β信号通路THBS1、PITX2、ID1、RBL1、INHBA的表达[31],促进MSCs的成骨分化。综上,维生素D可以通过BMP/TGF-β/Samd信号通路促进MSCs分化为成骨细胞。
4 维生素D通过ROS/ERK信号通路促进MSCs成骨分化
活性氧(reactive oxygen species, ROS)是MSCs分化的重要调节者,而激活ERK和p38 MAPK信号转导可以促进大鼠MSCs增值[32],可见ROS和ERK在骨稳态维持过程中起着重要作用。研究发现[33-37],1,25(OH)2D3可以上调人MSCs中CYP27B1(1-OHase),使25(OH)D3转化为活性维生素D-1,25(OH)2D3,过转化的1,25(OH)2D3通过抑制过氧化氢酶上调ROS表达,同时下调MSCs中CYP24A1(24-OHase),阻滞25(OH)D、1,25(OH)2D3由24-OHase催化而失活[38-40]。在体外培养的人椎骨MSCs中加入1,25(OH)2D3后ROS表达上调,ROS作为特定的信号分子,能够直接使目标蛋白氧化,随着氧化作用的积累,ROS通过模仿生长因子受体-配体的交互作用直接激活下游ERK,活化的ERK使Runx2磷酸化,引起Runx2过表达,进而促进MSCs的成骨分化[37]。
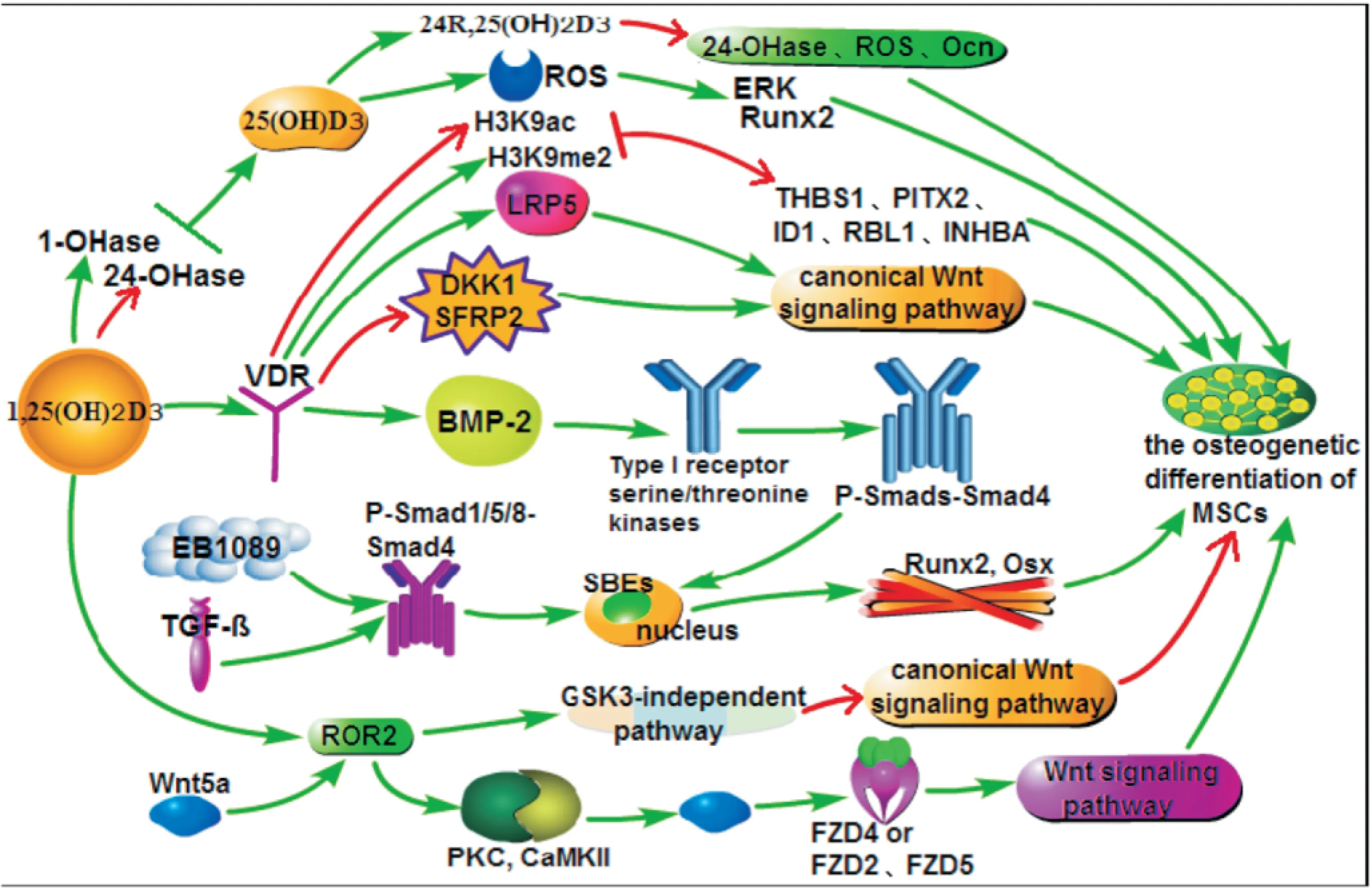
Fig 1 Molecular signaling pathway of regulatory effects of vitamin D on osteogenic differentiation of MSCs
5 结语
MSCs是有多向分化潜能的干细胞,能在体外增殖,维持非分化状态并具有分化成骨、软骨、脂肪、纤维及骨髓基质等中胚层组织的潜能,对骨骼的发育和代谢平衡具有十分重要的作用,是目前研究及关注较多的种子细胞之一。随着年龄的增长和绝经后骨质疏松症的发生、发展,骨髓腔内的成骨细胞减少,脂肪细胞增多,因此促进MSCs成骨分化是目前治疗骨质疏松症的新途径。维生素D通过不同的信号通路促进MSCs分化为成骨细胞(Fig 1),系统探讨其分子作用机制,为开发治疗骨质疏松新药、建立新方法奠定了理论基础。
[1]Backesjo C M, Li Y, Lindgren U, Haldosén L A. Activation of Sirtl decreases adipocyte formation during ostcoblast differentiation of mesenchymal stem cells[J].JBoneMinerRes, 2006, 21(7): 993-1002.
[2]Lam N N, Triliana R, Sawyer R K, et al. Vitamin D receptor overexpression in osteoblasts and osteocytes prevents bone loss during vitamin D-deficiency[J].JSteroidBiochemMolBiol, 2014, 144 Pt A: 128-31.
[3]Doroudi M, Olivares-Navarrete R, Hyzy S L, et al. Signaling components of the 1alpha,25(OH)2D3-dependent Pdia3 receptor complex are required for Wnt5a calcium-dependent signaling[J].BiochimBiophysActa, 2014, 1843(11): 2365-75.
[4]Yoshikawa Y, Yoshizawa T, Domae E, et al. RNA interference-mediated knockdown of Smad1 inhibits receptor activator of nuclear factor kappaB ligand expression induced by BMP-2 in primary osteoblasts[J].ArchOralBiol, 2015, 60(9): 1319-26.
[5]Li M, Zhao Y, Hao H, et al. Mesenchymal stem cell-conditioned medium improves the proliferation and migration of keratinocytes in a diabetes-like microenvironment[J].IntJLowExtremWounds, 2015, 14(1): 73-86.
[6]潘京华, 黄浩, 查振刚. 间充质干细胞向成骨细胞分化中的Wnt信号通路[J]. 中国组织工程研究, 2013, 17(40): 7144-9.
[6]Pan J H, Huang H, Zha Z G. Wnt signaling pathways in osteogenic differentiation of mesenchymal stem cells[J].ChinJTissueEngRes, 2013, 17(40): 7144-9.
[7]Chun J S, Oh H. Wnt signaling in cartilage development and degeneration[J].BMBRep, 2008, 41(7): 485-94.
[8]Shahi P, Seethammagari M R, Valdez J M, et al. Wnt and Notch pathways have interrelated opposing roles on prostate progenitor cell proliferation and differentiation[J].StemCells, 2011, 29(4): 678-88.
[9]昝昀, 安荣泽, 王兆杰. Wnt信号通路与软骨细胞分化[J]. 科学咨询, 2015, 29: 54-6.
[9]Zan Y, An R Z, Wang Z J. Wnt signaling pathway and chondrocyte differentiation[J].ScientificConsult, 2015, 29: 54-6.
[10]郑敏, 刘强. 维生素D及维生素D受体的研究进展[J]. 医学综述, 2013, 19(21): 3965-7.
[10]Zheng M, Liu Q. The progress in the studies of vitamin D and vitamin D receptor[J].MedRecapitulate, 2013, 19(21): 3965-7.
[11]李晨睿, 孟志远, 牛银波, 等. 黄芩苷通过Wnt/β-catenin信号通路对大鼠骨髓间充质干细胞成骨分化的促进作用[J]. 中国药理学通报, 2015, 31(7): 919-24.
[11]Li C R, Meng Z Y, Niu Y B, et al. Effect of Baicalin on the osteogenic differentiation of rat bone marrow mesenchymal stem cells by Wnt/β-catenin signaling pathway[J].ChinPharmacolBull, 2015, 31(7): 919-24.
[12]Cianferotti L, Demay M B. VDR-mediated inhibition of DKK1 and SFRP2 suppresses adipogenic differentiation of murine bone marrow stromal cells[J].JCellBiochem, 2007, 101(1): 80-8.
[13]黄启钊. FGFs/FGFR3与1,25(OH)2D3/VDR信号通路的交互作用及其在软骨发育中的作用及意义研究[D]. 西安:第三军医大学, 2014.
[13]Huang Q Z. Preliminary research on the crosstalk between FGFs/FGFR3 and 1,25(OH)2D3/VDR signaling pathway during chondrogenesis[D]. Xi’an:Network Center of Third Military Medical University, 2014.
[14]De P F, Dick-de-Paula I, Bornstein S, et al. VDR haploinsufficiency impacts body composition and skeletal acquisition in a gender-specific manner[J].CalcifTissueInt, 2011, 89(3): 179-91.
[15]Morvan F, Boulukos K, Clement-Lacroix P,et al. Deletion of a single allele of the Dkk1 gene leads to an increase in bone formation and bone mass[J].JBoneMinerRes, 2006, 21(6): 934-45.
[16]Wong G T, Gavin B J, McMahon A P. Differential transformation of mammary epithelial cells by Wnt genes[J].MolCellBiol, 1994, 14(9): 6278-86.
[17]卜海激, 朱明华. Wnt5a作用及信号转导通路研究进展[J]. 中华病理学杂志, 2015, 44(7): 535-8.
[17]Bu H J, Zhu M H. Research progress of function and signal transduction pathway of Wnt5a[J].ChinJPathol, 2015, 44(7): 535-8.
[18]Guan S, Wang Z, Xin F, Xin H. Wnt5a is associated with the differentiation of bone marrow mesenchymal stem cells in vascular calcification by connecting with different receptors[J].MolMedRep, 2014, 10(4): 1985-91.
[19]Cai S X, Liu A R, He H L,et al. Stable genetic alterations of β-catenin and ROR2 regulate the Wnt pathway, affect the fate of MSCs[J].JCellPhysiol, 2014, 229(6): 791-800.
[20]Torii K, Nishizawa K, Kawasaki A, et al. Anti-apoptotic action of Wnt5a in dermal fibroblasts is mediated by the PKA signaling pathways[J].CellSignal, 2008, 20(7): 1256-66.
[21]Tornero-Esteban P, Peralta-Sastre A, Herranz E, et al. Altered expression of Wnt signaling pathway components in osteogenesis of mesenchymal stem cells in osteoarthritis patients[J].PLoSOne, 2015, 10(9): e0137170.
[22]Chen J X, Olivares-Navarrete R, Wang Y,et al. Protein-disulfide isomerase-associated 3(Pdia3) mediates the membrane response to 1,25-dihydroxyvitamin D3 in osteoblasts[J].JBiolChem, 2010, 285(47): 37041-50.
[23]兰平文, 沈彬. TGF-β/BMP信号通路在骨关节炎软骨细胞退变中的作用机制[J]. 中华关节外科杂志, 2015, 9(5): 644-7.
[23]Lan P W, Shen B. The role of TGF- beta /BMP signaling pathway in the degeneration of cartilage cells in osteoarthritis[J].ChinJJointSurg, 2015, 9(5): 644-7.
[24]李晓敏, 张岩. 女贞子及其化合物对骨矿代谢影响的研究进展[J]. 中国药理学通报, 2015, 31(10): 1345-8.
[24]Li X M, Zhang Y. Research progress of Fructus Ligustri Lucidi and its compounds: effects on bone and mineral metabolism[J].ChinPharmacolBull, 2015, 31(10): 1345-8.
[25]Heldin C H, Miyazono K, ten Dijke P. TGF-beta signalling from cell membrane to nucleus through SMAD proteins[J].Nature, 1997, 390(6659): 465-71.
[26]Zhou S H, Glowacki J, Kim S W, et al. Clinical characteristics influenceinvitroaction of 1,25-dihydroxyvitamin D3 in human marrow stromal cells[J].JBoneMinerRes, 2012, 27(9): 1992-2000.
[27]Olivares-Navarrete R, Sutha K, Hyzy S L, et al. Osteogenic differentiation of stem cells alters vitamin D receptor expression[J].StemCellsDev, 2012, 21(10): 1726-35.
[28]Xu J J, Sun Y B, Zhang X L, et al. Vitamin D analog EB1089 could repair the defective bone marrow-derived mesenchymal stromal cells in patients with systemic lupus erythematosus[J].IntJClinExpMed, 2015, 8(1): 916-21.
[29]Honda Y, Ding X, Mussano F,et al. Guiding the osteogenic fate of mouse and human mesenchymal stem cells through feedback system control[J].SciRep, 2013, 3: 3420.
[30]Tan J, Lu J, Huang W, et al. Genome-wide analysis of histone H3 lysine9 modifications in human mesenchymal stem cell osteogenic differentiation[J].PLoSOne, 2009, 4(8): e6792.
[31]Pandey R, Guru R K, Mount D W. Pathway miner: extracting gene association networks from molecular pathways for predicting the biological significance of gene expression microarray data[J].Bioinformatics, 2004, 20(13): 2156-8.
[32]Qin S Y, Zhou W,Liu S Y, et al. Icariin stimulates the proliferation of rat bone mesenchymal stem cells via ERK and p38 MAPK signaling[J].IntJClinExpMed, 2015, 8(5): 7125-33.
[33]田丽花, 张劼, 黄松,等. 25(OH)D3、维生素D受体与糖皮质激素性骨质疏松关系的研究[J]. 中国骨质疏松杂志, 2015, 21(7): 769-73.
[33]Tian L H, Zhang J, Huang S, et al. Study on the relationship of VDR, 25(OH)D3and glucocorticoid-induced osteoporosis[J].ChinJOsteoporos, 2015, 21(7): 769-73.
[34]Geng S, Zhou S H, Bi Z G, Glowacki J. Vitamin D Metabolism in human bone marrow stromal (mesenchymal stem) cells[J].Metabolism,2013, 62(6): 768-77.
[35]Zhou S H, Geng S, Glowacki J. Histone deacetylation mediates the rejuvenation of osteoblastogenesis by the combination of 25(OH)D3and parathyroid hormone in MSCs from elders[J].JSteroidBiochemMolBiol, 2013, 136: 156-9.
[36]Geng S, Zhou S, Glowacki J. Effects of 25-hydroxyvitamin D(3) on proliferation and osteoblast differentiation of human marrow stromal cells require CYP27B1/1α-hydroxylase[J].JBoneMinerRes, 2011, 26(5): 1145-53.
[37]Curtis K M, Aenlle K K, Roos B A, Howard G A. 24R,25-dihydroxyvitamin D 3 promotes the osteoblastic differentiation of human mesenchymal stem cells[J].MolEndocrinol, 2014, 28(5): 644-58.
[38]Zhou S H, Leboff M S, Waikar S S, Glowacki J. Vitamin D metabolism and action in human marrow stromal cells: Effects of chronic kidney disease[J].JSteroidBiochemMolBiol, 2013, 136: 342-4.
[39]Van Driel M, Koedam M, Buurman C J, et al. Evidence for auto/paracrine actions of vitamin D in bone: 1alpha-hydroxylase expression and activity in human bone cells[J].FASEBJ, 2006, 20(13): 2417-9.
[40]Arai M, Shibata Y, Pugdee K, et al. Effects of reactive oxygen species(ROS) on antioxidant system and osteoblastic differentiation in MC3T3-E1 cells[J].IUBMBLife, 2007, 59(1): 27-33.
Research progress on molecular regulatory effects of vitamin D on osteogenic differentiation of bone marrow stromal cells
ZHANG Yao1, LI Xiao-li1, ZHANG Yan2
(1.CenterforSystemsBiomedicalSciences,UniversityofShanghaiforScienceandTechnology,Shanghai200093,China;2.LonghuaHospitalAffiliatedtoShanghaiUniversityofTraditionalChineseMedicine,Shanghai200032,China)
Marrow stromal cells (MSCs), component of the marrow stroma, play an important role in the growth of bone and metabolic balance. This paper mainly summarizes and reviews the molecular regulaory effects of vitamin D and its active form 1, 25 dihydroxy vitamin D3[1,25(OH)2D3] on the osteogenetic differentiation of MSCs by Wnt signaling pathway, Wnt5a/ROR2 axis, BMP/TGF-β/Samd signaling pathway and ROS/ERK signaling pathway, so as to clarify the molecular signaling pathway through which vitamin D regulates MSCs metabolically.
vitamin D; 1,25(OH)2D3; marrow stromal cells; molecular regulation; signaling pathway; osteogenic differentiation
时间:2016-9-22 11:14
http://www.cnki.net/kcms/detail/34.1086.R.20160922.1114.004.html
2016-06-21,
2016-08-14
国家自然科学基金资助项目(No 81202894);龙医创新团队计划项目(No LYCX-01)
张尧(1992-),男,硕士生,研究方向:药理学,E-mail: 313424919@qq.com;
张岩(1978-),男,博士,研究员,博士生导师,研究方向:药理学,通讯作者,E-mail: medicineyan@163.com
10.3969/j.issn.1001-1978.2016.10.002
A
1001-1978(2016)10-1337-04
R-05;R329.24;R977.24

