高效液相色谱法测定芪麦苓口服液中原儿茶醛含量
刁保忠,冯家龙,赵文法
(1.山东省聊城市人民医院,山东聊城252000;2.山东省聊城市食品药品检验检测中心,山东聊城252000)
高效液相色谱法测定芪麦苓口服液中原儿茶醛含量
刁保忠1,冯家龙2,赵文法2
(1.山东省聊城市人民医院,山东聊城252000;2.山东省聊城市食品药品检验检测中心,山东聊城252000)
目的建立芪麦苓口服液中丹参主要成分原儿茶醛含量测定的高效液相色谱(HPLC)法。方法色谱柱采用Diamonsil C18柱(250 mm× 4.6 mm,5 m),流动相为甲醇-0.1%冰乙酸(20∶80),检测波长为279 nm,流速为1.0 mL/min,柱温为30℃。结果原儿茶醛质量浓度在1.46~116.64 g/mL范围内与峰面积呈良好的线性关系(r=0.999 9);平均加样回收率为92.64%(RSD=1.49%,n=6)。结论该法简便、准确,结果稳定,可用于芪麦苓口服液中丹参主要成分原儿茶醛的含量测定。
芪麦苓口服液;原儿茶醛;含量测定;高效液相色谱法
芪麦苓口服液处方来源于聊城市人民医院名老中医的临床经验方,由丹参、黄芪、茯苓等11味药组方,经水煎、滤过、浓缩、配制、灌装、灭菌等工序制得,具有益气养阴、活血通络的功效,临床主要用于2型糖尿病的治疗和糖尿病并发症的防治。丹参经水煎提取后,其有效成分主要为原儿茶醛等水溶性物质,参考2010年版《中国药典(一部)》收载的含有丹参水煎提取物的成方制剂,大都采用了高效液相色谱(HPLC)法控制其中原儿茶醛的含量[1]。检索相关文献,多采用反相高效液相色谱法测定含有丹参的经水煎提取工艺最终制得的复方制剂中原儿茶醛的含量[2-8],亦有少数采用其他方法[9-11]。本试验中采用HPLC法对芪麦苓口服液中主要成分原儿茶醛进行了含量测定,可用于控制芪麦苓口服液的质量,为其质量标准的建立提供依据。
1 仪器与试药
1.1仪器
1200型高效液相色谱仪(紫外检测器,美国安捷伦公司);LC-20A型高效液相色谱仪(PDA检测器,日本岛津公司);BT125D型电子天平(德国赛多利斯公司)。1.2试药
原儿茶醛对照品(中国食品药品检定研究院,批号为110810-201007);芪麦苓口服液(聊城市人民医院,批号为20140201,20140202,20140203);甲醇(色谱纯,天津赛孚瑞科技有限公司),其他化学试剂(市售,分析纯)。
2 方法与结果
2.1色谱条件
色谱柱:Diamonsil C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇-0.1%冰乙酸(20∶80);检测波长:279 nm;流速:1.0 mL/min;柱温:30℃;进样量:10 μL。
2.2溶液制备
对照品溶液:取原儿茶醛对照品适量,精密称定,置量瓶中,加甲醇制成每1 mL含原儿茶醛20 μg的溶液,即得。
供试品溶液:精密量本品10 mL,加稀盐酸调pH至1~2,用醋酸乙酯提取3次,每次20 mL,合并醋酸乙酯液,挥干,残渣用甲醇溶解并定容至10 mL,摇匀,用0.45 μm微孔滤膜滤过,即得。
阴性对照品溶液:按处方工艺制备不含丹参的阴性对照品,按照供试品溶液制备方法操作,即得。
2.3方法学考察
专属性试验:分别精密吸取对照品溶液、供试品溶液和阴性对照品溶液各10 μL,注入液相色谱仪,按拟订色谱条件测定。结果表明,阴性对照品溶液对测定无干扰;PDA检测器记录的色谱峰纯度检查,峰纯度匹配度996,表明峰纯度符合规定,该方法专属性良好。色谱图见图1。
线性关系考察:取原儿茶醛对照品,精密称定,制成质量浓度为1.46,2.916,11.664,58.32,116.64 μg/mL的溶液,在拟订色谱条件下,分别注入液相色谱仪测定,以质量浓度(C)为横坐标、峰面积(A)为纵坐标绘制标准曲线,得回归方程为A=17.764 C-4.516,r= 0.999 9(n=5)。结果表明,原儿茶醛质量浓度在1.46~116.64 μg/mL范围内与峰面积线性关系良好。见表1。
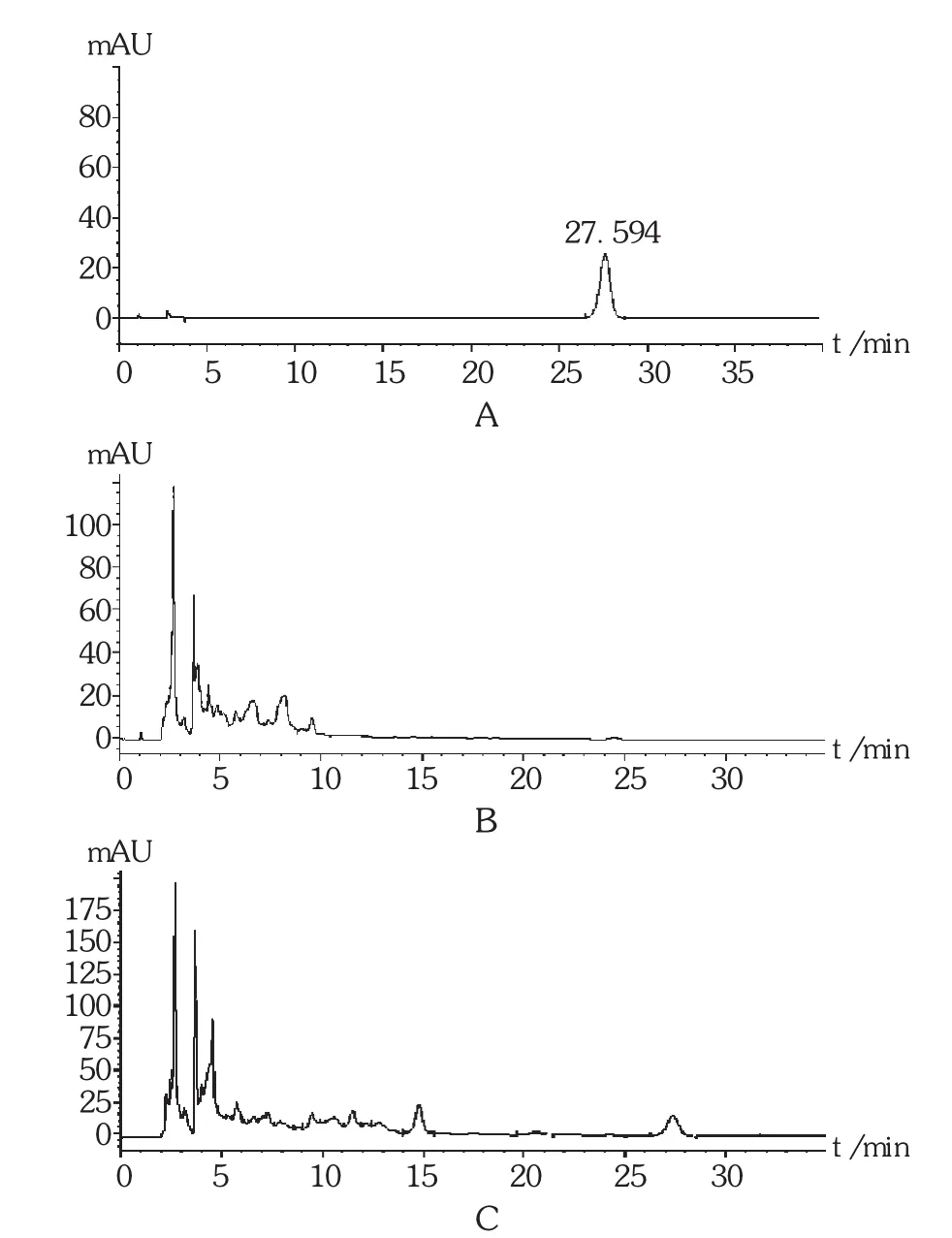
图1 高效液相色谱图
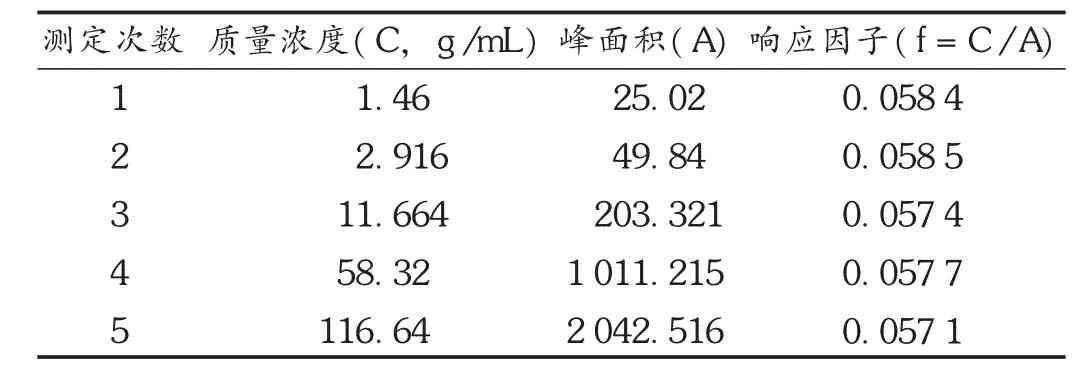
表1 原儿茶醛线性关系考察结果(n=5)
精密度试验:取低、中、高3个质量浓度的对照品溶液,拟订色谱条件下进样10 μL,分别于1 d内测定5次,连续测定5 d,记录峰面积,并计算日内和日间RSD。结果3种质量浓度对照品溶液的日内RSD均小于1%,日间RSD小于2%,表明仪器精密度良好,符合分析要求。
重复性试验:对同一均匀样品溶液,连续取样6份,各10 mL,依法制备供试品溶液,按拟订色谱条件测定。结果的RSD为1.70%(n=6),表明该方法重复性良好。见表2。
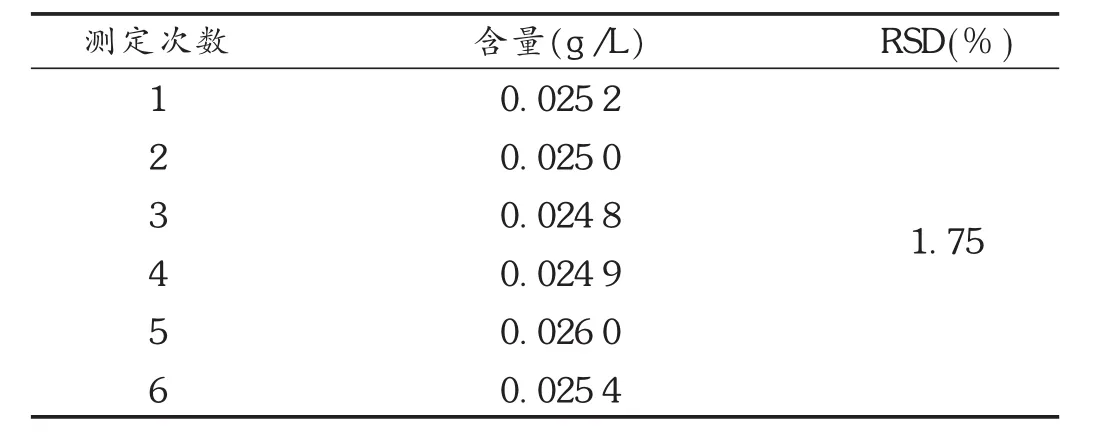
表2 重复性试验结果(n=6)
稳定性试验:取重复性试验项下供试品溶液,分别于0,6,12,24 h时各进样1次,测定供试品中原儿茶醛的含量。原儿茶醛溶液具有还原性,在环境中易被氧化分解而变色,试验过程中应密闭操作。结果的RSD为1.20%,表明供试品溶液在24 h内稳定性良好。见表3。

表3 稳定性试验结果(n=4)
加样回收试验:取已知含量的供试品(批号为20140201)适量,加入适量原儿茶醛对照品,制成低、中、高3个不同质量浓度的待测溶液各3份,分别测定其含量。结果见表4。
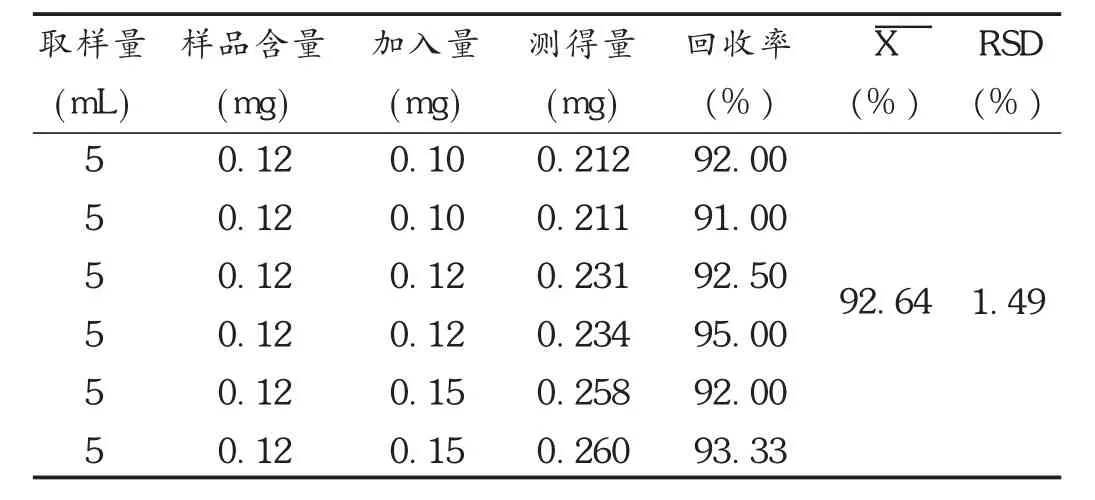
表4 原儿茶醛加样回收试验结果(n=6)
2.4样品含量测定
取3批样品,依法制备供试品溶液,按拟订色谱条件测定,以峰面积计算含量。结果批号为20140201,20140202,20140203的样品含量分别为0.024,0.025,0.025 g/L。
3 讨论
3.1色谱条件选择
主要选择依据供试品溶液中原儿茶醛主峰有无干扰。通过DAD检测器对供试品中原儿茶醛的全波长检测,流动相为甲醇-0.1%冰乙酸(20∶80),检测波长为279 nm,流速为1.0 mL/min,柱温为30℃,结果供试品原儿茶醛主峰与其他杂质峰分离良好,原儿茶醛主峰的纯度因子999,在可接受的阈值内。
3.2提取溶液考察
比较了乙醚和醋酸乙酯2种不同提取溶剂的提取效果,综合考虑提取溶剂的安全性,结果发现醋酸乙酯提取原儿茶醛效果相对较好,所以本试验中采用醋酸乙酯为提取溶剂。
综上所述,本方法简便、准确,结果稳定,可用于控制芪麦苓口服液的质量及本品中原儿茶醛含量的质量评价。
[1]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:38,456-457,579-580,835-836.
[2]蔡丽云,李子鸿,刘东文,等.骨伤康颗粒中原儿茶醛的含量测定[J].中国药业,2007,16(11):23-24.
[3]黄雅兰,孙广红,孙伟光,等.HPLC法测定不同厂家的复方丹参注射液中丹参素和原儿茶醛的含量[J].中国药业,2002,11(12):36.
[4]王道平,周欣,梁光义,等.不同产地丹参中有效成分的含量比较[J].天然产物研究与开发,2005,17(1):70-72.
[5]曹冬,黄喜茹,刘伟娜,等.反相高效液相色谱法测定冠心宁注射液中的丹参素和原儿茶醛[J].色谱,2006,24(5):533.
[6]王海龙,王宝全,赵庆华.反相高效液相色谱法测定胃炎片中原儿茶醛的含量[J].实用医药杂志,2007,24(5):574-575.
[7]涂琼,卢庆红.高效液相色谱法测定小儿清炎合剂中原儿茶醛的含量[J].实用临床医学,2013,14(2):4-6.
[8]朱春健,郁梅,柳冬梅,等.高效液相色谱法测定活血复脉合剂中原儿茶醛的含量[J].中国新药与临床杂志,2013,32(11):921-923.
[9]姚定友,王林丽.薄层扫描法测定补益口服液中原儿茶醛含量[J].中国药业,2005,14(1):43.
[10]何建国,雷永军,朱建华,等.一阶导数光谱法测定复方丹参注射液中原儿茶醛的含量[J].时珍国医国药,2002,13(10):590-591.
[11]朱迪,谭丹,侯靖宇,等.参芎葡萄糖注射液中总酚酸含量测定方法研究[J].中国药业,2015,24(13):28-29.
Content Determination of the Protocatechuic Aldehyde in Qimailing Oral Liquid by HPLC
Diao Baozhong1,Feng Jialong2Zhao Wenfa2
(1.Liaocheng People′s Hospital,Liaocheng,Shandong,China252000;
2.Liaocheng Institute for Food and Drug Control,Liaocheng,Shandong,China252000)
ObjectiveTo establish an HPLC method for the content determination of protocatechuic aldehyde in Qimailing Oral Liquid. MethodsThe Diamonsil C18(250 mm×4.6 mm,5 μm)was used as the chromatographic column,Methanol-0.1%glacial acetic acid solution(30∶70)as mobile phase;the wavelength was 279 nm.The flow rate was 1.0 mL/min,and the column temperature was at 30℃. ResultsThelinear rangeof protocatechuicaldehyde was 1.46-116.64μg/mL(r=0.999 9),with an averagerecovery rateof 92.64%(RSD=1.49%,n=6).ConclusionThe method is simple,accurate and stable,which could be used for the content determination of Qimailing Oral Liquid.
Qimailing Oral Liquid;protocatechuic aldehyde;content determination;HPLC
R284.1;R286.0
A
1006-4931(2016)15-0074-03
(2016-01-14;
2016-03-29)

