膀胱尿路上皮癌CHK1和P53的临床病理研究
郑林峰,孙文勇,郭振英,程国平,杨世峰
(浙江省肿瘤医院,浙江杭州310022)
·临床研究·
膀胱尿路上皮癌CHK1和P53的临床病理研究
郑林峰,孙文勇,郭振英,程国平,杨世峰
(浙江省肿瘤医院,浙江杭州310022)
目的 探讨细胞周期检测点激酶1(cell cycle checkpointkinase 1,CHK1)及P53蛋白在膀胱尿路上皮癌(bladder urothelial carcinoma,BUC)中的表达及意义。 方法 采用免疫组化EnVision两步法检测104例BUC组织和40例癌旁正常膀胱黏膜组织中CHK1及P53蛋白的表达,并分析其与BUC临床病理特征及预后的关系。结果 BUC组织中CHK1及P53蛋白表达明显高于癌旁正常膀胱黏膜组织(P<0.05)。CHK1及P53蛋白表达与BUC的病理组织学分级、临床病理分期及5年生存率差异有统计学意义(P<0.05),与性别、年龄、肿瘤长径、单发/多发以及在初发/复发患者中差异无统计学意义(P>0.05)。BUC组织中CHK1和P53蛋白表达呈正相关(P<0.05)。结论 (1)CHK1 和P53蛋白在BUC组织中呈高表达,两者在BUC发生、发展中起到重要作用;(2)BUC组织中CHK1和P53蛋白表达呈正相关,提示两者存在协同作用;(3)CHK1和P53蛋白阴性表达组预后好于阳性表达组,两者可作为BUC的预后评价指标。
膀胱尿路上皮癌;细胞周期检测点激酶1;P53;免疫组织化学
细胞周期检测点激酶 1(cell cycle checkpointkinase 1,CHK1)是细胞周期检测点的转导因子,在细胞周期G1、S和G2/M期的调控中发挥重要作用,其蛋白的稳定表达有利于维护DNA损伤修复和细胞周期检测点调节,以保证细胞基因组的完整和稳定[1]。研究发现,正常细胞中CHK1的表达较低,但在某些恶性肿瘤中却高表达[2]。P53作为最重要的抑癌基因之一,其主要功能是参与DNA的修复和复制过程,具有调节血管生成、促进凋亡及调节DNA修复的作用,可抑制正常细胞向癌细胞转化[3],P53突变后可诱导一些异常基因表达,促进肿瘤的发生[4]。本文采用免疫组化EnVision法检测CHK1和P53蛋白,探讨两种蛋白在膀胱癌发生、发展中的作用和预后的关系,为膀胱癌的治疗提供新的理论依据。
1 资料与方法
1.1 一般资料 收集本院2009年1月~2014年12月膀胱癌根治标本104例及其正常膀胱组织标本(距癌旁>2cm)40例,膀胱癌组中男92例,女12例;年龄27~84岁,平均(62.66±1.16)岁,其中<63岁者47例,≥63岁者57例;肿瘤长径<2cm者16例,≥2cm者88例;初发膀胱癌76例,复发者28例;肿瘤单发43例,多发61例。根据2016版WHO《泌尿和男性生殖系统肿瘤》分类标准,其中非浸润性尿路上皮癌11例,浸润性尿路上皮癌93例;低级别40例,高级别64例;临床分期Tis~T1期52例,T2~T4期52例。正常组男28例,女12例;年龄40~84岁,平均(57.53±1.02)岁。所有标本均经10%福尔马林固定,石蜡包埋,连续切片,行HE及免疫组化染色。
1.2 免疫组化 CHK1单克隆抗体和鼠抗人P53购自美国Santa Cruz公司。采用免疫组化EnVision两步法对CHK1和P53进行染色,具体步骤:4μm连续切片脱蜡至水,EDTA(pH 9.0)水浴法抗原修复,一抗均按1:200稀释,室温孵育1小时,再用辣根过氧化物酶标记的聚合物二抗(EnVision Flex试剂盒,丹麦DAKO公司)孵育30分钟,DAB显色10分钟,水洗后,苏木素复染,梯度乙醇脱水,中性树胶封固。以0.01mol/L PBS液(pH 7.4)替代一抗作为阴性对照,每例均有HE切片作对照观察。
1.3 结果判定 CHK1主要表达于细胞质,部分同时表达于细胞质和细胞核。P53主要表达于细胞核。综合考虑切片中阳性细胞占所观察同类细胞数的百分比和阳性细胞着色强度两项指标,半定量判断结果:(1)根据切片中阳性细胞占计数细胞百分数分为4级:阳性细胞<10%计为0分,10%~24%计为1分,25%~49%计为2分,50%~74%计为3分,≥75%计为4分。(2)根据着色程度分为4级:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。综合判定取阳性细胞百分数分值与着色强度相乘之积:0~1分计为(-),≥2分计为(+)。
1.4 观察指标 随访患者的生存结局,以患者死亡、2015年12月31日或失访作为随访结果点,随访时间为12~84个月,失访12例,失访率11.5%。记录膀胱癌临床病理资料,包括性别、年龄、病理分级、临床分期、肿瘤长径、单发/多发以及初发/复发情况,分析CHK1和P53蛋白表达与膀胱尿路上皮癌临床病理特征的关系以及预后的影响因素。
1.5 统计学处理 应用SPSS 21.0统计软件包进行处理,组间比较及临床病理指标的关系采用χ2检验和Fisher’s确切概率法,采用Spearman等级相关检验对CHK1和P53在膀胱癌中的相互关系进行分析,Kaplan-Meier法分析生存情况,生存曲线比较采用Log-rank检验,采用COX比例风险回归模型分析多种因素对预后的影响。
2 结果
2.1 膀胱癌及正常膀胱组织中CHK1和P53蛋白的表达 膀胱癌及正常膀胱组织中CHK1阳性率分别为68.26%(71/104)、7.5%(3/40),两者差异有统计学意义 (P<0.05);P53阳性率分别为42.31% (44/104)、2.5%(1/40),两者差异有统计学意义(P<0.05)。见表1、图1~4。
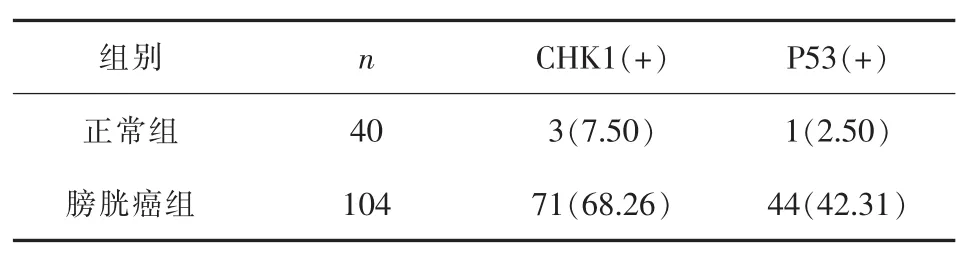
表1 两组CHK1和P53蛋白的表达(n,%)

图1 CHK1在正常膀胱黏膜中呈阴性(EnVision两步法×100)
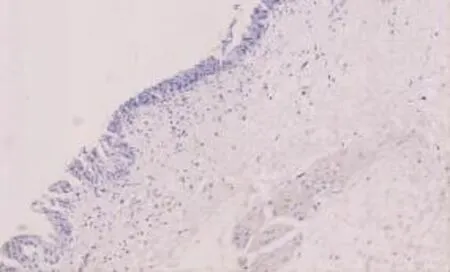
图2 P53在正常膀胱黏膜中呈阴性(EnVision两步法×100)
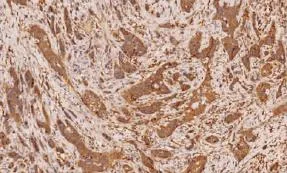
图3 CHK1在膀胱浸润性尿路上皮癌中呈强阳性(EnVision两步法×100)
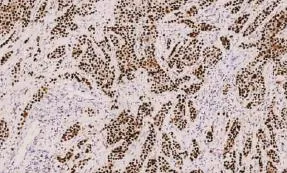
图4 P53在膀胱浸润性尿路上皮癌中呈强阳性(EnVision两步法×100)
2.2 CHK1和P53蛋白表达与膀胱癌临床病理特征的关系 CHK1与P53蛋白在低级别BUC中的阳性率明显低于高级别BUC,在临床分期T2~T4 期BUC中的阳性率明显高于Tis~T1期 (均P< 0.05);两者在性别、年龄、肿瘤长径、单发/多发以及初发/复发中差异无统计学意义(P>0.05),详见表2。膀胱癌组织中CHK1和P53蛋白表达呈正相关(r=0.207,P<0.05)。详见表3。
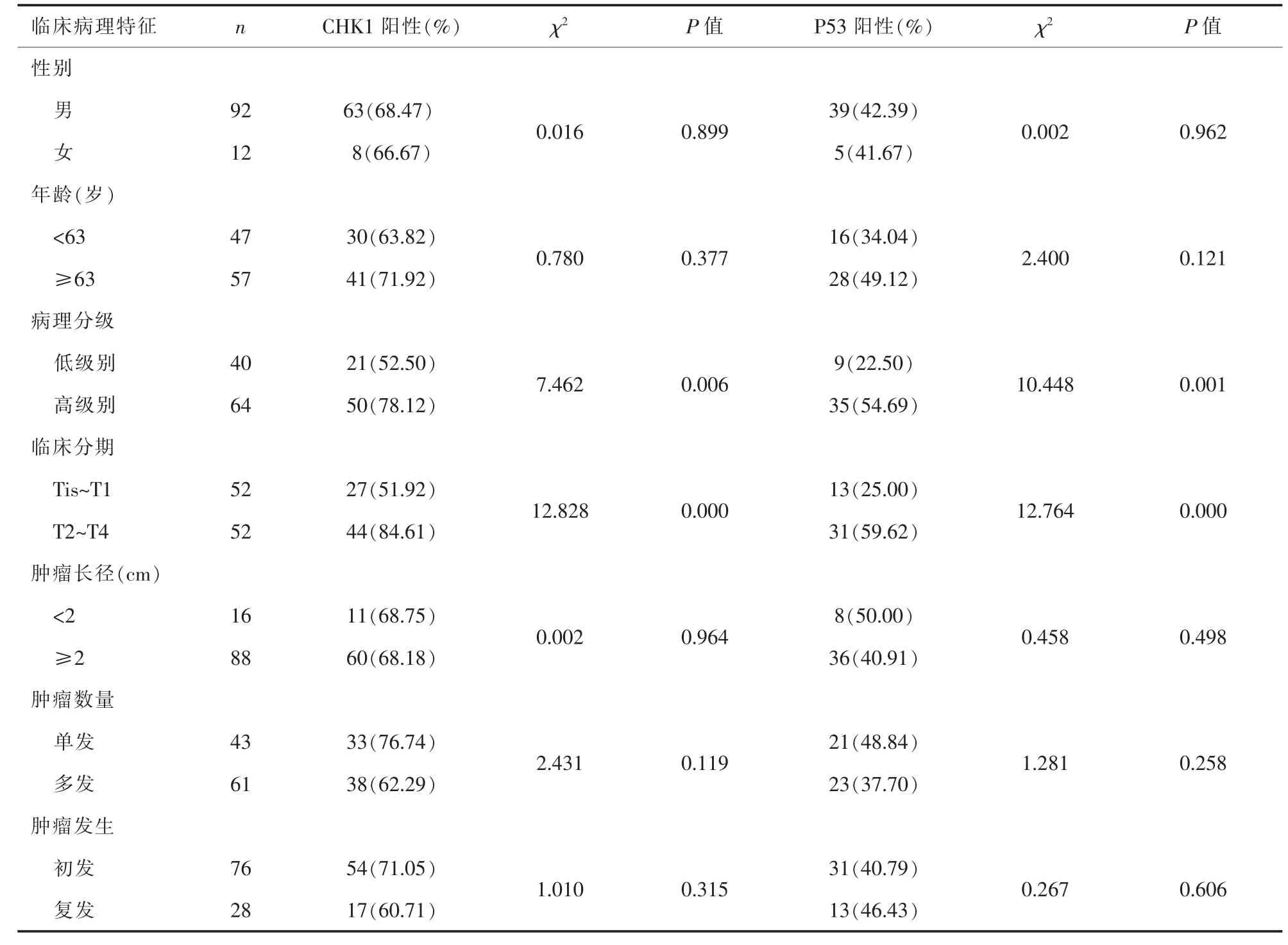
表2 CHK1和P53蛋白表达与膀胱尿路上皮癌临床病理特征的关系
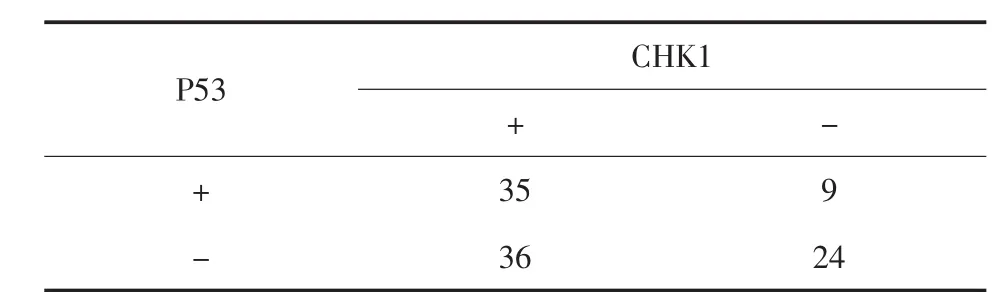
表3 CHK1和P53蛋白表达相关性
2.3 CHK1和P53蛋白表达与膀胱癌预后的关系本组104例BUC患者生存时间7~82个月,平均(36.54±2.00)个月,中位生存时间31.5个月。Kaplan-Meier法和Log-rank检验分析结果显示,患者5年总体生存率为60.57%(63/104),CHK1蛋白阳性表达和阴性表达的 5年生存率分别为 54.92%和72.72%,两者差异有统计学意义 (χ2=6.910,P= 0.009)。P53蛋白阳性表达和阴性表达的5年生存率分别为47.72%和70.00%,两者差异有统计学意义(χ2=7.411,P=0.006)。详见图5~6。
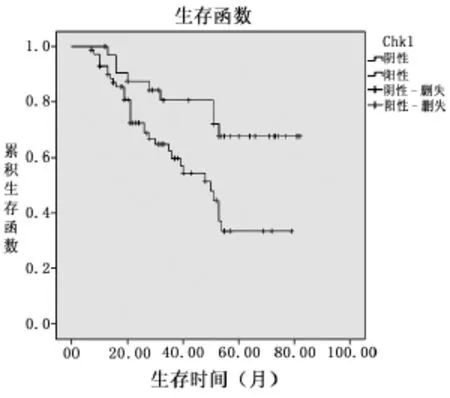
图5 CHK1蛋白阳性表达组和阴性表达组的生存曲线
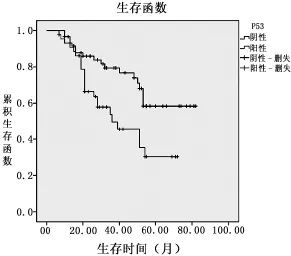
图6 P53蛋白阳性表达组和阴性表达组的生存曲线
2.4 膀胱癌预后单因素与多因素COX模型分析结果 单因素Cox模型分析:将CHK1蛋白、P53蛋白以及膀胱癌临床病理特征逐个引入Cox模型,结果显示,与BUC预后相关有统计学意义的因素有6个,分别为保护因素:肿瘤单发;危险因素:年龄、病理级别、临床分期、CHK1蛋白、P53蛋白。经Cox模型多因素综合评价上述影响因素,确定年龄、单发/多发及CHK1蛋白是影响BUC患者预后的独立因素(P<0.05);而病理级别、临床分期、P53蛋白并非影响BUC患者预后的独立因素 (P>0.05)。详见表4~5。
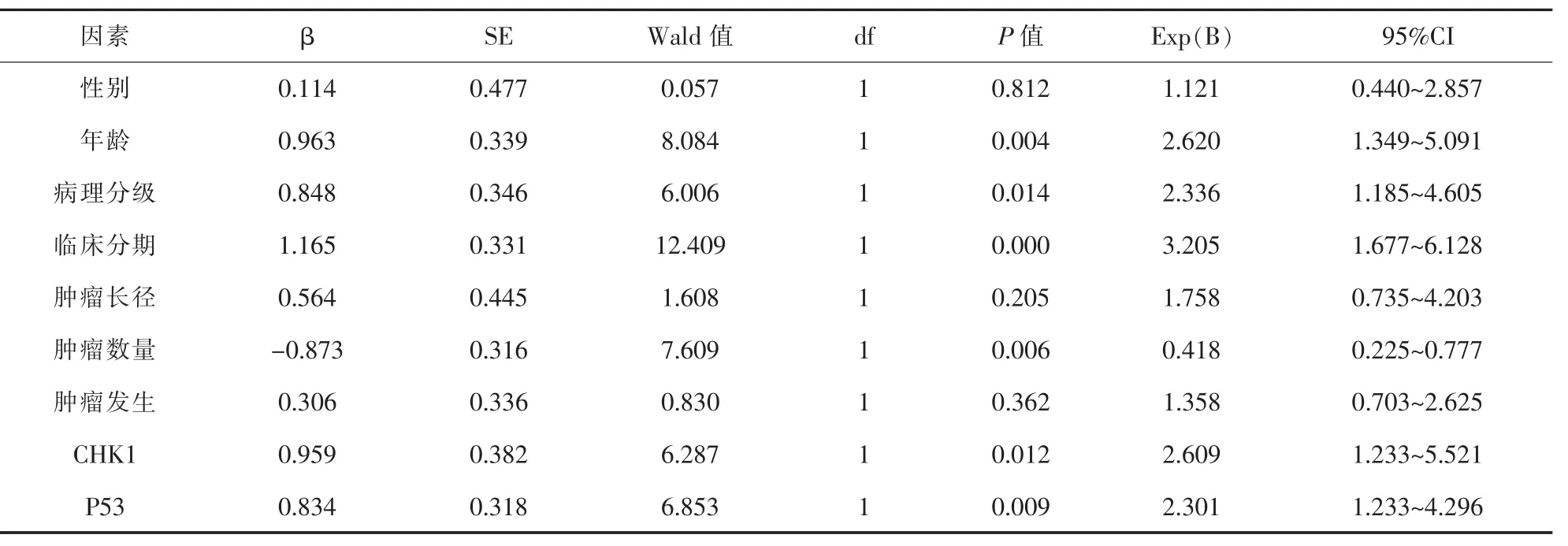
表4 膀胱尿路上皮癌患者预后单因素COX模型分析
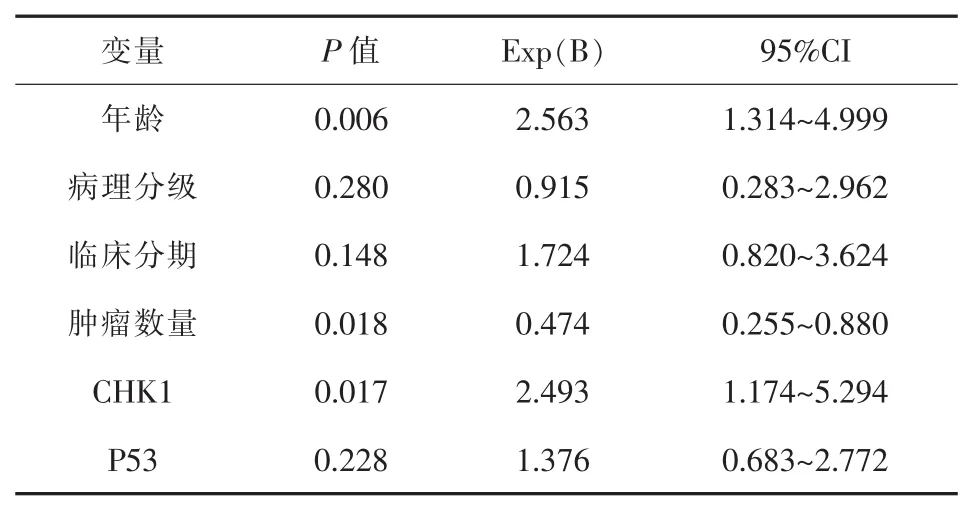
表5 膀胱尿路上皮癌患者预后多因素COX模型分析
3 讨论
CHK1是一个重要的周期检测点中调节蛋白,在细胞周期G1、S和G2/M期的调控中发挥重要作用,其蛋白的稳定表达有利于维护DNA损伤修复和细胞周期检测点调节,以保证细胞基因组的完整和稳定[1]。从其功能上看,CHK1可视为一个肿瘤抑制因子,当CHK1基因失活后,CHK1表现就会呈现出单倍体剂量不足,本应停止增殖或生理性凋亡的细胞不停地进入细胞周期,使得DNA损伤在复制中逐渐积累,从而导致细胞的恶性增殖[5]。正常细胞中CHK1的表达较低,但在某些恶性肿瘤中却存在着高表达[2]。
Bo等[6]发现,CHK1过表达能加强二烯丙基硫醚(DADS)诱导的G2/M周期停滞,从而导致胃癌细胞不断增殖。Fang等[7]发现,CHK1过表达能诱导CCNB1mRNA及蛋白表达上调,从而促进人结直肠癌细胞增殖及肿瘤生长。本组实验显示,104例BUC组织和40例正常膀胱黏膜组织中CHK1的阳性表达率分别为68.26%(71/104)、7.5%(3/40),两者差异有统计学意义 (P<0.05),CHK1的表达与病理分级及临床分期有关(P<0.05),并且出现随病理分级及临床分期提升而阳性表达率升高的趋势,提示CHK1在BUC的发生、发展过程中发挥着重要作用。Grabauskiene等[8]发现在非小细胞肺癌中CHK1过表达与预后不良相关。同样,本组生存分析结果示:CHK1是影响BUC患者预后的独立因素,CHK1阴性表达组5年生存率优于阳性表达组。通过解除CHK1对细胞周期检测点的阻滞作用进而促使肿瘤细胞凋亡,已成为肿瘤治疗的重要潜在靶点之一[9]。W-T等[10]应用人端粒酶反转录酶永生化的人泌尿道正常上皮细胞 (HTERT-NHU)与肿瘤细胞系来研究DNA损伤应答,发现膀胱癌细胞系予以ATM (共济失调毛细血管扩张症突变基因)抑制剂及复制抑制剂共处理后,CHK1表达降低,癌细胞进入S周期进程显著减缓,凋亡显著增加。同样,Li等[11]发现在膀胱癌治疗中,应用ATRCHK1通路的强效抑制剂WYC0209或siATR治疗后可提高顺铂-DNA加合产物的表达,并伴有p-糖蛋白的低表达。同时,顺铂与WYC0209联合治疗表现出抗癌的协同效应。因此,抑制CHK1蛋白表达可以提高BUC的化疗效果。
P53基因位于人染色体17p13.1上,P53基因转录成2.5kb的mRNA,编码393个氨基酸的蛋白,分子量为53000,是迄今发现与人类肿瘤相关性最高的基因,人类约50%的肿瘤与其有关[12],其分为野生型和突变型。野生型P53基因抗肿瘤作用主要是使DNA损伤细胞进入G1/G0期阻滞和DNA修复程序,而不能进入S期,从而抑制细胞的恶性增生,P53突变后可诱导一些异常基因表达,促进肿瘤的发生[4]。因P53蛋白野生型半衰期极短,而突变型半衰期很长,所以一般通过免疫组化检测到的是突变型P53基因。本组结果表明,P53在BUC中阳性率明显高于正常膀胱黏膜组织,且与病理分级、临床分期及预后密切相关(P<0.05),因此,推测P53蛋白异常高表达参与了BUC的发生、发展及预后过程。
最近Yang等[13]发现,通过对侵袭性膀胱癌基因测序发现约14%为CDKN1A(p21)突变,其中有一半为CDKN1A-TP53共突变。应用吉西他滨和CHK1抑制剂联合治疗后发现CDKN1A-TP53共突变的细胞系(647V和RT-112)在G2/M周期检验点中显著依赖CHK1活性,与其他细胞系 (TP53或P21单突变)对比,该两种细胞对治疗的敏感性显著增加。本文研究结果显示:膀胱癌组织中CHK1和P53蛋白表达呈正相关(r=0.207,P<0.05),提示两者存在协同作用。因此,认为在膀胱癌中联合检测CHK1和P53蛋白为临床治疗提供新的思路。
综上所述,本研究证明了CHK1和P53蛋白高表达与BUC的发生、发展及预后密切相关,且两者表达呈正相关关系,联合检测可为膀胱癌的诊断和治疗提供新的理论依据,尤其是抑制或降低CHK1蛋白表达水平可能在膀胱癌治疗中具有良好的应用前景,但两者间的相互作用机制等尚需进一步深入研究。
[1] Zaehos G,Rainey MD,Gillespie DA.Chkl-dependent S-M checkpoint delay invertebrate cells is linked to maintenance of viable replieation structure.Mol Cell Biol,2005,25(2):563
[2]Zhang Y,Hunter T.Roles of Chk1 in cell biology and cancer therapy.Int J Cancer,2014,134(5):1013
[3]Vazquez A,Bond EE,Levine AJ,et al.The genetics of the P53 pathway,apoptosis and cancer therapy.Nat Rev Drug Discov,2008,7(12):979
[4]汪勤,解正新,张卫琴.P16、P53和ki67蛋白在子宫颈上皮内瘤变中的表达及意义.临床与实验病理学杂志,2013,29 (5):551
[5]Schwartz GK,Shalt MA.Targeting the cell cycle:a new approach to cancer therapy.J Clin Onol,2005,23(36):9408
[6]Bo S,Hui H,Li W,et al.Chk1,but not Chk2,is responsible forG2/M phase arrestinduced by diallyl disulfide in human gastric cancer BGC823 cells.Food Chem Toxicol,2014,68(6):61
[7] Fang Y,Yu H,Liang X,et al.Chk1-induced CCNB1 overexpression promotes cell prolifer-ation and tumor growth inhumancolorectalcancer.CancerBiolTher,2014,15(9):1268
[8] Grabauskiene S,Bergeron EJ,Chen G,et al.Checkpoint kinase 1 protein expression indicates sensitization to therapy by checkpointkinase 1 inhibition in non-small cell lung cancer.J Surg Res,2014,187(1):6
[9]Russell MR,Levin K,Rader J,et al.Combination therapytargeting the Chk1 and Weel kinases shows therapeutic efficacy inneuroblastoma.Cancer Res,2013,73(2):776
[10]W-T Wang,J WF Catto,M Meuth.Differential response of normal and malignant urothelial cells to CHK1 and ATM inhibitors.Oncogene,2015,34(22):2887
[11]Li CC,Yang JC,Lu MC,et al.ATR-Chk1 signaling inhibition as a therapeutic strategy to enhance cisplatin chemosensitivity in urothelial bladder cancer.Oncotarget,2015,7(2):1947
[12]Soussi T,Beroud C.Assessing TP53 status in human tumours to evaluate clinical outcome.Nat Rev Cancer,2001,1(3):233
[13]Yang L,David J,Kwiatkowski.Combined CDKN1A/TP53 Mutation in Bladder Cancer Is a Therapeutic Target.Molecular Cancer Therapeutics,2015,14(1):174

