pH和溶解氧对上海蕴藻浜河道沉积物重金属的影响
袁时珏+张道方
摘要:通过改变上覆水体pH和溶解氧,并采用改进的由欧共标准测量与检测局(BCR)提出的连续提取法,研究pH和溶解氧对蕴藻浜沉积物中Cu、Cr释放的影响,以及沉积物释放前后Cu、Cr形态的变化,探索沉积物中重金属释放的机理.结果表明:随着pH增加,沉积物中重金属释放量下降,可还原态在沉积物中的含量上升,可氧化态与酸可提取态含量均有下降,这主要和H+与重金属离子的竞争以及沉积物中自然胶体的吸附有关;随着溶解氧含量增加,沉积物中重金属释放量升高,可氧化态含量呈明显下降趋势,而可还原态含量略有上升趋势,这主要与沉积物的还原性、硫化物及铁锰氧化态重金属有关.
关键词:pH; 溶解氧; 沉积物; 释放; Cu; Cr
中图分类号: X 52 文献标志码: A
Abstract:In this paper,effects of pH and dissolved oxygen(DO) on Cu and Cr release in the sediment from Yunzaobang River in Shanghai were studied by adjusting pH and concentration of the dissolved oxygen in the overlying water.The changes of Cu and Cr speciation in Yunzaobang River sediment were also analyzed and compared using the modified BCR sequential extraction method to explore the release mechanism.The results showed that with the increased pH,both Cu and Cr release from the sediment decreased.The percentage of the reducible form increased.But the percentage of the oxidizable form and HAc soluble form reduced,which was related to the competitive relation between H+ and metal ion as well as adsorption of the colloid in the sediment.With the rising concentration of DO,both Cu and Cr release increased.The percentage of the oxidizable form reduced obviously while that of the reducible form rose slightly,owing to the reducibility of the sediment itself as well as the existence of sulfide and FeMn oxides in the sediment.
Keywords:pH; dissolved oxygen; sediment; release; Cu; Cr
上海是具有悠久历史的工业化大城市,其人口密度高,排污总量大,污染负荷重,水环境问题也尤为突出.河道沉积物是河流生态系统的重要组成部分,也是各类污染物的载体,特别是重金属污染物的蓄积库.长期以来,沉积物与水体之间存在着密切的能量和物质交换[1],沉积物的污染状况也是衡量河道水环境的重要指标.
重金属主要通过人为来源(生活及工业排污)和自然来源(大气沉降[2]、海洋来源[3]、陆地风化[4]等地化学活动)进入河道水体.水体中有机质等胶体通过吸附、络合、絮凝、沉降等作用富集在沉积物中,一旦水体环境条件发生改变,水-沉积物界面的动态平衡会被打破,易使得沉积物中的重金属发生迁移转化而引发水体二次污染[5-7].重金属的迁移转化机制主要可概括为离子交换作用、溶解作用和解析作用[8],因此,体系中pH、溶解氧等条件的改变都会对重金属的迁移性以及形态分布产生一定影响.铜(Cu)在水体中的本底值较高,活性较大,可通过水生生物进入食物链,长期在人体内积累易引发肝硬化、肝腹水等疾病;铬(Cr)是水体及沉积物中含量较高的重金属元素,对水生生物和人体的危害也较大,长期积累会引发蛋白质变性而中毒.
蕴藻浜西起上海嘉定区吴淞江,于吴淞口汇入黄浦江,全长为38 km,是流经宝山工业区的一条主要航道,长期承担着宝山区调水排污的功能,区域内全长为15.6 km.此外,宝山区向蕴藻浜排污的企业多达181家,主要分布在钢铁、化工、机械、食品等行业[9].本文以蕴藻浜作为工业区的代表河道,采用实验室模拟、控制单因素的方法,研究不同pH和溶解氧(DO)对沉积物中Cu、Cr释放的影响,并选用改进的由欧共标准测量与检测局(BCR)提出的连续提取法[10-11]对重金属形态的变化进行分析.
1 材料与方法
1.1 样品采集与处理
利用柱状采样器在蕴藻浜-沪太路侧(东经121°22′和北纬31°20′) 采集表层沉积物样品,密封于聚乙烯盒中,样品总量约5 kg.利用水样采样器对采样点上覆水体进行采集,密封于聚乙烯瓶中,水样总量约20 L.样品运输至实验室后,对于沉积物样品,将其小部分样品烘干后,去除大颗粒杂质,研磨过100目筛,装入密封袋于干燥皿中保存,用于常规指标的检测;其余大部分样品,充分混合均匀后,于4 ℃冷藏保存,主要用于模拟释放实验.对于水样,去除大颗粒杂质如水草等后,于4 ℃冷藏保存.
1.2 仪器与试剂
本研究所用的仪器主要包括:电感耦合等离子质谱仪(ICPMS NexION300,美国珀金埃尔默公司)、微波消解仪与赶酸炉(上海屹尧仪器科技发展有限公司)、便携式水质分析仪(Multi 3410,德国WTW公司)、总有机碳分析仪(Muliti N/C 3100,德国耶拿公司)、激光粒度分布仪(BT9300Z,丹东百特仪器有限公司).实验设备主要包括:六联数显电动搅拌器(金坛市白塔新宝仪器有限公司)、柱状采样器与水样采样器(武汉轩明宇环保科技有限公司).试剂主要包括:NaAc、NH2OH·HCl、HAc、H2O2、NH4Ac、NaOH、HCl均为分析纯,由国药集团化学试剂有限公司购得;HNO3和HF均为分析纯,由德国默克公司购得.去离子水产自MilliQ Advantage超纯水系统(美国密理博公司,电阻率18.2 MΩ).实验所用容器均需在使用前用体积分数为10%的 HNO3溶液浸泡24 h以上,并用超纯水冲洗3次以上.
1.3 实验方法及条件
1.3.1 水体及沉积物理化指标的测定
现场采样时,需用便携式水质分析仪对水体的pH、溶解氧、水温、总悬浮颗粒(TDS)、沉积物氧化还原电位(ORP)进行测定.在选定的河道两点间,多次记录漂流物经过时间,求出水流的速度.返回实验后,需在24 h内对沉积物的pH、有机质含量、含水率、中值粒径(D50),水体总有机碳(TOC)进行测定.沉积物pH按照泥水质量比1∶2.5混合后测定;有机质含量选用烧失量法,温度为500 ℃,升温速度为3 ℃·min-1,恒温2 h[12].所有指标均需做3个平行样.
1.3.2 重金属总量的测定
精确称取0.10 g充分干燥的沉积物样品置于聚四氟乙烯消解罐中,将由浓硝酸、氢氟酸、双氧水按体积比6∶1∶1组成的消解液加至消解罐中进行微波消解.微波消解仪按工作程序参数分别设置为:第一步,温度160 ℃,压力1.515×106 Pa,时间2 min;第二步,温度190 ℃,压力1.818×106 Pa,时间3 min;第三步,温度210 ℃,压力2.222×106 Pa,时间10 min.冷却后,在温度150 ℃下赶酸2~3 h,定容,用0.45 μm水溶性过滤头过滤,采用ICPMS对Cu、Cr的质量浓度进行测定.同时采用水系沉积物国家标准物质GBW07309(GSD9)作为质控样,与样品一起消解并检测,检验方法的准确性.该方法的回收率需在80%~120%之间,相对误差在±10%以内.所有指标均需做3个平行样.
1.3.3 重金属形态的测定
采用改进的BCR连续提取法[10]对沉积物中Cu、Cr的形态进行分析.重金属形态可分为水溶态(F1)、酸可提取态(F2)、可还原态(F3)、可氧化态(F4)和残渣态(F5).酸可提取态主要包括离子交换态和碳酸盐结合态,可还原态主要为铁锰氧化物结合态,而可氧化态为有机质、硫化物结合态[13-14].提取步骤为:
(1) 提取水溶态(F1):准确称取1.00 g过100目筛的干燥沉积物,置于50 mL聚乙烯离心管内,加入25 mL去离子水,室温下振荡2 h后,以转速4 000 r·min-1离心20 min,分离上清液和残渣.上清液经0.45 μm水溶性过滤头过滤后储存于取样瓶中,此过程需完成两次.过滤样酸化,存放于4 ℃的环境中待测.
(2) 提取酸可提取态(F2):取0.50 g过100目筛的干燥沉积物样品,置于50 mL聚乙烯离心管内,加入20 mL 摩尔浓度为0.11 mol·L-1 的HAc溶液,室温下振荡16 h后,以转速4 000 r·min-1离心20 min,取5 mL上清液,将其经0.45 μm水溶性过滤头过滤后储存于取样瓶中,酸化,冷藏保存待测.用去离子水洗涤残渣2次,离心弃去上层清液,此过程每个提取步骤后都要进行.
(3) 提取可还原态(F3):向步骤(2)中装有残渣的离心管内加入20 mL 摩尔浓度为0.1 mol·L-1 的NH2OH·HCI溶液,室温下振荡16 h,转速4 000 r·min-1下离心20 min,取5 mL上清液经0.45 μm水溶性过滤头过滤后储存于取样瓶中,酸化,冷藏保存待测.
(4)提取可氧化态(F4):向步骤(3)中装有残渣的离心管内加入5 mL 体积分数为30%的 H2O2溶液,置于25 ℃水浴l h,再向管内加入5 mL体积分数为30%的H2O2溶液再置于(85±2)℃水浴加热l h,水浴蒸发至近干,然后加入25 mL摩尔浓度为1 mol·L-1 的NH4Ac溶液,室温下振荡16 h,转速4 000 r·min-1下离心20 min,取上清液经0.45 μm水溶性过滤头过滤后储存于取样瓶中,酸化,冷藏保存待测.
(5)提取残渣态(F5):将残渣于50 ℃充分干燥,研磨过100目筛,准确称取0.10 g,将由浓硝酸、氢氟酸、双氧水按体积比6∶1∶1组成的消解液加至聚四氟乙烯消解罐中微波消解.此步骤的提取液及之前四个步骤的水样均通过ICPMS的检测.同时,选用水系沉积物国家标准物质GBW07309(GSD9)作为质控样,与样品一起进行形态分析并检测,以检验形态,分析方法的准确性.该方法的回收率需在80%~120%之间,相对误差±10%以内.所有指标均需做3个平行样.
1.3.4 不同pH和溶解氧条件下重金属的释放实验
根据实际测得的蕴藻浜河水深度与沉积物厚度之比(8∶1),将混合均匀的蕴藻浜沉积物样品平铺于2 L烧杯底部,每个烧杯内沉积物厚度为(2±0.1)cm,质量为(500±2)g.沿烧杯壁缓慢加入(2±0.01)L河水,用六联电动搅拌器模拟实际河道水流流速(搅拌转速为150 r·min-1).采用单因素控制的方法,检测不同水体pH和溶解氧条件影响下上覆水体中重金属Cu、Cr的质量浓度,并分析Cu、Cr形态分布的变化,以探究其释放机理.
(1) pH条件:在模拟实际河道水温及流速的同时,采用摩尔浓度为1 mol·L-1的NaOH溶液和HCl溶液调节,使用pH计进行测量,控制pH分别为(3±0.2)、(5±0.2)、(7±0.2)和(9±0.2),DO等其他条件均与常态相同.
(2) DO条件:在模拟实际河道水温及流速的同时,采样曝气和充氮气的方式调节水体溶解氧,使用便携式水质分析仪测量,控制DO分别为(0.5±0.2)、(2±0.2)、(4±0.2)、(8±0.2)mg·L-1,pH等其他条件均与常态相同.
取烧杯底部底泥上方3 cm水样5 mL,用0.45 μm滤头过滤,滴加硝酸酸化,存放至4 ℃的环境中待测,此测量结果作为释放的背景初始值.之后,前三天每天采样,三天后每隔一天对烧杯底部沉积物上方3 cm进行采样.实验周期为21 d,每次采样5 mL至取样瓶,用0.45 μm滤头过滤,滴加硝酸酸化,存放至4 ℃的环境中待测Cu、Cr的质量浓度.
2 实验结果和讨论
2.1 蕴藻浜河道水体及沉积物的理化指标
供试水体的基本理化性质为:pH为7.11、DO的质量浓度为2.07 mg·L-1、温度为13.06 ℃,TDS的质量浓度为558 mg·L-1、TOC的质量浓度为8.50 mg·L-1、水流速度为0.57 m·s-1.沉积物的基本理化性质为:pH为6.87、有机质含量为46.58 mg·g-1、含水率(质量分数)为41.92%、中值粒径为23.36 μm、氧化还原电位为-123.57 mV.水体中Cu、Cr的质量浓度分别为11.10、13.02 μg·L-1,沉积物中Cu、Cr的质量浓度分别为459.65、418.40 μg·L-1.参考我国《地表水环境质量标准(GB 3838—2002)》[15],蕴藻浜—沪太路侧水质满足Ⅴ类标准,即适用于农业用水区及一般景观要求水域;参考沉积物氧化还原电位与沉积物特性及控制元素的关系[16],蕴藻浜—沪太路侧采样点沉积物性质为还原性,处于缺氧或厌氧环境,由SO2-4/HS-和S/HS-体系控制;参考乌顿—温德华氏粒级标准(UddenWentworth grade scale)[17-18],判断其粒径类别为粉砂.
2.2 pH对沉积物中重金属释放规律的影响
2.2.1 pH对沉积物中Cu、Cr释放量的影响
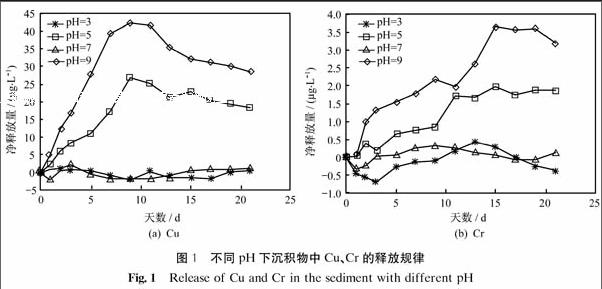
图1为不同pH下沉积物中Cu、Cr的释放规律.由图可以看出,沉积物中Cu、Cr在pH=3~9范围内释放量变化很大,Cu的净释放量在-5~45 μg·L-1,Cr的净释放量在-1~4 μg·L-1.Cu和Cr的释放量均呈现出随着pH增大而降低的趋势,且Cu的释放速率较快.在pH=3和pH=5两种实验条件下,水体处于酸性环境,两种重金属的释放量均较大,且随着时间增长释放量先增大,达到峰值后又略有下降并趋于稳定.在pH=7和pH=9两种实验条件下,水体处于中性或碱性环境,Cu、Cr的净释放量在0 μg·L-1左右波动,不易释放.其中,pH=7时,水体pH接近常态,在自然水体中重金属元素本身存在一定的动态平衡,不易有大量的释放或吸附;pH=9时,水体处于碱性环境,重金属元素易发生络合而出现沉淀现象,抑制重金属元素的释放.这与Atkinson等[19]的研究结果相符,在弱酸性(pH=6)条件下上覆水体中Zn、Cu、Pb、Cd的含量均明显高于中性条件(pH=7.2)和弱碱性条件(pH=8.1)的含量.
2.2.2 pH对沉积物中Cu、Cr形态分布的影响
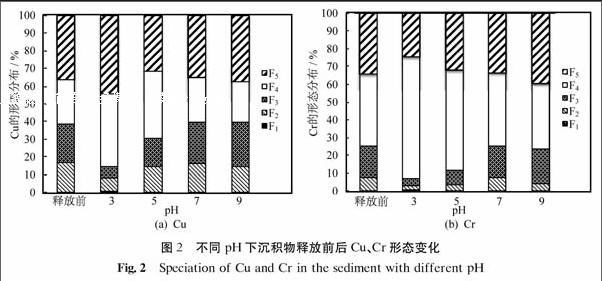
图2为不同pH下沉积物释放前后Cu、Cr形态的变化.由图可以看出,沉积物中Cu、Cr的形态在pH=3~9有明显变化,其中变化幅度最大的为可还原态(F3)和可氧化态(F4),酸可提取态(F2)和残渣态(F5)也稍有变化,由于水溶态(F1)本身含量较小,变化不明显.随着pH上升,可还原态(F3)在沉积物中含量上升,可氧化态(F4)下降,酸可提取态(F2)略有下降.残渣态(F5)相对比较稳定,其含量的变化主要是由于其他形态的变化而引起的.Appel等[20]的研究表明:pH是影响重金属吸附特性的主要因素,其控制着重金属的水合氧化物、碳酸盐和磷酸盐的溶解度,并且也影响着沉积物中重金属的水解、有机质的溶解、粘土表面电荷的变化以及离子对的形成.
2.2.3 pH影响下沉积物中重金属释放的机理
水体pH是引起沉积物中重金属释放的一个重要因素,主要表现在制约重金属的溶解度、控制沉积物对重金属吸附-解析的过程以及重金属的赋存形态等方面.从实验结果得出,酸性环境更有利于沉积物中重金属的释放,特别对于其可还原结合态和酸可提取态重金属的释放有促进作用.相关吸附-解析机制可概括为:① pH降低,沉积物中碳酸盐结合态溶解,H+与重金属离子发生竞争吸附而促进释放,故在酸性条件下酸可提取态(包含碳酸盐结合态)呈下降趋势.② 沉积物中存在着不同类型的自然胶体(铁锰氧化物等),铁锰氧化物本身具有两性的特点,又可作为重金属的主要吸附剂,其表面电荷和吸附位受pH影响较大[21-22].pH降低,铁锰金属水合氧化物析出OH-而带正电荷,与金属阳离子竞争吸附位,促使沉积物中金属离子向水体释放,同时,Fe(Ⅱ)和Mn(Ⅱ)氧化生成铁锰氧化物的速率受到抑制而使得吸附重金属的能力大大下降.pH升高,析出H+而带负电荷,易吸附金属阳离子而使得上覆水体中重金属向沉积物迁移.故随着pH降低,沉积物中重金属的可还原态(铁锰氧化物结合态)含量明显下降.③ 沉积物中重金属的释放还与重金属本身的性质有关,Cu、Cr在水体及沉积物中的本底值均相近,但低pH影响下Cu的释放量高达Cr释放量的10倍.
2.3 DO对沉积物中重金属释放规律的影响
2.3.1 DO对沉积物中Cu、Cr释放量的影响
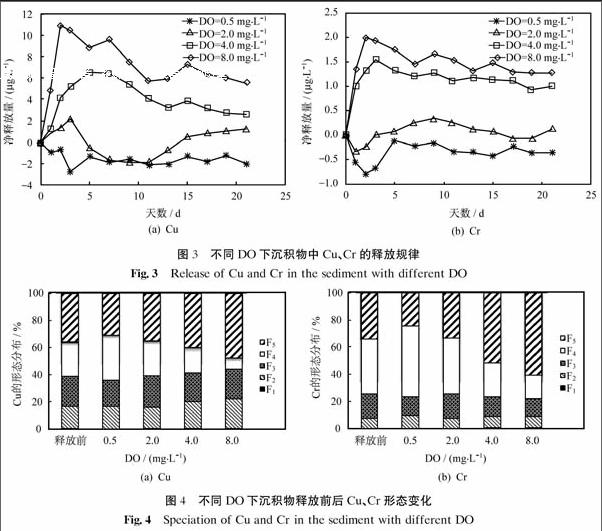
图3为不同DO下沉积物中Cu、Cr的释放规律.由图可以看出,沉积物中Cu、Cr在DO=0.5~8 mg·L-1范围内释放量变化很大,Cu的净释放量在-5~11 μg·L-1,Cr的净释放量在-1~2 μg·L-1.Cu、Cr的释放量均随着DO的增大而升高,释放速率也相近.在DO分别为4、8 mg·L-1时,随着DO上升,释放量的上升趋势较为明显,均在短时间内随时间增长释放量增大,达到峰值,随后又逐渐下降并趋于平稳;在DO为2 mg·L-1时,接近自然水体常态,重金属释放量随着时间增长在0 μg·L-1附近波动,表明在自然水体中重金属总量呈动态平衡;在DO为0.5 mg·L-1,水体处于临界缺氧状态,重金属Cu、Cr的净释放量均为负值,沉积物处于吸附重金属状态,其吸附量随时间先增大后下降,并趋于平稳.路永正等[23]的研究表明,经过曝气,沉积物中Pb、Cd、Cu、Zn均会有所释放,其重金属形态由相对稳定的形态转化为较为活跃的结合态,大大加重了生物毒性.
2.3.2 DO对沉积物中Cu和Cr形态分布的影响
图4为不同DO下沉积物释放前后Cu、Cr形态变化.由图可以看出,沉积物中Cu、Cr的形态在DO为0.5~8 mg·L-1之间有明显变化,其中变化幅度最大的为可氧化态(F4),其次为残渣态(F5)、酸可提取态(F2)和可还原态(F3).随着DO上升,可氧化态(F4)在沉积物中含量呈明显下降趋势,而可还原态(F3)含量略有上升.残渣态(F5)在沉积物中较为稳定,其含量的变化主要是由于其他形态的变化而引起的.Kelderman等[24]的相关研究表明,随着河道水体溶解氧含量的升高,Cu、Zn、Pb的酸可提取态含量随之升高,可氧化态随之下降,而对于可还原态,Cu有明显升高趋势,Pb则下降.
2.3.3 DO影响下沉积物中重金属释放的机理
水体溶解氧是影响沉积物中重金属活性的又一重要因素.对于蕴藻浜沉积物而言,沉积物为还原型,Cu、Cr的释放量与DO呈正相关,其可氧化态和可还原态受DO的影响较为明显.相关吸附-解析机制可概括为:① 与沉积物的本身性质及硫化物有关.在还原性沉积物中,氧化还原电位低,由硫系控制,硫酸盐易与重金属结合生成难溶性的金属硫化物,重金属的可氧化态为主要的赋存形态.DO升高,硫化物结合态的重金属易发生氧化反应生成硫酸盐,并释放出重金属从而使得上覆水体重金属含量升高.② 与重金属的可还原态有关.DO下降至临界缺氧状态,沉积物中铁锰水合氧化物被还原,引起重金属离子的释放,故Cu的可还原态含量略有下降趋势.DO升高,由于体系中存在FeS和MnS等硫化物,随着DO升高被氧化而释放出的Fe(II)和Mn(II)又迅速在高溶解氧条件下形成铁锰(氢)氧化物胶体.这种胶体又易吸附上覆水体中的重金属,而使得在高溶解下重金属先释放至峰值后共沉降[25].
3 结 论
本文以蕴藻浜沪太路侧沉积物为对象,研究不同pH和DO对沉积物中Cu、Cr的释放规律以及形态分布的影响,并探讨其释放机理.结果表明:
(1) 沉积物中Cu、Cr的酸可提取态、可还原态和可氧化态含量之和较大,迁移能力较高,易在环境条件发生改变时向水体迁移从而形成二次污染.
(2) 上覆水体pH和DO对沉积物中Cu、Cr的活动性有显著的影响.对于蕴藻浜还原型沉积物而言,酸性条件和高溶解氧条件较有利于Cu、Cr向水体的释放,这主要与沉积物的性质、硫化物结合态和铁锰氧化物结合态的特性,以及离子间的竞争吸附有关.
(3) 沉积物中重金属Cu的释放能力、最大释放量及释放速率均大于Cr,两种重金属的释放过程较为相似.
参考文献:
[1] MORIN S,DUONG T T,DABRIN A,et al.Longterm survey of heavymetal pollution,biofilm contamination and diatom community structure in the Riou Mort watershed,SouthWest France[J].Environmental Pollution,2008,151(3):532-42.
[2] 马建军,田林锋,马春梅,等.基于统计的石嘴山市工业园区大气污染物及其重金属分布特征[J].环境化学,2013,32(1):164-165.
[3] 彭修强,项立辉,郭娜,等.南黄海南部海域表层沉积物重金属来源解析及风险评价[J].环境科学学报,2015,35(11):3628-3638.
[4] 谢丽,张振克.长江北支口门圆陀角附近潮滩沉积物重金属来源及污染评价[J].地理科学,2015(3):380-386.
[5] 贾英,方明,吴友军,等.上海河流沉积物重金属的污染特征与潜在生态风险[J].中国环境科学,2013,33(1):147-153.
[6] 徐庆,钱瑾,张毓祥,等.上海市黄浦江表层沉积物重金属污染评价[J].中国环境监测,2011,27(3):89-92.
[7] 张兆永,吉力力·阿不都外力,姜逢清.艾比湖表层沉积物重金属的来源、污染和潜在生态风险研究[J].环境科学,2015,36(2):490-496.
[8] 吕继涛.颤蚓生物扰动对沉积物中重金属释放及形态分布的影响[D].长春:吉林大学,2009.
[9] 王旭.上海蕴藻浜沿岸生态适宜性评价[D].上海:上海交通大学,2013.
[10] VANK A,GRYGAR T,CHRASTNY V,et al.Assessment of the BCR sequential extraction procedure for thallium fractionation using synthetic mineral mixtures[J].Journal of Hazardous Materials,2010,176(1-3):913-918.
[11] URE A M,QUEVAUVILLER P,MUNTAU H,et al.Speciation of heavy metal in soils and sediments.An account of the improvement and harmonization of extraction techniques undertaken under the auspices of the BCR of the Commission of the European Communities[J].International Journal of Environmental Analytical Chemistry,1993,51(1-4):135-151.
[12] 胡彩莉,马玉贞,郭超,等.烧失量法测定土壤有机质含量的实验条件探究[J].地球与环境,2016,44(1):110-118.
[13] 冯素萍,鞠莉,沈永,等.沉积物中重金属形态分析方法研究进展[J].化学分析计量,2006,15(4):72-74.
[14] 王国莉,陈孟君,范红英,等.四种土壤重金属形态分析方法的对比研究[J].浙江农业学报,2015,27(11):1977-1983.
[15] 国家环境保护总局.GB 3838—2002 地表水环境质量标准[S].北京:中国标准出版社,2002.
[16] 吴金浩,刘桂英,王年斌,等.辽东湾北部海域表层沉积物氧化还原电位及其主要影响因素[J].沉积学报,2012,30(2):333-339.
[17] WENTWORTH C K.A scale of grade and class terms for clastic sediments[J].The Journal of Geology,1922,30(5):377-392.
[18] UDDEN J A.Mechanical composition of clastic sediments[J].Geological Society of America Bulletin,1914,25(1):655-744.
[19] ATKINSON C A,JOLLEY D F,SIMPSON S L.Effect of overlying water pH,dissolved oxygen,salinity and sediment disturbances on metal release and sequestration from metal contaminated marine sediments[J].Chemosphere,2007,69(9):1428-1437.
[20] APPEL C,MA L.Concentration,pH,and surface charge effects on cadmium and lead sorption in three tropical soils[J].Journal of Environmental Quality,2002,31(2):581-589.
[21] 毛竹,王浩.土壤重金属形态分布特性及其影响因素[J].科技资讯,2013(8):163-164.
[22] 章骅,何品晶,吕凡,等.重金属在环境中的化学形态分析研究进展[J].环境化学,2011,30(1):130-137.
[23] 路永正,董德明,沈秀娥,等.曝气对河流沉积物中重金属Cu,Pb,Zn和Cd释放的影响[J].吉林大学学报:理学版,2005,43(6):877-881.
[24] KELDERMAN P,OSMAN A A.Effect of redox potential on heavy metal binding forms in polluted canal sediments in Delft(The Netherlands)[J].Water Research,2007,41(18):4251-4261.
[25] CAETANO M,MADUREIRA M J,VALE C.Metal remobilisation during resuspension of anoxic contaminated sediment:Shortterm laboratory study[J].Water,Air,and Soil Pollution,2003,143(1-4):23-40.

