气体水合物分解热的研究进展
柳秀婷+刘妮+张亚楠+由龙涛
摘要:气体水合物作为新一代蓄冷介质,在空调蓄冷领域有良好的应用前景.其分解热是重要的热物性之一,对蓄冷系统的设计至关重要.介绍了国内外气体水合物分解热的研究进展,列出了气体水合物分解热的测量、计算方法以及影响气体水合物分解热的主要因素和影响机理,并指出气体摩尔分数和添加剂摩尔分数均会影响水合物的分解热,且气体分子直径是影响水合物分解热的主要因素.研究为水合物的开采利用、稳定性研究以及蓄冷系统的设计提供了理论基础.
关键词:气体水合物; 蓄冷; 分解热
中图分类号: TB 94 文献标志码: A
Abstract:As a new type of cool storage medium,gas hydrate has a good application prospect in air conditioning.The dissociation heat,one of the important thermal physical properties,is necessary to the designing of cool storage system.Recent advances in the dissociation heat of gas hydrate is presented in this paper.This work lists the calculated and measurement methods of the dissociation heat and elaborates the main factors affecting the dissociation heat and corresponding mechanism.This paper points out that the gas concentration and additive concentration have the effect on the dissociation heat.And the dominant factor that influences the dissociation heat of the hydrate is gas molecular diameter.The study on the dissociation heat provides the theoretical basis for the exploitation,the hydrate stability study,and the storage system design.
Keywords:gas hydrate; cool storage; dissociation heat
随着社会和经济的持续发展,空调使用越来越普及,工业和居民用电量增大,导致我国电网负荷和“峰谷”差越来越大.但是由于我国能源分布不均,能源利用效率普遍偏低,造成了能源供给的紧张.空调蓄冷技术能充分利用能量,节约费用.它利用白天与夜间的电价差,在夜间储存冷量,白天释放冷量制冷,有效平衡能源系统.
从外部而来的客体分子与水分子所形成的一种类似于包络状的结晶体被统称为气体水合物,它可以在冰点以上的条件
下进行结晶固化.制冷剂气体水合物由常规制冷剂和水在5~12℃相互作用生成,相变温度高,相变潜热大,储-释冷时的传递效率高,克服了水、冰和共晶盐等蓄冷介质的不足,被认为是一种比较有应用前景的空调蓄冷介质.
分解热是选择蓄冷材料时的一个重要依据.分解热越高,蓄冷剂的用量就越小,相应地可以减小蓄冷槽的容积,从而节省初投资和占地面积.此外,水合物的形成会堵塞油气输送系统,需要加热分解[1];每150~180个体积的天然气溶于每1个体积水中,可以储存和运输天然气[2];水合物的各种热性质直接影响它的稳定性,存在于地下的各种气体水合物的开采和一系列利用也需要利用水合物分解热数据进行分析[3].因此,测定水合物的分解热对于蓄冷材料的选择、蓄冷系统的设计以及水合物的开采利用和稳定性研究都非常必要.
1 气体水合物分解热的研究现状
气体水合物作为蓄冷介质应用于空调领域中具有很多优点.美国、日本率先对其展开研究,我国自20世纪80年代开始了这一研究工作.Gawron等[4]研究了相变温度在-70~0℃内的许多单元相变蓄冷材料的热物性;Krichel[5-6]绘制了大量的相变材料图表.20世纪70年代末,美国国家实验室开始利用差示扫描量热法(DSC)测试了多种相变材料的性能[7-8].Handa[9]和Lievois等[10] 都曾使用过量热法对纯组分和一些混合物的水合物分解热进行一系列测量分析,如甲烷、乙烷和丙烷气体水合物分解热.Rueff等[11]在平均温度为285 K时运用DSC对甲烷水合物的分解热进行了测量,最终结果为54.49 kJ·mol-1.文献[12-13]中也对CFC11水合物和HCFC141b水合物的分解热进行了测试.利用DSC测量了低压制冷剂HCFC141b气体水合物的分解热,结果表明,在相变温度约为6.5℃时,其分解热约为330 kJ·kg-1,和冰的潜热基本相同.
2 气体水合物分解热的测量方法
水合物分解热包含两部分:水由水合物相转变为液相所引起的焓差与气体水合物相转变为气相引起的焓差.分解热所包含的测量方法一般分为一般卡计法、差热分析法和差示扫描量热法.
2.1 一般卡计法
连续加热绝对法和投下冷却法为最常用的卡计法.当物质不发生过冷现象,并且融解热和凝结热保持一致时,可以使用投下冷却法进行测量.该方法需要测量四个温度,先测试融点Tm,然后分别对试样在低于融点的温度T1和高于融点的温度T2、T3三点做三次测试,由每次的焓值计算出融解热.该方法原理简单但测试过程繁琐,不适用于多相变点和有过冷现象的物质.在整个升温过程中均使用定常功率加热试样的方法称为连续加热绝对法 [14].使用该方法时卡计的热保护屏可以为试样系统提供一个绝热环境.忽略试样的热物性变化,在加热一段时间后,试样温度在空间的分布相对不变,试样各点的温度随时间的温升速率均相等.在此过程中,布置在试样任意点的热电偶均能测到试样的平均温升.
2.2 差热分析法
当温度在一定程序控制下以恒定速度变化时,对作为参比物的某种稳定物质与等量试样进行连续测量,得到温度差与温度之间的热谱图,并且通过分析从而得到所需要的数据被称为差热分析法(DTA).在选定参比物时,要求参比物在一定试验温度下不会发生任何化学反应和物理变化.
DTA曲线只适用于定性或半定量分析,主要原因是在产生热效应时试样与参比物,以及周围环境的温度有很大差异,热效应测量的灵敏度和精准度因三者之间发生了热交换均有所降低,并且试样升温速率的非线性使得校正系数K不断随温度变化,从而导致无法进行定量分析.
2.3 差示扫描量热法
差示扫描量热法是另外一种热分析法.在程序控制温度下,测量输入至试样与参比物内的热功率差和时间或温度之间的关系.DSC具有样品使用量少、测试速度快和定量分析精确的优点.利用DSC测试水合物分解热的研究在国内外都还很少,并且只进行了几种水合物的测试,主要有氙、四氢呋喃、环氧己烷、甲烷和丙烷等.
与DTA曲线不同的是,K在DSC曲线中与温度无关,不会随着温度变化而变化,因此DSC曲线可用于定量分析.然而,在使用DTA和DSC测量时,由于水合数均为假定,因此测量结果的准确性有待改进.
上述两种方法是测量水合物分解热最常用的方法.国内外已有学者利用这两种方法对不同水合物的分解热进行了测量分析.Fournaison等[15]利用DTA测得了CO2水合物的分解热为507 kJ·kg-1,比冰的分解热(333 kJ·kg-1)大.Lin等[16]在压力为2 MPa下使用DTA测得质量浓度为9.01%的四丁基溴化铵(TBAB)水合物的分解热为313.2 kJ·kg-1,比CO2水合物的分解热小,但是与冰的分解热接近.孙志高等[17]利用德国Netzsch的204HP/1/G Phoenix型DSC热分析仪,采用热循环法测量了TBAB水溶液的分解热,测量结果为195.9 kJ·kg-1.Marinhas等[18]也通过热循环法利用111type setaram 型高压DSC装置测得CO2水合物浆的分解热为500 kJ·kg-1,大约是冰浆分解热的1.5倍.此外,Sari等[19]通过实验证实了在压力为3 MPa时,水合物生成温度为1~2℃,溶解温度为8~10℃,并且利用高压DSC设备测得在固相质量分数10.8%时,CO2水合物的分解热为54 kJ·kg-1.此结果与Marinhas等[18]测得的结果一致.
3 气体水合物分解热的计算方法
水合物分解热不仅不易直接测量,而且也不可能直接测量所有条件下水合物的分解热,其主要原因是一些气体水合物的形成压力较高,以及形成的水合物纯度不易确定等.因此,可以利用测得的水合物相平衡数据,运用克劳修斯克拉贝龙方程计算0℃以上水合物的分解热.这为确定0℃以上气体水合物的分解热提供了一个简单可行的方法.计算方程可描述为
式中:p、T分别为水合物形成/分解的压力和温度;ΔH为分解热;Z为气体压缩因子;R为通用气体常数.
当压缩因子Z变化很小时,在很小的温度范围内都可以得到焓值.
然而,在使用克劳修斯克拉贝龙方程计算分解热时,得出的理论计算值与实验值往往会出现偏差.例如,理论上Ⅱ型水合物在形成时水分子与外来分子的分子数之比为17∶1,而在水合物的实际生成过程中,由于外来分子的晶格占有率可能稍有改变,从而导致理论计算值出现偏差.
为了得到更为准确的数据,在使用式(1)计算水合物的分解热时应同时考虑相体积变化、非理想气体、气体溶解度和水饱和度等因素.然而,在一定的限制条件下,式(1)可以应用在单变系统中(水+气体水合物)[1,20-21].
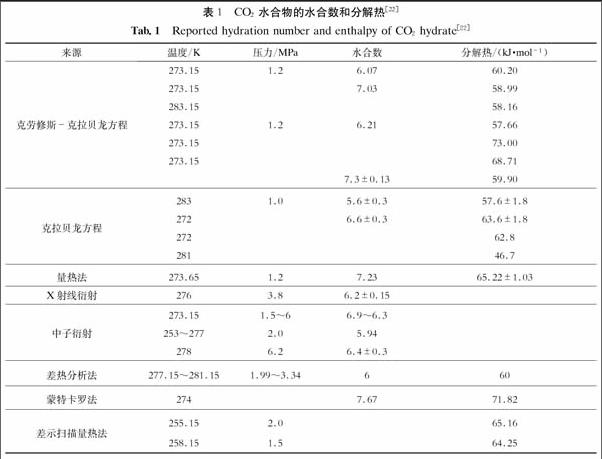
除了以上所介绍的方法外,还有很多测量水合物分解热的方法,只是不同方法得到的结果存在差异.表1给出了CO2水合物的水合数和分解热[22].但是目前还无法确定哪一种方法最精确.
4 影响水合物分解热的因素
4.1 气体分子摩尔分数对水合物浆分解热的影响
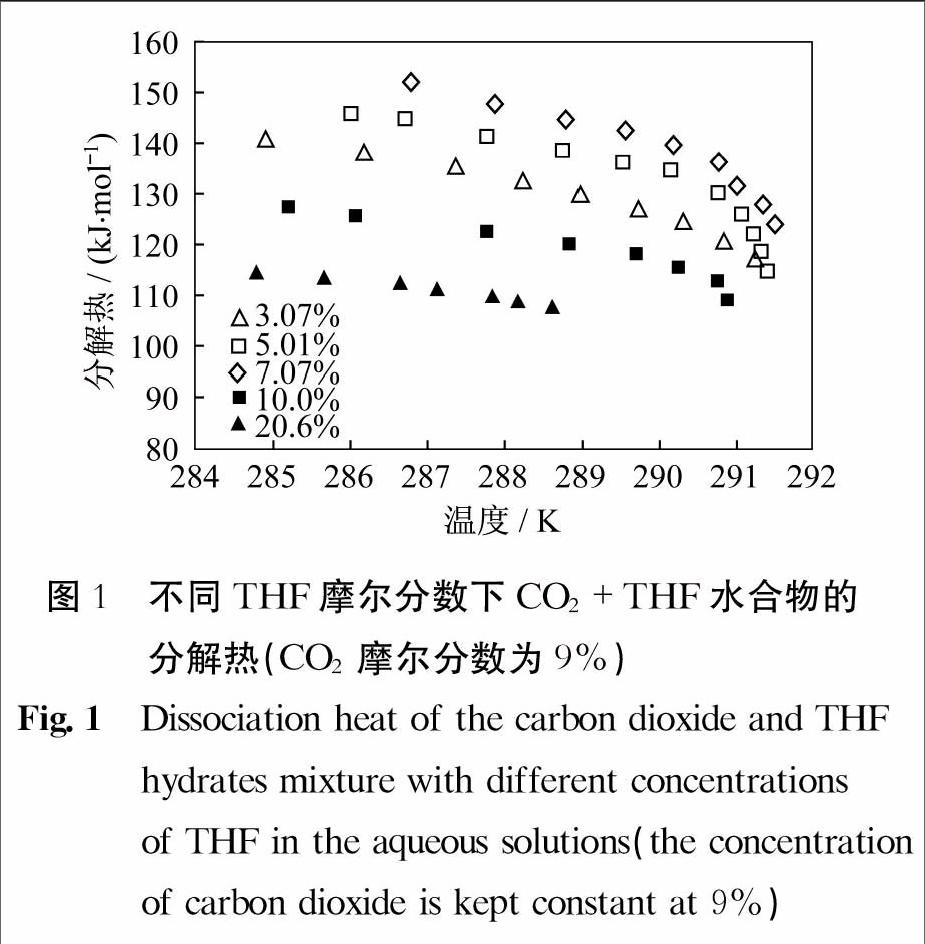
形成水合物浆的气体分子摩尔分数对浆体的相变潜热有较大影响,最佳的气体分子摩尔分数可以使水合物浆的表观黏度最小,相变潜热最大.CO2水合物浆的分解热与CO2摩尔分数有关[22-23],并且存在最佳摩尔分数.在四氢呋喃(THF)摩尔分数为5%,CO2摩尔分数分别为2%和3%时,发现CO2摩尔分数对CO2+THF水合物浆的分解热影响不大;当CO2摩尔分数增加至9%时分解热迅速增加,尤其是在低温区域;然而,当CO2摩尔分数增加到19%以及29%时,水合物浆的分解热明显减小.图1给出了不同THF摩尔分数下CO2+THF水合物浆的分解热.
4.2 添加剂对水合物分解热的影响
目前添加剂作为水合物生成促进剂已被广泛应用在水合物生成技术中,最佳的添加剂浓度应既可促进水合物的形成,又能促使水合物的分解[23].在生成CO2水合物时加入THF不仅可以降低水合物的生成压力,而且可以增加水合物的分解热[24].当温度在282.06~273.15 K内变化时,CO2水合物的分解热为56.85~75.37 kJ·kg-1,CO2+THF水合物的分解热为112.37~152.27 kJ·kg-1.水合物分解热增加了两倍,其主要原因是水合物的结构发生了改变(从Ⅰ型转变为Ⅱ型).并且,其分解热与THF摩尔分数有关(如图1所示),在摩尔分数为7%时得到最大值,大于7%时由于降低了水合物的稳定性反而对分解热有抑制作用.
Delahaye等[25]也将THF作为添加剂加入CO2中形成CO2+THF水合物,发现CO2+THF水合物的分解热约为CO2水合物分解热的两倍,此结果与Sabil等[23]的结果一致.
4.3 气体分子直径对水合物分解热的影响
水合晶体的结构取决于气体分子与晶穴内径的相对尺寸大小,并且外来气体分子的大小对水合物的形成起着至关重要的作用.刘永红等[26]根据测定的制冷剂气体水合物的形成条件和压缩因子,运用克劳修斯克拉贝龙方程计算并分析比较了HFC134a和HCFC141b水合物在0℃以上的分解热,结果表明水合物分解热与其结构有关.虽然这两种水合物的气体组分不同,但是分子大小相差无几,其分解热也比较接近.孙志高等[27]使用克劳修斯克拉贝龙方程分别计算了三种不同水合物的分解热,结果表明气体分子对水合物的分解热有很大影响.
5 结 论
本文指出了气体水合物分解热的研究进展、测量与计算方法及影响因素,指出了气体水合物在空调蓄冷领域的广阔前景.综述了国内外的研究成果后发现,形成水合物的气体摩尔分数和添加剂摩尔分数对水合物的分解热均有一定的影响,但由于实验过程中摩尔分数范围宽,为得到最佳浓度,还需要进一步分析研究.影响水合物分解热的主要因素并不是气体水合物的气体组分,而是形成水合物的气体分子直径.此外,水合物分解热还受到其他因素的影响,例如压缩因子、水合物的含水量等.在今后的研究工作中,应综合考虑各方面的影响因素,为气体水合物的稳定性研究以及蓄冷系统的设计等工作提供精确的基础数据.
参考文献:
[1] SLOAN E D,FLEYFEL F.Hydrate dissociation enthalpy and guest size[J].Fluid Phase Equilibria,1992,76:123-140.
[2] KHOKHAR A K.Storage properties of natural gas hydrates[D].Trondheim:Norwegian University of Science and Technology,1998.
[3] SLOAN E D J.Clathrate hydrates of natural gases[M].2nd ed.New York:Marcel Dekker Inc.,1998.
[4] GAWRON K,SCHROEDER J.Properties of some salt hydrates for latent heat storage[J].International Journal of Energy Research,1977,1(4):351-363.
[5] KRICHEL K.Latentwarmespeicher:Teil 1,Eigenshaften und anwendungs moglichkeien von latentwarmespeichern:Report BMVGFBWT,79-12[R].Berghausen,FRG:Institute fuer Chemie der Treib Explosivstoffe,1979.
[6] KRICHEL K.Latentwarmespeicher:Teil 2,Speichermassen bayformen und werkstoffe fuer schmelzwarmespeich:Report BMVGFBWT,79-13[R].Berghausen,FRG:Institute fuer Chemie der TreibundExplosivstoffe,1979.
[7] CANTOR S.Application of DSC (differential scanning calorimetry) to the study of thermal energy storage[J].Thermochimica Acta,1978,26(1/2/3):39-47.
[8] LANE G A.Solar heat storage:Latent heat materialVolume II:Technology[M].Florida:CRC Press Inc.,1986:50-65.
[9] HANDA Y P.Compositions,enthalpies of dissociation,and heat capacities in the range of 85 to 270 K for clathrate hydrates of CH4,C2H6,C3H8[J].The Journal of Chemical Thermodynamics,1986,18(10):915-921.
[10] LIEVOIS J S,PERKINS R,MARTIN R J,et al.Development of an automated,high pressure heat flux calorimeter and its application to measure the heat of dissociation and hydrate numbers of methane hydrate[J].Fluid Phase Equilibria,1990,59(1):73-97.
[11] RUEFF R M,SOLAN E D,YESAVAGE V F.Heat capacity and heat of dissociation of methane hydrates[J].AIChE Journal,1988,34(9):1468-1476.
[12] 梁德青.新型蓄冷介质制冷剂气体水合物相平衡热力学研究[D].上海:上海交通大学,2001.
[13] 梁德青,郭开华,樊栓狮,等.HCHC141B气体水合物融解热的DSC测试[J].工程热物理学报,2002,23(增刊):47-49.
[14] 陈则韶,葛新石,顾沁.量热技术和热物性测定[M].合肥:中国科学技术大学出版社,1990.
[15] FOURNAISON L,DELAHAYE A,CHATTI I.CO2 hydrates in refrigeration processes[J].Industrial & Engineering Chemistry Research,2004,43(20):6521-6526.
[16] LIN W,DELAHAYE A,FOURNAISON L,et al.Thermal properties of CO2 hydrate in the presence of TBAB[C].Beijing:International Congress of Refrigeration,2007.
[17] 孙志高,江承明,孙立.新型空调蓄冷材料四丁基溴化铵-水相变条件和相变热实验研究[J].制冷学报,2009,30(5):24-26.
[18] MARINHAS S,DELAHAYE A,FOURNAISON L,et al.Modeling of the available latent heat of a CO2 hydrate slurry in an experimental loop applied to secondary refrigeration[J].Chemical Engineering and Processing,2006,45(3):184-192.
[19] SARI O,HU J,BRUN F,et al.Insitu study of the thermal properties of hydrate slurry by high pressure DSC[C].Beijing:International Congress of Refrigeration,2007.
[20] GLEW D N.Some stoicheiometric gas hydrate[J].Nature,1959,184(4685):545-546.
[21] BARRER R M.Validity of clapeyrons equation for phase equilibria involving clathrates[J].Nature,1959,183(4659):462-463.
[22] HU J,SARI O,HOMSY P.Investigation of thermophysical and flow properties of CO2 hydrate slurry[J].International Journal of AirConditioning and Refrigeration,2011,19(3):213-229.
[23] SABIL K M,WITKAMPA GJ,PETERSA C J.Estimations of enthalpies of dissociation of simple and mixed carbon dioxide hydrates from phase equilibrium data[J].Fluid Phase Equilibria,2010,290(1/2):109-114.
[24] 刘莉,王世平,巫江虹,等.R142b气体水合物分解放冷过程的实验研究[J].制冷学报,1999,14(2):1-5.
[25] DELAHAYE A,FOURNAISON L,MARINHAS S,et al.Effect of THF on equilibrium pressure and dissociation enthalpy of CO2 hydrates applied to secondary refrigeration[J].Industrial & Engineering Chemistry Research,2006,45(1):391-397.
[26] 刘永红,梁德青,郭开华,等.制冷剂气体水合物分解热的确定[J].西安交通大学学报,2003,37(3):234-236.
[27] 孙志高,樊栓狮,郭开华,等.天然气水合物分解热的确定[J].分析测试学报,2002,21(3):7-9.

