直接氢化法制备氢化铝钠及性质
曹杰敏,王军勤,高建峰,龚 浩,黄媛媛,高生旺
(中北大学 理学院,太原 030051)
直接氢化法制备氢化铝钠及性质
曹杰敏,王军勤,高建峰,龚浩,黄媛媛,高生旺
(中北大学 理学院,太原030051)
以普通铝粉、卤代烃、氢化钠和H2等为主要原料,在常压低于100 ℃的条件下,采用铝的格氏试剂法,成功制备出氢化铝钠NaAlH4。通过FTIR、XRD表征,结合元素分析,研究其成分及结构,表明样品为氢化铝钠,实际与理论产率比值达到90%以上;根据SEM和online MS,对其进行表面形貌和稳定性研究。结果显示,晶体结构较完整,室温下稳定性好,自身储氢量与市售样品相当。该方法实现了常压下氢化铝钠的制备,且反应在常压下进行,产率和原料利用率都达到了工业要求,对其生产工艺的改进具有促进作用。
活化;直接氢化;多相反应;制备;氢化铝钠
0 引言
氢化铝钠(NaAlH4)是Schlesinger和Finholt等在1951年首次报道,并在1955年沿袭LiAlH4的合成方法,率先合成得到,因为其具有优秀的还原性能(与LiAlH4十分相似)受到众多学者的关注[1-3]。1997年,德国Plank-Max煤炭研究所的Bogdanovic等发现,NaAlH4在掺杂钛后,其储放氢性能大幅度得到改善[4-6],NaAlH4由此开始作为储氢材料被广泛研究[7-9],并成为氢能利用中的新成员[10]。
目前,关于NaAlH4的制备主要有复合法、液相法、单质直接合成法和固相球磨法等[11-14]。一般液相法对反应试剂纯度要求很高,需要加入催化剂来加速反应的进行,且产率较低;单质直接合成法对设备要求苛刻,需要在140 ℃以上的高压(13~18 MPa)环境下进行,难以满足工业化规模生产要求;固相反应条件要求也相对苛刻,常需要在较高压力下进行,且需要催化剂来加速反应[15]。根据过去研究表明,NaAlH4的制备比LiAlH4更为困难,这也是限制其大规模商品化的原因之一。尽管 NaAlH4的制备较为困难,国内的南开大学、复旦大学和中南大学等大学的学者们以及其他科研工作者还是对其进行了不懈的研究,并取得可喜的成果[16],在各种制备方法上有所突破。
根据以往研究结果和文献记载,烷基铝可直接氢化[17],进而与氢化钠发生反应;活化后的铝粉在液相中可直接氢化[18-19],得到氢化物与氢化钠很容易发生反应,综合各种制备方法的优缺点,并以近期实验结果为基础,文中提出了一种利用铝的直接氢化法[20]制备氢化铝钠的新方法。该方法利用普通铝粉、卤代烃、氢化钠和氢气等为主要原料,进行一系列的固液多相反应,进而结晶提纯得到样品,实现了NaAlH4在常温常压条件下的制备,使其制备成本和条件得到极大地降低,对其大规模生产工艺的改进具有一定意义。
1 实验
1.1氢化铝钠样品制备
对所用的试剂(分析纯)进行相关的除水处理,仪器真空干燥处理。称取一定量(约2 g)的普通铝粉(北京化学试剂厂)置于事先用氢气(99.999%,太原工业气体厂)置换过的三口烧瓶中,在氢气氛围中加入引发剂,以引发反应为适宜量(摩尔比约100∶1),再滴加卤代烃(天津化学试剂厂)进行反应,设定40 ℃左右搅拌(DF-101S集热式恒温加热磁力搅拌器),反应约30 min后,加入一定量的四氢呋喃溶液溶解,冷却至室温后,进行固液分离操作,分别取样测试。
全部操作尽可能迅速,避免长时间接触空气。向上述混合物中加入工业氢化钠NaH(60%,阿拉丁)(摩尔比1∶4)的甲苯(微量)溶液进行反应,升高温度至80 ℃,增大氢气的通入量,提高搅拌速率反应约6 h后加入一定量的四氢呋喃(天力化学试剂厂)进行溶解,继续搅拌约1 h后,冷却至室温,固液分离得到溶有样品的四氢呋喃溶液,蒸去溶剂得到固体样品,烘干后进一步重结晶提纯处理,得到样品产物。
1.2样品表征
使用FTIR-8400S型红外光谱仪(日本岛津),采用KBr压片法,测定样品制备过程中的红外光谱;使用vario ELCUBE型元素分析仪(德国elementary),对产品进行元素分析,表征其化学成分;采用Hitachi Su-1500场发射扫描电镜(日本电子),观察产品的表面形貌;使用Rigaku Ultimo IV Cu-Kα转靶型X射线衍射仪(日本理学电机株式会社),对样品结构进行最终确定;利用德国PFEIFFER Omni Star型气体分析质谱仪,对样品的储氢性能进行初步研究。
2 结果与讨论
2.1制备NaAlH4的理论设计与机理分析
普通铝粉的表面有一层氧化膜,活性很低,在引发剂作用下会破坏其表面的氧化层,将单质铝的表面暴露在液相环境中,进而可与卤代烃发生反应,实验中出现的大量白色烟雾,固体铝粉的明显减少,都表明反应被引发,活化后铝粉进入了液相中。暴露在液相中的活化铝粉活性较高,可与卤代烃生成有机铝试剂(烷基铝);高活性的铝粉甚至可直接与氢气化合生成不同晶型的氢化铝;这些高活性中间物质很容易与氢化钠发生反应,进而得到样品。这样的设计思路综合了固相和液相及直接法的优势,多类反应同时进行,既有利于产物的生成,又有利于原料的利用。直接氢化反应后固液分离进行表征,固体的XRD衍射如图1所示,液体的红外吸收如图2所示。
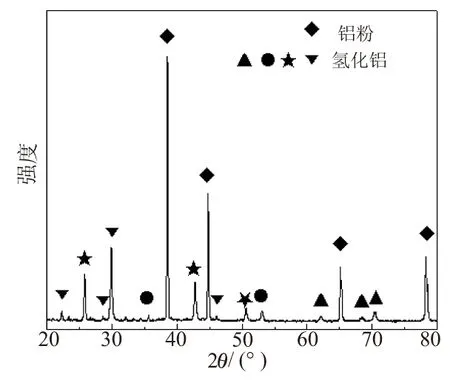
图1 直接氢化反应后固体的XRD衍射图谱
图1为直接氢化反应后固体部分的XRD衍射图。从图1可看出,固体中主要成分为铝粉,同时有不同晶型氢化铝的衍射峰存在,JCPDF卡片号分别为▲(23-0761)、●(28-0019)、★(34-1436)和▼(38-0756),表明反应中活化后的铝与氢气发生了反应,但生成量并不多。这是因为活性铝与氢气虽然可发生反应,但条件控制较困难,产率不会太高,生成的氢化铝也会覆盖在活化铝的表面,对其活性造成影响,阻止了反应的进行;另外,氢化铝[21]为活性物质,其本身稳定性不是很好(只有α-AlH3可在常温下稳定存在),容易分解。直接氢化反应后分离的固体与氢化钠半固相反应,在产物中虽然能检测到NaAlH4,但产率相对较低。一方面,该过程得到的氢化铝中间产物所占的比例较小;另一方面,半固相反应得到NaAlH4不能及时脱离反应体系,会包裹在氢化铝和活化铝的表面,阻碍反应进行。因此,导致产率偏低。在半固相反应中,氢气不仅作为保护气体,而且有一部分是直接参与反应的;同时,氢气氛围可产生一定的负压,达到抑制生成氢化铝钠分解的作用,这也是加入氢化钠反应后,需要加大氢气通入量的原因。
图2是直接氢化反应后液体的红外吸收光谱。从图2可看出,液体成分中有烷基铝出现,650 cm-1处C—Br键的特征峰消失,800 cm-1处出现Al—Br键的伸缩振动特征峰,以及1 200 cm-1处C—Al键特征峰,1 380、1 460、2 975 cm-1等是烷烃的特征峰,这些吸收峰的变化表明液体中有烷基铝生成,即活化后的铝粉与卤代烃发生类似格氏反应的过程。烷基铝活性很高,在氢气氛围中直接氢化,非常容易与氢化钠发生反应,NaAlH4的产率相对较高。为使更多活性铝粉进入液相反应,可通过加入稍过量的卤代烃实现。结果发现,反应液体变粘稠,出现交联现象,过量的卤代烃也会消耗氢化钠的量,反而使反应产率有所降低。因此,氢化钠的加入比例是一个关键影响因素,既要保证产率,又要消耗前期反应的剩余物,这就使得液相反应的原料利用率相对要低。
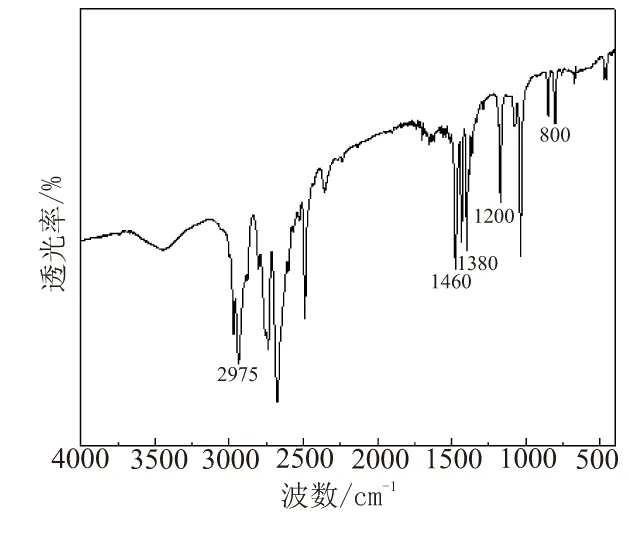
图2 直接氢化反应后液体的红外吸收光谱
综合考虑各种影响因素,采用固液不分离的多相反应体系。在直接氢化反应后,活化后的混合物会同时存在烷基铝和氢化铝,以及其他形式的有机铝,在此基础上,加入氢化钠的半固相溶液进行反应,这样既可利用各自的优势,也可避免固液分离反应的缺点,原料利用率和产率都得到很大提高。
图3是制备得到样品在重结晶前后的XRD衍射对比图。从图3可看出,其衍射峰与NaAlH4的(JCPDF:22-1337)衍射峰几乎完全一致,从而确定其得到样品为氢化铝钠NaAlH4。图中显示,重结晶之后NaAlH4的纯度明显提高,NaAlH4的衍射峰强度明显加强,杂质衍射峰基本消失,其杂质衍射峰可能是未反应的中间产物氢化铝(不同晶型的氢化铝在70~90 ℃范围内会向α-AlH3转化)固体和铝粉的残留。采用固液相不分离直接氢化反应与氢化钠反应的方法,稍过量的铝粉是有必要的。加入四氢呋喃作为溶剂,既可将铝粉表面的NaAlH4溶解,也可将液相中的NaAlH4分离出来,以减少生成NaAlH4对反应的影响。过滤就可除去未反应多余的原料,进行回旋蒸馏除去溶剂,即可得到样品,重结晶后,可得到高纯度的NaAlH4,如图3所示。根据实验数据显示,反应结束得到的样品质量约为3.71 g(反应原料铝粉为2 g),重结晶后,样品质量为3.63 g,实际产率与理论产率比值达到90%以上。
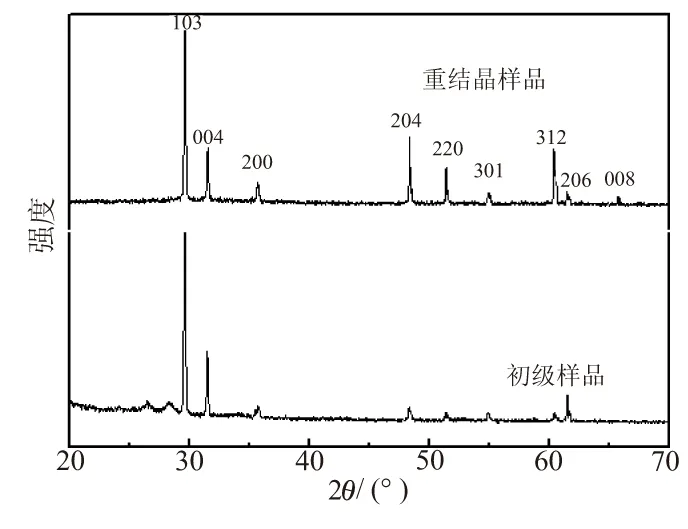
图3 重结晶前后的样品XRD衍射图
2.2样品NaAlH4元素分析
表1是对样品进行元素分析的实际测量值和NaAlH4的理论值的数据对比。从表1可看出,得到样品所含元素种类及含量分析与NaAlH4的理论数据基本一致,这与XRD的表征结果一致,进一步证明得到样品为NaAlH4,而且纯度相对较高,这也和预期的实验结果一致,体现了该方法的可行性。

表1 样品元素分析数据
2.3样品NaAlH4形貌表征
图4为样品氢化铝钠的SEM照片。其中,图4(a)是重结晶前,图4(b)是重结晶后。观察重结晶前后的样品表面形貌可看出,在制备过程中,得到的初级样品的结晶度并不是很好,晶体结构并不规整,有零星结晶不完整的颗粒存在,而且表面粗糙有细小的孔隙存在。重结晶提纯后,结晶度明显提高,晶体结构相对完整,可清晰看出氢化铝钠的正四面体结构,颗粒成型非常均匀,晶体结构接近完美。从其SEM图上也可看出,样品的晶体结构与NaAlH4的理论分析结果是一致的,表明该方法得到的样品NaAlH4的性质非常好,可达到目前的工业要求标准。
2.4样品NaAlH4分解过程表征
为研究样品NaAlH4的稳定性,对其进行在线质谱(H含量测试)表征。图5是样品NaAlH4的分解过程中氢气的在线质谱图,加热速率为5 ℃/min。

(a) 重结晶前

(b) 重结晶后
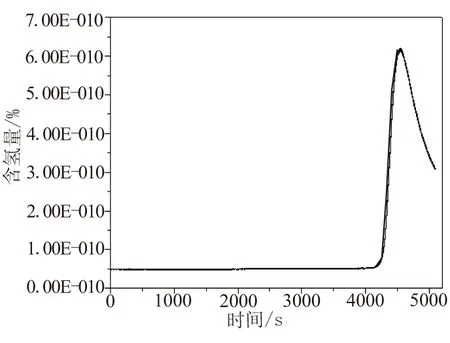
图5 样品NaAlH4的放氢在线质谱图
从图5可看出,在约230 ℃时,样品开始分解释放出H2,这与其理论分解放氢温度接近。结合图4形貌结构分析,说明该方法得到的NaAlH4稳定性非常好。经测定,该样品在常压干燥环境中保存3个月的分解率约为0.17%,适宜长期保存。
3 结论
本文提出在低于100 ℃常压条件下,利用铝的有机物活化直接氢化法,实现NaAlH4的制备。该方法利用普通铝粉,在引发剂作用下与卤代烃反应,进而在氢气氛围中与氢化钠反应得到NaAlH4,综合了固相和液相及直接化合等方法的优点,实现了高利用率和高产率的制备NaAlH4。反应在常压下进行,对设备和条件的要求大大降低。对样品进行重结晶提纯,得到高纯度的NaAlH4,实际与理论产率比高达90%以上;性质表征结果显示,其晶体结构完整,稳定性好,可在常压下长时间保存而不变质,具有非常好的工业化潜质。
[1]Li L,Xu C C,Chen C C,et al.Sodium alanate system for efficient hydrogen storage[J].International Journal of Hydrogen Energy,2013,38(21): 8798-8812.
[2]陈辰,张海斌,彭述明,等.Ti3AlC2体材料的高温临氢行为研究[J].无机材料学报,2014,29(8): 864-868.
[3]杨燕京,赵风起,仪建华,等.储氢材料在高能固体火箭推进剂中的应用[J].火炸药学报,2015,38(2): 8-14.
[4]Bhattacharyya R,Mohan S.Solid state storage of hydrogen and its isotopes: An engineering overview[J].Renewable & Sustainable Energy Reviews,2015,41(1): 872-883.
[5]梁初,梁升,夏阳,等.Mg(NH2)2-2LiH储氢材料的研究进展[J].物理化学学报, 2015,34(1): 627-635.
[6]Wu Z,Chen L X,Xiao X Z,et al.Influence of lanthanon hydride catalysts on hydrogen storage properties of sodium alanates[J].Journal of Rare Earths,2013,31(5): 502-506.
[7]李永涛,周广友,郑时友,等.NaAlH4空间约束体系的构建及其脱/加氢行为[J].中国材料进展, 2009,28(5):11-16.
[8]马俊, 李洁, 唐仁英, 等. 孔道Al2O3/SiO2对NaAlH4-Tm2O3体系储氢性能的影响[J].中国有色金属学报,2012,22(6): 1659-1666.
[9]Zheng X P,Liu S L.Effect of LaCl3and Ti on hydrogen storage properties of NaAlH4and LiAlH4[J].Rare Metal Materials and Engineering,2009,38(8): 1328-1332.
[10]Dathar G K P,Mainardi D S.Kinetics of hydrogen desorption in NaAlH4and Ti-containing NaAlH4[J].Journal of Physical Chemistry,2010,114(3): 8026-8031.
[11]Pukazhselvan D,Duncan P F,Srivastava O N.One step high pressure mechanochemical synthesis of reversible alanates NaAlH4and KAlH4[J].International Journal of Hydrogen Energy,2015,40(14): 4916-4924.
[12]卞祥,王日杰,杨晓霞.复分解法制备硼氢化钾[J].现代化工,2015,35(1): 95-100.
[13]Bergemann N,Pistidda C,Milanese C,et al. NaAlH4production from waste aluminum by reactive ball milling[J].International Journal of Hydrogen Energy,2014,39(18): 9877-9882.
[14]张伟,刘运飞,谢五喜,等. 热分析法研究AlH3与固体推进剂组分的相容性[J].火炸药学报,2015,38(1): 41-46.[15]王迎, 徐唱唱, 李佳, 等. NaAlH4-TiF3复合催化Mg(AlH4)2的正交试验探究[J].稀有金属,2014,38(1): 55-59.
[16]李丽.高容量A1基配位复合储氢材料的制备及其性能研究[D].天津: 南开大学,2014.
[17]夏宇,池俊杰,张晓勤,等. 三氢化铝干法合成研究进展[J].化学推进剂与高分子材料,2011,9(3): 33-36.
[18]唐安江,史永永,潘红艳,等. 新型储氢材料三氢化铝的研究进展[J].无机盐工业,2011,43(12): 5-10.
[19]Xu B,Liu J P,Wang X J.Preparation and thermal properties of aluminum hydride polymorphs[J].Vacuum,2014,99(1): 127-134.
[20]王哲清.简述格氏反应[J].中国医药工业杂志,2012,43(4): 311-316.
[21]刘明星,何金选,曹一林.三氢化铝的合成及性能研究[J].固体火箭技术,2008,31(1): 75-78.
(编辑:刘红利)
Preparation of NaAlH4by direct hydrogenation and characterization
CAO Jie-min,WANG Jun-qin,GAO Jian-feng,GONG Hao,HUANG Yuan-yuan, GAO Sheng-wang
(Department of Chemistry,North University of China,Taiyuan030051,China)
Sodium aluminum hydride was prepared by direct hydrogenation below 100 ℃ and atmospheric pressure,with ordinary aluminum, halogenated hydrocarbons,sodium hydride and H2as main material. Its composition and structure were determined by FTIR and XRD,combined with the results of elemental analysis,showing that the sample is NaAlH4,and the yield more than 90%.The surface morphology and stability of NaAlH4was characterized by SEM and online MS.Results show that it possesses complete crystal structure and good stability.Its hydrogen storage capacity is equivalent to the commercial sample.Sodium aluminum hydride was successfully prepared with this method under atmospheric pressure,and the yield and utilization of raw materials reach the industrial requirements,which have a role in promoting the improvement of production processes.
activation; direct hydrogenation; heterogeneous reaction; preparation; sodium aluminum hydride
2015-11-30;
2015-12-15。
山西省自然科学基金(2013011040-3);山西省攻关资助项目(20130321022-02)。
曹杰敏(1992—),女,硕士生,从事储氢储能材料的制备研究。E-mail:junqin2007@126.com
高建峰(1969—),男,教授,从事功能材料的制备与应用研究。E-mail:jianfenggao@163.com
V512
A
1006-2793(2016)05-0655-04
10.7673/j.issn.1006-2793.2016.05.010

