不同种源金线兰及近缘种多糖和总黄酮含量的研究
曹奕鸯,李永清,江金兰,雷伏贵,叶 炜
(福建省三明市农业科学研究院药用植物研究所,福建 沙县 365051)
不同种源金线兰及近缘种多糖和总黄酮含量的研究
曹奕鸯,李永清,江金兰,雷伏贵,叶炜*
(福建省三明市农业科学研究院药用植物研究所,福建沙县365051)
通过对6月龄棚栽不同种源金线兰及近缘种的农艺性状、多糖和总黄酮含量的测定,结果表明:不同种源金线兰农艺性状间差异显著,对照种福建金线兰百株鲜重和百株干重均最高,分别达284.75、45.885 g;来源于广西百色的金线兰多糖含量最高,含量达169.61 mg·g-1DW,比对照种增加36.56%;来源于福建省沙县南阳乡竹山村的金线兰(7号)总黄酮含量最高,含量达9.18 mg·g-1DW,比对照种增加34.74%。台湾银线兰多糖含量低于金线兰和野生齿唇兰,总黄酮含量高于野生齿唇兰,并与对照种福建金线兰相当;来源于福建沙县南阳乡竹山村的金线兰叶脉无线种(7号)多糖和总黄酮含量均较高,具有较好的开发前景。
金线兰;台湾银线兰;野生齿唇兰;多糖;总黄酮
金线兰Anoectochilusroxburghii为兰科开唇兰属多年生草本植物,又名金线莲、花叶开唇兰、金线金丝草等,是我国传统的珍贵药材,素有“金草”、“神药”及“乌人参”等美称[1],其性平、味甘,具有清热凉血、祛风利湿等功效,可用于治疗肾炎、支气管炎、膀胱炎、糖尿病、风湿性关节炎、小儿急惊风、毒蛇咬伤等[2]。生长于林下阴湿地,广泛分布于我国福建、浙江、江西、广东、广西、海南、云南、四川、贵州、西藏等省(自治区)[3]。近年来的研究表明金线兰多糖具有降血糖、降血脂、抗氧化、抗肿瘤等重要作用[4-7]。黄酮类化合物是福建金线兰化学成分中的重要组成部分[8-10],具有清除自由基、抗氧化、降血糖、降血脂、治疗糖尿病、抗癌和抗肿瘤等重要作用[11-15]。因此,金线兰的多糖和黄酮类化合物是金线兰的药用成分的重要指标。
福建省是金线兰的原产地,野生种质资源分布较广,由于金线兰种子微小,在自然条件下发芽率低,主要通过组织培养快速繁殖。目前福建省规模培育的主要是台湾银线兰、福建本地金线兰2种,种源品系较为单一[16],具有优异农艺性状、高含量药用成分的优良野生种质未能较好发掘。因此,广泛收集、引进、筛选出适合当地种植、药用成分含量高、农艺性状好、产量高的新种质具有重要意义。三明市农科院药用植物研究所收集了福建沙县、尤溪、德化、广西河池、广西百色等地的野生金线兰,引进福建、广东、广西等地金线兰,以及近缘种台湾银线兰、云南文山的野生齿唇兰等材料,比较不同种源金线兰及近缘种多糖、总黄酮含量和主要农艺性状的差异,为进一步研究、开发利用金线兰及近缘种提供依据。
1 材料与方法
1.1试验材料
9份不同种源的金线兰种质、2份台湾银线兰种质和1份云南省文山市野生齿唇兰种质由三明市农科院药用植物研究所收集(表1),均采用组培方式离体保存,对照种福建南靖福建种金线兰(23号)为福建省产业化规模较大、市场上较为常见的栽培种质之一。各材料对照《中国植物志》[3]描述初步确认其分类。

表1 金线兰及近缘种来源及部分特征描述
1.2仪器和试剂
1.2.1试验仪器AL104电子天平,购自METTLER TOLEDO公司;752型紫外可见分光光度计,购自上海菁华科技仪器有限公司;RO DI digital超纯水机,购自上海和泰仪器有限公司;3K30离心机,购自德国sigma公司。
1.2.2试验试剂芦丁标准品购自上海金穗科技有限公司,葡萄糖(AR)、苯酚(AR)、硫酸(AR)、95%乙醇(AR)、氢氧化钠(AR)、硝酸钠(AR)、硝酸铝(AR)均购自西陇化工股份有限公司。
1.3试验方法
本试验于2015年7月1日至2015年12月31日在三明市农科院药用植物研究所钢架大棚内进行。选取长势良好,无污染、无损伤的不同种源金线兰及近缘种组培苗,种植于以泥炭土为栽培基质的托盘(长×宽×高为42.5 cm×42.5 cm×5 cm)上,托盘置于薄膜钢架大棚的苗床上,行株距为5 cm×5 cm,试验采用完全随机区组设计,每个小区面积为0.81 m2,不同种源金线兰及近缘种组培苗栽培管理措施保持一致,按常规进行,试验设3个重复。
试验于2015年12月31日取样,每个小区随机取10株,洗净,置于85℃烘箱烘干至恒重,粉碎后过40目筛,置干燥器中保存,作为不同种源金线兰及近缘种多糖和总黄酮含量测定的样品。
1.3.1农艺性状调查试验于2015年12月31日取样,每个小区随机取10株,洗净晾干。使用游标卡尺,直尺等测定株高、茎粗(茎中部直径)、叶片数、鲜重,取倒数第3片叶测定叶长、叶宽、叶厚等性状。
1.3.2多糖含量测定称取待测样品粉末(过40目筛)约0.2 g(1/10000分析天平精密称定),转移至10 mL具塞离心管中,加水10 mL,旋紧盖子,沸水浴2 h,放冷,转移至25 mL容量瓶中,用少量水分次洗涤容器,洗液并入同一量瓶中,加水至刻度,摇匀,滤过,精密量取继滤液1.5 mL,置10 mL离心管中,精密加入无水乙醇7.5 mL,摇匀,置冰箱冷藏过夜,取出,离心20 min(转速4 000 r·min-1),弃去上清液,沉淀加80%的乙醇洗涤2次,每次8 mL,离心,弃去上清液,沉淀加温水溶解,转移至50 mL量瓶中,放冷,加水至刻度,摇匀,即得待测样品溶液。
多糖含量采用苯酚-硫酸法测定,以葡萄糖为对照测定多糖含量[17]。以吸光度(y)为纵坐标,葡萄糖浓度(x)为横坐标,进行回归分析,得回归方程:y=0.0082x+0.0134,R2=0.9967。根据标准曲线的回归方程计算供试样品多糖含量。
1.3.3总黄酮测定方法称取待测样品粉末(过40目筛)约0.2 g(1/10000分析天平精密称定),转移至10 mL具塞离心管中,加95%乙醇10 mL,80℃水浴加热回流1.5 h,放冷,转移至50 mL容量瓶中,重复提取3次,提取液并入同一量瓶中,加95%乙醇定容至刻度,摇匀即得待测样品溶液。
总黄酮采用NaNO2-Al(NO3)3-NAOH显色体系进行显色分析,以芦丁为对照测定黄酮含量[18]。以吸光度(y)为纵坐标,芦丁浓度(x)为横坐标,进行回归分析,得回归方程:y= 0.9382x- 0.0078,R2= 0.9995。根据标准曲线的回归方程计算供试样品总黄酮含量。
1.4统计分析
所得数据均由DPS V 7.05版数据处理软件统计分析,差异显著性标准采用Duncan新复极差法。
2 结果与分析
2.1不同种源金线兰及近缘种农艺性状的差异
本试验统计6月龄棚栽的9个不同种源金线兰农艺性状的结果表明:不同种源金线兰在株高、茎粗、叶片数、叶长、叶宽、叶厚方面均有极显著的差异(表2)。不同种源金线兰的株高为7.54~10.36 cm,以来源于福建省沙县南阳乡竹山村的金线兰为最高(8号),株高为10.36 cm,并与来源于广西河池市株高最低的金线兰(38号)差异极显著。不同种源金线兰的茎粗为0.205~0.353 cm,以来源于广西的金线兰(22号)茎粗为最高,达0.353 cm,是对照种福建金线兰(23号)的1.42倍。不同种源金线兰的叶片数为5.8~8.6片,以来源于广东省惠州市的金线兰(36号)为最高,叶片数8.6片,与对照种福建金线兰(23号)无显著差异。不同种源金线兰的叶长为2.56~3.48 cm,以广西种金线兰(22号)为最高,达3.48 cm,与对照种福建金线兰(23号)无显著差异。不同种源金线兰的叶宽为2.11~2.73 cm,以来源于沙县南阳乡竹山村的金线兰(8号)为最高,达2.73 cm,与对照种福建金线兰(23号)无显著差异。不同种源金线兰的叶厚为0.40~0.64 cm,以福建种金线兰(23号)为最高,叶厚达0.64 cm。
2个台湾银线兰种质在茎粗、叶片数、叶长、叶厚方面介于不同种源金线兰之间。台湾银线兰(21号)叶宽达3.00 cm,与叶宽最宽的沙县南阳乡竹山村的金线兰(8号)差异不显著,是对照种福建金线兰(23号)的1.23倍。2个台湾银线兰种质以叶长差异为最大,台湾银线兰(21号)叶长为3.51 cm,是台湾银线兰绿色突变株(20号)的1.16倍。

表2 不同种源金线兰及近缘种的农艺性状
注:同列数据中不同英文小写字母表示在5%水平上差异显著,不同英文大写字母表示在1% 水平上差异极显著,下同。
来源于云南文山的野生齿唇兰(47号)在茎粗、叶片数、叶厚等方面介于不同种源金线兰之间。野生齿唇兰(47号)叶长达3.72 cm,高于金线兰与台湾银线兰。叶宽达2.72 cm,与台湾银线兰差异不显著,高于大多数金线兰种质。
2.2不同种源金线兰及近缘种产量的差异
见表3。本试验测定了6月龄棚栽的9个不同种源金线兰的产量,结果表明:不同种源金线兰百株鲜重和百株干重间差异显著。不同种源金线兰以对照种福建南靖金线兰(23号)百株鲜重和百株干重为最高,分别达284.75 g和45.89 g,并与其他金线兰种质有极显著差异。百株鲜重和百株干重最低的种质为来源于广西河池市的金线兰(38号),百株鲜重和干重含量仅为112.22 g和19.19 g。此外百株鲜重含量最高的种质是含量最低种质的2.54倍,百株干重含量最高的种质是含量最低种质的2.39倍。
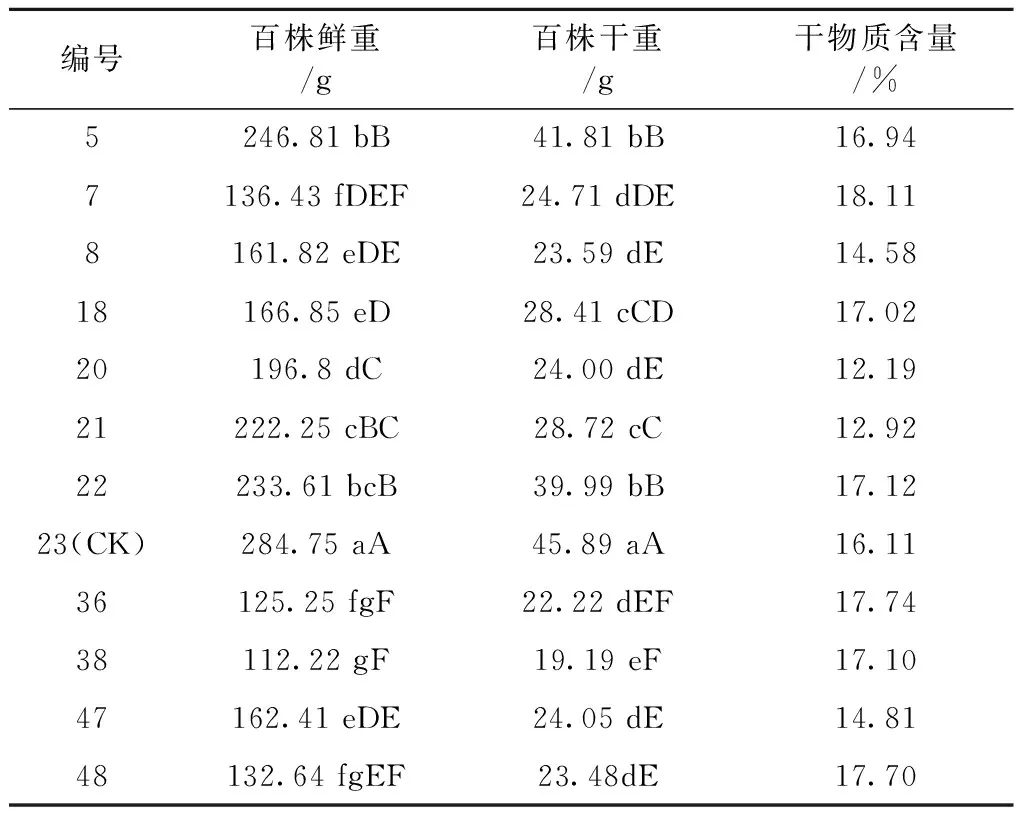
表3 不同种源金线兰及近缘种的产量
来源于福建的5个金线兰种质百株鲜重为136.43~284.75 g,不同种质百株鲜重从高到低顺序为:福建南靖>福建德化>福建尤溪>福建沙县(有线种)>福建沙县(无线种)。不同种质百株干重从高到低顺序为:福建南靖>福建德化>福建尤溪>福建沙县(无线种)>福建沙县(有线种)。来源于广西的3个金线兰种质百株干重与百株鲜重均表现为广西>广西百色>广西河池。来源于福建沙县南阳乡竹山村的野生金线兰叶脉有线种(8号)百株鲜重高于同一来源的野生金线兰叶脉无线种(7号),差异达显著水平,而百株干重无显著差异。
来源于云南文山的野生齿唇兰(47号)百株鲜重为162.41 g,百株干重为24.05 g,均介于不同种源金线兰之间,均低于台湾银线兰种质以及对照种福建金线兰,且差异达极显著水平。
台湾银线兰(21号)百株鲜重为222.25 g,百株干重为28.72 g,仅次于对照种福建南靖金线兰(23号)、福建省德化县大铭乡金线兰(5号)、广西种金线兰(22号)。台湾银线兰突变株(20号)百株鲜重,百株干重均低于台湾银线兰,其中百株干重差异达极显著水平。台湾银线兰(21号)及台湾银线兰突变株(20号)干物质含量仅分别为12.92%和12.19%,不仅低于所有金线兰种质,也低于来源于云南文山的野生齿唇兰。
2.3不同种源金线兰及近缘种多糖含量的差异
本试验测定了6月龄棚栽的9个不同种源金线兰多糖含量,结果表明:不同种源金线兰多糖含量间差异显著(表4),来源于广西百色的金线兰(48号)多糖含量最高,达169.61 mg·g-1,比对照种福建金线兰(23号)增加36.56%,与其他金线兰均有极显著差异。来源于福建省德化县大铭乡的金线兰(5号)多糖含量最低,仅为70.50 mg·g-1,比对照种福建金线兰(23号)减少43.24%,与福建省沙县南阳乡竹山村金线兰(8号)、广东省惠州市金线兰(36号)、广西河池市金线兰(38号)多糖含量差异不显著,与其他来源金线兰多糖含量差异显著。多糖含量最高的种质(48号)是多糖含量最低的种质(5号)的2.41倍。

表4 不同种源金线兰及近缘种多糖和总黄酮含量
来源于福建的5个金线兰种质多糖含量为70.50~132.17 mg·g-1,不同种质多糖含量从高到低顺序为:福建沙县(无线种)>福建南靖>福建尤溪>福建沙县(有线种)>福建德化。来源于广西的3个种质多糖含量为77.26~169.61 mg·g-1,不同种质多糖含量从高到低顺序为:广西百色>广西>广西河池。来源于福建沙县南阳乡竹山村的野生金线兰叶脉无线种(7号)与同一来源的野生金线兰叶脉有线种(8号)多糖含量差异极显著,叶脉无线种含量达132.17 mg·g-1,是叶脉金红线种的1.76倍。
台湾银线兰(21号)多糖含量为73.14 mg·g-1、台湾银线兰绿色突变株(20号)多糖含量为83.03 mg·g-1,均与多糖含量最低的金线兰种质无显著差异,分别比对照种福建金线兰(23号)减少41.11%和33.15%。2个台湾银线兰种质多糖含量间差异不显著。
来源于云南文山的野生齿唇兰多糖含量为121.18 mg·g-1,与对照种福建金线兰种质(23号)无显著差异,与台湾银线兰差异达极显著水平,多糖含量分别是台湾银线兰(21号)的1.66倍,台湾银线兰突变株(20号)的1.46倍。
2.4不同种源金线兰及近缘种总黄酮含量的差异
本试验测定了6月龄棚栽的9个不同种源金线兰总黄酮含量,结果表明:不同种源金线兰总黄酮含量间差异显著(表4),来源于福建省沙县南阳乡竹山村的野生金线兰(7号)总黄酮含量最高,达9.18 mg·g-1,比对照种福建金线兰(23号)增加34.74%,与其他金线兰均有极显著差异。来源于广西百色的金线兰(48号)总黄酮含量最低,仅为6.11 mg·g-1,比对照种福建金线兰(23号)减少10.34%,与福建省尤溪县梅仙镇金线兰(18号)总黄酮含量差异不显著,与其他来源金线兰总黄酮含量差异显著。总黄酮含量最高的种质(7号)是最低的种质(48号)的1.50倍。
来源于福建的5个金线兰种质总黄酮含量为6.15~9.18 mg·g-1,不同种质总黄酮含量从高到低顺序为:福建沙县(无线种)>福建德化>福建沙县(有线种)>福建南靖>福建尤溪。来源于广西的3个种质总黄酮含量为6.11~7.31 mg·g-1,不同种质总黄酮含量从高到低顺序为:广西河池>广西>广西百色。来源于福建沙县南阳乡竹山村的野生金线兰叶脉无线种(7号)与同一来源的野生金线兰叶脉有线种(8号)总黄酮含量差异极显著,叶脉无线种含量达9.18 mg·g-1,是叶脉金红线种的1.29倍。
台湾银线兰(21号)总黄酮含量为7.11 mg·g-1,与对照种福建金线兰(23号)差异不显著,比总黄酮含量最高的金线兰(7号)减少22.53%。台湾银线兰绿色突变株(20号)总黄酮含量为7.49 mg·g-1,比对照种福建金线兰(23号)增加9.91%,比总黄酮含量最高的金线兰(7号)减少18.43%。2个台湾银线兰种质总黄酮含量间差异不显著。
来源于云南文山的野生齿唇兰总黄酮含量为6.45 mg·g-1,与对照种福建金线兰种质(23号)无显著差异,与台湾银线兰差异达极显著水平,仅为台湾银线兰(21号)的85.91%,台湾银线兰突变株(20号)的81.58%。
2.5不同种源金线兰农艺性状和多糖含量的相关分析
不同种源金线兰农艺性状和多糖含量的相关分析的结果表明:金线兰的多糖含量与茎粗、叶长、叶宽有正相关,但相关性不显著(表5),金线兰的多糖含量与株高、叶片数、叶厚有负相关,但相关性不显著。
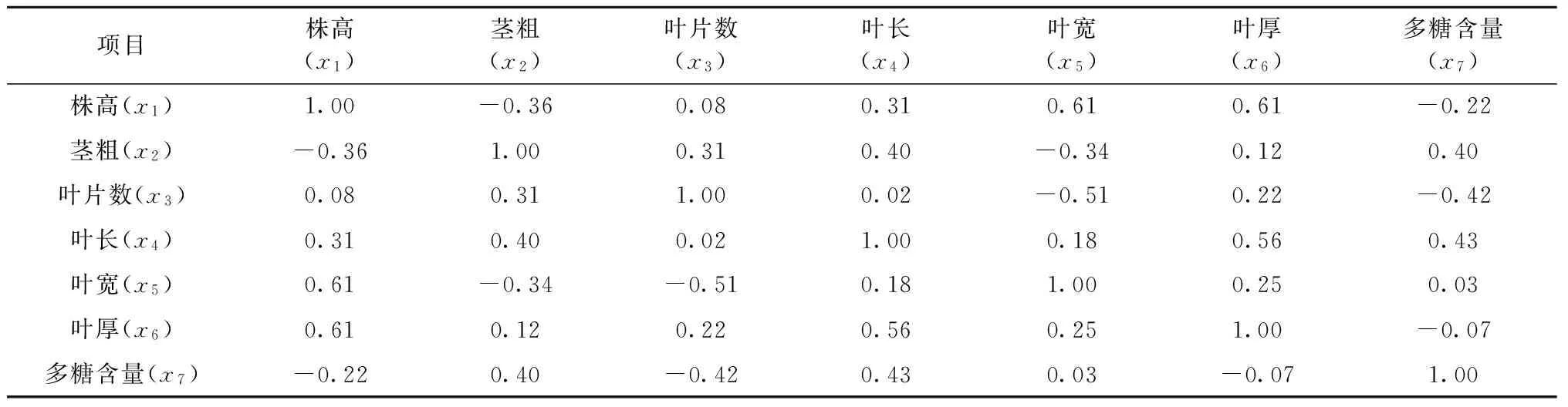
表5 金线兰农艺性状与多糖含量的相关性分析
注:*差异显著(P<0.05),**差异极显著(P<0.01)。表6同。
2.6不同种源金线兰农艺性状和总黄酮含量的相关分析
不同种源金线兰农艺性状和总黄酮含量的相关分析的结果表明:金线兰的总黄酮含量与株高、叶片数、叶长、叶宽有正相关,但相关性不显著(表6),金线兰的总黄酮含量与茎粗、叶厚有负相关,但相关性不显著。

表6 金线兰农艺性状与总黄酮含量的相关性分析
3 讨论与结论
不同种源6月龄棚栽金线兰及近缘种农艺性状的分析结果表明,9个金线兰种质在株高(7.54~10.36 cm)、茎粗(0.205~0.353 cm)、叶片数(5.8~8.6片)、叶长(2.56~3.72 cm)、叶宽(2.11~2.73 cm)、叶厚(0.40~0.64 cm)方面差异显著。这与邵清松等[19]的研究结果13个种质金线兰的植株鲜重、叶长、叶片数、叶宽、地径之间变异系数较大的结果相似。不同种源金线兰农艺性状与多糖和总黄酮含量间无显著相关,因此可能难以通过直观的农艺性状判断金线兰种质多糖与总黄酮含量的高低。
不同种源6月龄棚栽金线兰多糖含量间差异显著(70.50~169.61 mg·g-1),与秦朋[20](7.50%~19.31%)的研究结果相似,但是比张赛男[21](17.08%~25.51%)的研究结果低,这可能与金线兰的种质、栽培的条件、采收时期等有关。不同种源金线兰总黄酮含量间差异显著(6.11~9.18 mg·g-1),这与秦朋[20]的研究结果22份金线莲供试材料其总黄酮含量为0.43%~1.43%相似。来源于福建沙县南阳乡竹山村的野生金线兰叶脉无线种多糖和总黄酮含量均高于同一来源叶脉金红线种,这与张志信等[22]的研究结果叶片无明显叶脉的“金线莲公”多糖和总黄酮含量高于叶片具金黄色叶脉的“金线莲母”一致。此外,通过对福建、广西、广东种源金线兰多糖与总黄酮含量的分析,结果表明,金线兰多糖与总黄酮含量并不能按不同种源地明显区分,因此难以仅通过多糖含量和总黄酮含量高低来判断金线兰的种源地。来源于福建沙县南阳乡竹山村的金线兰无线种多糖含量在福建种源中含量最高,总黄酮含量在所有种源中含量最高,具有较高的药用价值,但是其产量较低,因此可作为育种的新材料供进一步利用。
来源于云南文山的野生齿唇兰多糖含量高于台湾银线兰,总黄酮含量低于台湾银线兰,与对照种福建金线兰无显著差异,其药用价值较高,具有较好的开发前景。
台湾银线兰叶脉白色,叶背紫红,三明市农科院药用植物研究所发现的台湾银线兰突变株叶脉白色,叶背为绿色。农艺性状的分析结果表明台湾银线兰百株鲜重、百株干重、干物质含量均高于台湾银线兰突变株,但二者多糖和总黄酮含量间差异不显著,表明台湾银线兰叶背绿色突变株相比叶背紫红的正常株减少了生物量,但不影响多糖和总黄酮的积累。此外台湾银线兰与台湾银线兰突变株多糖含量低于不同金线兰种质,总黄酮含量介于不同种质金线兰之间,这与黄瑞平等[23]栽培4个月后,福建种的金线兰多糖和总黄酮含量均高于台湾银线兰的结果不完全相同,这可能与金线兰的种质、栽培的条件、采收时期等有关。
[1]叶炜,江金兰,李永清,等.金线兰及近缘种植物遗传多样性ISSR分子标记分析[J].植物遗传资源学报,2015,16(5):1045-1054.
[2]黄有霖. 福建省中药材标准[M].福州:海风出版社,2006:154-156.
[3]中国科学院中国植物志编辑委员会.中国植物志:十九卷[M].北京:科学出版社,1999:117.
[4]余杰,李伟,张晓辉.金线莲多糖抗糖尿病作用的研究[J].海峡药学,2013,25(11):37-40.
[5]张赛男.金线莲多糖降血脂功能的实验研究[J].云南中医中药杂志, 2014,35(12):64-66.
[6]林丽清,黄丽英,郑艳洁,等.金线莲多糖的提取及清除氧自由基作用的研究[J].福建中医学院学报,2006,16(5):37-39.
[7]许丹妮,李健,马玉芳,等.金线莲多糖对免疫抑制小鼠脾淋巴细胞增殖及免疫器官的影响[J].兽药医药杂志,2011,30(3):15-17.
[8]何春年,王春兰,郭顺星,等.福建金线莲的化学成分研究[J].中国药学杂志,2005,40(8):581-583.
[9]何春年,王春兰,郭顺星,等.福建金线莲的化学成分研究Ⅱ[J].中国中药杂志,2005,30(10):761-763.
[10]关璟,王春兰,郭顺星.福建产金线莲中黄酮苷成分的研究[J].中草药,2005,36(10):1450-1453.
[11]HYUNG-KYOON CHOI,YONG-SUK LIMA,YOUNG-SUK KIM,et al.Free-radical-scavenging and tyrosinase-inhibition activities of Cheonggukjang samples fermented for various times[J].Food Chemistry,2008,106(2):564-568.
[12]LEONG CHENG,NING ABRAHAMA,TAKO MASAKUNI,et al.Antioxidant flavonoid glycosides from the leaves of Ficus pumila L[J].Food Chemistry,2008, 109(2):415-420.
[13] SHARMA B,CHANDRAJEET B,PARTHA R.Hypoglycemic and hypolipidemic effects of flavonoid rich extract from Eugenia jambolana seeds on streptozotocin induced diabetic rats[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2008,46(7):2376-2383.
[14]张德权, 台建祥, 付勤.生物类黄酮的研究及应用概况[J]. 食品与发酵工业, 1998, 25(6):52-57.
[15]MANTHER J A,NAJLA G.Antiproliferative Activities of Citrus Flavonoids against Six Human Cancer Cell Lines[J]. Journal of Agricultural & Food Chemistry, 2002, 50(21):5837-5843.
[16]张君诚,张超,陈 强,等.金线莲产业化现状及发展对策[J].福建林业科技, 2014, 41(4):220-224.
[17]国家药典委员会.中药典:第一部[M].北京:中国医药科技出版社,2015:282-283.
[18]赵保发,张志信,张仕秀,等. 正交试验法优选金线莲总黄酮的提取工艺[J].保山师专学报,2008,27(5):59-60.
[19]邵清松,黄瑜秋,胡润淮,等.金线莲形态学性状与产量形成关系的多重分析[J].中国中药杂志,2014,39(13):2456-2459.
[20]秦朋.金线莲遗传多样性和有效成分分析[D]. 福州:福建农林大学,2013.
[21]张赛男.不同地区金线莲多糖含量对比研究[J].北京农业2014,(33):125-126.
[22]张志信,张铁,赵保发,等.文山野生金线莲总黄酮及多糖含量测定[J].时珍国医国药,2009,20(6):1362-1364.
[23]黄瑞平,黄颖桢,陈菁瑛,等.不同月龄金线莲多糖和总黄酮含量的比较[J].热带生物学报, 2012,3(2):174-176.
(责任编辑:黄爱萍)
Polysaccharide and Flavonoid Contents inAnoectochilusroxburghiiand Related Species
CAO Yi-yang,LI Yong-qing,JIANG Jin-lan,LEI Fu-gui,YE Wei*
(TheInstituteofMedicinalPlant,SanmingAcademyofAgriculturalScience,ShaxianFujian365051,China)
Major agronomical characteristics and contents of polysaccharides and flavonoids inAnoectochilusroxburghiiand related species from different areas cultivated in a greenhouse for 6 months prior to the chemical analyses were compared. There were distinctive agronomical differences among the sampled species. For instance, the highest yield was shown CK from Fujian, with a per hundred plants fresh weight(FW) of 284.75 g and dry weight (DW) of 45.885 g; the highest polysaccharide content,in the variety from Baise, Guanxi, at 169.61 mg·g-1DW, which was 36.56% higher than CK; and, the highest total flavonoids, in the cultivars from Zhushan Village, Nanyang Township, Shaxian, Fujian (No.7), at 9.18 mg·g-1DW, which was 34.74% higher than CK.By comparison, the polysaccharide content ofA.formosanuswas lower than that ofA.roxburghiiandA.lanceolatus; the total flavonoids ofA.formosanus, higher than that ofA.lanceolatus, but not significantly different from those of the cultivars from Fujian; and, both polysaccharides and total flavonoid significantly higher in No. 7. Consequently, the cultivars from Zhushan was considered to have a potential for further study and promotion.
Anoectochilusroxburghii;A.formosanus;A.lanceolatus; polysaccharides; flavonoids
曹奕鸯,李永清,江金兰,等.不同种源金线兰及近缘种多糖和总黄酮含量的研究[J].福建农业学报,2016,31(6):604-610.
CAO Y-Y,LI Y-Q,JIANG J-L,et al.Polysaccharide and Flavonoid Contents inAnoectochilusroxburghiiand Related Species[J].FujianJournalofAgriculturalSciences,2016,31(6):604-610.
2016-03-12初稿;2016-05-14修改稿
曹奕鸯(1984-),男,硕士,助理研究员,研究方向:药用植物资源与利用(E-mail:caoyiyang@yeah.net)
叶炜(1980-),男,博士,副研究员,研究方向:园艺植物生物技术研究(E-mail:yewei922@qq.com)
国家级星火计划项目(2014GA720032);福建省种业创新与产业化工程项目(FJZZZX-1540);福建省三明市科技计划项目(2014-N-3)
S 567
A
1008-0384(2016)06-604-07

