浙贝母花期地上部分核苷类、氨基酸类及无机元素类成分分析与评价△
闫精杨,刘培*,江曙*,朱邵晴,李会伟,陈京,段金廒
(1.南京中医药大学 江苏省中药资源产业化过程协同创新中心 中药资源产业化与方剂创新药物国家地方联合工程研究中心,江苏 南京 210023;2.浙江中医药大学,浙江 杭州 310053)
浙贝母花期地上部分核苷类、氨基酸类及无机元素类成分分析与评价△
闫精杨1,刘培1*,江曙1*,朱邵晴1,李会伟1,陈京2,段金廒1
(1.南京中医药大学 江苏省中药资源产业化过程协同创新中心 中药资源产业化与方剂创新药物国家地方联合工程研究中心,江苏 南京 210023;2.浙江中医药大学,浙江 杭州 310053)
目的通过对浙贝母花期地上部分核苷类、氨基酸类及无机元素类化学成分的分析评价,为其资源化利用提供科学依据。方法采用UHPLC-MS/MS方法分别分析了浙贝母花期生长阶段的茎、花器不同部位中核苷类、氨基酸类化学组成及其含量;采用电感耦合等离子体-原子发射光谱法(ICP-AES)法及分光光度法分析了样品中的无机元素组成及其含量。结果浙贝母花(除去花药)、花药、茎中总核苷类成分含量分别为4.58、1.91、6.50 mg·g-1;总氨基酸类成分含量分别为69.77、68.79、103.98 mg·g-1;总无机元素类成分含量分别为1 295.27、1 306.76、772.74 μg·g-1。结论浙贝母花期地上部分含有较为丰富的核苷类、氨基酸类、无机元素类等资源性化学成分,具有潜在的药用和营养保健价值。
浙贝母;地上部分;化学成分分析;资源化利用评价
百合科植物浙贝母FritillariathunbergiiMiq.是多年生草本,多以其地下鳞茎入药,为中药浙贝母。浙贝母主产地分布在浙江、江苏、福建,浙江主产地主要有鄞州、磐安、缙云等地,江苏主产地主要有南通、苏州、泰州等地[1]。浙贝母生产上多采用鳞茎繁殖,在其种植过程中,为使养分集中供于鳞茎,必须适时摘花打顶,控制地上部分生长,避免因开花结果消耗大量养分。摘花打顶一般选择在3—4月浙贝母植株大致开放有2朵花左右之时,除少量花蕾晒干作药用外,摘下的大部分花蕾和茎弃置于田间自然降解[2-3]。浙贝母全国年产量约2100 t,而地上部分的重量鳞茎相当[4]。有文献报道,浙贝母地上部分中含生物碱和皂苷类成分[5]、芳香醛酮类[6]、以及氨基酸类成分[7]。中药废弃物资源化是一个涉及经济、环境、社会效益等多个目标的连续过程[8]。在中药收获时产生大量废弃物,既导致了中药资源的极大浪费又给生态环境带来了新的压力[9]。本文对浙江磐安地区浙贝母摘花打顶时期的花(除去花药)、花药以及茎中的氨基酸类、核苷类、无机元素类等营养物质进行了分析评价,以期为浙贝母种植期产生的废弃物的综合开发利用提供参考。
1 仪器与材料
1.1 仪器
Sartorius BT125D电子分析天平(德国赛利多斯公司);EPED超纯水系统(南京易普达易科技发展有限公司);KQ-250E型超声波清洗器(昆山禾创超声仪器有限公司);日立Z-2000型原子吸收分光光度计。ACQUITY UPLC系统(美国Waters公司);Xevo TQ质谱系统(美国Waters公司);MassLynxTM质谱工作站(美国Waters公司)。
1.2 试剂
超纯水(自制);乙腈、甲醇和甲酸为色谱纯;甲酸铵(上海凌峰化学试剂)和醋酸铵(国药控股化学试剂)均为分析纯。γ-氨基丁酸(16)、天冬酰胺(21)、瓜氨酸(22)、牛磺酸(26)、反式-4-羟基-L-脯氨酸(27)、L-鸟氨酸盐酸盐(28)、天冬氨酸(32)、谷氨酰胺(37)、胞嘧啶(1)、胞苷(2)、2′-脱氧腺苷(3)、胸苷(4)、尿苷(5)、腺苷(6)、肌苷(7)、次黄嘌呤(9)、黄嘌呤(11)、胸腺嘧啶(12)、腺嘌呤(13)、鸟苷(15)购自Sigma公司;尿嘧啶(10)、2′-脱氧肌苷(14)购自阿拉丁试剂公司;甲硫氨酸(17)、苯丙氨酸(18)、色氨酸(19)、谷氨酸(20)、L-脯氨酸(23)、缬氨酸(24)、酪氨酸(25)、精氨酸(29)、组氨酸(30)、赖氨酸(31)、亮氨酸(33)、丙氨酸(34)、苏氨酸(35)、丝氨酸(36)、半胱氨酸(38)、异亮胺酸(39)、鸟嘌呤(8)购自中国惠行生化试剂公司。化合物纯度均大于98%,由高效液相色谱仪测定。
1.3 材料及处理
实验用浙贝母地上部分3批采自江苏南通(批号:BMH20150301 ~ BMH20150303),经南京中医药大学段金廒教授鉴定为浙贝母FritillariathunbergiiMiq.的地上部分。采集时间为2015年5月间。每批次分别分取花(除去花药)、花药、茎3个不同部位,40 ℃鼓风干燥后,粉碎成粗粉,置干燥器中备用。
2 方法与结果
2.1 核苷类成分分析
2.1.1 供试品溶液制备 取样品粉末(40目)各1 g,精密称定,加入50 mL超纯水,置于100 mL锥形瓶中,精密称其重量。超声提取30 min(25 ℃、100 Hz),称重,加超纯水补足损失重量。提取液离心10 min(13 000r·min-1)后,取上清液,过0.22 μm滤膜,取续滤液作为供试品。
2.1.2 对照品溶液制备 分别精密称取对照品1~15 1.35、1.18、1.14、1.54、1.18、1.40、1.43、1.19、1.18、1.20、1.23、1.31、1.13、1.27、1.24 mg配制成质量浓度分别为27.0、23.6、21.3、30.8、23.6、28.0、28.6、23.8、23.6、24.0、21.2、26.2、22.6、25.4 μg·mL-1的甲醇-水(9∶1,V/V)溶液。不同浓度对照品溶液由上述储备液经甲醇-水(9∶1,V/V)稀释配制而成。
2.1.3 色谱及质谱条件 ACQUITY UPLC BEH Amide色谱柱(100 mm×2.1 mm,1.7 μm)。体积流量:0.4 mL·min-1,柱温:35 ℃。流动相:5 mmol·L-1甲酸胺-5 mmol·L-1乙酸胺-0.2%甲酸水溶液(A),1 mmol·L-1甲酸胺-1 mmol·L-1乙酸胺-0.2%甲酸乙腈溶液(B)。梯度洗脱:1~3 min,10%A;3~9 min,10%~18%A,9~15 min,18%~20%A;15~16 min,20%~46%A。
离子化模式:ESI+;毛细管电压为3.0 kV;采样锥电压为30 V;脱溶剂气流量为1000 L·h-1;锥气流为20 L·h-1;离子源温度为120 ℃;脱溶剂气温度为350 ℃;碰撞能量为6 V。典型样品色谱图见图1。
2.1.4 样品测定 分别精密吸取对照品与供试品溶液各1 μL,注入UHPLC仪测定,总核苷的量为各核苷的量之和,每份样品平行测定3次,取平均值,结果见表1。
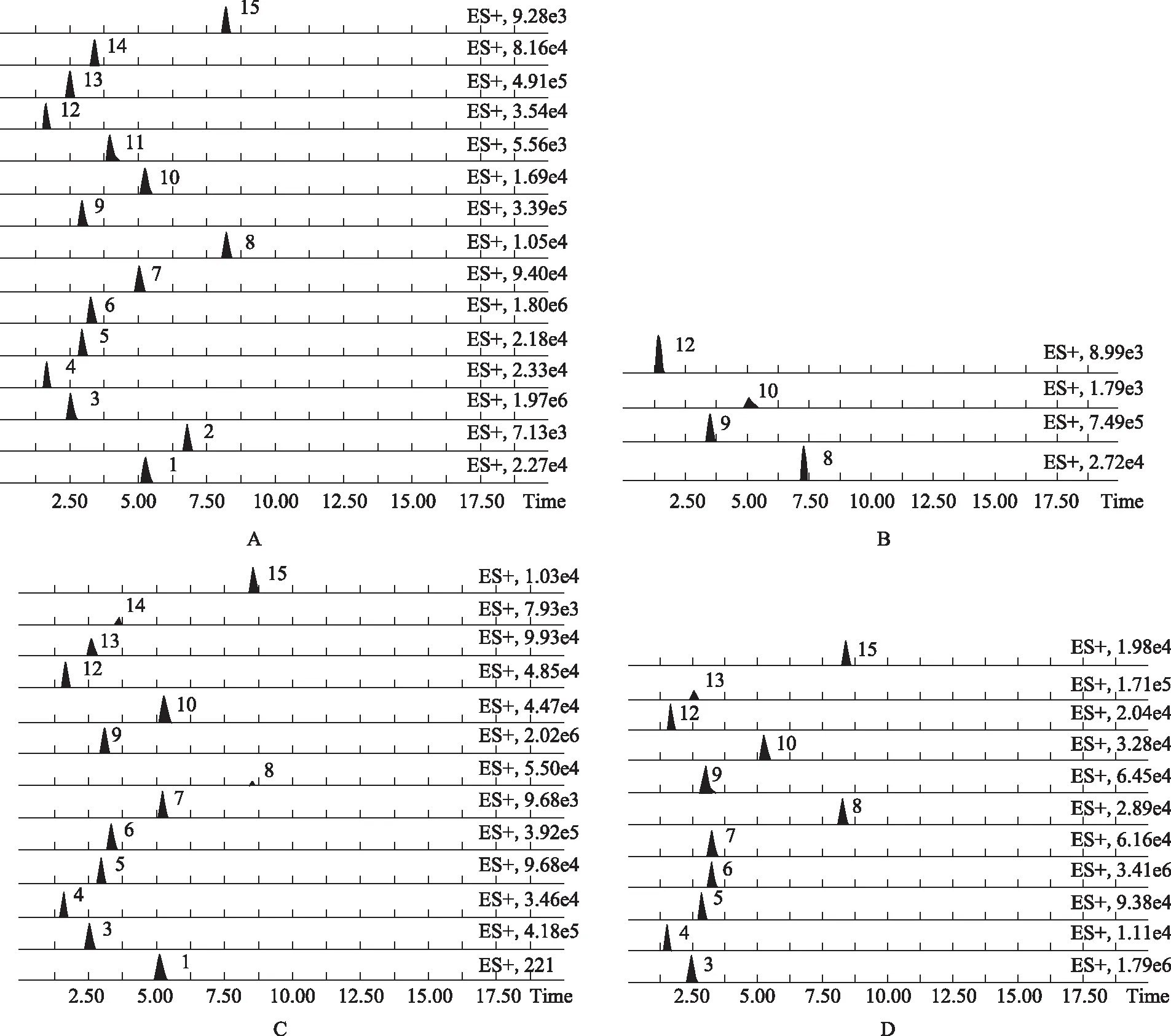
注:A. 核苷对照品;B. 花(除去花药);C. 花药;D. 茎;1. 胞嘧啶,2. 胞苷,3. 2′-脱氧腺苷,4. 胸苷,5. 尿苷,6. 腺苷,7. 肌苷,8. 鸟嘌呤,9. 次黄嘌呤,10. 尿嘧啶,11. 黄嘌呤,12. 胸腺嘧啶,13. 腺嘌呤,14. 2′-脱氧肌苷,15. 鸟苷。图1 浙贝母典型样品核苷类成分的UHPLC-MS/MS图谱
2.1.5 样品中核苷类成分测定结果分析 由表1可知浙贝母的花(除去花药)、花药、茎含有核苷类化学成分,所测核苷总量分别为1.91、6.50、4.58 mg·g-1。花(除去花药)中含有的核苷种类较少,以尿嘧啶的含量最高,为1.17 mg·g-1;胞嘧啶的含量最少,为0.03 mg·g-1。花药中尿嘧啶含量最高,为2.57 mg·g-1;2′-脱氧肌苷含量最少,为0.01 mg·g-1。茎中以尿苷含量最高,为1.28 mg·g-1;2′-脱氧肌苷含量最少,为0.002 mg·g-1。综合来看花药中含有的核苷种类最多、含量最大,其中尿嘧啶在3个部位的含量均较高。
2.2 氨基酸类成分分析
2.2.1 供试品溶液制备 取样品粉末(40目)各1 g,精密称定,加入50 mL超纯水,置于100 mL锥形瓶中,精密称其重量。超声提取30 min(25 ℃、100 Hz),称重,加超纯水补足损失重量。提取液离心10 min(13 000 r·min-1),取上清液,过0.22 μm微孔滤膜,取续滤液作为供试品。

表1 浙贝母地上部分核苷类化学成分的种类及含量 /mg·g-1
注:“—”表示核苷含量低于定量限,下同。
2.2.2 对照品溶液制备 分别精密称取对照品16~39 1.57、1.22、1.47、1.26、1.57、1.76、1.49、1.26、1.86、1.88、1.75、1.26、1.57、1.40、1.80、1.48、1.76、1.46、1.47、1.31、2.04、1.60、2.15、1.55 mg配制成质量浓度分别为31.4、24.4、29.4、25.2、31.4、35.2、29.8、25.2、37.2、37.6、35.0、28.0、36.0、29.6、24.0、29.2、29.4、26.2、35.4、24.6、40.8、32.0、24.0、31.0 μg·mL-1的甲醇-水(9∶1,V/V)溶液。不同质量浓度对照品溶液由上述储备液经甲醇-水(9∶1,V/V)稀释配制而成。
2.2.3 色谱及质谱条件 ACQUITY UPLC BEH Amide 色谱柱(100 mm×2.1 mm,1.7 μm)。体积流量:0.4 mL·min-1,柱温:35 ℃。流动相:5 mmol·L-1甲酸胺-5 mmol·L-1乙酸胺-0.2%甲酸-水溶液(A),1 mmol·L-1甲酸胺-1mmol·L-1乙酸胺-0.2%甲酸-乙腈溶液(B)。梯度洗脱:1~3 min,10%A;3~9 min,10%~18%A;9~15 min,8%~20%A;15~16 min,20%~46%A。
离子化模式:ESI+;毛细管电压为3.0 kV;采样锥电压为30 V;脱溶剂气流量为1000 L·h-1;锥气流为20 L·h-1;离子源温度为120 ℃;脱溶剂气温度为350 ℃;碰撞能量为6 V。典型样品色谱图见图2。
2.2.4 样品测定 分别精密吸取对照品与供试品溶液各1 μL,注入UHPLC仪测定,总氨基酸的量为各氨基酸的量之和,每份样品平行测定3次,取平均值,结果见表2。

表2 浙贝母地上部分氨基酸类化学成分的种类及含量
2.2.5 样品中氨基酸类成分测定结果分析 浙贝母的花(除去花药)、花药、茎中总氨基酸的含量分别为68.79、103.98、69.77 mg·g-1,花药中所含氨基酸总量高于花(除去花药)和茎。浙贝母的花(除去花药)、花药、茎中所含人体必需氨基酸(色氨酸、苯丙氨酸、苏氨酸、异亮氨酸、亮氨酸和甲硫氨酸)总量分别为28.23、41.91、21.81 mg·g-1;赖氨酸在花(除去花药)、花药、茎中较其他氨基酸含量均最高,分别为23.38、31.74、14.18 mg·g-1;其次为谷氨酰胺,含量分别为19.10、25.87、13.00 mg·g-1。
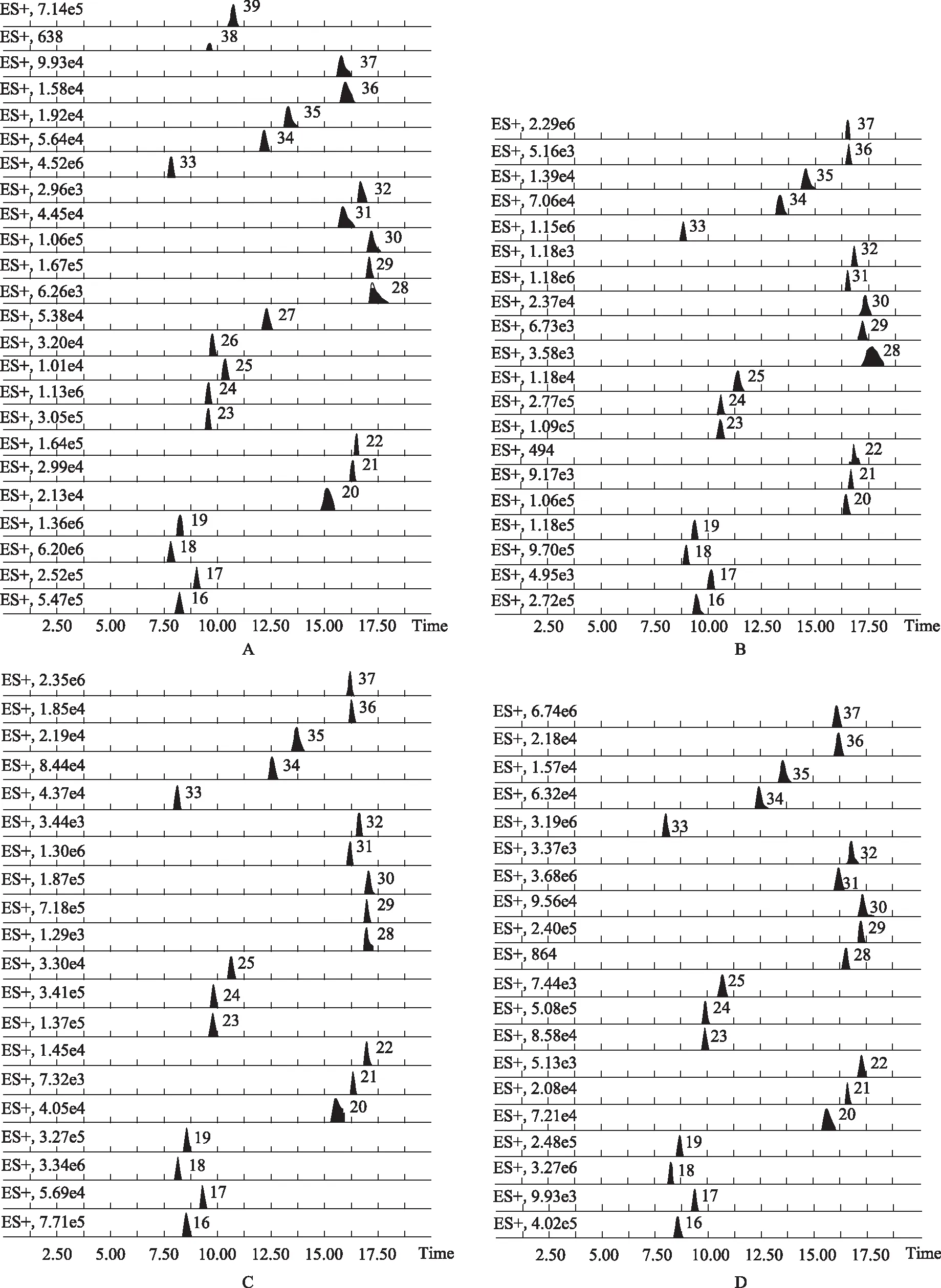
注:A. 氨基酸对照品;B. 花(除去花药);C. 花药;D. 茎;16. γ-氨基丁酸;17. 甲硫氨酸;18. 苯丙氨酸;19. 色氨酸;20. 谷氨酸;21. 天冬酰胺;22. 瓜氨酸;23. L-脯氨酸;24. 缬氨酸;25. 酪氨酸;26. 牛磺酸;27. 反式-4-羟基-L-脯氨酸;28. L-鸟氨酸盐酸盐;29. 精氨酸;30. 组氨酸;31. 赖氨酸;32. 天冬氨酸;33. 亮氨酸;34. 丙氨酸;35. 苏氨酸;36. 丝氨酸;37. 谷氨酰胺;38. 半胱氨酸;39. 异亮胺酸。图2 浙贝母典型样品氨基酸类成分的UHPLC-MS/MS图谱
2.3 无机元素测定
2.3.1 样品处理 各称取0.5 g样品粉末(40目),置于聚四氟乙烯消解罐中加硝酸5 mL过夜,加3 mL双氧水,拧紧密封盖,置于恒温烘箱120 ℃加热3~4 h,直至消解液澄清透明或略带黄色,冷却后定容过滤待测。
2.3.2 电感耦合等离子体-原子发射光谱(ICP-AES)测定条件 射频功率:1.3 kW,雾化气流量:0.8 L·min-1,辅助气流量:0.2 L·min-1,冷却气流量:15 L·min-1,观测方向:Axial,溶液提升量:1.5 mL·min-1。
2.3.3 样品测定及结果分析 由表3可以看出贝母地上部分中含有的无机元素种类较多且含量丰富,花(除去花药)、花药、茎中的总含量分别为1 306.76、772.74、1 295.27 μg·g-1,其中金属元素分别含有1 282.53、735.25、1 275.28 μg·g-1,非金属元素分别为24.23、37.49、19.99 μg·g-1。以钠、铁、铝的含量最高,锌、锰、钾、硼的含量次之。
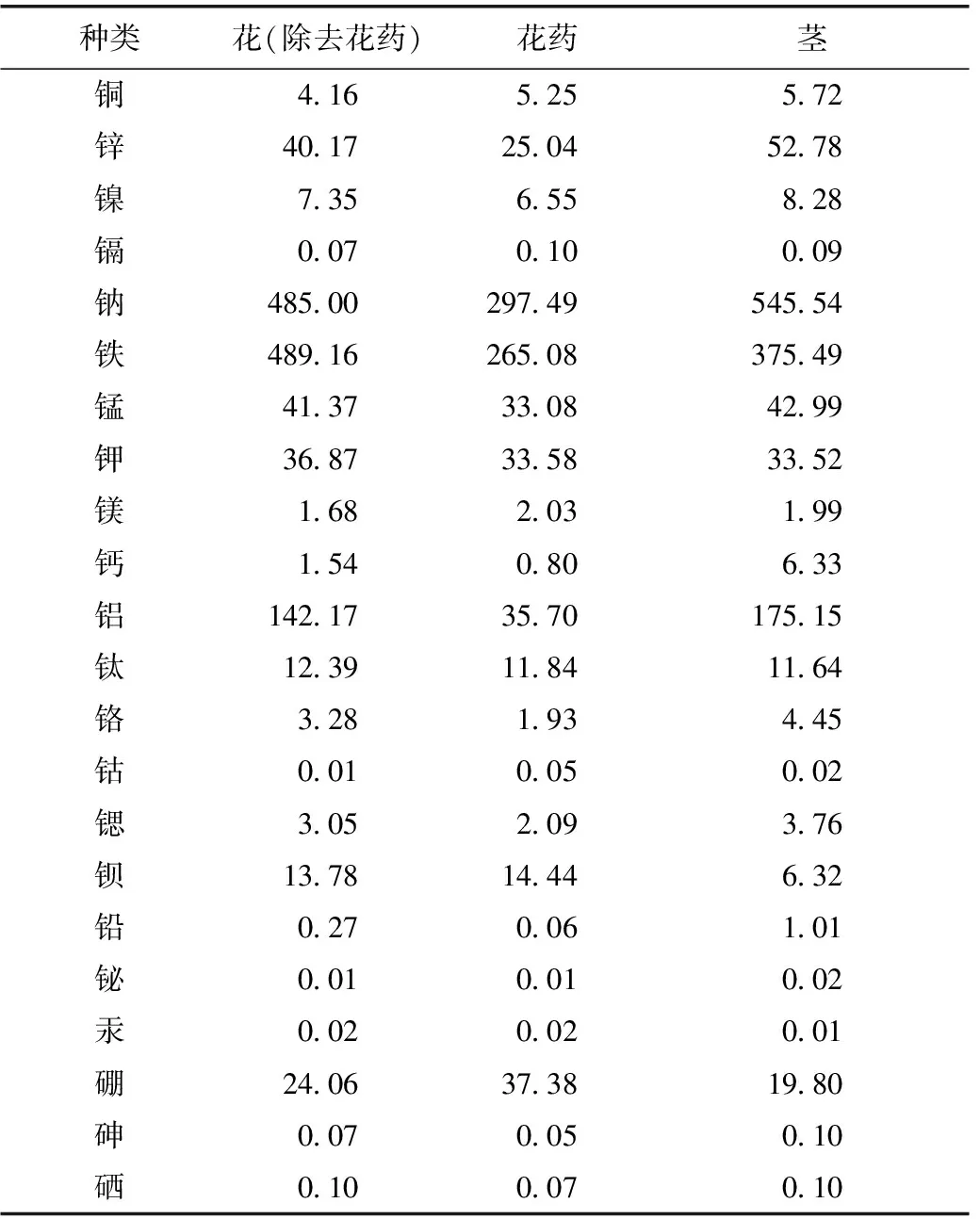
表3 浙贝母地上部分所含无机元素类化学成分的种类及含量 /mg·g-1
3 讨论
通过对本实验各种检测方法的精密度、重复性、稳定性、线性以及加样回收率进行方法学考察,各检测方法均符合定量测定的要求,因此可以用来检测各类成分。
浙贝母具有清热化痰、散结消肿的作用,用于上感咳嗽、支气管等,在民间浙贝母配桑叶,用于治疗风热咳嗽;配桑白皮,用于清肺化痰;配玄参,可治疗痰火郁结。浙贝母地上部分中含有较多种类的核苷类资源性化学成分,实验共测定了浙贝母地上部分的15种核苷,花(除去花药)、花药、茎中分别含有5、12、11种。3个部位均含有一定量的尿嘧啶,花(除去花药)、花药中含有一定量的鸟嘌呤、尿苷。核苷类物质的结构具有多变的特点,由于研究者们通过化学和生物修饰,核苷及其衍生物具有显著的生理功能和药用活性而受到重视[10-11],如腺苷具有保护神经、改善血流的作用[12-13]。鸟嘌呤可用作抗病毒药物阿昔洛韦中间体、硫鸟嘌呤、开环鸟嘌呤的中间体[14]。鸟苷具有抗抑郁、抗氧化的作用[15]。尿苷本身是一种药物,也可用于合成尿苷肽类抗生素,尿苷参与糖原合成,有助于提高细胞的耐缺氧能力,提高机体抗体水平,并可以阻断癌细胞和病毒的基因合成[16]。因此我们推断核苷可能与浙贝母地上部分治疗感冒、支气管炎引起的咳嗽、喉咙痛有一定关系。
实验结果表明,浙贝母花中含有大量氨基酸。氨基酸在医学上具有防病治病的作用,也可作为营养型化妆品的有效成分及合成药物、表面活性剂、其他工业产品的化工原料[17],氨基酸在人体生理活动中起着重要作用,尤其是必需氨基酸,浙贝母地上部分中含有6种必需氨基酸。同时含有大量的谷氨酰胺及精氨酸。谷氨酰胺虽然不是必需氨基酸,但是在生命活动中却有着不可替代的作用,具有增强免疫、提高机体抗氧化能力的功能。精氨酸是一氧化氮、尿素、鸟氨酸及肌丁胺的直接前体,对高氨血症、肝脏机能障碍等均有疗效。精氨酸和谷氨酰胺同时作用更是大大提高机体免疫功能[18]。
浙贝母地上部分含有一定量的无机元素,钠、铁、铝的含量较高。无机元素是人类必不可缺的成分,部分具有一定的药用活性,如铁元素可以治疗缺铁性贫血、营养不良,铝元素是治疗胃病的抗酸剂、胃黏膜保护剂中必不可少的成分。因此,通过对浙贝母地上部分核苷、氨基酸、无机元素进行分析,发现浙贝母地上部分具有潜在的药用和保健价值。
本文对浙贝母地上部分所含的氨基酸、核苷、无机元素类成分进行了分析,为浙贝母地上部分的资源利用提供了参考。而浙贝母地上部分的生物碱、皂苷类成分和芳香醛酮类有待于进一步研究。
[1] 张彦南,陆兵,王康才,等.浙贝母主产地栽培品种与生产现状调查研究[J].中国现代中药,2012,14(10):42-45.
[2] 崔明超,程斌,陈宏降,等.贝母花的定性鉴别及含量测定研究[J].中医药信息,2014,31(4):20-22.
[3] 崔明超.贝母花研究进展[J].齐鲁药事,2011,30(11):661-662,667.
[4] 周晓龙.浙贝母产销分析[J].中国现代中药,2013,15(2):157-158.
[5] 陈文君,郑卫红,项颖华.浙贝母花、地上茎与鳞茎总生物碱、总皂苷含量测定的比较[J].浙江中医药大学学报,2008,32(4):530-531.
[6] 梁君玲,曹小吉,李建伟,等.浙贝母花挥发油的气相色谱-飞行时间质谱分析[J].中国中药杂志,2011,36(19):2689-2692.
[7] 郭梦喆,李建伟,吴世华.浙贝母花的氨基酸成分分析[J].安徽农业科学,2011,39(10):5782-5783.
[8] 段金廒,宿树兰,郭盛,等.中药资源产业化过程废弃物的产生及其利用策略与资源化模式[J].中草药,2013,44(20):2787-2797.
[9] 段金廒,宿树兰,郭盛,等.中药废弃物的转化增效资源化模式及其研究与实践[J].中国中药杂志,2013,38(23):3991-3996.
[10] 张海娟,马世震,肖远灿,等.RP-HPLC同时测定暗紫贝母中10个核苷及碱基类成分的含量[J].药物分析杂志,2012,32(6):986-989.
[11] 刘洋,李明花,邢向红.核苷类抗肿瘤药物研究进展[J].中国新药杂志,2012,21(21):2493-2498.
[12] Shah A,Chan W,Seidelin P H.Ventricular Fibrillation Precipitated by Intracoronary Adenosine During Fractional Flow Reserve Assessment-A Cautionary Tale[J].Heart Lung & Circulation,2015,24:173-175.
[13] Hinzman J M,Gibson J L,Tackla R D,et al.Real-time monitoring of extracellular adenosine using enzyme-linked microelectrode arrays[J].Biosensors & Bioelectronics,2015,74:512-517.
[14] 王永成,陈涛,石婷,等.嘌呤核苷及其衍生物的代谢工程[J].中国生物工程杂志,2015,35(5):87-95.
[15] Bettio L E B,Freitas A E,Neis V B,et al.Guanosine prevents behavioral alterations in the forced swimming test and hippocampal oxidative damage induced by acute restraint stress[J].Pharmacology Biochemistry & Behavior,2014,127:7-14.
[16] 曹琰,严辉,段金廒,等.不同产地当归药材核苷类成分的分析[J].药物分析杂志,2010,30(11):2026-2030.
[17] 林太凤,赵梦柯,王妍鸣,等.氨基酸检测技术研究进展[J].安徽农业科学,2015,43(18):16-19.
[18] 王宝贵,秦全红,王学军,等.精氨酸、谷氨酰胺双肽强化肠外营养对创伤后肠屏障功能和机体免疫功能的影响[J].中国临床营养杂志,2006,14(2):95-99.
AnalysisandEvaluationofChemicalComponentofAerialPartsofFritillariathunbergiiinFloweringPeriod
YANJingyang1,LIUPei1*,JIANGShu1*,ZHUShaoqing1,LIHuiwei1,CHENJing2,DUANJin’ao1
(1.JiangsuCollaborativeInnovationCenterofChineseMedicinalResourcesIndustrialization,andNationalandLocalCollaborativeEngineeringCenterofChineseMedicinalResourcesIndustrializationandFormulaeInnovativeMedicine,NanjingUniversityofChineseMedicine,Nanjing210023,China;2.ZhejiangChineseMedicalUniversity,Hangzhou310053,China)
Objective:To provide the theoretical basis for the comprehensive utilization of aerial parts ofFritillariathunbergiiin flowering period,amino acids,nucleosides and inorganic elements in different parts of aerial parts ofF.thunbergiiin flowering period,including flower without anther,anther and stem were analyzed and evaluated.MethodsUltra performance liquid chromatography-mass spectrometry (UPLC/MS-MS) technique was used to determine the contents of nucleosides and dissociative amino acids of different parts in above-ground portion ofF.thunbergiiin flowering period.Plasma-atomic emission spectrometry (ICP-AES) and spectrophotometer were applied to determine the contents of inorganic elements.ResultsThe total contents of nucleoside in flower without anther,anther and stem were 1.91,6.50,4.58 mg·g-1,respectively,the contents of twenty-four kinds of amino acids was 68.79 mg·g-1in flower without anther,103.98 mg·g-1in anther and 69.77 mg·g-1in the stem,which indicated that the amino acids were mainly stockpiled in the flower without anther.In addition,the total content of inorganic elements were 1 306.76,772.74,1 295.27 mg·g-1,respectively.ConclusionThe aerial parts ofF.thunbergiiin flowering period contain a number of amino acids,iron element and uracil,which could be further utilized in food and medicinal chemistry.
Fritillariathunbergii;aerial parts;chemical composition analysis;resource utilization evaluation
2015-11-21)
江苏高校优势学科建设工程资助项目(ysxk-2013);江苏省“333高层次人才培养工程”项目
*
刘培,助理研究员,研究方向:中药与方剂功效物质基础,Tel:(025)85811917,E-mail:liupei@njucm.edu.cn;江曙,教授,研究方向:微生物与中药相互作用,Tel:(025)85811516,E-mail:jiangshu2000@163.com
10.13313/j.issn.1673-4890.2016.8.005

