3.0T高分辨MRI对症状性大脑中动脉狭窄的诊断价值
王婷婷, 张 磊, 吴 军, 钟耀祖, 罗雯媛
3.0T高分辨MRI对症状性大脑中动脉狭窄的诊断价值
王婷婷1,2,张磊3,吴军1,钟耀祖3,罗雯媛1
目的应用3.0T高分辨磁共振成像(High-resolution MRI,HRMRI)探讨:症状性大脑中动脉(MCA)狭窄的病因;症状性MCA粥样硬化狭窄患者责任血管与非责任血管斑块特点及管壁特征的区别。方法应用3.0T磁共振扫描仪对18例症状性MCA狭窄患者进行MCA管壁成像扫描,扫描系列包括T1w-db space(平扫+增强)。结果符合图像质量要求的16例症状性MCA狭窄患者图像纳入统计分析,其中13例MCA为动脉粥样硬化,2例MCA为血管炎,1例MCA为动脉夹层;责任血管组上壁斑块、不规则斑块、强化斑块较非责任血管组常见(P分别为0.034、0.001、0.011),且责任血管组斑块强化更明显;在最大管腔狭窄处(MLN)处,与非责任血管组相比,责任血管组具有较大的管腔狭窄程度、斑块负荷(PB)、管壁面积(WA)、最大管壁厚度(MVT)(P分别为0.008、0.002、0.042、0.043),责任血管组具有较小的血管面积(VA)、管腔面积(LA),较大的重塑指数(RI)及平均管壁厚度(mVT),差异无统计学意义(P均>0.05);判断双侧MCA斑块特点(位置、规则性、强化类型、强化程度)的组间一致性较好(K分别为0.83、0.94、0.88、0.95,P均<0.001);测量管壁特征时组间信度良好,MLN处的血管面积VA、LA、WA、PB、RI、管腔狭窄程度、MVT、mVT的组间相关系数(ICC)分别为0.94、0.96、0.92、0.99、0.91、0.99、0.94、0.94(P均<0.001),参考管腔(REF)处的VA、LA的ICC分别为0.96、0.92(P均<0.001)。结论HRMRI可清晰显示MCA管壁、管腔,甄别动脉狭窄的病因,试验可重复性高;可根据不同管壁病理改变在HRMRI的表现特征鉴别动脉狭窄的病因:动脉粥样硬化斑块在HRMRI上表现为管壁偏心性增厚,增强扫描呈偏心性强化;血管炎在HRMRI上表现为管壁显著环形增厚,增强扫描呈环形强化;动脉夹层在HRMRI T1WI像上为长条状高信号表现;责任血管的斑块特点、管壁特征不同于非责任血管,这有助于识别罪犯斑块、责任血管及评估斑块稳定性。
大脑中动脉;高分辨磁共振成像;动脉粥样硬化;血管炎;动脉夹层
颅内动脉疾病(Intracranial Arterial Diseases,ICAD)是由颅内动脉粥样硬化(Intracranial Atherosclerosis,ICAS)、血管炎、动脉夹层、Moyamoya等不同病因构成的一组异质性疾病[1]。其中,ICAS是ICAD的主要病因,我国46.6%的急性缺血性卒中由ICAS所致[2],与ICAS相关的缺血性脑血管事件的年复发风率可高达17.1%[3]。不同的管壁病理改变可导致类似的管腔狭窄[1];除了管腔狭窄程度,斑块特征亦是卒中发生的主要预测指标[4,5]。常用的影像学检查,如CT血管成像(CTA)、核磁共振血管成像(MRA)、数字减影血管造影 (DSA)可准确判断管腔狭窄程度,但无法清晰显示管壁结构,在鉴别ICAS与颅内非动脉粥样硬化病变、判断斑块特征上缺乏特异性。颅内、外动脉的HRMRI研究[1,4,6~9]表明,HRMRI能识别出与卒中发生相关的斑块成为[如斑块内出血(IPH)、脂质核心、薄纤维帽]、特点(如上壁、不规则、强化)、管壁特征(如WA、PB),甄别动脉狭窄的病因,且与颅外动脉组织病理活检结果具有较高一致性。目前,MCA狭窄的HRMRI研究多为症状组与无症状组的MCA粥样硬化特点的对比研究,而症状性MCA狭窄病因的HRMRI研究及双侧MCA粥样硬化特点的对比研究较少。本研究旨在应用3.0T HRMRI探讨症状性MCA狭窄的病因,比较动脉粥样硬化性MCA狭窄患者双侧MCA的斑块特点、管壁特征。
1 材料和方法
1.1研究对象
2015年3~12月在北京大学深圳医院连续住院的症状性MCA狭窄患者。入组标准:(1)症状性MCA狭窄患者,90 d内发生过短暂性脑缺血发作(Transient Ischemic Attack,TIA)或急性缺血性卒中(Ischemic Cerebral Stroke,ICS),且诊断的“ TIA”、“ICS”分别满足以下定义[10]:由脑或视网膜局灶性缺血性引起的、不伴脑组织急性梗死的短暂性神经功能障碍则为TIA;而一旦出现引起神经功能障碍的相应脑组织梗死则为ICS;(2)诊断动脉粥样硬化者需具备至少2项以下动脉粥样硬化危险因素[11]:男性(>50岁)、女性(>60岁)、高血压、糖尿病、高血脂、高同型半胱氨酸血症、吸烟、超重(BMI≥25 kg/m2)、既往ICS或TIA、脑梗死家族史;(3)获得患者或患者合法的授权代表签署的知情同意书。排除标准:(1)有MRI禁忌证:恐惧、体内金属物体(如起心脏起搏器等)、病情不稳定的患者;(2)存在心源性栓塞的证据:房颤,风心病,瓣膜手术,近3 m发生过心梗;(3)颈动脉彩超提示的一侧或双侧颈动脉狭窄≥50%的患者。
1.2检查方法
1.2.1影像学检查3.0T MRI 检查系统(TIM TRIO,Siemens,Erlangen),包括3.0T MRI扫描仪及32通道头颅线圈。扫描序列包括常规头颅扫描序列和HRMRI,后者包括T1w-db space(T1Weighted-The delay alternating with nutation for tailored excitation,Sampling perfection with application-optimized contracts by using different flip angle evolutions)(即T1WI)平扫和T1w-db space增强扫描。T1w-db space参数如下:TR/TE=1140 ms/23 ms,FOV=212x159 mm2,层厚/层间隔=0.74 mm/0,层数=72,矩阵=336×256,体素=0.62×0.62×0.62,扫描时间=7 m 36 s。对比剂为钆喷替酸葡甲胺(Gd-DTPA,中国北陆药业),用量2 ml/kg,注射速率3.0 ml/s。完成扫描后,在图像工作站上应用最大密度投影(maximum intensity projection,MIP),多平面重建 (multi-planar reformation,MPR)及曲面重建(curved MPR)技术重建三维图像(矢状位、冠状位、轴位)。
1.2.2图像分析由两名资深磁共振研究者在三维图像上分析MCA管壁结构。首先判断图像质量,然后分析管壁病变,最后分析MCA粥样硬化患者的双侧MCA斑块特点、测量管壁特征。
图像质量分级标准[12]:差:有较多的伪影,管腔内外壁无法观察;一般:大部分层面能够观察到管腔的内外壁,但显示欠清晰;良:大部分层面管腔内外壁显示清晰,部分层面管腔外壁显示欠清晰;优:管腔内外壁显示清晰。意见不一致时商讨决定,如果图像质量为良或优,则认为检查成功。18例患者中,16例图像质量为良或优,予纳入进一步分析。
管壁病变诊断标准[1]:具备至少2项动脉粥样硬化危险因素者,则为动脉粥样硬化;若患者动脉粥样硬化危险因素 ≤1项,则为非动脉粥样硬化:(1)实验室检查提示自身免疫疾病抗体阳性,则为血管炎;(2)CTA/ MRA/DSA提示为动脉夹层/动脉瘤/Moyamoya,则相应诊断为动脉夹层/动脉瘤/Moyamoya。据此标准,将16例患者分为动脉粥样硬化者(13例)及非动脉粥样硬化者(3例)。
将13例动脉粥样硬化者的MCA分为责任血管(责任血管指引起脑梗死或脑缺血发作的MCA[4])组与非责任血管(非责任血管指对侧未引起脑梗死或脑缺血发作的MCA[4])组,对比两组斑块特点与管壁特征。
比较两组动脉粥样硬化斑块位置、形态:将两组MCA在MLN处的横断面平分为四个相等的壁区[13],即前壁、上壁、后壁、下壁,若斑块位于两个壁区,则以最大斑块厚度的壁区为主;若管腔闭塞或斑块环绕管腔一周呈相对均匀分布,则为全壁。若斑块近管腔侧轮廓较为光滑,则为规则斑块,若斑块凹凸不平,出现破口,则为不规则斑块,若管腔闭塞,难以判断,则为其他类型;若斑块呈均质性或环形强化,则为向心性强化,若斑块呈非360°环形强化或强化处最薄斑块不及最厚斑块的50%,则为偏心性强化[1]。
比较两组MCA粥样硬化斑块强化程度[14]:肉眼观察增强扫描前后两组MCA斑块信号变化,增强扫描前斑块信号为基准,以增强扫描后垂体信号强度为标准:与增强扫描强化前斑块信号相近,则无强化(-);高于扫描前斑块信号但明显低于垂体信号为轻度强化(+);稍低于垂体信号为中度强化();与垂体信号相近,为高度强化()。
测量两组MCA管壁参数:在增强扫描后双侧MCA最大管腔狭窄处(MLN)及临近参考管腔处(REF)(临近参考管腔定义[4]为在高分辨T1图像上管腔无狭窄、管壁表现正常或相对正常层面)图像上勾勒血管面积(Vessel Area,VA)、(Lumen Area,LA),系统便自动生成VA、LA、MVT、mVT(见图1)。狭窄程度= (1-MLN处的LA)/REF处的LA*100[4];WA=VA-LA[4];PB=(MLN处WA/VA)×100%[15];RI=MLN处VA/REF处VA[4]。
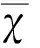
2 结 果
2.1一般资料符合图像质量要求的症状性MCA狭窄患者16例,年龄为51.9±14.0岁,发病至扫描时间为28.9±20.6 d,男女比例为3∶1;4例为TIA,12例为ICS。
2.2MCA狭窄性病变性质13例动脉粥样硬化患者中,3例MCA管腔闭塞,10例MCA在T1WI上为不同程度的偏心性增厚,增强扫描见57.7%的斑块呈不同程度强化,偏心性强化较向心性强化常见(80% vs 20%)(见图2);其中1例右侧MCA斑块并发斑块内出血(Intraplaque Hemorrhage,IPH),在T1WI像上表现为局部高信号(见图3)。3例非动脉粥样硬化患者中,2例患者的MRA发现多发颅内血管狭窄,患侧MCA、颈内动脉末段为血
管炎性改变,在T1WI上表现为管壁显著环形增厚,管腔向内缩小,增强扫描见部分狭窄管壁环形强化(见图4);另1例患侧MCA为动脉夹层,在MRA上为不规则性狭窄,在T1WI像上呈长条状高信号(见图5)。
2.3两组MCA斑块特点比较两组前壁斑块最为常见(50.0%),其次为上壁斑块(19.5%),责任血管组上壁斑块多于非责任血管组(23.1% vs 15.4%,P=0.034);责任血管组不规则斑块较非责任血管组常见(62.9% vs 23.1%,P=0.001);总体,偏心性强化斑块多于向心性强化斑块(61.5% vs 30.8%),其中,责任血管组强化斑块较非责任血管组常见(84.6% vs 30.8%),两者差异有统计学意义(P=0.011);责任血管组高度强化斑块显著多于非责任血管组(53.8% vs 7.7%),非责任血管组仅4例斑块强化,轻度强化占50%,两者差异具有统计学意义(P=0.003)。
2.4两组MCA管壁特征比较在REF处,责任血管组的VA小于、LA大于非责任血管组的VA、LA,差异无统计学意义(VA:P=0.78;LA:P=0.90)。在MLN处,责任血管组RI大于非责任血管组RI(1.20±0.31 vs 1.03±0.20,P=0.17);责任血管组的VA、mVT大于非责任血管组的VA、mVT,差异无统计学意义(VA:P=0.10;mVT:P=0.20);责任血管组的管腔狭窄程度[90.0(37.4,91.1)]、PB[86.00(71.80,91.18)]、WA(8.03±1.70 mm2)、MVT(1.77±0.58 mm)大于非责任血管组的管腔狭窄程度[19.6(4.6,35.8)]、PB[32.17(15.66,61.35)]、WA(6.42±1.56 mm2)、MVT(1.33±0.26 mm),差异具有统计学意义(管腔狭窄程度:P=0.008,;PB:P=0.002;WA:P=0.042;MVT:P=0.043);责任血管组的LA[1.61(0.76,3.02) mm2]小于非责任血管组的LA(3.27±1.50 mm2),差异无统计学意义(P=0.06)。
2.5组间一致性比较两名研究者判断MCA斑块位置、规则性、强化类型、强化程度的组间一致性较好,K分别为0.83、0.94、0.88、0.95(P均<0.001);测量管壁特征时组间信度良好,两者测量MLN处的VA、LA、WA、PB、RI、管腔狭窄程度、MVT、mVT的组间相关系数(ICC)分别为0.94、0.96、0.92、0.99、0.91、0.99、0.94、0.94(P均<0.001);REF处的VA、LA的ICC分别为0.96、0.92 (P均<0.001)。

图1血管面积(VA)/管腔面积(LA)/管壁面积(WA)测量方法示意图。绿圈表示血管面积,红圈表示管腔面积,*表示管腔,绿圈与红圈之间为斑块/管壁面积

图2动脉粥样硬化斑块在高分辨核磁共振成像(HRMRI)增强扫描前后表现。患者,男,39岁,吸烟及高脂血症,表现为部分运动性失语、右侧中枢性面瘫、右上肢轻偏瘫。A:DWI示左基底节区缺血灶;B和C:MRA及DSA分别示左侧MCA重度狭窄(>90%),右侧MCA轻度狭窄;HRMRI T1WI像轴位钆增强扫描前(C)、后(D)示双侧MCA前壁偏心性强化斑块(虚框),左侧MCA斑块较大且表面不规则

图31例右侧MCA狭窄的脑梗死患者HRMRI扫描责任血管可见斑块内出血(IPH)。A:DWI示右侧大脑半球多发缺血灶;B:MRA示右侧MCA中度狭窄;HRMRI T1WI像矢状位钆增强扫描前(C)、后(D)示右侧MCA前壁偏心斑块伴局部明显高信号,增强扫描前后信号无明显改变
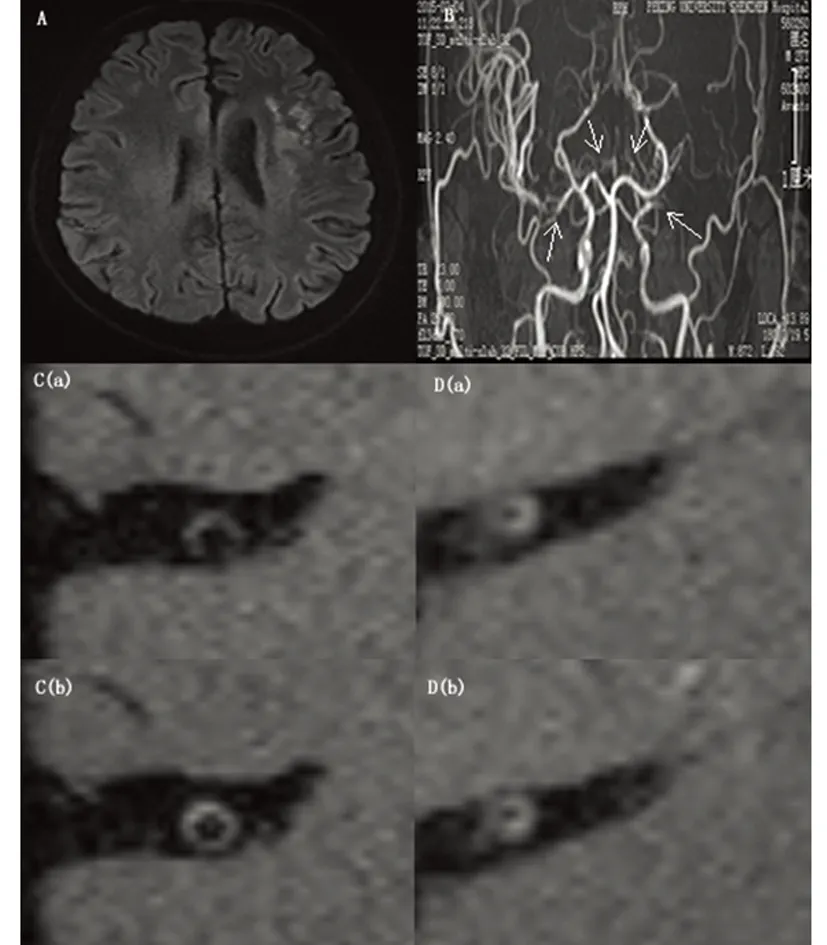
图4血管炎在HRMRI上增强扫描前后的表现。患者男性,27岁,患Grave病3 y,表现为混合性失语,右侧肢体偏瘫。A:DWI示左侧脑室旁缺血灶;B:MRA示双侧大脑前动脉、左侧MCA未见显影,右侧MCA不规则狭窄(箭头);C:HRMRI T1WI像轴位钆增强扫描前[C(a)]、后[C(b)]示右侧MCA管壁环形增厚、环形强化;D:HRMRI T1WI像轴位钆增强扫描前[D(a)]、后[D(b)]示左侧MCA管壁环形增厚、管腔向内缩小,管壁无明显强化

图51例左侧大脑中动脉夹层的脑梗死患者HRMRI图像。A:DWI示左侧脑室旁缺血灶;B:MRA示左侧MCA不规则性狭窄(箭头);C:HRMRI T1WI像冠状位示左侧MCA长条状高信号,可见真腔(白*)及血肿(黑*);D和E:HRMRI T1WI像冠状位图(经cMPR重建)(D)、轴位图(E)示左侧MCA血肿呈长条状高信号
3 讨 论
传统影像学技术,如CTA、MRA、DSA可清晰显示颅内血管轮廓,评估管腔狭窄程度,但在显示管壁结构、动脉粥样硬化斑块特征方面的分辨率及特异性不如HRMRI。颈动脉组织病理活检与HRMRI对照研究[9]证实HRMRI可识别与血栓栓塞相关的斑块形态,如IPH。组织病理活检证实的颞动脉炎[1]在HRMRI上表现为管壁呈光滑、弥漫性、向心性强化,这不同于动脉粥样硬化斑块的强化特点。目前,颅内动脉狭窄性病变、粥样硬化斑块在HRMRI的表现特点尚未得到相应颅内动脉组织病理活检证实。颅内动脉与颅外动脉具有相似的管壁构成、病理生理改变,不同颅内动脉狭窄性病变性质、斑块特征在HRMRI的信号表现可由类似的颅外动脉HRMRI研究推断。颅内动脉HRMRI研究[1,4,6]表明,HRMRI能有效甄别缺血性卒中的颅内动脉狭窄的病因(如动脉粥样硬化、血管炎、夹层、Moyamoya等),根据颅内动脉斑块信号特点判断斑块稳定性。
ICAS是颅内动脉疾病常见的病因,亦是造成缺血性卒中的主要原因,但对于无明显动脉粥样硬化危险因素而发生卒中的患者,需重点鉴别动脉粥样硬化与血管炎、动脉夹层等其他颅内动脉疾病。本研究纳入分析的16例症状性MCA狭窄患者,13例患者具有至少2项动脉粥样硬化危险因素,患侧MCA在HRMRI上表现为不同程度的偏心性增厚、甚至闭塞,增强扫描呈偏心性强化,与文献[1,6]报道的斑块强化特点相符。1例无明显动脉粥样硬化危险因素患者,发病前1 w有头颅闭合性外伤,患侧MCA在MRA上呈不规则性狭窄,在T1WI像上表现为长条状高信号,其余颅内动脉未见异常,与研究[1,16]发现的颅内动脉夹层在HRMRI的表现一致。2例临床怀疑中枢神经系统血管炎的患者,只有1项动脉粥样硬化危险因素,均有Grave病及服用抗甲亢药物病史,抗甲状腺抗体阳性,MRA发现多发颅内动脉狭窄,部分狭窄的颅内动脉在T1WI像上表现为管腔向内缩小,管壁向心性增厚,增强扫描呈环形强化,符合血管炎的HRMRI表现[1,17]。文献[18~20]报道甲状腺功能亢进症可并发血管炎,抗甲亢药物可引起抗中性粒细胞胞质抗体(Anti-neutrophil Cytoplasmic Antibodies,ANCA)相关性血管炎或中枢神经系统血管炎。因此,尽管这2例患者MCA的HRMRI表现符合血管炎性改变,其根本病因不甚明确,我们推断可能与Grave病自身、抗甲亢药物或两者共同作用相关。
普遍认为管腔狭窄程度是卒中复发的高危因素,而越来越多的颅内、外动脉HRMRI研究[4,6,7,9,13,21,22]表明,不同斑块成分(如IPH、脂质核心、薄纤维帽)、斑块特点(如上壁、不规则、强化等)、管壁特征(如WA、PB、RI、MVT)与卒中发生或复发密切相关。因而,除管腔狭窄程度外,其他反应ICAS性质的特征,如斑块成分及特点、管壁特征,可能成为ICAS患者发生脑卒中或卒中复发的预测因素。本研究对比研究了13例症状性MCA粥样硬化患者双侧MCA斑块特点及管壁特征,发现1例患侧MCA斑块在T1WI像上出现局部高信号,与文献[21]报道的IPH在HRMRI的表现一致,而Xu等[22]发现症状性MCA狭窄者IPH发生率显著高于无症状者。据此,IPH可能为斑块不稳定的标志之一,与卒中发生相关。关于MCA粥样硬化斑块位置与脑缺血事件关系,目前研究[4,13]多发现症状性MCA狭窄者上壁斑块较无症状性MCA狭窄者多见,而多数MCA的穿支动脉起源于上壁。因此,与他管壁位置相比,上壁斑块更容易堵住穿支动脉开口引起脑梗死,提示上壁斑块可能为ICAS患者发生卒中的预测指标。本研究结果显示,前壁斑块(50.0%)最为常见,责任血管组上壁斑块较非责任血管组常见(23.1% vs 15.4%,P=0.034),与上述研究结论一致。但本研究样本量小,两组上壁斑块数目相差较小,难以有力证明斑块分布是卒中的独立危险因素。斑块分布是否为卒中发生的独立预测因子,有待进一步研究。本研究还发现,责任血管组不规则斑块较非责任血管组(62.9% vs 23.1%)常见,3例管腔闭塞见于责任血管组,两者差异具有高度统计学意义(P=0.001),与文献报道[1,4]较为一致,提示不规则斑块可能为破裂斑块的表现之一,与卒中发生相关。在本研究中,尽管斑块形态在责任血管组与非责任血管组的比例显著不同,由于样本量较小,斑块形态是否为脑缺血事件的一个预测指标有待大样本、前瞻性研究明确。
在评估斑块稳定性的指标(薄纤维帽、脂质核心、IPH、斑块强化)中,斑块强化是最常见、最可靠的指标,在T1WI像钆增强扫描后表现为不同程度的高信号[14]。研究[14]表明,斑块强化与新发卒中相关,随着发病时间的推移,斑块强化程度逐渐减弱。斑块出现强化的解释是,炎症与斑块形成与发展相关,炎症可改变斑块内血管内皮的通透性,增强扫描时造影剂从微血管漏出,在T1WI上表现为特定的强化特征[9,23]。因此,伴炎性成分或新生血管形成的裸露血管内皮最有可能出现强化,明显斑块强化提示发病时间比较短、斑块内炎症反应严重。据此,斑块强化为斑块不稳定的重要标志,与卒中或TIA发生密切相关,这已得到前瞻性HRMRI研究[6]证实。可根据斑块强化的程度来识别罪犯斑块、预测卒中发生风险,进而为加强稳定斑块治疗、降低卒中复发风险提供有力依据。本研究结果显示,责任血管组斑块强化发生率高于非责任血管组(84.6% vs 30.8%,P=0.015),且责任血管组斑块强化更明显,与文献[1,7]报道一致。非责任血管组部分斑块出现轻至中度强化,提示炎症不只限于患侧血管,还可同时累及其余颅内动脉粥样硬化斑块,但斑块炎症程度不同引发斑块不稳定从而造成卒中发生的时机不同,此时加强稳定斑块治疗可能大大减少其余部位脑梗死发生或卒中复发风险。
症状性MCA狭窄与无症状性MCA狭窄相比,除斑块特点不同外,管壁特征亦存在差异,目前关于MCA粥样硬化管壁特征的研究结论不一。Zhao等[4]发现,尽管两者狭窄程度无统计学差异,与无症状性MCA狭窄组相比,症状性MCA狭窄组具有更大的斑块面积(Plaque Area,PA),但两组MLN处WA、LA、VA以及REF处VA、LA无显著差异,但其他研究[7]表明,较大的WA与新发梗死相关,新发梗死组PA、LA、管腔狭窄程度与无梗死组无差异。本研究发现,责任血管组与非责任血管组在REF处的VA、LA无显著差异;在MLN处,与非责任血管组相比,责任血管组具有更大的WA(P=0.042)、PB(P=0.002)、MVT(P=0.043)、管腔狭窄程度(P=0.008),提示具有这些管壁特征的ICAS引起卒中发生的风险可能较高。
血管重构是管壁特征的一个重要指标,被定义为血管结构或组成的持续性改变,是动脉粥样硬化的常见特征之一[24],主要分为正性重构(Positive Remodeling,PR)、负性重构(Negative Remodeling,NR)。症状性MCA的HRMRI研究[7,24]表明,PR与卒中发生密切相关,正性重构组可观察到更多的微栓子信号,提示正性重构与斑块不稳定、破裂有关,而破裂的斑块可促进局部血栓形成在原位闭塞血管或脱落后随血流移动至远端血管而堵塞血管,结果均是造成脑组织缺血坏死。本研究中,责任血管组具有更大的RI、更常见的PR,虽然两组差异无统计学意义(P=0.17),但动脉粥样硬化为系统性疾病,部分动脉粥样硬化血管通过正性重构来维持管腔通畅,正性重构程度不同引发脑梗死的时机不同。且本研究部分血管无论轻重度狭窄均有正性重构表现,提示正性重构可能是动脉粥样硬化早期的活跃性病变,贯穿斑块的发生与发展全程。因正性重构与斑块不稳定密切相关,对于血管狭窄轻微但出现正性重构的患者,应尽早加强稳定斑块治疗,预防脑卒中的发生。总之,症状性MCA与无症状性MCA的管壁特征不同,但前述管壁特征中哪些与卒中发生或复发更相关,待大样本、前瞻性研究明确。
本试验可重复性高,两研究者间阅片一致性较好(K均>0.8,P均<0.001);组间测量信度良好(ICC 均>0.9,P均<0.001),与文献[25]报道的类似。因此,应用HRMRI显示颅内动脉管壁结构、鉴别动脉狭窄的病理性质及不同斑块特点具有较高的可行性。
本研究将3D-SPACE技术[4]与DANTE技术[26]结合,即T1w-db space,可同时抑制血流及脑脊液信号,减少血流伪影对斑块识别的干扰,扫描后图像经MIP、MPR、cMPR重建,可从冠状位、矢状位、轴位等多角度显示显示管壁、管腔情况,为判断斑块特点、测量管壁特征提供更为详细的信息。据我们所知,尚无其他学者应用T1w-db space研究症状性MCA狭窄的病因。但本研究为一组应用T1w-db Space对MCA狭窄性病变进行探索性研究的结果,样本量小,缺乏颅内动脉组织病理活检结果对照,所选参考血管并非绝对正常,可能影响管壁特征的测量,仅为HRMRI辨别MCA狭窄性病变、斑块特点及管壁特征提供参考信息。如何利用该项技术更准确地甄别MCA狭窄性病因需增大样本量,行颅内动脉管壁组织活检证实。
4 结 论
综上,HRMRI可清晰显示MCA管壁、管腔,甄别动脉狭窄的病因,试验可重复性高。可根据不同管壁病理改变在HRMRI的表现特征鉴别动脉狭窄的病因:动脉粥样硬化斑块在HRMRI上表现为管壁偏心性增厚,增强扫描呈偏心性强化;血管炎在HRMRI上表现为管壁显著环形增厚,增强扫描呈环形强化;动脉夹层在HRMRI T1WI像上为长条状高信号表现。责任血管的斑块特点、管壁特征不同于非责任血管,这有助于识别罪犯斑块、责任血管及评估斑块稳定性。
[1]Swartz RH,Bhuta SS,Farb RI,et al. Intracranial arterial wall imaging using high-resolution 3-tesla contrast-enhanced MRI [J]. Neurology,2009,72(7):627-634.
[2]Wang Y,Zhao X,Liu L,et al. Prevalence and outcomes of symptomatic intracranial large artery stenoses and occlusions in China:the Chinese Intracranial Atherosclerosis (CICAS) Study[J]. Stroke,2014,45(3):663-669.
[3]Wong KS,Li H. Long-term mortality and recurrent stroke risk among Chinese stroke patients with predominant intracranial atherosclerosis [J]. Stroke,2003,34(10):2361-2366.
[4]Zhao DL,Deng G,Xie B,et al. High-resolution MRI of the vessel wall in patients with symptomatic atherosclerotic stenosis of the middle cerebral artery[J]. Journal of Clinical Neuroscience,2015,22(4):700-704.
[5]王婷婷,吴军. 颅内动脉粥样硬化斑块稳定性的高分辨率核磁共振成像研究进展[J]. 中华神经科杂志,2015,48(12):1115-1121.
[6]Kim JM,Jung KH,Sohn CH,et al. Intracranial plaque enhancement from high resolution vessel wall magnetic resonance imaging predicts stroke recurrence[J]. International Journal of Stroke,2016,11(2):171-179.
[7]Xu P,Lv L,Li S,et al. Use of high-resolution 3.0-T magnetic resonance imaging to characterize atherosclerotic plaques in patients with cerebral infarction[J]. Experimental and Therapeutic Medicine,2015,10(6):2424-2428.
[8]Underhill HR,Hatsukami TS,Cai J,et al. A noninvasive imaging approach to assess plaque severity:the carotid atherosclerosis score [J]. AJNR American Journal of Neuroradiology,2010,31(6):1068-1075.
[9]Moody AR,Murphy RE,Morgan PS,et al. Characterization of complicated carotid plaque with magnetic resonance direct thrombus imaging in patients with cerebral ischemia [J]. Circulation,2003,107(24):3047-3052.
[10]Easton JD,Saver JL,Albers GW,et al. Definition and evaluation of transient ischemic attack:a scientific statement for healthcare professionals from the American Heart Association/American Stroke Association Stroke Council;Council on Cardiovascular Surgery and Anesthesia;Council on Cardiovascular Radiology and Intervention;Council on Cardiovascular Nursing;and the Interdisciplinary Council on Peripheral Vascular Disease. The American Academy of Neurology affirms the value of this statement as an educational tool for neurologists [J]. Stroke,2009,40(6):2276-2293.
[11]O’Donnell MJ,Xavier D,Liu L,et al. Risk factors for ischaemic and intracerebral haemorrhagic stroke in 22 countries (the INTERSTROKE study):a case-control study[J]. Lancet,2010,376(9735):112-123.
[12]李明利,徐蔚海,冯逢,等. 磁共振颅内动脉斑块成像技术的临床应用[J]. 中国医学科学院报,2012,34(5):443-449.
[13]Xu WH,Li ML,Gao S,et al. Plaque distribution of stenotic middle cerebral artery and its clinical relevance[J]. Stroke,2011,42(10):2957-2959.
[14]Skarpathiotakis M,Mandell DM,Swartz RH,et al. Intracranial atherosclerotic plaque enhancement in patients with ischemic stroke[J]. AJNR American Journal of Neuroradiology,2013,34(2):299-304.
[15]Ma N,Jiang WJ,Lou X,et al. Arterial remodeling of advanced basilar atherosclerosis:a 3-tesla MRI study [J]. Neurology,2010,75(3):253-258.
[16]Lee HO,Kwak HS,Chung GH,et al. Diagnostic usefulness of high resolution cross sectional MRI in symptomatic middle cerabral arterial dissection[J]. Journal of Korean Neurosurgical Society,2011,49(6):370-372.
[17]Bley TA,Uhl M,Venhoff N,et al. 3-T MRI reveals cranial and thoracic inflammatory changes in giant cell arteritis[J]. Clinical Rheumatology,2007,26(3):448-450.
[18]Tripodi PF,Ruggeri RM,Campenni A,et al. Central nervous system vasculitis after starting methimazole in a woman with Graves’ disease[J]. Thyroid,2008,18(9):1011-1013.
[19]Shikha D,Harris J,Resta C,et al. Antineutrophilic Cytoplasmic Antibody Positive Vasculitis Associated with Methimazole Use [J]. Case Reports in Endocrinology,2015,2015:530319.
[20]Puras Tellaeche A,del Villar Sordo V,Gonzalez Serrano M,et al. Hyperthyroidism associated with leukocytoclastic vasculitis[J]. Revista Clinica Espanola,1985,176(9):485.
[21]Chen XY,Wong KS,Lam WW,et al. High signal on T1sequence of magnetic resonance imaging confirmed to be intraplaque haemorrhage by histology in middle cerebral artery[J]. International Journal of Stroke,2014,9(4):19.
[22]Xu WH,Li ML,Gao S,et al. Middle cerebral artery intraplaque hemorrhage:prevalence and clinical relevance[J]. Annals of Neurology,2012,71(2):195-198.
[23]Libby P,Ridker PM,Hansson GK. Progress and challenges in translating the biology of atherosclerosis[J]. Nature,2011,473(7347):317-325.
[24]Shi MC,Wang SC,Zhou HW,et al. Compensatory remodeling in symptomatic middle cerebral artery atherosclerotic stenosis:a high-resolution MRI and microemboli monitoring study [J]. Neurological Research,2012,34(2):153-158.
[25]Yang WQ,Huang B,Liu XT,et al. Reproducibility of high-resolution MRI for the middle cerebral artery plaque at 3T[J]. European Journal of Radiology,2014,83(1):49-55.
[26]Zhang L,Hu XQ,Wu J. High resolution three dimensional imaging of extracranial and intracranial arteries[J]. Proc 23rd Annual Meeting of ISMRM,2015,552.
The value of 3.0T High-resolution magnetic resonance imaging in the diagnosis of symptomatic middle cerebral arterial stenosis
WANGTingting,ZHANGLei,WUJun,etal.
(DepartmentofNeurology,PekingUniversityShenzhenHospital,Shenzhen518036,China)
ObjectiveUsing 3.0T High-resolution magnetic resonance imaging (HRMRI) to investigate:causes of symptomatic middle cerebral artery (MCA);differences of plaque and vessel wall characteristics between culprit arteries and non-culprit arteries in patients with symptomatic MCA atherosclerotic stenosis. MethodEighteen patients with symptomatic MCA stenosis underwent middle cerebral arterial wall imaging. HRMRI scans included pre-contrast T1w-db space and post-contrast T1w-db space. ResultsAmong 16 patients qualified for statistical analysis,13 MCAs were atherosclerosis,2 were vasculitis and 1 was arterial dissection. Compared with group of non-culprit artery,group of culprit artery had more plaques on superior wall,and more irregular and enhanced plaques (Pwas 0.034,0.001 and 0.011 respectively). At maximal lumen narrowing (MLN),group of culprit artery had larger lumen stenosis,plaque burden (PB),wall area (WA) and maximal vessel thickness (MVT) (Pwas 0.008、0.002、0.042 and 0.043 respectively);group of culprit artery had smaller vessel area (VA) and lumen area (LA),greater remodeling index (RI) and mean vessel thickness (mVT),but no significant differences existed between two groups (AllP>0.05). Inter-observer reproducibility was excellent for identifying plaque characteristics (location,regularity,enhanced type and degree) (K was 0.83,0.94,0.88 and 0.95 respectively,allP<0.001),and for measuring VA、LA、WA、PB、RI、lumen stenosis、MVT and mVT at MLN(Interclass correlation coefficient [ICC ]was 0.94、0.96、0.92、0.99、0.91、0.99、0.94、0.94,allP<0.001) and VA,LA at
ite(REF)(ICC was 0.96,0.92 respectively,bothP<0.001). ConclusionHRMRI helps to clearly visualize the lumen and vessel wall of MCA,and distinguish causes of arterial stenosis with high reproducibility. Different pathological manifestations on HRMRI indicate underlying causes of arterial stenosis:atherosclerotic plaques manifest as eccentric thickening of arterial wall with eccentric enhancement,vasculitis has concentric vessel thickening and enhancement,arterial dissection shows long-striped hyper-intensity on HRMRI T1WI. The plaque and vessel wall characteristics differ between culprit arteries and non-culprit arteries,which help to identify culprit plaques and arteries,and evaluate plaque stability.
Middle cerebral artery;High-resolution magnetic resonance;Atherosclerosis;Vasculitis;Arterial dissection
1003-2754(2016)09-0783-07
2016-05-10;
2016-06-02
深圳市科技研发资金项目(No. JCYJ20130402114317402)
(1.北京大学深圳医院神经内科,广东 深圳 518036;2.汕头大学医学院,广东 汕头 515041;3.中国科学院深圳先进技术研究院,广东 深圳 518055)
吴军,Email:wujun188@163.com
R743
A

