紫茎泽兰凋落物提取液对自身种子萌发和幼苗生长的影响
张凤英, 杜芝芝, 和加卫, 杨丽云
(1.云南农业大学 热带作物学院, 昆明 650201; 2.中国科学院 昆明植物研究所,昆明 650201; 3.云南省农业科学院 高山经济植物研究所, 云南 丽江 674100)
紫茎泽兰凋落物提取液对自身种子萌发和幼苗生长的影响
张凤英1, 杜芝芝2, 和加卫3, 杨丽云3
(1.云南农业大学 热带作物学院, 昆明 650201; 2.中国科学院 昆明植物研究所,昆明 650201; 3.云南省农业科学院 高山经济植物研究所, 云南 丽江 674100)
采用恒温培养法研究了不同浓度紫茎泽兰凋落物提取液对其种子萌发和幼苗生长的影响。结果表明:紫茎泽兰凋落物提取液对自身种子萌发与幼苗生长起到一定程度的抑制作用,并且浓度越高抑制作用越强;当提取液浓度低于0.05 g/ml时,种子萌发和幼苗生长过程中各指标与对照均无显著差异(p>0.05);提取液浓度高于0.05 g/ml时,种子发芽率、发芽势、发芽指数、胚根长、幼苗鲜重和干重随提取液浓度的增加急剧降低(p<0.05),并且紫茎泽兰凋落物提取液延长了种子发芽时间,而对幼苗鲜重和干重影响不显著(p>0.05);高浓度(0.30 g/ml)紫茎泽兰凋落物提取液致使种子失活。统计相关检验表明,紫茎泽兰叶片丙二醛(MDA)含量、细胞膜透性均与提取液浓度呈显著的线性正相关(p<0.001),叶绿素含量、根系活力(TTC)、保护性酶(POD,SOD,CAT)和非保护性酶(PPO,PAL)活性均与提取液浓度呈显著的线性负相关(p<0.001)。综合以上结果表明紫茎泽兰凋落物提取液对其种子萌发和幼苗生长存在一定程度的自毒作用。
紫茎泽兰; 凋落物; 提取液; 种子萌发; 幼苗生长
凋落物是植物和微生物所需养分的主要来源和维持生态系统物质循环与能量流动的物质基础[1-3],生态系统长期的稳定性主要依赖于植物生长和凋落物养分之间的动态平衡[4-6]。传统意义上的凋落物主要包括植物的枯枝落叶、落皮、繁殖器官,林下枯死的草本植物以及枯死植物的根等[1,7-10],在植被原生演替过程中具有改变群落生境的作用,强烈影响种群、群落的结构和动态,物种组成和多样性,其在地表的积累被认为是植被演替的一部分[11-13]。天然条件下的种子萌发和幼苗生长是植物生活史中的脆弱阶段,植物将对不利环境因素的适应力大幅度提高[14-16],此阶段对土壤环境变化十分敏感,尤其是种子在凋落物覆盖的表层土壤中等待萌发期间,凋落物分泌的营养与化学物质对自身种子萌发、形成幼苗并完成定居整个过程产生强烈的影响[9,17-18],认知这种影响及其作用机制,对于理解和预测生态系统中群落组成、演替以及种子更新具有重要的指导作用。
紫茎泽兰(EupatoriumadenophorumSpreng.)是菊科泽兰属多年生草本植物,为我国西南地区的主要外来入侵植物,对全球自然和农业生态系统造成了严重危害[19-20],紫茎泽兰入侵后排挤当地植物,表现出较强的竞争优势,并且种子产量高,适应光和养分变化的能力强,其繁殖及扩散能力强,它的入侵带来了一些颇具争议的生态环境问题[21-23]。为了深入理解紫茎泽兰的入侵和危害机制,本文从凋落物对自身种子萌发和幼苗生长方面揭示其危害机制、广泛蔓延特性和田间防治有着重要的指导意义,并且为深入探讨紫茎泽兰的化感作用与其入侵关系提供数据支撑。鉴于此,本研究以紫茎泽兰凋落物为供体,通过室内模拟试验并采用恒温培养法研究不同浓度紫茎泽兰凋落物提取液对自身种子萌发各项指标和幼苗生长中根系活力、细胞膜的受损程度以及抗氧化物酶活性等的影响,从生理生化角度探讨不同浓度紫茎泽兰凋落物提取液与自身种子萌发和幼苗生长的关系,为全面评估紫茎泽兰入侵对生态系统的影响提供理论科学依据。
1 材料与方法
1.1试验材料
紫茎泽兰凋落物取自于四川省西昌市马鞍山乡外10 km处的山谷地带(27°41′15″N,102°03′41″E),属亚热带高原季风气候,常绿阔叶混交林,海拔1 420~1 903 m,干湿季节分明,年均降雨量870~1 250 mm,5—10月为雨季,其余为旱季,年均气温15.8℃,极端最高气温41.3℃,极端最低气温-10.3℃,总积温5 000℃以上,日照丰富,全年日照时数2 500 h以上,无霜期120~140 d,土壤类型为冲击红壤,土质较紧实,质地较粘,研究区紫茎泽兰从中心向边缘地带辐射分布,大部分已形成紫茎泽兰单优群落,株高约2 m,并有大量凋落物。于2013年10月,在研究区采集大量紫茎泽兰凋落物,带回实验室用自来水清洗后再用蒸馏水冲洗自然风干后粉碎过60目筛后贮藏备用;同时并在四川农科院购买大量的紫茎泽兰种子带回实验室备用。
紫茎泽兰种子千粒重为63.54 g,选取健壮饱满、无损伤和虫害的灰黑色种子,福尔马林消毒10 min后蒸馏水冲洗数次,100℃水5 min 处理后蒸馏水冲洗降温,放置24 h备用。
1.2紫茎泽兰凋落物提取液的配置
分别称取风干并碾碎的紫茎泽兰凋落物50,100,150,200,250,300 g溶入1 L蒸馏水中静置24 h,然后5 000 rpm离心机离心15 min,过滤得到5种浓度分别为0.05,0.10,0.15,0.20,0.25,0.30 g/ml(1 g/ml为1 ml水溶液中含有1 g凋落物干物质的提取物)的提取液,于4℃冰箱贮藏备用。
1.3提取液对种子萌发和幼苗生长的试验
室内试验在山东省济宁学院生科院进行,从紫茎泽兰种子中精选大小基本一致的种子均匀摆放在铺有两层滤纸的培养皿中,每个培养皿摆放种子50粒,分别加入不同浓度的提取液15 ml(对照采用去离子蒸馏水),包括对照共7个处理,每个处理3次重复。在恒温生化培养箱中培养,调节光周期25℃,12 h,暗周期15℃,8 h,光强50 nmol/(m2·s),相对湿度控制在75%~80%的范围内,种子萌发以胚根突破种皮为标准,每天等量补充少量对应处理浓度的提取液以保持发芽盒内滤纸的湿度,安置发芽的当天为第1天,第3天后每天观察、统计并记录种子发芽数。待连续3 d无萌发时测量根长(mm)、苗高(mm)、鲜重和干重(精度0.1 mg),计算各处理种子的发芽率、发芽势和发芽指数,并取紫茎泽兰幼苗的根和幼叶测定其生理生化指标。
1.4种子萌发和幼苗生长各生理指标测定
发芽率=(发芽数/50)×100%;
发芽势=(发芽初期12 d的发芽粒数/50)×100%;
发芽指数=∑(Gt/Dt);式中:Gt——在t天的种子发芽数;Dt——相对应的种子发芽天数。采用愈创木酚法测定过氧化物酶(POD)活性;氮蓝四唑(NBT)光还原法测定超氧化物歧化酶(SOD)活性;过氧化氢分解法测定过氧化氢酶(CAT)活性;比色法测定丙二醛含量(MDA);四氮唑法测定幼苗根系活力(TTC);相对电导率法测定细胞膜透性;多酚氧化酶(PPO)活性测定采用分光光度计;液氮分离纯化测定苯丙氨酸解氨酶(PAL)活性;参照《植物生理学试验指导》方法测量并计算出叶绿素含量[24]。
1.5数据分析
试验数据采用平均值±标准偏差(mean±SD)表示,采用Excel 2003.0和SPSS 18.0进行统计分析,种子萌发和幼苗生长过程中各指标进行单因素方差比较(One-way ANOVA)分析,方差分析用Duncan′s法(显著水平设置α=0.05),Origin 7.5作图。
2 结果与分析
2.1紫茎泽兰凋落物提取液对种子萌发的影响
由表1可知,紫茎泽兰凋落物提取液对自身种子萌发起到不同程度的抑制作用,并且随提取液浓度的增大抑制作用增强,紫茎泽兰种子萌发各项指标随提取液浓度的增加而逐渐降低,并且降低幅度逐渐变大。多重分析比较显示,当提取液浓度为0.05 g/ml时,紫茎泽兰种子萌发各项指标与对照均无显著差异(p>0.05),当提取液浓度高于0.05 g/ml时,不同浓度提取液处理后的紫茎泽兰种子萌发各项指标与对照的差异均达到显著水平,并且不同处理间也基本达到显著差异(p<0.05);当提取液浓度为0.25,0.30 g/ml时,种子萌发各项指标无显著差异(p>0.05),也即,高浓度紫茎泽兰凋落物提取液对自身种子的萌发造成了一定程度的伤害,提取液浓度为0.30 g/ml时,种子基本不再萌发,相比于对照,提取液对自身种子发芽率、发芽势、发芽指数、胚芽长和胚根长的抑制率分别为90.18%,93.36%,93.92%,62.95%,70.03%;经不同浓度提取液处理后,虽然对紫茎泽兰幼苗鲜重和干重的增加表现出了一定的抑制作用,但与对照的差异不显著(p>0.05),抑制率分别为63.96%和22.80%;另外,提取液也延长了紫茎泽兰种子萌发所需时间。由此可见,紫茎泽兰凋落物提取液对其种子萌发的抑制作用非常明显。

表1 紫茎泽兰凋落物提取液对种子萌发的影响
注:同列相同字母表示在0.05水平差异不显著,下同。
2.2紫茎泽兰凋落物提取液对幼苗叶绿素含量和细胞膜透性的影响
由图1A可知,幼苗叶绿素含量随紫茎泽兰凋落物提取液浓度的增加呈降低趋势,并且降低幅度逐渐增大,二者呈显著的负线性相关关系,低浓度提取液(0.05 g/ml)对幼苗叶绿素含量无显著影响(p>0.05),随提取液浓度的增加,紫茎泽兰凋落物提取液对自身幼苗叶片叶绿素含量的抑制作用也逐渐增加,当提取液浓度为0.30 g/ml时,与对照相比,叶绿素含量降低了84.88%。
由图1B可知,幼苗细胞膜透性随紫茎泽兰凋落物提取液浓度的增加呈增加趋势,并且增加幅度逐渐增大,二者呈显著的正线性相关关系,低浓度紫茎泽兰凋落物提取液对种自身幼苗叶片细胞膜透性无显著影响(p>0.05),当浓度逐渐增加时,显著增加了幼苗叶片细胞膜透性,当提取液浓度为0.30 g/ml时,与对照相比,叶片细胞膜透性增加了82.65%,直到幼苗生长后期,部分高浓度处理的幼苗已经死亡。
2.3紫茎泽兰凋落物提取液对幼苗MDA和TTC的影响
由图2A可知,幼苗MDA含量随紫茎泽兰凋落物提取液浓度的增加呈增加趋势,并且增加幅度逐渐增大,二者呈显著的正线性相关关系,低浓度紫茎泽兰凋落物提取液对种自身幼苗叶片MDA含量无显著影响(p>0.05),当浓度逐渐增加时,紫茎泽兰明显受到伤害,并且凋落物提取液显著增加了自身幼苗叶片MDA含量;当提取液浓度高于0.20 g/ml时,MDA随着凋落物提取液浓度的增加呈平缓的上升,但总的来说MDA含量的增幅不大表明其受到伤害程度较小,说明紫茎泽兰种子对凋落物提取液较为敏感,轻微质量浓度种子就已经开始出现不适;当提取液浓度为0.30 g/ml时,与对照相比,叶片MDA含量增加了75.37%,此时紫茎泽兰种子受到严重伤害,也可能是因为种子随着时间加长受到病菌侵染霉变,内部毒害物质上升所致。
由图2B可知,不同浓度紫茎泽兰凋落物提取液对自身幼苗TTC有不同程度的抑制作用,TTC含量随提取液浓度的增加呈显著下降,相比于对照,分别下降了13.23%,23.68%,45.36%,62.68%,83.79%,93.56%,并且与提取液浓度呈极显著的负相关关系,且随提取液浓度的增加,其抑制作用愈强,当提取液浓度在0~0.10 g/ml变化时,幼苗TTC含量缓慢下降,提取液浓度高于0.10 g/ml时,幼苗TTC含量急剧下降,说明紫茎泽兰凋落物提取液处理下种子内部反应更为剧烈,物质和能量的转化率要明显低于对照,从而降低了种子的成活率和抗逆性。
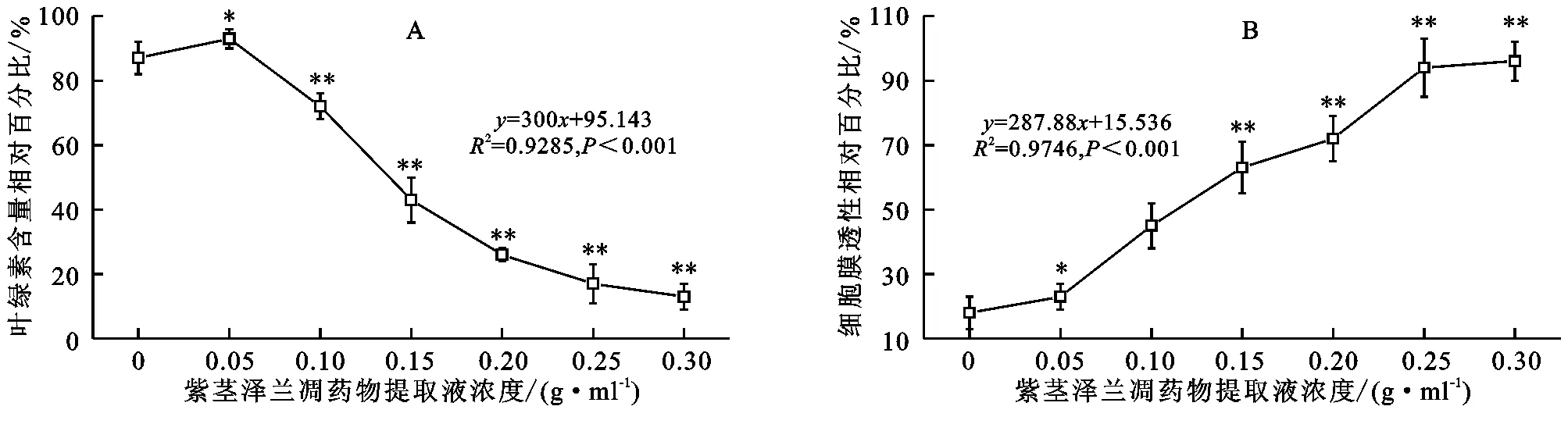
注:*,**分别表示与对照在0.05,0.01水平上差异显著,下同。
图1紫茎泽兰凋落物提取液对幼苗叶片叶绿素含量和细胞膜透性的影响

图2紫茎泽兰凋落物提取液对幼苗MDA和TTC的影响
2.4紫茎泽兰凋落物提取液对幼苗保护性酶及非保护性酶活性的影响
由表2可知,紫茎泽兰凋落物提取液对幼苗保护酶(SOD,POD,CAT)活性的影响整体呈下降趋势,经统计学检验(p<0.001),均与提取液呈显著的负线性关系关系,其相关系数在R2介于0.879 7与0.985 5之间。当提取液浓度为0.05 g/ml时,幼苗保护酶活性与对照没有明显差异(p>0.05),局部略高于对照,表明紫茎泽兰幼苗对保护酶活性较为敏感,在轻微的提取液下就能诱导保护酶活性增加或者降低;当提取液浓度高于0.10 g/ml时,幼苗保护酶活性急剧降低,当提取液浓度为0.30 g/ml时,与对照相比,SOD,POD和CAT活性分别降低了53.13%,86.36%,84.93%。从表2可以看出,紫茎泽兰幼苗非保护酶(PAL,PPO)活性与保护酶(SOD,POD,CAT)活性的变化趋势一致,也即紫茎泽兰凋落物提取液降低了自身幼苗非保护酶活性,当提取液浓度为0.30 g/ml时,与对照相比,PAL和PPO活性分别降低了89.67%和89.08%,综合以上可知高浓度紫茎泽兰凋落物提取液抑制了幼苗保护酶活性和非保护酶活性。

表2 紫茎泽兰凋落物提取液对幼苗保护性酶及非保护性酶活性的影响
3 讨 论
在紫茎泽兰凋落物提取液处理前期,低浓度提取液对自身种子萌发和幼苗生长产生了一定的刺激效应(表1),0.05 g/ml的提取液处理下种子萌发和幼苗生长各项指标均高于对照,与对照无明显差异(p>0.05);在此浓度范围内,细胞中离子转运蛋白和各种离子通道蛋白可以参与细胞离子稳态重建,提高植物的生存能力[9,14,25-27]。本研究初步表明了紫茎泽兰种子萌发最佳凋落物提取液浓度为0.05 g/ml,高于0.05 g/ml阈值以后,提取液能够显著抑制种子萌发和幼苗生长的各项指标,但对幼苗鲜重和干重的影响并不显著(p>0.05),说明紫茎泽兰凋落物提取液幼苗生长的各项指标对提取液浓度的敏感度不一样;当提取液浓度为0.30 g/ml时,种子基本不再萌发,各项生理指标均为最低,由此可知,高浓度紫茎泽兰凋落物提取液在一定程度上导致了种子基本失活。
从紫茎泽兰种子萌发和幼苗生长的整个过程来看,凋落物提取液对种子萌发和幼苗生长均具有明显的抑制作用,种子萌发各项指标均随提取液浓度的增加而降低(表1),叶片中丙二醛(MDA)含量和细胞膜透性与提取液浓度呈显著的线性正相关(p<0.001),叶绿素含量、根系活力(TTC)、保护性酶(POD,SOD,CAT)和非保护性酶(PPO,PAL)活性与提取液浓度呈显著的线性负相关(p<0.001),高浓度提取液不仅导致种子萌发率降低,而且还延长了种子的初始萌发时间,而低浓度下恰恰相反,种子萌发和幼苗生长阶段各项指标均高于对照,同时也大大缩短了发芽时间,这可能是由于高浓度凋落物提取液导致种子产生浅度休眠,而在低浓度下环境相对适宜,种子迅速萌发以免除环境变化带来的负效应[14,25,28-29]。
正常情况下,植物细胞内自由基的产生与清除处于一种动态平衡,逆境条件下这种平衡被打破,当自由基积累到一定程度时产生膜脂过氧化,对植物造成伤害,但生物体本身的保护酶系统可清除产生的自由基[18,30-31]。SOD是活性氧清除系统中发挥作用的抗氧化酶,POD和CAT可以使植物体内的H2O2分解成无毒的H2O和O2,维持体内的活性氧代谢平衡,使植物在一定程度上忍耐、减缓或抵抗逆境胁迫[14,30-32]。本研究中,低浓度提取液使幼苗保护酶活性升高,主要是由于受到化感物质的胁迫后体内过氧化产物增多而启动的一种应激机制,但这种适应性的反应只能够在一定受害程度内发挥作用,当幼苗体内氧化产物累积到一定水平时导致酶活性下降。
MDA在植物体内的积累在一定程度上反映了自由基的活动状态;同时,MDA也是膜脂过氧化产物,与细胞膜的损害程度直接相关,可以反映植物遭受逆境伤害的程度[14,33-37]。本研究表明低浓度的紫茎泽兰凋落物提取液(0.05 g/ml)能促进种子萌发和幼苗生长,提高保护酶(SOD,POD,CAT)和非保护酶(PPO,PAL)活性(表2),修复膜系统损伤,提高其生存能力;当提取液浓度高于0.05 g/ml,幼苗MDA含量随提取液浓度的升高显著增加(图2左),这可能是提取液通过抑制、清除内源活性氧酶的活性,导致活性氧的积累和膜脂过氧化加剧,从而导致幼苗细胞膜透性与MDA含量的变化趋势相一致(图1B),由此说明紫茎泽兰凋落物提取液迫使种子对逆境条件反应增强,高浓度提取液造成植株生理代谢紊乱,最终导致其受到伤害和各项生理指标均下降等。综合图1,图2和表2的结果可知,紫茎泽兰幼苗在低浓度提取液下MDA含量低于对照,随着提取液浓度的增加,MDA含量增加引起种子代谢紊乱、造成无氧呼吸上升,并且引起保护酶活性下降,减弱机体清除自由基能力;在化感作用下,提取液对自身幼苗产生一定的自毒作用,保护酶(SOD,POD,CAT)和非保护酶(PPO,PAL)活性系统的启动抵御高浓度凋落物提取液产生的自毒作用,从而最终导致高浓度的抑制作用。浓度相对较低时,自毒性物质对幼苗生长的抑制作用掩盖了营养物质的化感效应[9,35-37];高浓度提取液下与种子萌发和幼苗生长相关的各种酶活性急剧降低,主要受体植物对紫茎泽兰自身凋落物提取液化感和自毒作用产生的生理调节反应[9,18,37-39]。
综合来看,紫茎泽兰凋落物提取液对其种子萌发和幼苗生长各生理指标具有一定的自毒作用,说明紫茎泽兰凋落物提取液凋落物中含有自毒物质,至于自毒物质的主要成分及主要作用机理还有待进一步研究鉴定。值得注意的是,低浓度的凋落物提取液可能使自毒物质的抑制作用转变为轻微的促进作用,如在凋落物提取液浓度为0.05 g/ml时,对种子和幼苗生长各指标表现出一定的促进作用等,与前人的研究结果相一致[14,33-36,40-41],此浓度的作用效果在化感作用的机理研究和实际应用中具有重要的意义。
[1]Biology of plant litter decomposition[M]. New York: Elsevier,2012.
[2]Hawlena D, Strickland M S, Bradford M A, et al. Fear of predation slows plant-litter decomposition[J]. Science,2012,336(6087):1434-1438.
[3]Makkonen M, Berg M P, Handa I T, et al. Highly consistent effects of plant litter identity and functional traits on decomposition across a latitudinal gradient[J]. Ecology letters,2012,15(9):1033-1041.
[4]Blagoveshchenskii Y N, Bogatyrev L G, Solomatova E A, et al. Spatial variation of the litter thickness in the forests of Karelia[J]. Eurasian Soil Science,2006,39(9):925-930.
[5]Donohue I, Petchey O L, Montoya J M, et al. On the dimensionality of ecological stability[J]. Ecology Letters,2013,16(4):421-429.
[6]Thébault E, Fontaine C. Stability of ecological communities and the architecture of mutualistic and trophic networks[J]. Science,2010,329(5993):853-856.
[7]Currie W S, Harmon M E, Burke I C, et al. Cross-biome transplants of plant litter show decomposition models extend to a broader climatic range but lose predictability at the decadal time scale[J]. Global Change Biology,2010,16(6):1744-1761.
[8]周祥,赵一鹤,张洪江,等.云南高原典型林分林下枯落物持水特征研究[J].生态环境学报,2011,20(2):248-252.
[9]羊留冬,杨燕,王根绪,等.森林凋落物对种子萌发与幼苗生长的影响[J].生态学杂志,2010(9):1820-1826.
[10]张东来,毛子军,张玲,等.森林凋落物分解过程中酶活性研究进展[J].林业科学,2006,42(01):105-109.
[11]Weltzin J F, Keller J K, Bridgham S D, et al. Litter controls plant community composition in a northern fen[J]. Oikos,2005,110(3):537-546.
[12]Knight K S, Oleksyn J, Jagodzinski A M, et al. Overstorey tree species regulate colonization by native and exotic plants:a source of positive relationships between understorey diversity and invasibility[J]. Diversity and Distributions,2008,14(4):666-675.
[13]Sayer E J. Using experimental manipulation to assess the roles of leaf litter in the functioning of forest ecosystems[J]. Biological Reviews,2006,81(1):1-31.
[14]麦苗苗,石大兴,王米力,等. PEG处理对连香树种子萌发与芽苗生长的影响[J].林业科学,2009,45(10):94-99.
[15]Anuradha S, Rao S S R. Effect of brassinosteroids on salinity stress induced inhibition of seed germination and seedling growth of rice(OryzasativaL.)[J]. Plant Growth Regulation,2001,33(2):151-153.
[16]Traveset A, Riera N, Mas R E. Ecology of fruit-colour polymorphism in Myrtus communis and differential effects of birds and mammals on seed germination and seedling growth[J]. Journal of Ecology,2001,89(5):749-760.
[17]张东来,毛子军,张玲,等.森林凋落物分解过程中酶活性研究进展[J].林业科学,2006,42(01):105-109.
[18]潘存德,王强,阮晓,等.天山云杉针叶水提取物自毒效应及自毒物质的分离鉴定[J].植物生态学报,2009,33(1):186-196.
[19]Ahluwalia V, Sisodia R, Walia S, et al. Chemical analysis of essential oils of Eupatorium adenophorum and their antimicrobial, antioxidant and phytotoxic properties[J]. Journal of Pest Science,2014,87(2):341-349.
[20]Bai J, Cao A, Guo M, et al. Identification of9-oxo-10,11-dehydroagerophorone in Eupatorium adenophorum by high performance liquid chromatography[J]. Chin. Bull. Bot.,2011,46(4):470-475.
[21]Nong X, Fang C L, Wang J H, et al. Acaricidal activity of extract fromEupatoriumadenophorumagainst thePsoroptescuniculiandSarcoptesscabieiin vitro[J]. Veterinary Parasitology,2012,187(1):345-349.
[22]Kurade N P, Jaitak V, Kaul V K, et al. Chemical composition and antibacterial activity of essential oils ofLantanacamara,AgeratumhoustonianumandEupatoriumadenophorum[J]. Pharmaceutical Biology,2010,48(5):539-544.
[23]Gao X, Zhao Y, Yang X, et al. Linking trait differences to community dynamics: evidence fromEupatoriumadenophorumand co-occurring native species during a three-year succession[J]. PLOS ONE,2013,8(1):e50247.
[24]高俊凤.植物生理学试验指导[M].北京:高等教育出版社,2006.
[25]陈林,李学斌,王磊,等.紫茎泽兰茎叶水浸提液对4种农作物幼苗生理特性的影响[J].水土保持学报,2013,27(2):164-167.
[26]郑丽,冯玉龙.紫茎泽兰叶片化感作用对10种草本植物种子萌发和幼苗生长的影响[J].生态学报,2005,25(10):2782-2787.
[27]贺宇,丁国栋,汪晓峰,等.水分和沙埋对4种沙生植物种子萌发和出苗的影响[J].中国沙漠,2013,33(6):1711-1716.
[28]王雷,董鸣,黄振英.种子异型性及其生态意义的研究进展[J].植物生态学报,2010,34(5):578-590.
[29]秦文静,梁宗锁.四种豆科牧草萌发期对干旱胁迫的响应及抗旱性评价[J].草业学报,2010,19(4):61-70.
[30]王冬梅,李登武,曹哲.侧柏不同器官水提取物对油松种子萌发和幼苗生长的他感效应[J].植物研究,2012,32(6):675-679.
[31]宋亮,潘开文,王进闯,等.酚酸类物质对苜蓿种子萌发及抗氧化物酶活性的影响[J].生态学报,2006,26(10):3393-3402.
[32]焦树英,李永强,沙依拉·沙尔合提,等.干旱胁迫对3种狼尾草种子萌发和幼苗生长的影响[J].西北植物学报,2009,29(2):308-313.[33]余进德,胡小文,王彦荣,等.霸王果翅及其浸提液对种子萌发的影响[J].西北植物学报,2009,29(1):143-147.
[34]马闯,张文辉,刘新成.等渗的盐分和水分胁迫对杠柳种子萌发的影响[J].植物研究,2008,28(4):465-470.
[35]郑丽,冯玉龙.紫茎泽兰叶片化感作用对10种草本植物种子萌发和幼苗生长的影响[J].生态学报,2005,25(10):2782-2787.
[36]魏岩,王习勇.果翅对梭梭属(Haloxylon)种子萌发行为的调控[J].生态学报,2006,26(12):4014-4018.
[37]黄振英.光照,温度和盐分对梭梭种子萌发的影响[J].植物生理学报,2001,27(3):275-280.
[38]张国斌,郁继华,冯致,等.NO和ABA对辣椒幼苗自毒作用缓解的生理生化机制[J].园艺学报,2013,40(3):458-466.
[39]张国斌,郁继华,冯致,等.NO和ABA对自毒作用下辣椒幼苗光合作用的影响[J].中国农业科学,2013,46(10):2076-2084.
[40]Sinkkonen A. Density-Dependent Chemical Interference-An Extension of the Biological Response Model[J]. Journal of Chemical Ecology,2001,27(7):1513-1523.
[41]An M, Pratley J E, Haig T. Phytotoxicity of vulpia residues:Ⅲ. Biological activity of identified allelochemicals from Vulpia myuros[J]. Journal of Chemical Ecology,2001,27(2):383-394.
Effects ofEupatoriumadenophorumiiLitter Aqueous Extract on Its Seed Germination and Seedling Growth
ZHANG Fengying1, DU Zhizhi2, HE Jiawei3, YANG Liyun3
(1.CollegeofTropicalCrops,YunnanAgricultureUniversity,Kunming665000,China;2.KunmingInstituteofBotany,ChineseAcademyofSciences,Kunming650204,China;3.InstituteofAlpineEconomicPlants,YunnanAcademyofAgriculturalSciences,Lijiang,Yunnan674100,China)
Seed germination and seedling growth ofEupatoriumadenophorumiiwere measured under treatments of its litter aqueous extracts with the concentrations ranging from 0.05 to 0.30 gDW/ml under incubation. The results showed that the indexes of seed germination and seedling growth were significantly inhibited by the higher concentration ofEupatoriumadenophorumiilitter aqueous extract. When the concentration of aqueous extract was 0.05 g/ml, the indexes of seed germination and seedling growth was no significant difference with CK (p>0.05). Seed germination rate, germination potential, germination index, radicle length, seedling fresh weight and dry weight were sharply reduced with the increase of the aqueous extract concentration (p<0.05). At the same time, the seed germination time was delayed when the concentration of aqueous extract was higher than 0.05 g/ml, but the increase of seedling dry weight were not affected under the same concentration. The higherEupatoriumadenophorumiilitter aqueous extract (0.30 g/ml) led to the seed deactivation. Correlation analysis showed that contents of malondialdehyde (MDA) and membrane permeability were a significant linear positive correlation with aqueous extract concentration (p<0.001), respectively. The content of chlorophyll, root activity (TTC), protective enzyme (POD, SOD, CAT) and the activity of protective enzyme (PPO, PAL) had the significant linear negative correlation with aqueous extract concentration (p<0.001). Comprehensive analysis indicated that the aqueous extracts from the litter ofEupatoriumadenophorumiihad autotoxicity on its seed germination and seedling growth.
Eupatoriumadenophorumii; litter; aqueous extract; seed germination; seedling growth
2015-12-04
2015-12-23
张凤英(1971—),女,云南昆明人,讲师,主要从事植物学、植物生长与环境、树木学、植物生理学等课程的教学与研究。E-mail:ZHANGfy1971@126.com
Q793
A
1005-3409(2016)03-0291-06

