NCX1在肝癌中的表达、调控Ca2+浓度及其对肝癌细胞增殖和迁移的影响
徐靖宇,江义霞,谢 睿,金 海,文国容,庹必光
1.遵义医学院附属医院消化内科,贵州 遵义 563000;
2.遵义医学院生理学教研室,贵州 遵义 563000
NCX1在肝癌中的表达、调控Ca2+浓度及其对肝癌细胞增殖和迁移的影响
徐靖宇1,2,江义霞1,谢睿1,金海1,文国容1,庹必光1
1.遵义医学院附属医院消化内科,贵州 遵义 563000;
2.遵义医学院生理学教研室,贵州 遵义 563000
背景与目的:钠钙交换体亚型1(Na+-Ca2+exchanger isoform 1,NCX1)可通过对细胞Ca2+平衡的调节参与癌症的发生,但是否参与肝癌的发生、发展及其作用机制的研究鲜见报道。该研究旨在探讨NCX1在肝癌中的表达变化,对人肝癌细胞HepG2增殖、迁移能力的影响及其可能的机制。方法:运用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)和蛋白[质]印迹法(Western blot)检测NCX1 mRNA及蛋白在人正常肝细胞株LO2、肝癌细胞株HepG2、人正常肝组织和原发性肝细胞癌患者癌组织中的表达。采用共聚焦显微镜技术观察NCX1在细胞外无钠溶液刺激活化后,对正常肝细胞LO2及肝癌细胞HepG2中钙离子浓度的调控。采用MTT法、细胞划痕实验检测NCXl特异性的阻断剂KB-R7943对人肝癌细胞HepG2增殖、迁移的影响。结果:在肝癌细胞株HepG2和肝细胞癌组织中,NCX1 mRNA和蛋白质的表达均高于正常肝细胞株LO2和正常肝组织(P<0.05)。共聚焦显微镜实验发现,细胞外无钠溶液可以激活细胞内钙升高,正常肝细胞LO2及肝癌细胞HepG2细胞内钙离子浓度均增高,但肝癌细胞HepG2细胞内钙离子增高的幅值明显高于LO2细胞(P<0.05),NCXl特异性阻断剂KB-R7943可以显著阻断胞外无钠诱导的细胞内钙离子升高(P<0.05)。KB-R7943可以显著抑制肝癌细胞HepG2的增殖及迁移(P<0.05)。结论:原发性肝癌中NCX1的表达量上调,NCX1的活化可以调节细胞内钙变化,抑制NCX1的活性可以进一步抑制肝癌细胞的增殖和迁移。这提示NCX1可能在原发性肝癌的发生、发展中起了重要的作用。
钠钙交换体亚型1;钙离子;肝细胞癌;细胞增殖;细胞迁移;KB-R7943
肝癌是我国最常见的恶性肿瘤之一。多年来的临床研究表明,由于肝脏具有强大的代偿能力,早期症状不明显,近80%的患者都是到了中、晚期才能明确诊断,因此肝癌的高转移性及高复发性成为肝癌患者术后5年生存率并不理想的主要原因。为了改善肝癌的预后和治疗,研究者一直致力于肝癌细胞恶性转化及防止肝癌侵袭转移的分子生物学机制研究,近年的研究显示,细胞内钙离子(Ca2+)平衡失调在恶性肿瘤的发生、发展中发挥重要的作用[1],并有研究发现肝癌细胞中的Ca2+平衡遭到破坏,其细胞质内Ca2+浓度是增加的[2]。由于细胞内Ca2+平衡主要是通过膜相关蛋白如钙泵、钙离子交换体和钙通道等共同来实现的,因此,上述Ca2+调节蛋白在肿瘤领域的研究中已日益受到关注。钠钙交换体亚型1(Na+-Ca2+exchanger isoform 1,NCX1)是细胞膜上广泛表达的一种膜蛋白,可通过正向转运或者反向转运方式将Na1+和Ca2+进行交换[3],因此,是维持细胞内外Ca2+平衡的重要蛋白之一。关于NCX1与肿瘤的关系,已有研究发现其通过对Ca2+平衡的调节参与了乳腺癌的发生、发展[4],但针对NCX1与肝癌发生、发展的研究,目前基本未涉及。本文首先通过检测对比NCX1在正常肝组织和肝癌组织、正常肝细胞和肝癌细胞的表达变化,继而进行NCX1对肝癌细胞内Ca2+调控的功能观察,再进一步通过使用NCX1特异性抑制剂处理,观察其对肝癌细胞增殖、迁移的影响,旨在为临床肝细胞癌的治疗寻找新的潜在药物作用靶点。
1 材料和方法
1.1主要试剂
NCX1单克隆抗体购自美国Millipore公司,β-actin单克隆抗体和钙染料Frua-2/AM购自美国Invitrogen公司,辣根过氧化物酶(HRP)标记山羊抗小鼠二抗购自杭州联科生物技术股份有限公司,细胞培养用DMEM高糖培养液购自美国Gibco公司,青霉素-链霉素溶液、RIPA裂解液和BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司,实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)及PCR相关试剂购自宝生物工程(大连)有限公司,NCX1特异性抑制剂KB-R7943购自美国Sigma公司,MTT试剂盒购自南京凯基生物科技发展有限公司。
1.2组织来源
人正常肝组织来源于遵义医学院附属医院因外伤切除的正常肝脏组织,人肝癌组织为第三军医大学附属医院及遵义医学院附属医院外科手术切除肝细胞性肝癌患者的癌组织。正常组织及癌组织各20例,所有标本均经病理确诊。
1.3方法
1.3.1细胞培养
人肝癌细胞株HepG2以及正常肝细胞株LO2购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库细胞资源中心,用美国Gibco公司的改良型RPMI-1640培养基(内含有10%胎牛血清、100 ug/L青霉素和100 ug/L链霉素)在37 ℃、CO2体积分数为5%的培养箱中培养肝癌细胞HepG2和正常肝细胞株LO2,用含0.02%EDTA的0.25%胰蛋白酶溶液消化并传代。
1.3.2RTFQ-PCR检测NCX1的mRNA表达变化
取对数生长期的正常肝细胞株LO2及肝癌细胞株HepG2,以及人正常肝组织及肝癌组织。按照RNA试剂盒的操作方法提取细胞及组织总RNA,最后将RNA原液用0.1%DEPC水稀释50倍(即2 µL+98 µL 0.1%DEPC),用全波段酶标仪测定并记录吸光度(D)值D260nm、D280nm、D260nm/ D280nm值(重复3次)。样本中总RNA浓度= D260nm×40 µg/mL×50倍。(注:D260nm值介于0.15~0.1,D260nm/D280nm值介于1.8~2.2提示浓度及纯度均可靠)。
引物的合成由宝生物工程(大连)有限公司合成。NCX1(230 bp)上游引物序列:5'-TGTGCAT CTCAGCAATGTCA-3',下游引物序列 :5 '- TT CCTCGAGCTCCAGATGTT-3'。β-actin(186 bp)上游引物序列:5'-TGGCACCCAG CACAATGAA-3',下游引物序列:5'-CTAAG TCATAGTCCGCCTAGAAGCA-3'。结果以2-ΔΔCt值表示目的mRNA 的相对表达水平。实验重复3 次。
1.3.3蛋白[质]印迹法(Western blot)检测NCX1蛋白表达水平
取对数生长期的正常肝细胞株LO2及肝癌细胞株HepG2细胞,以及人正常肝组织及肝癌组织,用RIPA裂解液取总蛋白,并定量为100 μg,Western blot测量肝癌组织与正常肝细胞中NCX1蛋白的含量,并同步检测内参β-actin的蛋白量。Western blot操作步骤:将上述提取的蛋白加入等量的2×上样缓冲液,100 ℃煮沸5 min后上样,上样体积为20 μL,然后进行电泳、转膜,用含5%脱脂奶粉的TBST室温封闭1 h,然后在一抗稀释液(1%的BSA)按照1∶500的比例加入NCX1抗体,4 ℃过夜,次日用TBST洗膜3次,每次10 min,加入用TBST稀释的二抗,在室温下作用1 h,洗膜3次,每次10 min,加入ECL发光剂作用1 min后曝光。用软件IPWin 60测量目的蛋白条带积分光密度值(IOD),其结果用目的条带IOD除以相应组的内参条带IOD表示。实验重复3次。
1.3.4共聚焦显微镜技术检测细胞内Ca2+变化
细胞爬片用0.25%的胰酶消化后,用10% RPMI-1640培养基制成密度2×104个的细胞悬液,滴入24孔板中,预先在特殊的glass coverslip载玻片上爬片,常规培养过夜。实验时用PSS(含140 mmol/L Na+、5 mmol/L K+、2 mmol/L Ca2+、147 mmol/L Cl+、10 mmol/L HEPES和10 mmol/L葡萄糖,pH为7.4)液漂洗3次后,加入终浓度为10 μmol/L Frua2/AM,室温避光温育60 min,温育结束再用 PSS溶液漂洗3次(10 min/次),在激光共聚焦显微镜下观察,激发波长340 nm,发射波长510 nm处探测荧光发射,数据采集间隔时间为10 s,扫描时间为16 min,动态观察Frua2/AM所标Ca2+的荧光强度的变化来表示细胞质内游离Ca2+水平的变化。
具体实验分组(注:每次上机每个实验至少重复3次):
① 通过无钠PSS溶液激活细胞NCX1,观察细胞内钙离子浓度的变化,记录比较正常肝细胞及肝癌细胞NCX1活化后细胞内Ca2+荧光强度的改变。
② 抑制剂验证NCX1具有调控正常肝细胞及肝癌细胞内钙升高的作用:先用无钠PSS溶液刺激出第一次上升峰,然后用含NCX1阻断剂KB-R7943(10 μm/L)的有钠PSS溶液将升高的荧光洗回基线,待基线稳定后再用含阻断剂KBR7943(10 μm/L)的无钠刺激,观察加入阻断剂前后细胞内Ca2+的荧光强度的变化并采集数据。
1.3.5MTT法检测肝癌细胞HepG2的增殖能力
处于对数生长期的细胞,0.25%胰蛋白酶消化吹打成单细胞悬液,用含10%胎牛血清的培养液调整细胞密度为2×104个/mL,接种于96孔板中,200 μL/孔。细胞贴壁后去掉培养液,配置终浓度为10、20和40 μmol/L的KB-R7943培养基加入96孔板中,对照组用PBS替代,每个浓度做6个复孔。连续温育48 h后每孔加MTT 20 μL(5 mg/mL),继续培养4 h,小心去除上清液,每孔再加入DMSO 150 mL,终止反应,为使MTT还原产物完全溶解,将96孔板放入恒温振荡器,水平振荡10 min。用酶标仪于490 nm波长处测定每孔D值,并用空白对照组的D值调零。 细胞生长抑制率(IR) = (1-D实验组/D对照组) ×100%。若IR为+,说明药物对细胞增殖具有抑制作用;IR为0,说明对细胞增殖无影响;IR为-,说明对细胞增殖具有促进作用。实验重复3次。
1.3.6细胞划痕法检测细胞迁移能力
将细胞密度为(5×104~10×104)个/mL的HepG2细胞铺于48孔板内,每孔500 μL,加入含10%胎牛血清的DMEM-改良型RPMI-1640培养基,培养16~24 h后使细胞爬满孔板底部,形成单层细胞。将这些细胞分为对照组和KBR7943组。用10 μL灭菌枪头在单层细胞上呈“一”字划痕,用无菌PBS清洗3次,分别给予终浓度为10、20和40 μmol/L的KB-R7943无血清培养基温育细胞,对照组加入等量的PBS代替,平行重复2个副孔,在倒置显微镜下拍照,每个孔取3~5个视野。用图像分析仪测量24 h后划痕两侧细胞间距离的变化,测量划痕宽度,比较各组细胞间划痕的愈合情况。实验重复3 次。
1.4统计学处理
采用SPSS 16.0和GraphPad Prism 5.0软件对各实验结果进行统计学分析,各实验均独立重复3次。结果数据以x±s 表示,多组间均数比较采用单因素方差分析,组内两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1NCX1 mRNA在不同细胞及组织中的表达
NCX1扩增产物凝胶电泳检查特异的目的条带,长度为230 bp,β-actin长度为186 bp,两目的条带与理论值相符。肝癌细胞HepG2中NCX1 mRNA表达显著高于正常肝细胞LO2(P=0.023 1),肝癌组织中NCX1 mRNA表达显著高于正常肝组织(P=0.038 3,图1)。

图 1 采用RTFQ-PCR检测正常肝细胞、肝癌细胞、正常肝组织及肝癌组织中的NCX1mRNA的表达水平Fig. 1 The expression levels of NCX1 mRNA in diferent cells and tissues detected by RTFQ-PCRA: Detection in cell lines; B: Detection in tissues; 1: NCX1 mRNA in LO2 cell lines; 2: NCX1 mRNA in HepG2 cell lines; 3: β-actin in LO2 cell lines; 4: β-actin in HepG2 cell lines; 5: NCX1 mRNA in human normal hepatic tissues; 6: β-actin in human normal hepatic tissues; 7: NCX1 mRNA in HCC tissues; 8: β-actin in HCC tissues;*: P<0.05, as compared with LO2 (n=3),#: P<0.05, as compared with HCC (n=20). M: Marker
2.2正常肝细胞株LO2、肝癌细胞株HepG2及正常肝组织、肝癌组织中NCX1蛋白的表达比较
与正常肝组织相比,肝癌组织中NCX1蛋白表达明显增高(P=0.031 7);同样,肝癌细胞HepG2中NCX1的蛋白表达同样也高于正常肝细胞LO2,提示病理情况下NCX1表达上调(图2,P=0.039 0)。
2.3共聚焦显微镜检测NCX1对正常肝细胞株LO2和肝癌细胞株HepG2细胞内Ca2+的调控作用
通过无钠环境激活NCX1后正常肝细胞LO2和肝癌细胞HepG2细胞内的Ca2+荧光值均瞬时升高,并且HepG2细胞升高幅度较LO2细胞更为明显,差异有统计学意义(P=0.015 8)。这提示NCX1在癌症中对细胞内钙的调控能力增强。进一步为了反向验证NCX1对细胞内钙的调控能力,我们用含有NCX1阻断剂KB-R7943的PSS溶液将细胞内Ca2+洗脱回基线,并再次给予的含有NCX1阻断剂的无钠PSS溶液刺激,发现KBR7943抑制了NCX1的功能后,LO2及HepG2细胞内Ca2+荧光值升高幅度较前均明显下降,其上升幅度仅为无阻断剂组的1/3左右,差异有统计学意义(P均<0.05)。由此证明NCX1的确参与正常肝细胞及肝癌细胞的内钙调控(图3)。
2.4Western blot检测用PSS和KB-R7943处理后,正常肝细胞株LO2和肝癌细胞株HepG2细胞NCX1的表达变化
与PSS溶液处理组相比,KB-R7943处理10 min后LO2细胞NCX1的蛋白表达无明显变化(P=0.637 0);同样,在肝癌细胞HepG2中NCX1的蛋白表达相对于PSS处理组差异亦无统计学意义(图4,P=0.787 1),这一结果提示至少在此作用时间点,NCX1抑制剂KB-R7943对细胞内钙信号的抑制可能并不是因为影响了NCX1的蛋白表达,而是通过阻断NCX1的功能来实现的。
2.5NCX1特异性抑制剂KB-R7943对HepG2细胞增殖的影响
MTT结果显示,加入不同浓度NCX1阻断剂KB-R7943处理48 h后,均能不同程度地抑制HepG2细胞生长,48 h后发现10 μmol/L处理组细胞增殖能力低于对照组,差异有统计学意义(P=0.028 4),20 μmol/L处理组细胞增殖能力明显低于对照组(P=0.011 8),40 μmol/L处理组细胞增殖能力被进一步抑制(P=0.002 6,图5)。
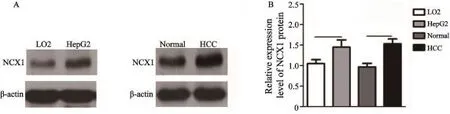
图 2 Western blot检测正常肝细胞株LO2、肝癌细胞株HepG2、正常肝组织、肝癌组织中NCX1蛋白的表达Fig. 2 The expression levels of NCX1 protein in normal hepatic cells (LO2), HCC cell lines (HepG2), human normal hepatic tissues and hepatocellular carcinoma tissues were detected by Western blot, respectivelyA: Western blot analysis; B: Data analysis by bar graph;*: P<0.05, as compared with LO2 (n=3),*: P<0.05, as compared with HCC (n=20)

图 3 共聚焦检测正常肝细胞LO2和肝癌细胞HepG2细胞内Ca2+浓度变化Fig. 3 Removal of external Na+(0Na+)-induce Ca2+entry via the Ca2+model of plasma membrane NCX1 in LO2 (A) and HepG2 (B) cells and can be attenuated by treated with KB-R7943Cells were superfused with normal physiological salt solution (140 mmol/L Na+) caused a rapid increase [Ca2+]cytconcentration of fuorescence ratio. Treated with KB-R7943 (10 μm) signifcantly inhibited the 0Na+-induced increase in [Ca2+]cytconcentration. A: LO2 cells; B: HepG2 cells; C: Summarized data showed the efect of KB-R7943 on 0Na+- induced rise in [Ca2+]cytin LO2 and HepG2 cells, 30-40 cells for each group.*: P<0.05, LO2 vs HepG2 (n=3),#: P<0.05; LO2 vs LO2+KB (n=3);&: P<0.05, HepG2 vs HepG2+KB (n=3)
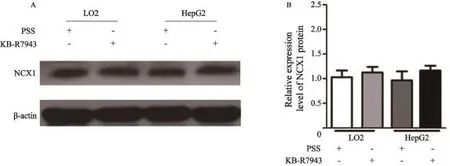
图 4 Western blot检测阻断剂KB-R7943对HepG2肝癌细胞NCX1蛋白表达的影响Fig. 4 Protein expression of NCX1 in LO2 and HepG2 cells after treament of KB-R7943 by Western blot A: LO2 and HepG2 Cells were lysed and then Western blot analysis was performed to detect NCX1 protein expression after treatment of KBR7943 (10 μm) for 10 minutes, PSS solution was control; B: Summary data showed the efect of KB-R7943 on NCX1 expression in HepG2 cells. P>0.05, as compared with PSS (n=3).

图 5 浓度梯度的KB-R7943对人肝癌细胞株HepG2细胞增殖的抑制作用Fig. 5 The efects of KB-R7943 on cell proliferative capability The proliferation of HepG2 cells were detected by MTT in 48 h, high dose of KB-R7943 (10, 20 and 30 μm) signifcantly inhibited HepG2 cells proliferation.*: P<0.05,**: P<0.01, as compared with the control(n=3).
2.6NCX1特异性抑制剂KB-R7943对HepG2细胞迁移的影响
细胞划痕实验结果显示,24 h后空白对照组HepG2细胞的迁移距离为(40.1± 13.5)μm;10 μmol/L KB-R7943组HepG2细胞的迁移距离为(22.3±11.2)μm,小于空白对照组,差异有统计学意义(P=0.036 1);20 μmol/L KB-R7943组HepG2细胞的迁移距离为(14.5±13.1) μm,明显小于空白对照组(P=0.0371,P<0.05);40 μmol/L KB-R7943处理后的HepG2细胞的迁移距离为(7.7± 13.1) μm,细胞迁移能力显著降低(P=0.002 0),提示NCX1阻断剂KB-R7943能明显抑制HepG2细胞的迁移能力。这一结果表明,抑制NCX1的活性可以抑制胃癌细胞HepG2的迁移(图6)。
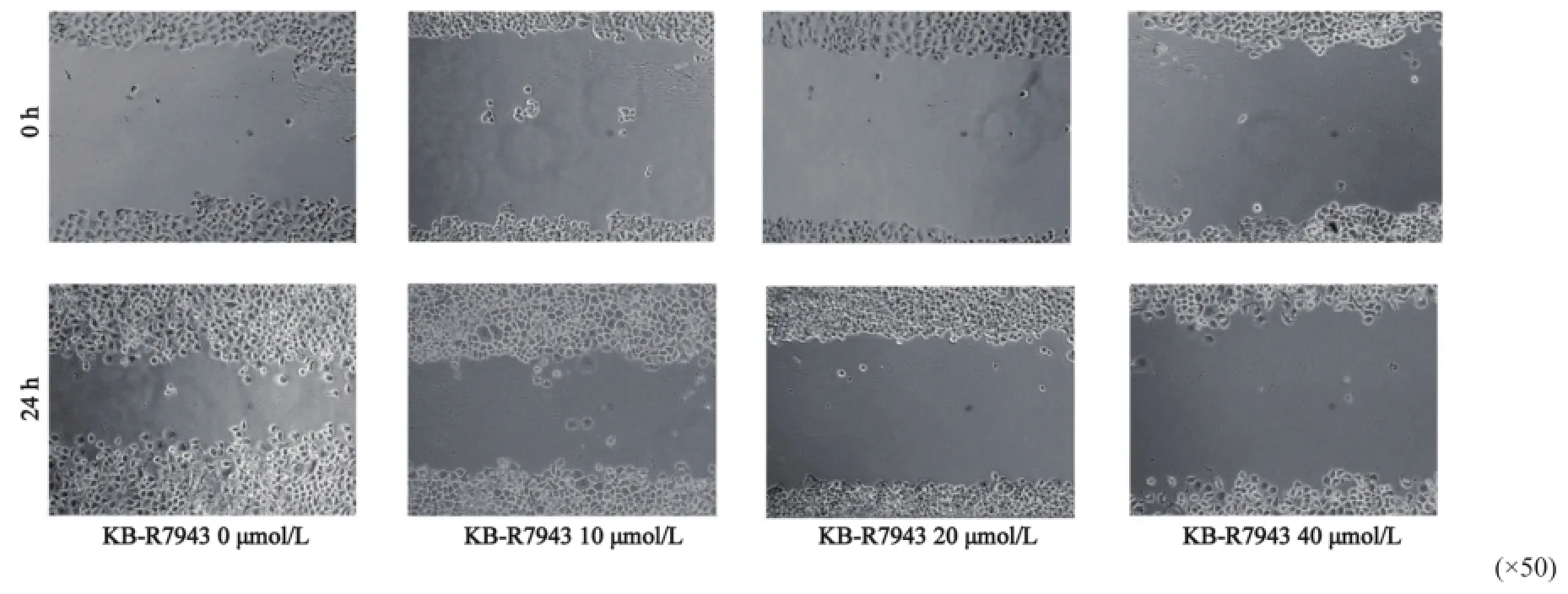
图 6 NCX1阻断剂KB-R7943对人肝癌细胞株HepG2细胞迁移的抑制作用Fig. 6 Efect of KB-R7943 inhibition on migration of HepG2 cells by scratch wound assay Cells were treated with diferent concentrations of KB-R7943 (10, 20 and 40 μmol/L) for 48 h.*: P<0.05,**: P<0.01, as compared with the control(n=3)
3 讨 论
本研究显示,在肝癌细胞株和肝癌组织中,NCX1的mRNA和蛋白表达水平均明显高于正常肝细胞株和正常肝组织。通过对NCX1调控细胞内Ca2+的功能研究发现,在无钠PSS溶液刺激后,正常肝细胞和肝癌细胞内Ca2+浓度均大幅度升高,但是肝癌细胞Ca2+浓度升高幅度明显高于正常肝细胞,进一步用NCX1蛋白特异性抑制剂KB-R7943作用后,细胞内Ca2+升高则被明显抑制。同时,MTT和细胞划痕实验显示,10、20和40 μmol/L剂量的KB-R7943处理对肝癌细胞的增殖和迁移均具有显著的抑制作用,且都存在剂量依赖性。上述结果提示,在原发性肝癌中NCX1的表达量增加、Ca2+浓度升高,这可能在原发性肝癌的发展中起了重要的作用。此外,抑制NCX1的活性可以抑制HepG2肝癌细胞的增殖和迁移,其机制可能与NCX1参与调控肝癌细胞内Ca2+浓度的平衡有关。
NCX1为NCX的3个亚型之一,是一种主要存在于细胞膜上的双向转运蛋白,首见报道于枪乌贼巨大神经轴突及豚鼠心脏上,后续发现哺乳动物细胞中NCX1亦广泛表达,尤其在可兴奋性细胞如心肌、脑组织的细胞中,其主要功能是将细胞内多余的Ca2+转移到细胞外,因此,是Ca2+排出细胞外的重要途径[5],但在某些病理条件下,也可反向转运Ca2+入细胞(即反向模式)[6],导致细胞内Ca2+超载。而Ca2+则是一种普遍存在的细胞信号分子,参与调节了各种各样的细胞生理生化过程。既往研究发现,NCX1参与了多种疾病中Ca2+平衡的调控,尤其是在中枢神经系统、心血管系统、内分泌系统等多种疾病的病理生理过程中发挥关键作用[7-11]。在肿瘤领域,近年有文献报道,TGF-B诱导胰腺癌细胞内Ca2+浓度的增加很可能就是通过NCX1,进而激活了PKCa信号通路导致肿瘤侵袭的发生[4]。本实验发现,在静息状态下,LO2和HepG2细胞内Ca2+维持在恒定水平,但在给予细胞外无钠溶液刺激后,两种细胞内Ca2+水平均迅速增高,出现明显的钙峰,这主要由于胞外的无钠状态形成了Ca2+浓度梯度,激活了NCX1的钙流入模式(即反向模式),大量Ca2+迅速流入细胞内,从而引起细胞内Ca2+浓度的增加。但经NCX1蛋白特异性抑制剂KB-R7943(其主要作用是抑制NCXl的钙流入模式即反向模式)作用后,细胞内Ca2+浓度升高被明显抑制,表明NCX1参与了肝癌细胞内Ca2+浓度变化的调节,且根据实验所检测KB-R7943处理后对正常肝细胞株LO2和肝癌细胞株HepG2细胞NCX1的表达结果,初步提示,在NCX1抑制剂KB-R7943处理10 min这一时间点,对细胞内钙信号的抑制可能不是依赖于对NCX1蛋白表达的影响,而是通过抑制NCX1的活性来实现的,并由此推断NCX1可能还是调控肝癌细胞内Ca2+平衡的一种主要蛋白。而实验结果中得到的肝癌细胞HepG2在无钠环境中细胞内Ca2+高于正常肝细胞LO2,分析其主要原因可能是肝癌细胞NCX1表达高于正常肝细胞LO2。而且,有较多的研究表明,细胞内Ca2+浓度的变化是触发细胞增殖、迁移相关信号转导的始动因素,Ca2+在哺乳类动物的细胞周期中发挥着重要作用,特别是在G1早期、G1/S转折和G2/M转折中[12-14]。例如TRPV6在高度分化的前列腺癌中高表达,其在癌症中表达的增强可使大量Ca2+内流导致细胞核因子的激活,进而影响细胞周期的进程[15]。此外,在癌细胞迁移过程中,Ca2+首先会在癌细胞内部形成一个稳定而瞬时的浓度梯度变化—从细胞迁移头端至尾部促使细胞迁移、侵袭。结合本实验NCX1特异性抑制剂KB-R7943既能抑制细胞内Ca2+浓度升高,又能抑制肝癌细胞HepG2的过度增殖与迁移,且存在剂量依赖性,表明由NCX1介导的钙信号异常可能是肝癌细胞异常增殖、迁移的一个重要促进因素。
综上,本研究首次发现了NCX1在肝癌组织及肝癌细胞中表达。功能实验结果进一步证实NCXl在肝癌细胞中可能通过对细胞内Ca2+的调节参与了肝癌的发生及发展,提示NCX1可能作为原发性肝癌的潜在治疗靶点。但其肝癌细胞内Ca2+浓度增高后具体是怎样影响肝癌细胞生物学特性的机制尚不清楚,还有待于进一步的研究。
[1] MEGIVEM J G. Targeting N-type and T-type calcium channels for the treatment of pain[J]. Drug Discov Today, 2006, 11(5-6): 245-253.
[2] JIANG J L,ZHOU Q,YU M K, et al.The involvement of HAlbl8G/CD1 47 in regulation of store-operated calcium entry and metastasis of human hepatoma cels[J]. Bid Chem, 2001, 276(50): 46870-46877.
[3] SCHULZE D H, MUQHAI M, LEDERER W J, et al. Sodium/ calcium exchanger (NCX1) macromolecular complex[J]. J Biol Chem, 2003, 278(31): 28849-28855.
[4] DONG H, SHIM K N, LI J M, et al. Molecular mechanisms underlying Ca2+mediated motility of human pancreatic duct cells[J]. Am J Physiol Cell Physiol, 2010, 299(6): 1493-1503.
[5] LINCK B, QIU Z, He Z, et al. Functional comparison of the three isoforms of the Na+/Ca2+exchanger (NCX1, NCX2, N CX3)[J]. Am J Physiol, 1998, 274(2): 415-423.
[6] KITAO T, TAKUMA K, KAWASAKIi T, et al. The Na+/Ca2+exchanger mediated Ca2+influx triggers nitric oxide-induced cytotoxicity in cultured astrocytes[J]. Neurochem Int, 2010, 57(1): 58-66.
[7] ROOME C J, POWER E M, EMPSON R M. Transient reversal of the sodium/calcium exchanger boosts presynaptic calcium and synaptic transmission at a cerebellar synapse[J]. J Neurophysiol, 2013, 109(6): 1669-1680.
[8] ARONSEN J M, SWIFT F, SEJERSTED O M. Cardiac sodium transport and excitation-contraction coupling[J]. J Mol Cell Cardiol, 2013, 61: 11-19.
[9] TONG X P, LI X Y, ZHOU B, et al. Ca2+signaling evoked by activation of Na+channels and Na+/Ca2+exchangers is required for GABA-induced NG2 cell migration[J]. J Cell Biol, 2009, 186(1): 113-128.
[10] THOMAS M J, SJASSTAD I, ANDERSEN K, et al. Localization and function of the Na+/Ca2+-exchanger in normal and detubulated rat cardiomyocytes[J]. J Mol Cell Cardiol, 2003, 35(11): 1325-1337.
[11] TU J, LU L, CAI W, et al. cAMP/protein kinase A activates cystic fibrosis transmembrane conductance regulator for ATP release from rat skeletal muscle during low pH or contractions[J]. PLoS One 2012, 7(11):e50157.
[12] WHITAKER M, PATEL R. Calcium and cell cycle control[J]. Development, 1990, 108(4): 525-542.
[13] KAHI C R, MEANS A R. Regulation of cell cycle progression by calcium/calmodulin-dependent pathways[J]. Endocr Rev, 2003, 24(6): 719-736.
[14] AFROZE T, HUSAIN M. Cell cycle dependent regulation of intracellular calcium concentration in vascular smooth muscle cells: a potential target for drug therapy[J]. Curr Drug Targets Cardiovasc Haematol Disord, 2001, 1(1): 23-40.
[15] LEHEN'KYI V, FLOURAKIS M, SKRYMA R, et al. TRPV6 channel controls prostate cancer cell proliferation via Ca(2+)/ NFAT-dependent pathways[J]. Oncogene, 2007, 26(52):7380-7385.
The expression of NCX1 and its effect on proliferation and migration of hepatocellular carcinoma cells through regulation of intracellular Ca2+
XU Jingyu1,2, JIANG Yixia1, XIE Rui1, JIN Hai1, WEN
Guorong1, TUO Biguang1(1.Dpeartment of Gastroenterology, Afliated Hospital, Zunyi Medcial College,Zunyi 563000, Guizhou Province, China; 2.Department of Physiology, Zunyi Medical College, Zunyi 563000, Guizhou Province, China)
Correspondence to: TUO Biguang E-mail: tuobiguang@aliyun.com
Background and purpose: Previous studies have suggested Na+-Ca2+exchanger isoform 1 (NCX1)as a key component of calcium homeostasis was involved in the tumorigenesis. However, the role of NCX1 and calcium signal in tumorigenesis of hepatocellular carcinoma (HCC) has not been explored. This study aimed to investigate the effect of NCX1 on cell proliferation and migration of HCC HepG2 cells in vitro and the possible mechanism. Methods: Both the real-time fluorescent quantitative polymerase chain reaction (RTFQ-PCR) and Western blot were applied to assess the expression of NCX1 mRNA and protein in normal hepatic cells (LO2), HCC cell line (HepG2), human normal hepatic tissues and hepatocellular carcinoma tissues. The change of intracellular calcium signal in LO2 and HepG2 cells via activated NCX1 channel in the presence or absence of Na+was examined by a confocal laser scanning microscope. The effects of NCX1 special inhibitor KB-R7943 on cell proliferation and migration of HepG2 cells were measured by MTT and cellscratch test. Results: Both mRNA and protein expression of NCX1 were higher in HCC tissues and cell line HepG2 than in the normal tissues and cell line LO2 (P<0.05). The activation of NCX1 channel induced a slight rise in cytoplasmic Ca2+concentration ([Ca2+]cyt) in normal cells, but caused a marked increase in cancer cells. And the NCX1 activation induced intracellular calcium increase was significantly reversed by NCX1 inhibitor KB-R7943 (P<0.05). Both NCX1-mediated proliferation and migration of HepG2 were also significantly attenuated by the KB-R7943 (P<0.05). Conclusion: NCX1 is up-regulated in HCC cells and tissues. The activation of NCX1 mediates intracellular calcium homeostasis. The inhibition of NCX1 activity can suppress the proliferation and migration of HepG2 cells. It is suggested that NCX1 may be involved in the development and progression of HCC.
Na+-Ca2+exchanger isoform 1; Calcium; Hepatocellular carcinoma; Proliferation; Migration; KBR7943
10.19401/j.cnki.1007-3639.2016.09.003
R735.7
A
1007-3639(2016)09-0735-08
2015-05-19
2015-08-19)
国家自然科学基金资助项目(81160265);
贵州省科技厅、遵义医学院、遵义市科技局科学技术联合基金(黔科合JLKZI2011J46号)。
庹必光 E-mail: tuobiguang@aliyun.com

