FoxO1转录因子在巨噬细胞中的表达与炎症的关系
张娜,张紫燕,赵凌霞,姚怡,杨莹,张建林,郑国平
山西医科大学基础医学院,山西太原 030000
FoxO1转录因子在巨噬细胞中的表达与炎症的关系
张娜,张紫燕,赵凌霞,姚怡,杨莹,张建林,郑国平
山西医科大学基础医学院,山西太原030000
目的通过研究叉头框蛋白1(forkhead transcription factors of O class 1,FoxO1)转录因子mRNA水平和蛋白水平在巨噬细胞的表达以及检测Foxo1干扰和过表达后巨噬细胞分泌的炎症因子含量,从炎症进展的角度探讨FoxO1转录因子与炎症之间的关系。方法①利用脂多糖(lipopolysaccharide,LPS)刺激巨噬细胞Ana-1制作炎症模型,ELISA测炎症因子IL-6、TNF-α的浓度;②采用Real-Time PCR,Western Blot测FoxO1转录因子在mRNA水平以及蛋白水平的含量;③利用脂质体2 000将FoxO1 siRNA转染Ana-1细胞,采用ELISA检测对照组和干扰组分泌的炎症因子IL-6、TNF-α的含量;④利用脂质体2 000将FoxO1过表达质粒转染Ana-1细胞,采用ELISA检测LPS组和过表达组炎症因子IL-6、TNF-α的含量。结果①ELISA实验显示,在LPS的浓度为50 ng/mL时巨噬细胞分泌的炎症因子IL-6、TNF-α含量分别为2190、1124ng/mL,干预时间为36h时分别为2190、1995 ng/mL。此条件下炎症因子含量最高;②Real-Time PCR实验和Western blot实验结果显示,在LPS组FoxO1转录因子mRNA水平是对照组的0.36倍,蛋白水平的表达量是对照组的0.58倍;③Foxo1 siRNA干扰实验结果显示,与对照组相比,干扰组巨噬细胞分泌炎症因子TNF-α含量从782 ng/mL上升到1 290 ng/mL,IL-6的含量从161 ng/mL上升到251 ng/mL;4.脂质体转染过表达FoxO1质粒实验显示,与LPS组相比,过表达组巨噬细胞分泌炎症因子TNF-α的含量从1 785 ng/mL下降到1 329 ng/mL,IL-6含量从486 ng/mL下降到317 ng/mL。结论LPS刺激巨噬细胞Ana-1产生炎症反应,导致炎症因子的释放,同时下调Foxo1转录因子在mRNA水平和蛋白水平的含量,特异性FoxO1基因沉默可上调炎症因子的释放。过表达FoxO1可以使炎症反应减轻,证明Foxo1转录因子参与巨噬细胞引起的炎症反应。
FoxO1转录因子;巨噬细胞;炎症反应
炎症是临床上常见的病理生理反应过程,任何能够引起组织损伤的因素都可能诱发炎症反应,而且持续的炎症会导致器官和组织的功能障碍,因此如何控制炎症是目前医学界的一个难题。在炎症过程中巨噬细胞扮演着比较重要角色。虽然巨噬细胞在损伤和组织修复中起着重要的保护作用,但是它的持续激活会促进机体的病理状态。研究表明巨噬细胞可根据接收的不同微环境信号被诱导成为不同极化状态的巨噬细胞,从而执行多种多样的功能比如炎症、细菌吞噬、免疫调节等[1]。FoxO1是Fox转录家族的重要成员,广泛分布于机体的各类组织和细胞中,其在胞浆内的存在形式为磷酸化的FoxO1,上游主要受到PI3K/Akt信号传导通路调控,活化后的Akt可使FoxO1转录因子发生磷酸化由核内转移至细胞胞浆而失去转录活性[2]。罗丹等[3]的研究显示FoxO1转录因子在mRNA水平的表达在胆汁淤积性肝纤维化的肝性炎症中有低表达现象,因此该研究想探讨在巨噬细胞引起的炎症反应中Foxo1的变化情况以及Foxo1的变化对炎症的影响情况。
1 资料与方法
1.1一般资料
1.1.1试剂改良型RPMI-1640培养基,胎牛血清,ELISA试剂盒,Trizol Reagent、反转录试剂盒、Lipo2 000,SYBR GREEN实时PCR预混液,凝胶制备试剂盒、ECL化学发光液,Phospho-FoxO1 Rabbit mAb、FoxO1 Rabbit mAb、siRNA FoxO1,羊抗兔IgG。
1.1.2细胞巨噬细胞Ana-1(中国科学院细胞库)。
1.2实验方法
1.2.1实验分组共分为4组。对照组为正常Ana-1细胞;LPS组为Ana-1细胞中加入LPS;干扰组为用FoxO1 siRNA转染Ana-1细胞;过表达组为用过表达质粒pcDNA-FoxO1转染Ana-1细胞。
1.2.2利用LPS刺激Ana-1细胞制作炎症模型ELISA法检测炎症因子IL-6、TNF-α的浓度:将细胞铺六孔板,按LPS浓度0、10、50、100、500、1 000 ng/mL加入培养基,刺激时间按16、24、36、48 h处理,收上清。相同标本3个复孔,重复3次,在酶标仪450 nm测定吸光度值,根据ELISA软件绘制标准曲线,计算各样本浓度。
1.2.3Real-Time PCR检测FoxO1基因的变化:收集对照组和LPS组Ana-1细胞,加1 mL Trizol RNA提取试剂,提取Ana-1细胞总RNA,根据反转录试剂盒将提取的总RNA反转录成cDNA,最后使用大连Takara公司SYBR GREEN试剂盒说明书进行下一步操作。
1.2.4Western杂交分析收集对照组和LPS组Ana-1细胞,加入细胞裂解液,在冰上放置2 h裂解细胞,离心机4℃12 000×g离心5 min,提取上清液用BCA法测蛋白含量。按30 ug蛋白经煮沸10 min后,开始10%SDS-PAGE凝胶电泳,随后湿转将蛋白质转到PVDF膜上。膜在5%脱脂奶粉中封闭,室温1h。而后分别与不同一抗(1:1 000)孵育(anti-phospho-FoxO1、anti-FoxO1和GAPDH抗体),4℃摇床过夜,第二日PBST洗膜,15 min,洗3次,然后使用对应的二抗杂交,室温1 h,PBST洗膜3次后在,将PVDF膜放入凝胶成像仪内,膜上滴ECL发光液,A液:B液= 1:1,30 s曝光。
1.2.5siRNA FoxO1转染转染的前24 h在培养皿中培养Ana-1细胞,细胞数量适中,用MEM稀释好Lipo2 000和siRNA,将两者轻轻摇晃至均匀,然后在室温条件下孵育20 min使之形成siRNA-Lipo2 000混合液,添加到24 h前已经在培养皿中培养的Ana-1细胞中。36 h后收集细胞以及上清液,利用细胞做普通PCR检测FoxO1转录因子mRNA水平的表达量,上清液做ELISA测炎症因子的含量[4]。
1.2.6过表达质粒转染将过表达质粒pcDNA-Fox-O1转染入巨噬细胞Ana-1细胞中。转染步骤同上[5-6]。
1.3统计方法
使用SPSS 16.0统计软件包对数据进行分析,实验数据以(±s)表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1ELISA检测炎症因子IL-6、TNF-α的浓度
LPS浓度从0 ng/mL增加到50 ng/mL的时候,Ana-1细胞分泌的炎症因子IL-6和TNF-α的含量逐渐升高。当浓度为50 ng/mL时,此时炎症因子的含量是最高的,炎症因子IL-6、TNF-α的含量分别为1 124、2 241 ng/mL。从LPS加到100 ng/mL开始,Ana-1细胞分泌的炎症因子IL-6、TNF-α的含量开始缓慢降低趋于平稳。当LPS浓度固定在50 ng/mL,随着时间的变化,炎症因子的含量也在变化,从16 h炎症因子的含量逐渐上升,到36 h达到高峰,然后缓慢下降。因此,LPS刺激巨噬细胞Ana-1的浓度为50 ng/mL,时间为36 h。见图1。

图1 不同浓度LPS以及时间下炎症因子的浓度
2.2Real-Time PCR测得FoxO1 mRNA水平的含量变化
用Real-Time PCR方法检测对照组Ana-1细胞以及LPS组Ana-1细胞中FoxO1转录因子mRNA水平的含量表达。结果显示,与对照组Ana-1细胞相比,在LPS组中FoxO1转录因子在mRNA水平的表达量下降,是对照组的0.36倍,因此差异有统计学意义(P<0.05)。说明在LPS刺激会引起炎症因子的含量的升高,同时引起FoxO1 mRNA水平的下降,可以推断出炎症反应确实和FoxO1转录因子有关。见图2。

图2 FoxO1的实时荧光定量PCR扩增结果
2.3Western Blotting测得FoxO1蛋白水平含量变化
Western Blotting结果表明,巨噬细胞Ana-1磷酸化FoxO1蛋白在对照组细胞的表达量和LPS组细胞差异无统计学意义(P>0.05),但是FoxO1蛋白在LPS组的表达量是对照组的0.58倍,差异有统计学意义(P<0.05)。反映了FoxO1转录因子在基因水平和蛋白水平的同步。见图3。
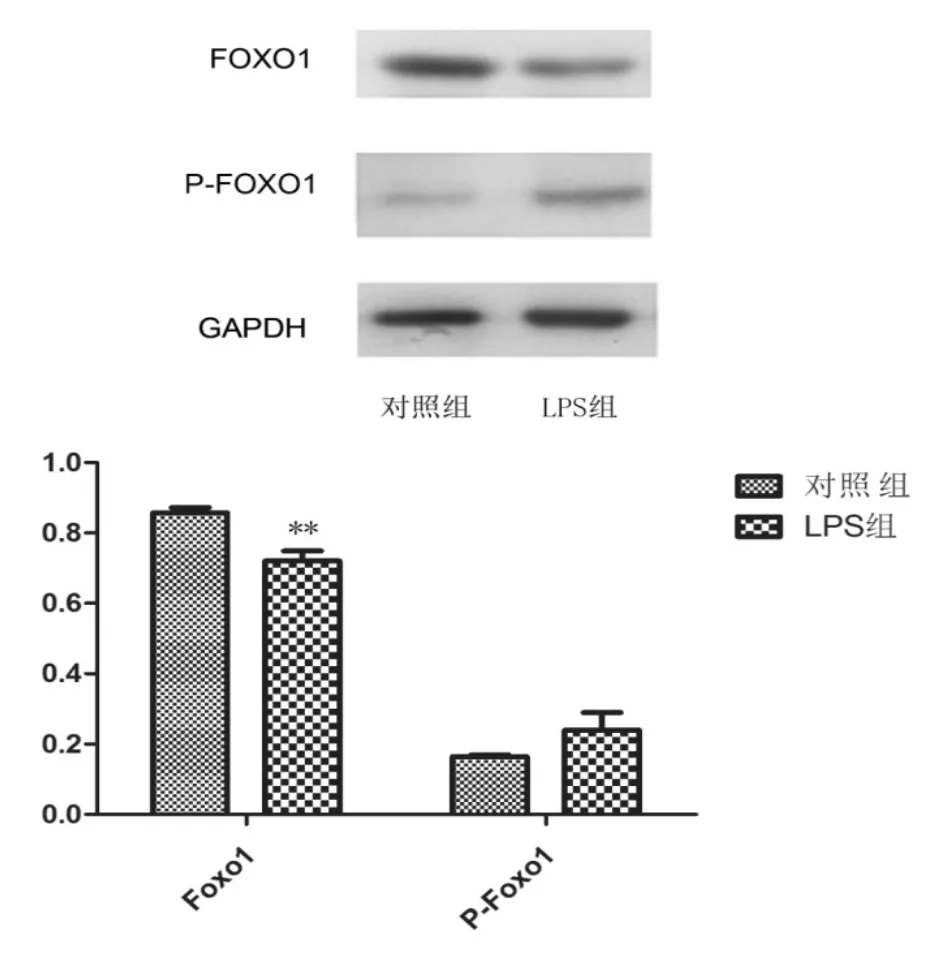
图3 western blot检测FoxO1蛋白水平的表达
2.4Foxo1 siRNA转染后测炎症因子含量变化
Ana-1细胞进行Foxo1 siRNA转染后,用普通PCR检测转染成功。ELISA实验检测出炎症因子的含量,转染组相比于对照组,细胞炎症因子TNF-α含量从782 ng/mL上升到1 290 ng/mL,IL-6的含量从161 ng/mL上升到251 ng/mL,炎症因子含量显著上升,此结果提示Foxo1转录因子mRNA水平在正常巨噬细胞中表达下降会诱导细胞分泌炎症因子,因此可以推测FoxO1转录因子在炎症反应过程中确实发挥很重要的作用。见图4。

图4 Foxo1 siRNA转染后炎症因子的含量
2.5脂质体2 000转染过表达质粒检测炎症因子含量
利用脂质体2 000将过表达质粒pcDNA-FoxO1转染进入LPS组细胞中,普通PCR检测转染成功。ELISA检测炎症因子含量,过表达组Ana-1细胞相比于LPS组细胞,细胞炎症因子TNF-α的含量从1 785 ng/mL下降到1 329 ng/mL,IL-6含量从486 ng/mL下降到317 ng/mL,炎症因子含量显著下降。此结果可以推测,过表达FoxO1可以抑制炎症因子的释放,对炎症反应起到抑制作用。见图5。

图5 过表达质粒转染后炎症因子的含量
3 讨论
炎症是免疫反应中的一个重要概念,指的是病原微生物或组织损伤引起的机体的局部和全身发生的一系列复杂的免疫应答过程。急性炎症反应是机体自身防御感染以及修复损伤的保护性反应,当炎症持续进展变成慢性时,就会造成组织细胞的损伤,引发多种疾病[7]。在炎症反应过程中巨噬细胞扮演着重要角色,它通过吞噬以及分泌多种炎症因子对炎症反应发挥重要的调节作用[8]。巨噬细胞分泌的炎症因子中TNF-α、IL-6是比较经典的炎性因子,它们的分泌进一步导致血管内皮损伤、炎症细胞的募集和粘附等,加重炎症。如果能控制炎性因子的分泌,就能够极大减轻炎症反应。
Fox(forkhead/winged helix transcription factor)基因家族具有高度保守的Forkhead结构域,同时还有DNA结合、转录活化和转录抑制等功能。转录因子FoxO家族成员包括FoxO1、FoxO4、FoxO3a、FoxO6等。FoxO1在胞浆内的存在形式为磷酸化的FoxO1,活化的Akt能够使FoxO1发生磷酸化从核内转移至细胞胞浆,失去转录活性[9]。杨双双等[10]研究发现在小鼠肝脏结扎至肝胆管致纤维化的模型中,有关炎症和增殖的Fox转录因子明显下降,提示Fox转录因子有可能参与了肝脏炎症以及肝脏纤维化的发生。罗丹[3]研究在胆汁淤积性肝纤维化的肝性炎症中,应用realtime PCR测出模型组小鼠肝组织FoxO1在4个时间点(1、3、7、14 d)mRNA水平的表达全部低于阴性对照组。这些实验结果暗示也许FoxO1是炎症过程中一个重要转录因子。因此该研究在细胞水平观察FoxO1转录因子的变化探讨其与炎症的关系。
本研究首先是制作炎症模型,利用LPS刺激巨噬细胞Ana-1分泌促炎性细胞因子建立体外炎症模型,虽然是体外模型,但是可以模拟体内的炎症反应过程[11]。采用ELISA技术测出炎症模型分泌的炎症因子TNF-α和IL-6的浓度,结果显示:在LPS的浓度为50 ng/mL时巨噬细胞分泌的炎症因子IL-6、TNF-α含量分别为2 190、1 124 ng/mL,干预时间为36 h时炎症因子IL-6、TNF-α含量分别为2 190 ng/mL、1 995 ng/mL。此条件下炎症因子含量最高,提示我们此时炎症模型的效果最佳。其次应用Real-Time PCR以及Western blotting检测对照组Ana-1细胞和LPS组Ana-1细胞FoxO1转录因子在mRNA以及蛋白的表达水平。结果显示:与对照组Ana-1细胞比较,FoxO1转录因子在mRNA水平是对照组的0.36倍,蛋白水平是对照度的0.58倍,表达含量均下降(P<0.05),提示FoxO1转录因子在巨噬细胞引起的炎症反应中有含量变化,可能参与炎症反应。最后观察FoxO1 siRNA以及过表达质粒pcDNA-FoxO1转染Ana-1细胞后炎症因子的分泌量,结果显示:siRNA下调Fox O1转录因子mRNA水平的含量后,与对照组Ana-1细胞相比,干扰组Ana-1细胞分泌的炎症因子TNF-α含量从782 ng/mL上升到1 290 ng/mL,IL-6的含量从161 ng/mL上升到251 ng/mL;过表达质粒pcDNA-FoxO1转染Ana-1细胞上调FoxO1转录因子mRNA水平的表达后,与LPS组细胞相比,过表达组细胞分泌炎症因子TNF-α的含量从1 785 ng/mL下降到1 329 ng/mL,IL-6含量从486 ng/mL下降到317 ng/mL。结果提示:FoxO1转录因子参与由巨噬细胞引起的炎症反应。
这个实验初步探讨了在单一环境中巨噬细胞引起的炎症改变FoxO1转录因子在mRNA水平和蛋白水平的表达以及两者之间的关系,下一步我们将在动物体内观察FoxO1转录因子是否具有同样的功效,为临床控制炎症反应提供初步的理论基础。
[1]Biswas SK,Mantovani A.Macrophage plasticity and interaction with Lymphocy-te subsets:Cancer as a paradigm[J]. Nat Immunol,2010,11:889-896.
[2]黄宁,李佳文,安利国,等.FoxO1的功能及其与人类疾病的关系[J].生命科学.2012,4(21):35-37.
[3]罗丹.胆汁淤积性肝纤维化时的肝性炎症及Foxo基因表达的意义初探[D].重庆:重庆医科大学,2009:39-44.
[4]孟祥斌.NF-kB p65 siRNA转染体外抑制VSMC增殖和放置抑制静脉内膜增生的实验研究[D].济南:山东大学,2015:16-17.
[5]杨硕,金玉怀.PcDNA3/PD-L1及pcDNA3/B7.1真核表达质粒构建以及免疫作用的初步研究[D].石家庄:河北医科大学,2013:34-42.
[6]Karlowicz A,Wegrzyn K.Proteolysis in plasmid DNA stable maintenance in bacterial cell[J].Plasmid,2016(5):1-7.[7]Kitamura T,Kitamura Y.The roles of FOXO1 in various metabolic organs[J].Seikagaku,2015,87(2):176-182.
[8]杨琴,张志仁,姜曼,等.小鼠巨噬细胞功能极化可塑性的初步探讨[J].免疫学杂志,2013(2):24-27.
[9]Lars-Oliver Klotz,et al.Redox regulation of FoxO transcription fators[J].Redox Biology.2015,6:51-72.
[10]杨双双,黄世峰,张莉萍,等.Fox转录因子家族在正常和胆道结扎小鼠肝脏中的动态表达[J].国际检验医学杂志,2010,6(31):533-535.
[11]余功旺,黄文浩,刘爱梅,等.小鼠腹腔巨噬细胞炎症模型的建立[J].广东药学院学报,2014,30(6):766-770.
The Content Change Of FoxO1 Transcription Factor in Macrophages and the Relationship with Inflammation
ZHANG Na,ZHANG Zi-yan,ZHAO Ling-xia,YAO Yi,YANG Ying,ZHANG Jian-lin,ZHENG Guo-ping Basic medical,Shanxi Medical University,Taiyuan,Shanxi Province,030000 China
Objective Through study the content changes of FoxO1 transcription factor in the level of mRNA and protein in Macrophage as well as after the interference of the Foxo1 siRNA detective the content of inflammatory factors.From the perspective of inflammation progress to discuss the relationship between Foxo1 transcription factor and inflammation.Methods①Used LPS stimulate the Macrophage(Ana-1 cell)to product model of inflammation,then detected the inflammatory factor with ELISA.②Used Real-Time PCR、Western blotting to detect the content of FoxO1 transcription factor in level of mRNA and protein.③Used Lipo2 000 put FoxO1 siRNA in Ana-1 cell Media,We utilized ELISA to detect the concentration of the inflammation factor IL-6,TNF-α in control group and interference group.4. Used Lipo2 000 put FoxO1 over-expression plasmid in Ana-1 cell,We utilized ELISA to detect the concentration of the inflammation factor IL-6,TNF-α in LPS group and over-expression group.Results①Elisa test showed:when the concentration of LPS was 50 ng/mL,the content of inflammatory factor TNF-α、IL-6 is factor IL-6、TNF-α is 2 190、1 995 ng/mL.In this condition,the content of inflammatory factor was the maximum;②Real-Time PCR and Western blot test showed:The content of FoxO1 transcription factor in level of mRNA in the interference group was 0.36 times as much as the control group,the content of FoxO1 transcription factor in level of protein was 0.58 times as much as the control group;③Foxo1 siRNA interference test showed:compared with the control group,the interference group Ana-1cell secreted the content of inflammatory factors TNF-α was increased from 782 ng/mL to 1 290 ng/mL、IL-6 was increased from 161 ng/mL to 251 ng/mL;④Using Lipo 2 000 transfect the over-expreesion plasmid test showed:Compared with LPS group,the over-expression group Ana-1 cell secreted the content of inflammatory factors TNF-αwas dropped from 1 785 ng/mL to 1 329 ng/mL,IL-6 was dropped from 486 ng/mL to 317 ng/mL.Conclusion LPS stimulate the Ana-1 cell,then cause the inflammatory reaction,inducing the release of inflammation factor,meanwhile down-regulate the Foxo1 transcription factor in level of mRNA.Specific gene sliencing can up-regulate the release of inflammatory factors.Foxo1 transcription factor indeed participate in the progress of inflammatory reaction.
FoxO1 transcription factor;Macrophage;Inflammatory reaction
R36
A
2096-1782(2016)09-0001-06
10.19368/j.cnki.2096-1782.2016.09.001
2016-06-15)
张娜(1989.11-),女,陕西西安人,硕士研究生,研究方向:生物化学与分子生物学。
郑国平(1962.6-),男,澳大利亚人,博士,教授,研究方向:肾脏纤维化,E-mail:guoping.zheng@sydney.edu. au。

