飞龙掌血醇提物对佐剂性关节炎模型大鼠炎症相关因子的影响
王先坤,李 溥,任 一,梁子聪,杨再波(.贵州省黔南布依族苗族自治州中医医院,贵州都匀 558000;.黔南民族师范学院/贵州省高校民族药用植物资源开发工程研究中心,贵州都匀 558000)
飞龙掌血醇提物对佐剂性关节炎模型大鼠炎症相关因子的影响
王先坤1*,李 溥1,任 一1,梁子聪1,杨再波2(1.贵州省黔南布依族苗族自治州中医医院,贵州都匀 558000;2.黔南民族师范学院/贵州省高校民族药用植物资源开发工程研究中心,贵州都匀 558000)
目的:研究飞龙掌血醇提物对佐剂性关节炎(AA)模型大鼠炎症相关因子的影响。方法:将70只SD大鼠随机分为正常对照组、模型对照组、阳性对照化学药组(来氟米特片,0.012 g/kg)、阳性对照中药组(雷公藤多苷片,0.012 g/kg)和飞龙掌血醇提物低、中、高剂量组[1、4、6 g(生药)/kg],每组10只。除正常对照组外,其余各组大鼠均id弗氏完全佐剂复制AA模型,造模同时各给药组大鼠ig相应药物,正常对照组和模型对照组大鼠ig等容生理盐水,每天2次,连续28 d。检测各组大鼠足趾肿胀度,关节炎指数,血清及关节滑膜组织中白细胞介素(IL)-1β、IL-6、IL-10、肿瘤坏死因子α(TNF-α)、前列腺素E2(PGE2)含量。结果:与正常对照组比较,模型对照组大鼠原发性、继发性足趾肿胀度和关节炎指数升高;血清及关节滑膜组织中IL-1 β、IL-6、TNF-α、PGE2含量增加,IL-10含量减少(P<0.01)。与模型对照组比较,各给药组大鼠上述指标均明显改善(P<0.05或P<0.01)。结论:飞龙掌血醇提物通过调节血清及滑膜组织中抗炎、促炎因子的表达,从而发挥对AA模型大鼠的防治作用。
飞龙掌血;醇提物;佐剂性关节炎;大鼠;白细胞介素;肿瘤坏死因子α;前列腺素E2
类风湿性关节炎(Rheumatoid arthritis,RA)是一种以关节滑膜慢性炎症增生病变为特征的自身免疫性疾病[1],主要临床表现为关节肿胀、晨僵、疼痛、畸形和功能障碍等。RA患者的关节破坏与白细胞介素(IL)-1β、IL-6、IL-10、肿瘤坏死因子α (TNF-α)的表达失衡有关[2-3]。飞龙掌血[Toddalia asiatica (L.)Lam.]是贵州苗族民间常用药物,为芸香科飞龙掌血属植物的根或根皮[4],具有祛风止痛、解毒消肿之功,主要用于治疗风湿痹痛[5]。本实验拟建立大鼠佐剂性关节炎(AA)模型(该模型的发病机制与RA相似,多用于RA的研究),观察飞龙掌血醇提物对AA大鼠血清及滑膜组织中IL-1β、IL-6、IL-10、TNF-α和前列腺素E2(PGE2)含量的影响,以探讨其治疗RA的可能机制。
1 材料
1.1 仪器
PV-200型足趾容积测定仪(成都泰盟科技有限公司);EB-340HW型电子天平(日本岛津公司);ELx808型酶标仪(美国BioTec公司)。
1.2 药材、药品与试剂
飞龙掌血[Toddalia asiatica(L.)Lam.]药材采自贵州省都匀市摆忙乡,经贵阳中医学院生药学教研室李江教授鉴定为真品;雷公藤多苷片(浙江得恩德制药有限公司,批号:1500903,规格:10 mg/片);来氟米特片(福建汇天生物药业有限公司,批号:1501208,规格:10 mg/片);弗氏完全佐剂(美国Sigma公司,批号:SLBB1397,纯度:>98%);IL-1β、IL-6、IL-10、TNF-α酶联免疫吸附(ELISA)试剂盒(美国RD公司,批号:20151113、20151102、20151217、20151021);PGE2ELISA试剂盒(南京建成科技有限公司,批号:20151224);其余试剂均为分析纯。
1.3 动物
SPF级SD大鼠,70只,♂,体质量(200±20)g,购自第三军医大学实验动物中心[生产许可证号:SCXK(渝)2012-008]。所购大鼠普通饮食喂养7 d后开始实验,期间控制饲养温度为(20±2)℃、湿度为(50±15)%、12 h明暗循环。
2 方法
2.1 飞龙掌血醇提物的制备
称取飞龙掌血根皮100 g,用8倍量75%乙醇溶液(800 ml)超声提取(功率为150 W,频率为40 kHz)3次,每次30 min,合并3次提取液,滤过,滤液减压浓缩得总浸膏。将浸膏用5%羧甲基纤维素钠(CMC-Na)溶液制备成质量浓度为1 g/ml的浓缩液,即得。
2.2 分组、造模与给药
2.2.1 分组 将大鼠随机分为7组,即正常对照组、模型对照组、阳性对照化学药组(来氟米特片,0.012 g/kg,人临床用量的12倍剂量)、阳性对照中药组(雷公藤多苷片,0.012 g/kg,人临床用量的8倍剂量)[6]和飞龙掌血醇提物低、中、高剂量组[1、4、6 g(生药)/kg][7],每组10只。采用足趾容积测定仪测量每组大鼠右后足跖容积(ml)作为基础值,采用SPSS 16.0软件分析差异有无统计学意义、检验分组均衡性。
2.2.2 造模 确认分组均衡后,除正常对照组外,其余各组大鼠均于右后足跖部id弗氏完全佐剂(0.1 ml)致炎,复制AA大鼠模型[7-8],每天1次,连续14 d。
2.2.3 给药 于造模当天,各给药组大鼠分别按“2.2.1”项下剂量ig相应药物(以5%羧甲基纤维素钠溶液为溶剂),正常对照组和模型对照组大鼠ig等容生理盐水,每天2次,连续28 d。
2.3 足趾肿胀度测定
采用足趾容积测定仪分别于致炎前和致炎后12、24 h测定大鼠右后足跖容积,并测定致炎前和致炎后7、14、21、28 d大鼠右前足跖容积。右后足跖肿胀为原发性病变,右前足跖肿胀为继发性病变,以足趾肿胀度[足跖肿胀度(ml)=致炎后足跖容积-致炎前足跖容积]结果为指标,进行统计分析。
2.4 关节炎指数评价
分别于致炎前和致炎后观察并记录各组大鼠关节病变程度,按5级评分法进行评价[9],计算关节炎指数:0级,无红肿,记0分;1级,跖关稍肿,记1分;2级,小趾关节及足跖关节肿胀,记2分;3级,踝关节以下足爪肿胀,记3分;4级,包括踝关节在内的全部关节肿胀,记4分。将大鼠各肢体的评分累计起来,即为每只大鼠的关节炎指数。
2.5 血清和关节滑膜组织中IL-1β、IL-6、IL-10、TNF-α、PGE2含量测定
末次给药后24 h,各组大鼠均ip 3%戊巴比妥进行麻醉,腹主动脉取血,每只大鼠取血4~5 ml,置于一次性试管中,分离血清,备用。同时,分离各组大鼠后肢膝关节,取出滑膜组织,称质量,制备滑膜匀浆,离心,取上清液,备用。采用ELISA法,按照相应试剂盒说明操作,分别测定大鼠血清和关节滑膜组织中IL-1β、IL-6、IL-10、TNF-α、PGE2含量。
2.6 统计学方法
3 结果
3.1 足趾肿胀度测定结果
3.1.1 原发性足趾肿胀度测定结果 致炎前,各组大鼠足跖肿胀度差异均无统计学意义(P>0.05)。与致炎前比较,致炎后12、24 h模型对照组和各给药组大鼠足跖肿胀度明显升高(P<0.01)。致炎后12、24 h,与正常对照组比较,模型对照组和各给药组大鼠足跖肿胀度明显升高(P<0.01)。致炎后24 h,与模型对照组比较,各给药组大鼠足跖肿胀度明显降低(P<0.05或P<0.01)。各组大鼠原发性足趾肿胀度测定结果见表1。
表1 各组大鼠原发性足趾肿胀度测定结果(±s,n=10,ml)Tab 1 The degrees of primary toe swelling of rats in all groups(±s,n=10,ml)

表1 各组大鼠原发性足趾肿胀度测定结果(±s,n=10,ml)Tab 1 The degrees of primary toe swelling of rats in all groups(±s,n=10,ml)
注:与致炎前比较,ΔP<0.01;与正常对照组比较,*P<0.01;与模型对照组比较,#P<0.05,##P<0.01Note:vs.pro-inflammation,ΔP<0.01;vs.normal control group,*P<0.01;vs.model control group,#P<0.05,##P<0.01
致炎后24 h 0.01±0.10 1.96±0.24Δ*1.71±0.26Δ*#1.75±0.22Δ*#1.74±0.22Δ*#1.68±0.16Δ*#1.62±0.23Δ*##组别正常对照组模型对照组阳性对照化学药组阳性对照中药组飞龙掌血醇提物低剂量组飞龙掌血醇提物中剂量组飞龙掌血醇提物高剂量组致炎前0.03±0.10 0.01±0.12 0.02±0.13 0.01±0.14 0.03±0.12 0.02±0.10 0.03±0.11致炎后12 h 0.08±0.11 1.99±0.14Δ*1.89±0.22Δ*1.87±0.24Δ*1.87±0.28Δ*1.82±0.25Δ*1.78±0.23Δ*
3.1.2 继发性足趾肿胀度测定结果 致炎前,各组大鼠右前足跖肿胀度差异均无统计学意义(P>0.05)。与致炎前比较,致炎后7、14、21、28 d模型对照组和各给药组大鼠足趾肿胀度明显升高(P<0.01)。致炎后7、14、21、28 d,与正常对照组比较,模型对照组和各给药组大鼠足趾肿胀度升高(P<0.01);与模型对照组比较,各给药组大鼠足趾肿胀度明显降低(P<0.01)。各组大鼠继发性足趾肿胀度测定结果见表2。
表2 各组大鼠继发性足趾肿胀度测定结果(±s,n=10,ml)Tab 2 The degrees of secondary toe swelling of rats in all groups(±s,n=10,ml)
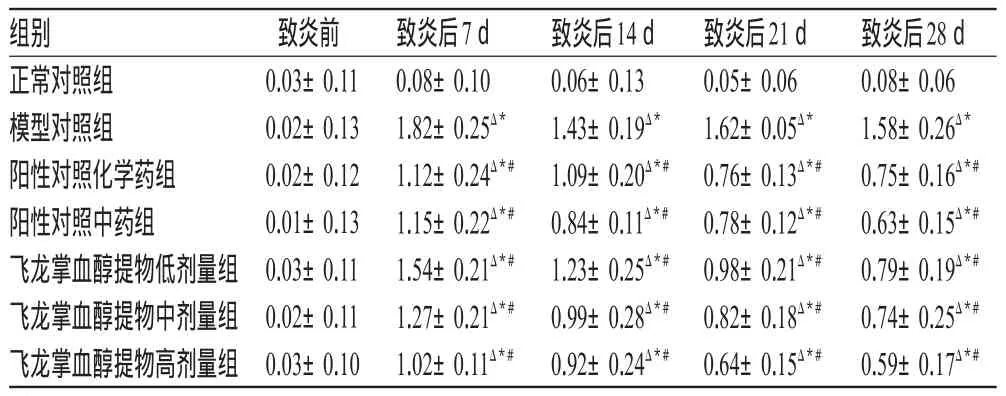
表2 各组大鼠继发性足趾肿胀度测定结果(±s,n=10,ml)Tab 2 The degrees of secondary toe swelling of rats in all groups(±s,n=10,ml)
注:与致炎前比较,ΔP<0.01;与正常对照组比较,*P<0.01;与模型对照组比较,#P<0.01Note:vs.pro-inflammation,ΔP<0.01;vs.normal control group,*P<0.01;vs.model control group,#P<0.01
致炎后28 d 0.08±0.06 1.58±0.26Δ*0.75±0.16Δ*#0.63±0.15Δ*#0.79±0.19Δ*#0.74±0.25Δ*#0.59±0.17Δ*#组别正常对照组模型对照组阳性对照化学药组阳性对照中药组飞龙掌血醇提物低剂量组飞龙掌血醇提物中剂量组飞龙掌血醇提物高剂量组致炎前0.03±0.11 0.02±0.13 0.02±0.12 0.01±0.13 0.03±0.11 0.02±0.11 0.03±0.10致炎后7 d 0.08±0.10 1.82±0.25Δ*1.12±0.24Δ*#1.15±0.22Δ*#1.54±0.21Δ*#1.27±0.21Δ*#1.02±0.11Δ*#致炎后14 d 0.06±0.13 1.43±0.19Δ*1.09±0.20Δ*#0.84±0.11Δ*#1.23±0.25Δ*#0.99±0.28Δ*#0.92±0.24Δ*#致炎后21 d 0.05±0.06 1.62±0.05Δ*0.76±0.13Δ*#0.78±0.12Δ*#0.98±0.21Δ*#0.82±0.18Δ*#0.64±0.15Δ*#
3.2 关节炎指数测定结果
致炎后14 d,与正常对照组比较,模型对照组和各给药组大鼠关节炎指数均明显升高(P<0.01);与模型对照组比较,各给药组大鼠关节炎指数有继续升高的趋势,但差异无统计学意义(P>0.05)。致炎后28 d,与正常对照组比较,模型对照组和各给药组大鼠关节炎指数均明显升高(P<0.01);与模型对照组比较,各给药组大鼠关节炎指数均明显降低(P<0.01)。各组大鼠关节炎指数测定结果见表3。
表3 各组大鼠关节炎指数测定结果(±s,n=10,分)Tab 3 The arthritis indexes of rats in all groups(±s,n= 10,score)

表3 各组大鼠关节炎指数测定结果(±s,n=10,分)Tab 3 The arthritis indexes of rats in all groups(±s,n= 10,score)
注:与正常对照组比较,*P<0.01;与模型对照组比较,#P<0.01Note:vs.normal control group,*P<0.01;vs.model control group,#P<0.01
致炎后28 d 0.27±0.06 8.36±1.17*4.72±1.07*#4.83±0.98*#5.42±1.24*#4.62±1.17*#4.18±1.16*#组别正常对照组模型对照组阳性对照化学药组阳性对照中药组飞龙掌血醇提物低剂量组飞龙掌血醇提物中剂量组飞龙掌血醇提物高剂量组致炎后14 d 0.23±0.04 7.89±0.56*8.42±1.05*8.35±1.06*8.29±1.17*8.33±0.97*8.24±0.95*
3.3 血清和关节滑膜组织中IL-1β、IL-6、IL-10、TNF-α、PGE2含量测定结果
与正常对照组比较,模型对照组和各给药组大鼠血清和关节滑膜组织中IL-1 β、IL-6、TNF-α、PGE2含量增加,IL-10含量减少(P<0.05或P<0.01)。与模型对照组比较,各给药组大鼠血清和关节滑膜组织中IL-1 β、IL-6、TNF-α、PGE2含量减少,IL-10含量增加(P<0.01)。各组大鼠血清和关节滑膜组织中IL-1β、IL-6、IL-10、TNF-α、PGE2含量测定结果见表4、表5。
4 讨论
陆怡等[7]的研究结果显示,飞龙掌血乙醇提取物具有较好的抗炎作用,但没有考察相关炎症因子的变化情况。在本实验中,笔者选用常用的炎症实验进一步考察了飞龙掌血乙醇提物的抗炎作用,考察了炎症相关因子在大鼠血清和滑膜组织中含量的变化,同时还观察了飞龙掌血乙醇提物对AA大鼠踝关节病理变化的影响并进行关节炎指数考察,进一步证实飞龙掌血乙醇提物的抗炎作用。为了能较为客观地评价飞龙掌血醇提物的作用效果,笔者选择临床上治疗RA的经典化学药来氟米特片为阳性对照化学药,经典中药雷公藤多苷片为阳性对照中药进行研究。研究结果显示,飞龙掌血醇提物低、中、高剂量组大鼠在致炎后24 h右后足跖肿胀度明显降低;致炎后7、14、21、28 d,飞龙掌血醇提物低、中、高剂量组大鼠右前足跖肿胀度均有不同程度降低,病理损伤得到明显改善,且与阳性对照化学药组和阳性对照中药组治疗效果相当,这提示飞龙掌血醇提物有明显的抗炎作用。
表4 各组大鼠血清中IL-1β、IL-6、IL-10、TNF-α、PGE2含量测定结果(±s,n=10,ng/L)Tab 4 The contents of IL-1β,IL-6,IL-10,TNF-α and PGE2in serum of rats in all groups(±s,n=10,ng/ L)

表4 各组大鼠血清中IL-1β、IL-6、IL-10、TNF-α、PGE2含量测定结果(±s,n=10,ng/L)Tab 4 The contents of IL-1β,IL-6,IL-10,TNF-α and PGE2in serum of rats in all groups(±s,n=10,ng/ L)
注:与正常对照组比较,*P<0.05,**P<0.01;与模型对照组比较,#P<0.01Note:vs.normal control group,*P<0.05,**P<0.01;vs.model control group,#P<0.01
PGE21 145.28±95.42 1 995.32±92.69**742.68±88.42**#785.21±94.25**#866.23±84.57**#843.97±79.24**#658.75±68.36**#组别正常对照组模型对照组阳性对照化学药组阳性对照中药组飞龙掌血醇提物低剂量组飞龙掌血醇提物中剂量组飞龙掌血醇提物高剂量组IL-1β 7.22±2.09 19.65±3.57**10.23±2.87**#10.34±2.21**#12.07±2.22**#11.57±2.52**#9.75±2.82*#IL-6 56.97±18.31 189.72±26.31**118.64±24.02**#113.45±32.48**#132.46±29.31**#124.66±33.24**#109.87±65.43**#IL-10 46.29±9.17 20.69±7.22**32.48±9.24**#33.46±7.33**#29.42±6.57**#32.54±6.71**#40.23±5.22#TNF-α 81.27±24.59 135.44±33.21**94.51±32.72**#96.33±31.46**#117.56±33.25**#95.67±22.48**#84.56±23.45#
表5 各组大鼠关节滑膜组织中IL-1β、IL-6、IL-10、TNF-α、PGE2含量测定结果(±s,n=10,ng/g)Tab 5 The contents of IL-1β,IL-6,IL-10,TNF-α and PGE2in joint synovial membranes of rats in all groups(±s,n=10,ng/g)

表5 各组大鼠关节滑膜组织中IL-1β、IL-6、IL-10、TNF-α、PGE2含量测定结果(±s,n=10,ng/g)Tab 5 The contents of IL-1β,IL-6,IL-10,TNF-α and PGE2in joint synovial membranes of rats in all groups(±s,n=10,ng/g)
注:与正常对照组比较,*P<0.05,**P<0.01;与模型对照组比较,#P<0.01Note:vs.normal control group,*P<0.05,**P<0.01;vs.model control group,#P<0.01
组别正常对照组模型对照组阳性对照化学药组阳性对照中药组飞龙掌血醇提物低剂量组飞龙掌血醇提物中剂量组飞龙掌血醇提物高剂量组PGE2523.45±24.35 1 148.26±33.17**334.29±24.11**#322.64±21.35**#355.88±20.46**#348.57±19.73**#244.26±19.32**#IL-1β 3.24±1.03 9.67±1.57**4.22±1.16**#4.25±1.21**#5.11±1.28**#4.96±1.36**#4.38±1.04*#IL-6 35.88±3.54 95.31±11.27**51.24±2.78**#50.39±2.42**#54.63±2.96**#52.25±2.64**#49.21±2.91**#IL-10 27.86±5.24 9.54±1.34**21.67±2.53**#20.64±2.87**#18.46±2.02**#19.65±1.77**#23.33±2.24**#TNF-α 20.75±3.24 59.67±4.65**34.28±2.98**#32.11±4.12**#41.25±3.22**#34.86±2.41**#25.46±2.02**#
关于RA的研究虽然较多,但其病因和发病机制至今尚不完全清楚。近年来大量的研究表明,炎性细胞因子在RA的发生发展中起重要作用[9-10]。IL-1β含量增加可激活单核巨噬细胞诱发局部炎症,促进骨和软骨破坏,加重骨损伤[10];IL-6可增加组织血管通透性,导致组织水肿[10];TNF-α是一种促炎细胞因子,能分泌IL-6等因子刺激滑膜成纤维细胞的增生,诱导炎性反应的发生[11];IL-10是内源性抗炎细胞因子,可抑制TNF-α、IL-1β、IL-2、IL-6的产生,减轻RA炎性反应,促进组织修复作用[10];PGE2是一种极其重要的脂质代谢产物,在炎症的发展过程中,其4个受体与其他前列腺素类物质共同以条件依赖的方式参与了炎症不同阶段的调节,并且在致炎和抗炎两个方向上参与整个调节过程[12]。本研究结果显示,飞龙掌血醇提物提物低、中、高剂量组大鼠血清和关节滑膜组织中IL-1β、IL-6、TNF-α、PGE2含量均明显减少,IL-10含量均明显增加,这提示飞龙掌血醇提物可重建促炎和抗炎细胞因子的平衡,可能是其治疗RA的机制之一。
综上所述,飞龙掌血醇提物能有效缓解AA大鼠原发性炎症和继发性炎症,显著减轻AA大鼠关节肿胀,其机制可能与降低血清及滑膜组织中IL-1β、IL-6、TNF-α的含量,升高IL-10含量,下调PGE2表达,调节促炎和抗炎细胞因子的平衡有关。
[1]Lin B,Zhao Y,Han P,et al.Anti-arthritic activity of Xanthium strumarium L.extract on complete Freund’s adjuvant induced arthritis in rats[J].J Ethnopharmacol,2014,155(1):248.
[2]Lu KH,Yang SF,Chu SC,et al.The significance of altered gelatinase expression in the synovium of patient with arthritic effusions[J].Clin Rheumatol,2004,23(1):21.
[3]韩望,李运曼.肿瘤坏死因子抑制剂治疗类风湿性关节炎的研究进展[J].药学与临床研究,2012,20(3):218.
[4]邱德文,杜江.中华本草:苗药卷[M].上海:上海科学技术出版社,2005:211.
[5]黄璐琦.中草药与民族药药材图谱[M].北京:北京大学医学出版社,2005:16.
[6]张秋萍,张晶,宋洪涛.雷公藤多苷片的抗炎作用及其药效动力学研究[C]//2010年中国药学大会暨第十届中国药师周论文汇编.北京:中国药学会,2010.
[7]陆怡,朱元章,郭晨旭,等.飞龙掌血提取物的镇痛作用及相关机制研究[J].上海中医药杂志,2015,49(7):82.
[8]张晓军,刘健,万磊,等.新风胶囊对佐剂性关节炎大鼠关节滑膜组织中VEGF-A mRNA表达的影响[J].世界中西医结合杂志,2013,8(12):1 204.
[9]张静,孟楣,王晓玉,等.新风胶囊对佐剂性关节炎模型大鼠的抗炎作用[J].中国药房,2015,26(22):3 083.
[10]刘德芳,郭明阳,呼永河,等.类风湿关节炎湿热痹阻型患者血清和关节液IL-1、IL-6、TNF-α的表达研究[J].免疫学杂志,2014,33(5):447.
[11]万磊,刘健,冯云霞,等.新风胶囊改善佐剂关节炎大鼠肺功能及调节T细胞功能的实验研究[J].中华中医药杂志,2013,28(4):905.
[12]薛瑞,苗一非,杨吉春,等.前列腺素E2对免疫细胞及炎症相关疾病的调控作用[J].生理科学进展,2011,42(3):165.
(编辑:林 静)
Effects of Alcohol Extract of Toddalia asiatica on the Inflammation-associated Cytokines of Model Rats with Adjuvant Arthritis
WANG Xiankun1,LI Pu1,REN Yi1,LIANG Zicong1,YANG Zaibo2(1.Guizhou Qiannan Buyi and Miao Autonomous Prefecture Hospital of Traditional Chinese Medicine,Guizhou Duyun 558000,China;2.Qiannan Normal College for Nationalities/Guizhou Province College Research Center of Ethnical Medicinal Plant Resources Exploitation Engineering,Guizhou Duyun 558000,China)
OBJECTIVE:To study the effect of alcohol extract of Toddalia asiatica on the inflammation-associated cytokines of model rats with adjuvant arthritis(AA).METHODS:70 SD rats were randomly divided into a normal control group,a model control group,a positive control chemical medicine group(Leflunomide tablets,0.012 g/kg),a positive control TCM group(Tripterygium glycosides tablets,0.012 g/kg)and the groups of low,medium and high-dose[1,4,6 g(crude drug)/kg]alcohol extract of T.asiatica,with 10 rats in each group.The rats in all groups except for the normal control group were given complete Freund’s complete adjuvant id for the establishment of AA models.At the same time,the rats in the drug administration groups were given corresponding drugs ig,while those in the normal control group and the model control group were given isometric normal saline ig,twice a day,for 28 consecutive days.The degree of toe swelling,arthritis index and the levels of interleukin(IL)-1β,IL-6,IL-10,tumor necrosis factor α(TNF-α)and prostaglandin E2(PGE2)in serum and synovial membranes of all groups of rats were determined.RESULTS:Compared to the normal control group,the model control group demonstrated higher degree of primary and secondary toe swelling,arthritis index and levels of IL-1β,IL-6,TNF-α and PGE2in serum and joint synovial membrane,and lower level of IL-10 therein(P<0.01).Compared to the model control group,all the above-mentioned indexes of the rats in drug administration groups significantly improved(P<0.05 or P<0.01).CONCLUSIONS:The alcohol extract of T.asiatica.has a preventive and therapeutic effect on the model rats with AA by regulating the expression of anti-inflammatory and proinflammatory cytokines in serum and synovial membrane.
Toddalia asiatica;Alcohol extract;Adjuvant arthritis;Rats;Interleukin;Tumor necrosis factor α;Prostaglandin E2
·药房管理·
R285
A
1001-0408(2016)25-3524-04
10.6039/j.issn.1001-0408.2016.25.21
2016-03-01
2016-06-01)
*副主任药师。研究方向:医院药学、药事管理。电话:0854-8253762。E-mail:wxk0508@sina.com

