环境响应性纳米给药系统的研究进展
李剑华(泉州市第一医院药剂科,福建泉州 362000)
环境响应性纳米给药系统的研究进展
李剑华*(泉州市第一医院药剂科,福建泉州 362000)
目的:为环境响应性纳米给药系统的设计提供新思路。方法:以“纳米给药系统”“环境敏感制剂”“药物释放”“Nanometer drug delivery system”“Drug release”“pH-responsive”“Redox-responsive”等为关键词,组合检索2000年1月-2016年2月在Web of Science、PubMed、ScienceDirect、中国知网、万方、维普等数据库中的相关文献,对纳米给药系统环境的敏感条件及其释药机制方面作简要综述。结果:共检索到相关文献237篇,其中有效文献26篇。常见的敏感条件有pH敏感、氧化还原敏感、热敏感、超声波敏感、光敏感等;此类给药系统在稳态中可保持稳定,但经环境刺激后可响应性改善纳米制剂的释药性能与结构、改变药物的释放位点、调控胞内药物代谢途径,发挥靶向治疗、快速释药的效果,提高肿瘤治疗的疗效。结论:本研究为设计性能更佳的纳米给药系统提供了一定的参考。后续研究需深入探索肿瘤微环境,充分了解外加刺激的性质以及环境响应性纳米聚合物的相关特性,以提高给药系统药物释放速率,增强疗效。
抗肿瘤药物;纳米给药系统;环境响应性;释放机制
研究显示,纳米给药系统可改善抗肿瘤药物的分布、提高疗效、降低毒副作用[1]。常见的纳米系统包括脂质体、胶束、分枝状聚合物[2]、微球、微囊与无机纳米粒子(如金纳米粒、碳纳米管、量子点等)。近年来,纳米系统的研究还延伸到了大分子给药系统,如聚乙二醇化的蛋白共聚物(PEG-protein)、聚乙二醇化的小干扰核糖核酸共聚物(PEG-siRNA)[3]。近年研究发现,当纳米给药系统大量进入到高通透性和滞留(EPR)效应部位或靶细胞内时,并没有达到预期的疗效,其原因可能与纳米给药系统的药物释放有关[4]。通过对纳米载体进行筛选和修饰,改善给药系统的生物学特性和释放性能,可提高药物在诊断和治疗过程的抗肿瘤活性和生物利用度[5]。在本研究中,笔者以“纳米给药系统”“环境敏感制剂”“药物释放”“Nanometer drug delivery system”“Drug release”“pH-responsive”“Redox-responsive”等为关键词,组合检索2000年1月-2016年2月在Web of Science、PubMed、ScienceDirect、中国知网、万方、维普等数据库中的相关文献。共检索到相关文献237篇,其中有效文献26篇。对环境响应性纳米给药系统的主要类型及其释药机制等方面作简要综述,现报道如下。
1 环境响应性纳米给药系统的概念
环境响应性纳米给药系统是指在外界刺激下可响应性发生构象变化或桥链断裂的聚合物或脂质体,且这些材料在条件改变中可保持良好性状,确保给药系统在肿瘤细胞或其微环境中暴露功能特性基团,以成功释放药物。各类环境响应性纳米给药系统设计原理见图1。
2 常见环境响应性纳米给药系统的类型
为进一步改善药物的释放性能,提高给药系统疗效,根据肿瘤微环境的特殊性(如酸性pH环境、氧化还原电势特异性等),以及外界环境中的刺激(如热、超声波、光照等),可以设计环境响应性敏感载体。此类载体可改善纳米制剂的药物释放性能、改变药物的释放位点、调控胞内药物代谢途径,从而提高抗肿瘤效果。
2.1 pH-敏感性给药系统
细胞内低pH环境是实体瘤的特征之一[6]。由于实体瘤内部代谢过于旺盛,可产生过量的乳酸和CO2,同时导致空泡型(Vacuolar-type,V-type)H+-质子泵(ATPase)在肿瘤细胞中的表达和活性增强。正常血液和组织的pH为7.4,而肿瘤细胞内pH可能下降到6.5甚至更低,内涵体pH可低至5.5,溶酶体内则低于5.5,这种反常的pH梯度变化从细胞间微环境延伸到细胞内各细胞器中[7]。这种pH梯度与多药耐药机制(Multidrug resistance,MDR)有关[8]。肿瘤细胞外基质到细胞内涵体pH值下降2个单位对制剂来说是强力的刺激。针对肿瘤微环境和核内酸性变化而设计的环境响应性纳米制剂已成为常见的给药系统[9]。

图1 环境响应性纳米给药系统设计原理
Chen F等[7]以聚β-氨基酸酯(PBAE)为骨架,构建了pH敏感性的智能给药系统——维生素E聚乙二醇1000嵌段共聚物(TPSS)。由于PBAE碱的电离平衡常数(pKb)约为6.5,TPSS在正常的生理环境下带负电荷,在体循环中不易被吞噬和聚集。当给药系统富集在肿瘤部位时,肿瘤微环境(肿瘤细胞外)的pH值约为6.5,TPSS上的叔胺与水分子形成氢键,实现了给药系统的电荷翻转,使TPSS带正电荷。由于肿瘤细胞对带正电荷TPSS的摄取能力更强,进而提高了TPPS抗肿瘤的疗效。
Duan X等[10]将多柔比星(DOX)以前药的形式通过pH敏感键(腙键)与大分子聚合物苯乙烯马来酸聚合物(SMA)偶联,构建了SMA-己二酸二酰肼(ADH)-DOX聚合物胶束,包封P糖蛋白(P-gp)抑制剂戒酒硫(Disulfiram,DSF),形成给药系统包封DSF的聚合物胶束(DSM)。DSM可响应肿瘤细胞内低pH环境,先后快速释放DSF和DOX。DSF可阻断P-gp的功能,减少DOX的外排,提高细胞内药物浓度。因此,DSM在乳腺癌耐药细胞(MCF-7/ADR)上的毒性比DOX高89.7倍,比未包封DSF的聚合物胶束高2.41倍。可见,DSM可有效减少耐药细胞对DOX的外排,增加细胞毒性。
因此,通过引入pH敏感键,可以加速给药系统的药物释放,提高胞内药物浓度,达到增强疗效的目的。
2.2 氧化还原敏感性给药系统
雷杨[11]的研究表明,肿瘤细胞的细胞质和内涵体中谷胱甘肽(GSH)的浓度均较高,在0.5~10 mmol/L之间;而在正常细胞和机体体液中浓度较低,约为2~20 μmol/L。因此,二硫键在体液中很稳定,而在胞内高GSH条件下则易断裂成巯基。二硫键的聚合物在还原条件下可迅速降解。
Huang H等[12]利用含二硫键的胱胺,经过反复交联,形成一个具有两亲型结构的给药系统。在体外用二硫苏糖醇(DTT)模拟肿瘤细胞内的还原环境,通过测定胱胺聚合物分子质量的变化、粒径的改变以及体外药物释放情况,证明该类含有二硫键的聚合物确实具有还原敏感性。
Hu YW等[13]以含有二硫键的3,3-二硫代二丙酸作为桥连试剂,构建了二硫键糖脂嫁接物(CSO-ss-SA),并有效包封紫杉醇(PTX)形成CSO-ss-SA/PTX载药纳米粒。该载药纳米粒在含GSH 10 mmol/L的还原条件和肿瘤细胞内,均可快速释放其所包封的PTX,相较于酰胺键糖脂纳米载体(CSO-SA)可大幅提高细胞内药物释放速率,增强细胞内抗肿瘤疗效。其响应过程示意图见图2。
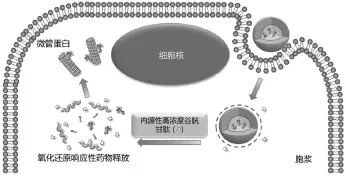
图2 CSO-ss-SA/PTX载药纳米粒在肿瘤细胞内对GSH响应的过程示意图
CSO-ss-SA/PTX载药纳米粒经被动靶向作用大量富集在肿瘤部位,并在肿瘤内快速释放药物,实现了给药系统对肿瘤的高效靶向治疗。
2.3 热敏性给药系统
尽管热敏性给药系统的设计灵感来源于炎症与肿瘤部位的高热现象,但是实际正常组织与病变组织之间的温差不足以使制剂特异性地在病变部位聚集并发挥作用,通常需要如热水浴[14]、电磁体[15]、激光[16]、高强度超声波[17]等外加热源帮助热敏性制剂发挥作用。
在脂质体中加入某种相变温度的热敏性凝胶,可使脂质体纳米制剂具有温度响应性。这种热敏凝胶材料能随环境温度改变而发生一定的相变,由液态转化为非化学交联的半固体凝胶,具有临界溶解温度。目前,研究较为广泛的热敏凝胶材料有丙烯酰胺类[18]。
Li W等[19]基于上临界溶解温度的新型药用材料构建了温度触发型纳米靶向给药系统,并认为温度控制下的药物快速释放是简单、安全的。利用这种热敏性胶束包封DOX,当载药纳米粒通过EPR效应实现其在肿瘤组织中高度聚集时,通过微波治疗仪提高肿瘤部位温度至43 ℃,此时温度达到上临界溶解温度,胶束结构被破坏,药物瞬间完全释放,可高效地杀死肿瘤细胞。
2.4 超声波敏感给药系统
超声波显像技术作为一种体内组织器官可视化、超声治疗、肿瘤消融、结石击碎的技术手段已有多年的临床使用经验。为了获得分辨率更高的图像,临床研究者已经应用了包括脂质纳米粒、微囊在内的对比试剂通过增强声波与稳定气泡之间的回声来增强超声效应[20]。超声波会在物质内部形成“声孔效应”(Sonoporation),即当材料内部包含许多微小气泡时,其即可在超声波作用下产生膨胀、收缩、振荡、崩溃等空化作用,导致物质表面产生孔状结构;停止超声波作用后该载体材料的结构又恢复常态,孔状结构消失。利用“声孔效应”可设法使载体材料产生瞬时的孔隙结构,引起药物的泄漏。因此,超声波可用于触发超声波敏感性纳米制剂的药物靶向释放。
最常见的超声波敏感纳米载体是包载空气或全氟化烷化物的脂质体和脂质微泡。由氢化大豆磷脂酰胆碱(Hydrogenated soybean phosphatidylcholine,HSPC)制备的脂质体对低频超声具有响应性,可在3 min内释放包封药物顺铂的80%。该脂质体的组成为胆固醇-PEG2000-二硬脂酰磷脂酰乙醇胺(DSPE)摩尔比51∶44∶5,低频超声可在该脂质体表面形成瞬时孔样结构[21]。在荷淋巴瘤小鼠模型中,腹腔注射该药物后发现低频超声可使药物在2 min内释放70%,与此同时,在没有低频超声作用下的药物释放则低于3%[22]。可见,超声波敏感纳米载体可对特定频率下的超声波产生特异性响应,实现药物的快速释放。
2.5 光敏感给药系统
光的各项参数,如波长、强度、脉冲持续时间和周期均为可调节的刺激,在生物药学研究领域有相当广阔的应用前景。尽管可见光、紫外光(UV)和近红外光(Near-infrared,NIR)均在临床中应用广泛[23],但只有NIR可以穿透较深层组织,因此在肿瘤靶向治疗领域具有更广阔的应用前景。
使用包括卟啉衍生物(Porphyrin derivatives)、卟吩类(Chlorins)、酞菁类(Phthalocyanines)和卟啉烯(Porphycenes)在内的光敏剂(Photosensitizing agent,PSA)进行光动力学治疗是光敏感肿瘤靶向的策略之一[24]。光照激活的光敏剂可引起细胞内氧自由基(ROS)的产生,进而损伤靶细胞。另外,还可通过应用光敏性聚合物赋予纳米制剂光敏感特性。光敏性脂质在光刺激下易发生结构变化,如光异构化、光碎片化或光聚合等,使纳米载体裂解或崩塌,从而释放药物[25]。
除光敏性脂质体以外,其他纳米载体也可被赋予光敏感特性。目前合成了一种新型的光敏感两亲性树枝状聚合物(Glucose/lactose-D3-PCL-DNQ),其中重氮萘醌(DNQ)是NIR敏感的酚醛树脂类[26]。该聚合物可在水溶液中形成光敏感胶束状纳米载体。疏水的DNQ基团位于胶束的内核,可用来包封与阿霉素类似的水溶性较差的药物,并通过对外部NIR光照响应性破坏胶束、加速药物释放。
3 结语
与传统药物传递系统相比,环境响应性纳米给药系统在控制药物释放部位和时间方面表现出了优越的性能。其利用肿瘤微环境和肿瘤细胞的特殊性,如胞内酸性pH环境、氧化还原电势特异性等,以及外界环境中的刺激如热、超声波、光照等,刺激敏感性给药系统,实现了药物的快速释放,提高了给药系统的疗效。当然,目前设计的环境响应纳米给药系统还不够完美。存在的主要问题是不同肿瘤细胞在pH、氧化还原上存在一定差异,肿瘤微环境存在一定的不确定性,对药物在体内的释放难以达到准确的调控。因此,要设计出性能优良的刺激响应性纳米给药系统,还需进一步深入探索肿瘤微环境,要充分了解外加刺激的性质以及刺激敏感性聚合物或脂质的相关特性,利用一种或多种敏感方式使给药系统对外界环境的响应能力更强,实现更快的药物释放。
[1] Du YZ,Cai LL,Liu P,et al.Tumor cells-specific targeting delivery achieved by A54 peptide functionalized polymeric micelles[J].Biomaterials,2012,33(34):8 858.
[2]李远达,朱亮.聚合物胶束在肿瘤治疗中的研究进展[J].中国医药工业杂志,2010,41(8):615.
[3]Lorusso PM,Weiss D,Guardino E,et al.Trastuzumab emtansine:a unique antibody-drug conjugate in development for human epidermal growth factor receptor 2-positive cancer[J].Clin Cancer Res,2011,17(20):6 437.
[4]Bao Y,Guo Y,Zhuang X,et al.D-α-tocopherol polyethylene glycol succinate-based redox-sensitive paclitaxel prodrug for overcoming multidrug resistance in cancer cells[J].Mol Pharm,2014,11(9):3 196.
[5] Torchilin V.Multifunctional and stimuli-sensitive pharmaceutical nanocarriers[J].Eur J Pharm Biopharm,2009,71 (3):431.
[6]李茹恬,钱晓萍,刘宝瑞.恶性肿瘤pH依赖性生理性耐药及其对策[J].肿瘤,2012,32(5):384.
[7]Chen F,Zhang J,Wang L,et al.Tumor pH(e)-triggered charge-reversal and redox-responsive nanoparticles for docetaxel delivery in hepatocellular carcinoma treatment.[J].Nanoscale,2015,38(7):15 763.
[8]Wojtkowiak JW,Verduzco D,Schramm KJ,et al.Drug resistance and cellular adaptation to tumor acidic pH microenvironment[J].Mol Pharm,2011,8(6):2 032.
[9]刘艳红,周建平,霍美蓉.肿瘤微环境响应型智能纳米药物载体的研究进展[J].中国药科大学学报,2016,47(2):125.
[10] Duan X,Xiao J,Yin Q,et al.Smart pH-sensitive and temporal-controlled polymeric micelles for effective combination therapy of doxorubicin and disulfiram[J].Acs Nano,2013,7(7):5 858.
[11]雷杨.基于氧化还原响应的RGD-PEG-SS-PEI/DNA基因递释系统的构建[D].上海:复旦大学,2012.
[12] Huang H,Zhang X,Yu J,et al.Fabrication and reduction-sensitive behavior of polyion complex nano-micelles based on PEG-conjugated polymer containing disulfide bonds as a potential carrier of anti-tumor paclitaxel[J].Colloids Surf B Biointerfaces,2013,110(10):59.
[13]Hu YW,Du YZ,Liu N,et al.Selective redox-responsive drug release in tumor cells mediated by chitosan based glycolipid-like nanocarrier[J].J Control Release,2015,206(5):91.
[14]Lin Z,Huo Z,Wang L,et al.Targeted delivery of methotrexate to skeletal muscular tissue by thermosensitive magnetoliposomes[J].Int J Pharm,2009,370(1/2):136.
[15] Pradhan P,Giri J,Rieken F,et al.Targeted temperature sensitive magnetic liposomes for thermo-chemotherapy [J].J Control Release,2010,142(1):108.
[16] Sherlock SP,Tabakman SM,Xie L,et al.Photothermally enhanced drug delivery by ultrasmall multifunctional FeCo/graphitic shell nanocrystals.[J].Acs Nano,2011,5 (2):1 505.
[17] Ranjan A,Jacobs GC,Woods DL,et al.Image-guided drug delivery with magnetic resonance guided high intensity focused ultrasound and temperature sensitive liposomes in a rabbit Vx2 tumor model[J].J Control Release,2011,158(3):487.
[18]赵宇,王晓波,张治然,等.热敏凝胶的研究与应用进展[J].中国药房,2015,26(1):132.
[19] Li W,Huang L,Ying X,et al.Antitumor drug delivery modulated by a polymeric micelle with an upper critical solution temperature[J].Angew Chem Int Ed Engl,2015,54(23):6 671.
[20] Schroeder A,Kost J,Barenholz Y.Ultrasound,liposomes,and drug delivery:principles for using ultrasound to control the release of drugs from liposomes[J].Chem Phys Lipids,2009,162(1/2):1.
[21]Schroeder A,Avnir Y,Weisman S,et al.Controlling liposomal drug release with low frequency ultrasound:mechanism and feasibility[J].Langmuir,2007,23(7):4 019.
[22] Schroeder A,Honen R,Turjeman K,et al.Ultrasound triggered release of cisplatin from liposomes in murine tumors[J].J Controlled Release,2009,137(1):63.
[23] Katz JS,Burdick JA.Light-responsive biomaterials:development and applications[J].Macromol Biosci,2010,10 (4):339.
[24]Robertson CA,Evans DH,Abrahamse H.Photodynamic therapy(PDT):a short review on cellular mechanisms and cancer research applications for PDT[J].J Photochem Photobiol B,2009,96(1):1.
[25] Yavlovich A,Smith B,Gupta K,et al.Light-sensitive lipid-based nanoparticles for drug delivery:design principles and future considerations for biological applications.[J].Mol Membr Biol,2010,27(7):364.
[26] Sun L,Yang Y,Dong CM,et al.Two-photon-sensitive and sugar-targeted nanocarriers from degradable and dendritic amphiphiles[J].Small,2011,7(3):401.
(编辑:刘明伟)
·药师之友·
R94
A
1001-0408(2016)25-3589-03
10.6039/j.issn.1001-0408.2016.25.40
2016-04-29
2016-07-15)
*主管药师。研究方向:医院药学。电话:0595-22277052。E-mail:422533961@qq.com

