慢性肺曲霉菌病的CT动态观察
1.南方医科大学第五附属医院放射科 (广东 广州 510900)
2.广州医科大学附属第一医院放射科 (广东 广州 510120)
3.北京大学深圳医院医学影像科
(广东 深圳 518036)
梁健华1 李远章1 黄晓燕2曾庆思2 成官迅3
慢性肺曲霉菌病的CT动态观察
1.南方医科大学第五附属医院放射科 (广东 广州 510900)
2.广州医科大学附属第一医院放射科 (广东 广州 510120)
3.北京大学深圳医院医学影像科
(广东 深圳 518036)
梁健华1李远章1黄晓燕2曾庆思2成官迅3
目的 探讨慢性肺曲霉菌病病灶CT征象动态变化情况。方法 搜集近9年具有完整临床资料及胸部CT检查资料的66例继发于陈旧性肺结核的慢性肺曲霉菌病患者。根据病灶的CT变化情况分为三组观察,将没有变化的稳定性病灶定为Ⅰ组,不稳定性病灶中,空洞形态改变的病灶定为Ⅱ组,空洞不变的(仅其内曲霉菌形态发生改变的病灶)定为Ⅲ组;回顾分析各组的临床资料及CT征象并进行对比。结果 1、Ⅰ组18例;Ⅱ组16例;Ⅲ组32例。2、与Ⅰ组对比,曲霉菌血清学检查阳性、炎症标记物阳性患者Ⅱ组及Ⅲ组多见(分别为Ⅱ组10/16、12/16及Ⅲ组24/32、19/32),免疫功能减低患者Ⅲ组多见(17/32)。3、含球简单空洞以Ⅰ组多见(11/18),非含球简单空洞以Ⅱ组多见(11/16),含球复杂空洞以Ⅲ组多见(20/32)。结论 慢性肺曲霉菌病是动态发展的,对病灶进行胸部CT追踪复查能提高疾病的影像学诊断并为临床分型提供全面的影像学依据。
慢性肺曲霉菌病;X线,计算机体层摄影术;动态观察
[Key wrods] Chronic Pulmonary Aspergillosis; X-ray, Computed Tomography; Followup Review
慢性肺曲霉菌病常常继发于陈旧性肺结核、糖尿病、长期类固醇治疗等致低免疫功能状态患者,尤以继发于陈旧性肺结核患者常见[1]。空洞内曲霉菌其生长发展是一个动态的过程,其形态变化取决于所在空洞的性状(复杂性、密闭性等)及是否具有侵袭性、曲霉菌所处发展阶段、空洞内脓液及脓液清除所带走菌丝碎片数量等情况[2,3]。胸部影像学检查可对曲霉菌的生长发展能进行很好的动态观察,了解曲霉菌各阶段的形态变化、发展及病灶的严重程度。本研究收集以陈旧性肺结核为基础疾病的慢性肺曲霉菌病患者,对确诊病灶的所有胸部CT检查及相关临床资料进行回顾性分析,旨在探讨慢性肺曲霉菌病的动态变化情况,提高对该病的影像学诊断及为临床分型提供影像学依据。
1 资料与方法
1.1 一般资料 收集广州医科大学第一附属医院2006年1月~2015年6月间收治的陈旧肺结核合并慢性肺曲霉菌病患者66例,其中男50例,女16例,年龄28~80岁,平均48.6岁。28例行剖胸探查肺叶切除,38例经支气管镜肺活检,全部均经病理确诊。所有65例患者检查次数共327次,每人胸部CT检查3~7次。
1.2 检查方法 66例患者327次胸部CT平扫(增强131次,其中CTA66次,增强及CTA不纳入本次研究)。
CT机采用Toshiba-Aquilion 4层及16层螺旋CT机,扫描范围为胸廓入口至肺底,扫描条件为管电压120kV,管电流使用智能毫安:30~90mAs,螺旋因子0.936,X线球管转速:0.5s/r,FOV 320mm,采集矩阵512×512,采集层厚为2mm。
Siemens Aqulifation AS 128层螺旋CT机,管电压120kV,管电流为自动毫安,X线球管转速0.33s/转,采集0.6mm×128mm,矩阵512×512,FOV 320mm。
1.3 研究方法
1.3.1 病灶分组:根据病灶的复查情况,对病灶的CT征象的变化进行动态观察和分析。根据病灶的变化情况,可分为以下三组病灶进行对比分析。
Ⅰ组(稳定性病灶,见图1-2):病灶的形态及空洞内曲霉菌形态每一次复查均与首次检查大致相同,未发生明显变化;Ⅱ组(发生空洞形态改变的病灶,见图3-8):病灶多次复查中,空洞发生侵袭性改变,空洞形态出现一次或多次改变的病灶,伴或不伴空洞内曲霉菌形态改变;Ⅲ组(空的不变,仅其内曲霉菌形态发生改变的病灶,见图9-12):病灶多次复查中,空洞形态始终未发生明显变化,但空洞内曲霉菌形态发生一次或多次改变的病灶。
1.3.2 对三组病灶的临床资料进行对比分析。
1.3.3 根据病灶在系列复查中所表现的CT征象,并对空洞性病灶按照空洞的复杂程度及是否含典型曲菌球表现,进行单因素及双因素对比分析。
1.4 统计方法 采用软件SPSS 17.0对各组病例之间病灶的CT征象进行统计学分析,使用R×C总体χ2检验比较对各组的呼吸道征象、实验室检查及CT征象出现率是否具有统计学差异,具有统计学差异(P<0.05)的征象,进一步采用Bonferroni法调整检验水准对三组病灶作两两比较,P<0.0167差异具有统计学意义。
2 结 果
三组病灶患者共66例,Ⅰ组(稳定性病灶)18例(27.3%);Ⅱ组(空洞发生侵袭性改变的病灶)16例(24.2%);Ⅲ组(空洞不变,仅其内曲霉菌形态发生改变的病灶)32例(48.5%)。
2.1 各组病灶相关临床资料及对比分析 见表1。
2.2 各组病灶CT征象分析及对比 见表2。
3 讨 论
3.1 慢性肺曲霉菌病病灶变化特点及临床表现 本研究66例陈旧性肺结核继发慢性肺曲霉菌病患者中,经多次复查的动态观察,病灶属于稳定性病灶(Ⅰ组)的只有18例(27.3%),而不稳定性病灶Ⅱ组(空洞形态改变的病灶)及Ⅲ组(空洞不变仅空洞内曲霉菌形态发生改变的病灶)两组病灶共48例(72.7%),说明慢性肺曲霉菌病发生动态演变的情况较为多见,多数情况为不稳定状态。国内外学者曲霉菌生长的动态过程可分为6个阶段,其中含典型曲菌球的稳定阶段并不常见[2-4]。
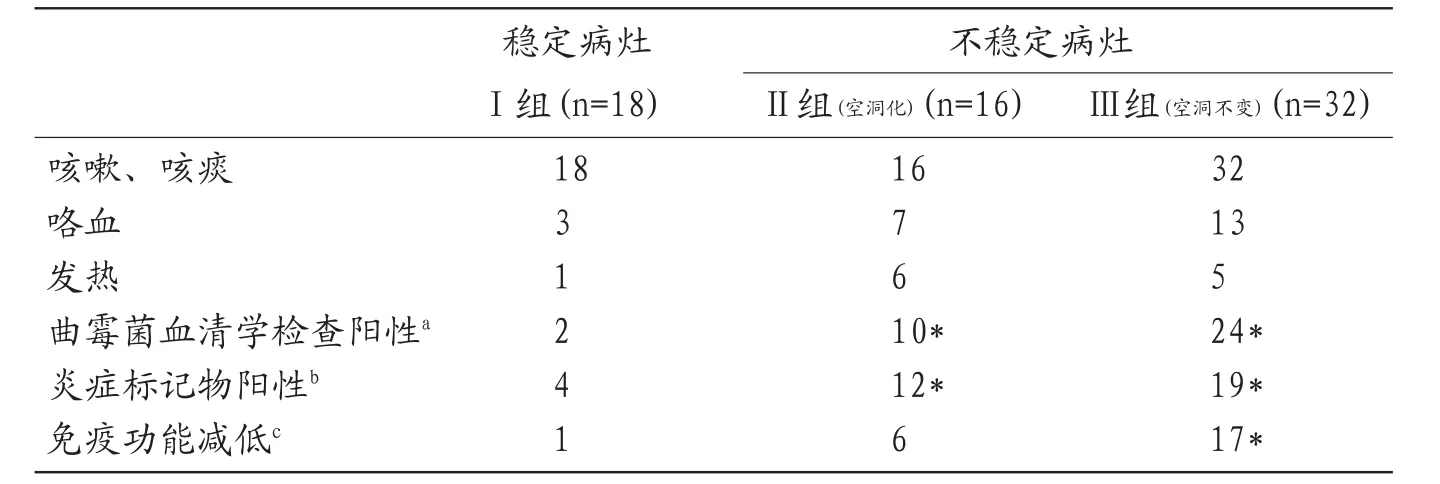
表1 各组病灶患者相关临床资料对比分析

表2 各组病灶检查中(首检及复查)所见CT征象对比分析
慢性肺曲霉菌的病理特点是肺组织内曲霉菌丝浸润伴有出血、组织坏死、微脓肿形成、炎性细胞浸润等[5]。真菌细胞壁含有丰富的半乳糖甘露聚糖,是真菌的主要抗原成分,在曲霉侵犯组织早期就可释放入血,这种抗原血症可持续1~8周[6]。表1中,不稳定性病灶(Ⅱ组及Ⅲ组)曲霉菌血清学检查及炎性标志物检查阳性率明显高于稳定性病灶(Ⅰ组)。曲霉菌病灶处于活动期时产生炎性介质、破坏周围小血管及抗原释放入血等均较稳定期明显,故患者相应呼吸道症状较重,曲霉菌相关实验室检查及炎性标志物检查阳性率较高。而Ⅲ组患者免疫功能明显较Ⅰ组患者低,慢性性肺曲霉菌病的生长发展取决于全身性免疫功能及肺组织局部的免疫功能[7]。陈旧性肺结核常形成较为复杂的空洞,被破坏的肺组织免疫功能较低且不可逆,容易继发空洞性肺曲霉菌病[8]。
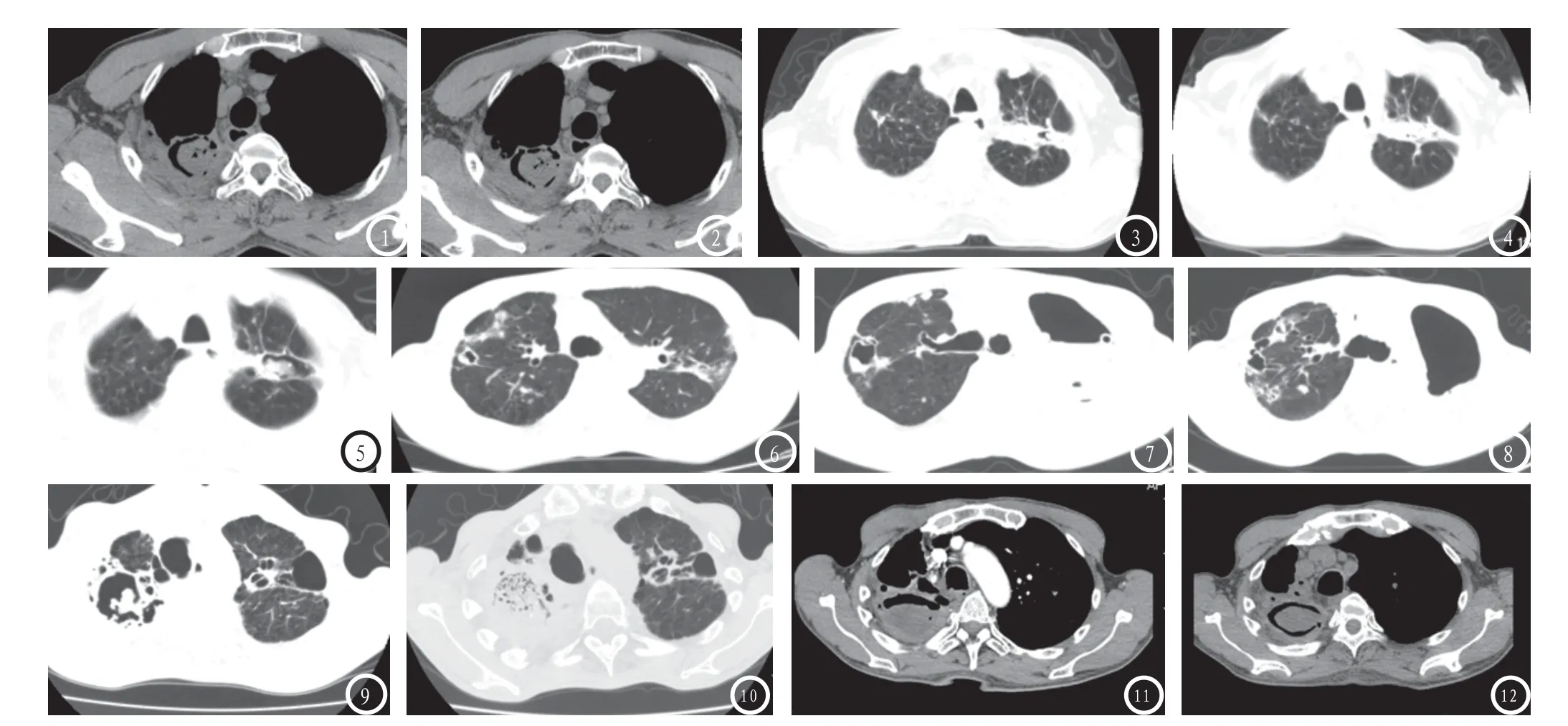
图1-2 图1 2007年图像;图2 2009年图像。右上肺简单空洞内见典型菌球征,2009年较2007年未见明显变化。图3-5 图3-5分别为2007年图像,2009年和2010年。左上肺空洞完全填充的实变病灶,2009年较2007年病灶无明显变化,2010年病灶增大并菌球形成。图6-8 图6-8分别为2011年,2013年和2014年图像。右上肺病灶2011年新增病灶,2013及2014年病灶持续增大并由简单变复杂(左上肺病灶术后切除)。图9-10 图9-10分别为2008年和2010年图像。右上肺复杂性空洞内见典型菌球征,两年后菌球征消失。图11-12 右上肺复杂空洞内见部分软组织填充,邻近胸膜增厚,两周后菌球形成。
3.2 慢性肺曲霉菌病CT单征象分析 从慢性肺曲霉菌病患者病灶的系列CT复查中发现:1、曲菌球,典型曲菌球征象较为我们熟悉,曲霉菌在空洞内的滋生是一个动态过程的某一相对稳定阶段,随着病程的变化,形态会不断改变[9]。稳定性病灶(Ⅰ组)与空洞内曲霉菌形态改变的病灶(Ⅲ组)典型曲菌球征象比较无明显差异,可见单以典型曲菌球征象难以判断病灶的稳定性。空洞侵袭性改变的病灶(Ⅱ组)出现曲菌球的病灶较为少见(31.3%),在影像上容易造成延迟诊断。2、空洞形态,Ⅰ组病灶以简单空洞多见,Ⅲ组病灶以复杂空洞多见。曲霉菌生长与死亡还取决于空洞的理化环境,复杂的空洞或与支气管相通的空腔,曲霉菌容易获得养分,有助于其生长发展,曲霉菌形态也随之不断改变[2,3]。Ⅱ组病灶由于空洞具侵袭性,其空洞可形成简单或复杂性改变,并可相互转化[10]。可见,单次检查中仅以空洞的复杂程度难以区别病灶的稳定性。
3.3 慢性肺曲霉菌病CT双征象综合分析 1、含球简单空洞征象,Ⅰ组最为多见,特点为稳定无变化的的单发空洞内见典型菌球,临床征象较轻,国内学者将这类称为简单菌球(SA)[11]。由于Ⅱ组患者临床表现明显较稳定性病灶患者严重,故对表现为含球的简单空洞时,应注意复查前后对比,观察有否发生空洞的侵袭性改变。2、非含球简单/复杂空洞征象,Ⅱ组多见。由于这种征象不典型,容易将其诊断为支气管扩张、结核空洞的而延误诊断。因为这类病灶空洞具有侵袭性且病灶进展缓慢,故常称为半侵袭性肺曲霉菌病或慢性坏死性肺曲霉菌病(CNPA或SAI)[12,13]。对于简单空洞病灶,可根据洞内没有典型曲霉球而与稳定的简单菌球(SA)进行鉴别。3、含球/非含球复杂空洞征象,Ⅲ组多见,对空洞无明显变化的复杂性空洞伴或不伴菌球形成的病灶,常称为慢性空洞性肺曲霉菌病(CCPA)[14],由于复杂的空洞或与支气管相通的空洞,曲霉菌容易获得养分,形态多变,其临床表现明显较稳定性病灶严重。而常表现为软组织填充的不典型征象,容易漏诊,或等菌球出现时才作出诊断而延诊。表现为不典型征象时,由于影像征象及临床表现与坏死性肺曲霉菌病(CNPA或SAI)相仿,临床上难以区分,需进行复查动态观察其空洞的变化[15]。有学者认为慢性空洞性肺曲霉菌病(CCPA)其空洞为已知存在的,也有学者认为三个月内发生变化的空洞考虑为为CNPA[16,17]。4、非空洞性征象,主要表现为肉芽肿或肿瘤样结节或肿块,发展为半侵袭性肺曲霉菌病CNPA多见。
综上所述,陈旧性肺曲霉菌病是一个动态发展的疾病,所表现的各种CT征象及其各种临床分型只是疾病发展过程中的某一状态的表现,发展过程中各种征象及病灶形态可相互转化。胸部CT动态复查是诊断空洞性肺曲霉菌的重要手段,能提高疾病的诊断及为临床分型提供全面的影像学依据。
[1]Soubani AO, Chandrasekar PH. The clinical spectrum of pulmonary aspergillosis[J].Chest,2002, 121:1988-1999.
[2]Fraser, R. S. Pulmonary aspergillosis: pathologic and pathogenetic features[J]. Pathol Annu,1993,28(1)231-277.
[3]S e v e r o,L.C.,G e y e r,G. R. & Porto,N.S.Pulmonary Aspergillus intracavitary c o l o n i z a t i o n(P A I C)[J]. Mycopathologia,1990,112,93-104.
[4] 张言斌,周强,汪复康等.螺旋CT薄层扫描机CT值测定在继发性肺菌球诊断中的作用[J].影像诊断与介入放射学,2005.14(2)86-89.
[5] Franquet T, Muller NL, Gimenez A, et al. Spectrum of pulmonary aspergillosis: histologic, clinical and radiologic findings[J].Radiographics, 2001,21:825-837.
[6]李德容,钟淑卿,陈国勤等.慢性坏死性肺曲霉菌18例临床分析[J].中国真菌学杂志,2006,1(5):260-263.
[7]Hohl, T M, Feldmesser, M. A s p e r g i l l u s f u m i g a t u s: principles of pathogenesis and host defense[J]. Eukaryot Cell, 2007, 6: 1953-1963.
[8] Hiroshi O, Masaki F, Satoshi I, et al. Successful treatment of refractory chronic necrotizing pulmonary aspergillosis with micafungin[J].J Infect Chemother, 2007,13:258-262.
[9]Walsh TJ, Anaissie EJ, Denning DW, et al. Treatment of aspergillosis: clinical practice guidelines of the infectious diseases society of America[J].Clin Infect Dis, 2008,46:327-360.
[10]Tashiro T, Izumikawa K, Tashiro M, et al. Case series of chronic necrotizing pulmonary aspergillosis and new proposal[J]. J Infect Dis, 2013,66:312-316.
[11]Denning DW. Chronic forms of pulmonary aspergillosis[J]. C l i n M i c r o b i o l Infect,2001,7:25-31.
[12]Denning DW, Riniotis K, Dobrashian R,et al. Chronic cavitary and fibrosing p u l m o n a r y a n d p l e u r a l aspergillosis: case series, proposed nomenclature change, and review[J]. Clin Infect Dis, 2003,37:265-280.
[13]Hope WW, Walsh TJ, Denning DW. The invasive and saprophytic syndromes due to Aspergillus spp[J].Med Mycol, 2005,43:207-238.
[1 4]R i s c i l i B P, W o o d K L. N o n i n v a s i v e p u l m o n a r y Aspergillus infections[J]. Clin Chest Med,2009,30:315-335.
[15]Koichi Izumikawa, Takayoshi tashiro, Masato Tashiro,et al. Pathogenesis and clinical features of chronic pulmonary aspergillosis-Is it possible to distinguish CNPA and CCPA clinically[J].J Infect Chemother 2014: 20 :208-212.
[16]Samuel A,Yousem MD.The histological spectrum of chronic necrotizing forms of pulmonary aspergillosis[J]. Human Pathology,1997,28(6):650-656.
[17]Hae SN,Kyeongman J,Sang WU,et al. Clinical characteristics and treatment outcomes of chronic necrotizing pulmonary aspergillosis: a review of 43 cases[J].International Journal of Infectious Diseases 2010,14:479-482.
CT Follow-up Review of Chronic Pulmonary Aspergillosis
LIANG Jian-hua, LI Yuan-zhang, HUANG Xiao-yan,et al., Department of Radiology, The Fifth Affiliated Hospital of Southern Medical University, Guangzhou 510900, China
Objective To investigate the changing of lesions CT signs about chronic pulmonary aspergillosis. Methods 66 cases of chronic pulmonary aspergillosis second to obsolete pulmonary tuberculosis who had complete clinical and Chest CT data over the last 9 years were collected. All patients were divided into three groups according to the changing of lesions CT signs. The patients with the stable lesions which CT signs without changing were divided as Group Ⅰ, and with the unstable lesions who were divided into two groups as group Ⅱ and group Ⅲ. Group Ⅱ requires having invasive cavity, and Group Ⅲ requires the CT signs of aspergillus inside the cavity having changed and the cavity without changing. Reviewing and comparative analyzing clinical information and CT signs of each group. Results 1 We found 18, 16 and 32 cases of groupⅠ, group Ⅱand group Ⅲ, respectively. 2 Compared with groupⅠ, The positive results for serological test and inflammatory makers for aspergillus were more common in group Ⅱ (10/16, 12/16) and group Ⅲ(24/32, 19/32), and the cases of immunocompromised patients were more common in group Ⅲ(17/32). 3 The CT signs of simple cavity with aspergilloma, simple cavity without aspergilloma and complex cavity with aspergilloma were most commonly found in groupⅠ(11/18), group Ⅱ(11/16) and group Ⅲ(20/32), respectively. Conclusion Chronic pulmonary aspergillosis are in a dynamic process of development. Through chest CT follow-up reviewing for lesions, we can raise the accuracy of radiological diagnosis in chronic pulmonary aspergillosis and provide complete radiological basis for clinical classification.
R322.3+5
A
DOI:10.3969/j.issn.1672-5131.2016.05.017
李远章
(本文编辑: 刘龙平)
2016-04-09
论 著

