海洋缺氧现象的研究进展
郑静静,刘桂梅,高 姗(.国家海洋环境预报中心,北京0008;2.厦门大学近海海洋环境科学国家重点实验室,福建厦门36005)
海洋缺氧现象的研究进展
郑静静1,2,刘桂梅1,高姗1
(1.国家海洋环境预报中心,北京100081;2.厦门大学近海海洋环境科学国家重点实验室,福建厦门361005)
综述海洋缺氧研究的国内外现状,缺氧形成生物化学机理,以及从物理方面分别分析径流冲淡水、上升流、风、气候变暖等因素对缺氧影响;并分别从箱式模型、一维模型、二维模型、三维模式这4个角度,探讨了缺氧数值模型的发展和现状。基于目前取得的主要研究进展,提出未来我国缺氧研究发展重点和方向。
缺氧;机理;模型
1 引言
海洋中的溶解氧是重要的生源要素参数,也是海洋生态系统得以维持发展的关键因子。近几十年来,受人类活动的影响,大量的污染物排入近岸海域,造成水体富营养化逐年加剧,致使的近岸底层水体缺氧现象也呈不断上升趋势。通常定义水体中的溶解氧(DO)浓度<2.0 mg/L为缺氧状态[1],当水体中溶解氧的浓度<2.0 mg/L时,海洋中大部分水生生物将面临死亡,海底拖曳无法捕捉到鱼虾种群。
水体缺氧严重危害河口、近海环境,表现在多个方面。首先,海洋中大多数生物都需要溶解氧来维持。如鱼类生长需要6 mg/L的溶解氧,虾、蟹生长所需的溶解氧为2—3.5 mg/L[2]。缺氧对海洋中底栖生物的影响最为显著,当溶解氧浓度小于2 mg/L,且持续时间较长时,海洋中的大多数鱼类、浮游动物,特别是运动能力较弱的底栖生物群落将面临大规模死亡[3]。缺氧事件发生还会降低海洋物种多样性,改变海洋生物的群落结构,减少鱼类和底栖动物的丰富度,从而影响渔业生产,带来直接或间接的经济损失[4]。如波罗的海的“死亡区”因为长时间持续缺氧,每年损失的碳有2.64×105t,占整个波罗的海总初级生产力的30%,并造成渔业减产总量为1.06×105t[5]。
随着全球缺氧区域的扩张,释放越来越多的温室气体,如NO2、H2S,进而对全球气候产生潜在影响[6]。Naqvi等对全球缺氧区每年向大气释放的N2O和CH4总量进行估算,结果显示N2O和CH4分别为1.48—3.11 Tg和0.36—0.72 Tg[7]。
海洋缺氧事件不但影响了海洋生物化学过程,而且也会改变全球的碳氮循环,从而对整个生态系统产生严重的危害[8]。海洋的缺氧现象已经在全球范围内愈演愈烈,引起科学家们的高度重视,缺氧形成机制及成因成为当今海洋领域研究的热点之一。文章综述了海洋缺氧的现状和形成机理,以及利用模型来研究海洋缺氧形成过程,并提出现阶段缺氧研究的侧重点。
2 缺氧的现状
近几十年来,由于人为排污加剧,发生缺氧的海域数量以每年5.54%的指数速率迅速增长[9]。另外缺氧发生的频率、范围和持续时间均有显著增加。如西大西洋最大的缺氧区出现在墨西哥湾北部,密西西比河入海口处,其2002年的缺氧面积达到2.2×104km2,而1993到2009年缺氧区域的平均面积为1.6×104km2[10]。Conley等发现波罗的海最早出现缺氧区是20世纪60年代,其1991—2000年缺氧区年均面积为4.9×104km2[11]。地中海海湾从1987年开始出现缺氧[12],近几年缺氧现象愈发严重,导致大量海洋生物死亡[13]。也有学者研究发现秘鲁近海[14]、美国新泽西洲海岸[15]、弗吉尼亚州的切萨皮克湾[16]、卡罗莱纳州沿岸河流(大西洋西海岸)[17]、韩国南部海湾[18]均出现不同程度的缺氧现象。这些海域的缺氧现象已经不是海洋生态系统循环自然发生的生态现象,人类活动造成的环境污染是导致缺氧区形成的一个重要原因。
我国珠江口外和长江口外海域也存在底层水体明显的缺氧现象。1999夏季的调查显示长江口外存在一处面积高达1.37×104km2的缺氧区域,氧亏损总量高达1.59×106t[19]。20世纪50年代,长江口外发生夏季缺氧事件的频率为60%,而到了1990年后缺氧事件发生频率达到90%,并且缺氧面积大于5.0×103km2的基本上都发生在20世纪90年代末,这说明近几十年来长江口缺氧区范围不断扩大,严重程度也是逐年加剧。夏季,在我国珠江口外海域亦发现有底层水体缺氧现象,1985年的调查发现珠江口缺氧区主要位于横琴岛和高栏岛附近水域,底层溶解氧含量最低为1.76 mg/L,此后,珠江口缺氧区呈现不断扩大化、严重化趋势[20]。王丽芳等于2005年1月和8月的两次调查发现,珠江口上游广州河段的底层溶解氧浓度平均为3.09 mg/L和1.21 mg/L,在广州附近水域底层溶解氧最低值分别为0.48 mg/L和0.21 mg/L[21]。Helly等研究了近岸海域缺氧的全球分布,结果表明近岸缺氧区的面积高达1.0×106km2[22]。这些缺氧区主要分布在西欧、北欧沿海,美国东、西部海岸,中国东部沿海,以及日本沿海等人口密集、经济发达的海岸带区域,这也进一步印证了人类活动对缺氧区的形成有着不可推卸的责任。
3 缺氧形成机理
缺氧实际上就是溶解氧消耗大于补给过程的持续。要弄清海洋中缺氧的问题,首先需要知道海洋中溶解氧的源和汇。
海洋中溶解氧的源,主要有两方面:大气复氧和浮游植物光合作用。大气复氧是大气中的氧通过海气界面进入到海洋中的过程,是海水溶解氧重要来源之一。当海水中的溶解氧不饱和时,氧气就会从大气进入到海洋,当海水中溶解氧为过饱和状态时,水中的氧气就会释放到空气中。目前广泛使用的水体大气复氧方程见式(1):

式中:k2为复氧系数,Os为溶解氧饱和浓度,O为实际溶解氧浓度。这个公式表明大气对水体的复氧速率与溶解氧的亏损(Os-O)成正比[23]。此外,海水温度、紊动(如风浪、环流)等对海气交换也有一定影响。水体表面传质系数与温度的关系满足式(2):

式中:KT为温度T时的传质系数,K20为20℃时的表面传质系数,θ为常数,T为温度[24]。由此可见海水温度越高,越有利于氧气与海水之间的气体交换。然而在海气交换过程中,温度越高,氧气的溶解度越低,这样会部分抵消温度对复氧速率的影响。另外温度升高,溶解氧饱和度会降低,将不断从海洋中释放氧。紊动(风浪、环流)不仅影响海气界面氧气传输,而且对水体内部溶解氧的扩散、输运也有着重要作用。海洋中溶解氧的另一种来源是浮游植物光合作用,其光合作用强弱和光照强度有关,随着深度的增加,透光层以下的光合作用急剧减小,因此光合作用主要发生在上面的透光层区。海洋中浮游植物的光合作用过程可由式(3)的正过程表示:

海洋中溶解氧的汇,主要有生物呼吸作用,有机物的分解耗氧,无机物的氧化作用,底泥耗氧等过程。浮游植物的呼吸作用是光合作用的逆过程,在补偿深度(呼吸耗氧量等于光合产氧量)以下,特别是在透光层以下,由于光线减弱,浮游植物的呼吸作用占主导地位,消耗溶解氧。有机物的降解过程也消耗大量的溶解氧,氧的消耗量主要取决于有机物的含量。河口地区有机物来源丰富,含量高,其分解耗氧量多,所以容易出现缺氧现象。研究表明珠江口外海域底层水体缺氧主要是由有机物分解消耗了底层溶解氧导致的,尤其是密度跃层以上水域[25]。此外海洋中的一些还原态无机物如Fe2+、Mn2+在氧气充足的情况下会发生氧化反应,转化为更稳定的高价态,此过程氧消耗量很小。另外,NH4+通过硝化作用耗氧,珠江口缺氧区形成很大一部分是由硝化反应耗氧贡献的。据估计,珠江口上游缺氧区硝化作用的耗氧量占总耗氧量的20%—30%[26]。海洋中的底泥是指沉积到海底的颗粒态有机物,其经矿化作用消耗溶解氧。底泥耗氧在水体耗氧中也有着非常重要的贡献,在珠江口密度跃层以下水域,底泥耗氧占据主导地位[25]。
3.1生物化学机制
缺氧现象的形成是个复杂的过程,是物理和生物化学共同作用的结果,受温度、盐度、水体层化、浮游植物的生物量以及有机物等诸多因素的影响。河口近岸区域的缺氧研究均指出河口水域,夏季温度适宜,河流携带的大量氮、磷营养盐促使的浮游植物爆发性繁殖,初级生产力增加,浮游植物通过光合作用产生的氧气也随之增加,与此同时,大量繁殖的浮游植物通过呼吸作用的耗氧量也对应增加。除了呼吸作用耗氧外,有机物的氧化分解是最为主要的生物化学耗氧过程。有机物的降解耗氧可以用下面的经验方程(4)表达:

河口中有机物的来源主要有浮游植物死亡的贡献和河流输入。夏季,一方面河流径流量增加,河流输入的有机物也随之增加;另一方面浮游植物初级生产力提高,浮游植物死亡贡献的有机物也相应增加。以上两种有机物进入河口后,溶解态有机物会直接在水体中分解消耗溶解氧。颗粒态有机物中有一部分在细菌等微生物的作用下转化为溶解态有机物消耗溶解氧,另一难分解的部分在输运过程中沉降到底层,发生复杂的矿化反应,大量消耗溶解氧。虽然目前已经明确有机物降解耗氧是水体缺氧的一个重要因素,但是关于导致河口缺氧的有机物来源一直备受争论。Jia等通过使用放射性同位素δ13C对珠江口伶仃洋中的沉积物柱状样进行研究,发现伶仃洋内河流输入的陆源有机物对底泥中有机物的贡献远大于浮游植物死亡后对底泥有机物的贡献[27]。但是也有研究认为河流输入的有机物对低氧的贡献微小。Dagg等认为河流输入的陆源有机物中,只有极少一部分的有机物是能被细菌利用分解,而来自海源的有机物(即浮游植物残体),在短时间内细菌能对其大部分进行分解。实验表明,河流输入的有机物,细菌在经过620 d的分解后,仅有34%被利用;而相对于海源有机物来讲,细菌仅分解3 d就利用了58%的有机物[28]。越来越多研究表明缺氧的形成与浮游植物的初级生产力有着直接的关系。Kemp等对切萨皮克湾的总有机碳收支研究发现,陆源输入的有机物远小于海源输入的有机物,缺氧形成主要是由海源有机物分解消耗溶解氧导致[29]。亚得里亚海北部,波罗的海和黑海,其缺氧程度的增加与河流输入的N通量、初级生产力的增加直接相关[30]。
近几十年来,随着人为排污加剧,尤其是营养盐负荷增加的近岸海域,缺氧事件频发,很多研究认为水体富营养化是造成水体缺氧重要的“原始驱动力”。从直接影响来看,富营养化的近海为浮游植物的爆发性繁殖提供了极其有利的物质基础,这些生物在生长过程中通过呼吸作用会消耗水体中的溶解氧,而其死亡后,残体会沉降到水体底层被细菌分解,也会消耗大量的溶解氧,加剧低氧状态;从间接影响来看,营养盐比率的变化,使浮游植物的种群结构发生改变,新演替出的优势种由于一般不受捕食者喜爱而不被捕食,最终下沉到底层被细菌分解耗氧。另外水体底层缺氧又会诱发底泥磷的释放,释放的磷上升至透光层促进浮游植物生长,形成一种正反馈效应,进一步加剧低氧趋势。水体富营养化导致浮游植物大量繁殖为缺氧的形成提供了物质基础,如果物理条件成熟,使水体出现层化,阻止溶解氧的垂向交换,底层溶解氧得不到表层溶解氧的补充,水体底层就会出现缺氧现象。同时如果水动力条件能够维持较长的水体停留时间,那么水体缺氧就会进一步恶化,导致生态系统崩溃。我国长江口缺氧区形成的生化过程,主要是由于长江径流带来的大量陆源营养盐,促进表层浮游植物生长,产生的大量颗粒态有机碳向底层输送,底层溶解氧的消耗主要包括陆源有机物,浮游植物死亡贡献以及底泥再悬浮[31]。切萨皮克湾浮游植物生长主要受N限制,Testa等研究发现,当氮输入增加时,浮游植物初级生产力增加,植物残体死亡降解以及呼吸作用消耗大量氧气,发生缺氧的区域扩张,而当1—5月氮输入减少时,7—8月缺氧区域也对应减小[32]。Justić等人利用数值模型研究墨西哥湾北部水体底层缺氧对密西西比河营养盐输入变化的响应,结果表明如果密西西比河营养盐通量减少30%,缺氧发生频率也随之减少37%[33]。
3.2物理机制
缺氧现象除了受生物和化学过程影响之外,物理因素在缺氧现象的形成、维持和破坏中也起着重要作用。径流冲淡水、上升流、风、气候变暖对海洋缺氧现象有着重要的贡献。
3.2.1径流冲淡水
径流冲淡水不但可以携带大量陆源有机物,而且可以在河口区形成温盐跃层,限制表底层的水体交换。夏季大量径流冲淡水向外扩散,高温低盐的淡水浮在低温高盐的海水上面,咸淡水交界处有着明显的密度差异,一方面形成温盐跃层,阻碍了表层溶解氧的补充,另一方面形成锋面,如同一堵墙,阻碍营养物质和颗粒物质的运输,使其在锋面所处位置附近大量沉降。如夏季长江口外海的高温、低盐的表层长江冲淡水和底层北上的台湾暖流高盐、低温水形成较强的温度和盐度跃层成为垂向溶解氧交换的屏障[34]。近几十年来美国墨西哥北部湾缺氧现象的越来越严重,这与密西西比河、阿查法拉亚河近50a来的营养盐通量成数倍增长有着密切的关系[35]。Djakovac等研究发现亚得里亚海北部自1990年后发生大规模缺氧事件的频率明显减少,这与波河输入营养盐减少有关[36]。
3.2.2上升流
陆架浅海上升流,一方面携带外源性低溶解氧入侵,使溶解氧背景值相对偏低,更易发生缺氧现象;另一方面使底层富含营养盐的水体上升,加剧富营养化并促使藻华爆发,植物残体沉降从而增加底层有机碎屑,其分解需要消耗更多溶解氧。由美国新泽西海岸的西南风和适宜的海底地形共同作用而引起上升流,能够持续几个星期,而由上升流带来的颗粒态有机物降解会消耗大量溶解氧,从而致使氧亏损[15]。春夏季,在强烈的南风以及西南季风作用下,秘鲁-智利陆架处的高NO3、低氧的赤道次表层水涌升,使得真光层富营养化,浮游植物生长旺盛,植物呼吸作用增强消耗溶解氧,随后出现缺氧现象[37]。在墨西哥湾北部陆架区,风引起的上升流加剧了缺氧现象,Feng等利用模型研究发现由于上升流导致的高初级生产力在底层水体消耗大量的溶解氧[38]。
3.2.3风
风场强弱也影响缺氧现象的发生和发展,风速增加有利于增强水体的垂向混合过程,打破水体层化,促进溶解氧的垂向交换,破坏水体底层缺氧的形成。风向影响河口环流和水体滞留时间,进而影响缺氧水体发生的位置。美国北卡罗莱纳州的Pamlico河口在弱风速条件下,水体混合弱,层化稳定持续时间长,阻止溶解氧的垂向交换,因此更易出现缺氧现象[39]。台风可以增强水体垂向混合过程,使得表层的溶解氧能有效向水体底层补充,从而使河口水体底层缺氧现象消失;台风带来强降雨使得台风过后的河口与近海水体出现盐度跃层,同时也使得陆源营养盐和颗粒有机物增加,浮游植物爆发,从而加剧低氧事件发生。墨西哥湾北部密西西比河径流冲淡水通量直接影响营养盐通量大小和水体层化程度,台风过境的频率与强度也会影响墨西哥湾北部缺氧现象[40]。在路易斯安娜州西北部的德克萨斯陆架处,热带风暴使得底层的沉积物再悬浮,降解消耗大量的溶解氧,Justić等通过数值模拟发现,热带风暴(Fay)过后,德克萨斯陆架底层的溶解氧消耗速度达到0.5 mg/d,一周后开始出现缺氧现象[41]。
3.2.4气候变暖
全球变暖,导致海水温度升高,温度与氧的溶解度呈显著负相关,温度越高,氧的溶解度越低,从而使得通过海气交换进入到缺氧区表层的溶解氧降低,限制了缺氧区溶解氧的有效补充。此外温度升高,生物的呼吸作用增强,消耗氧气。Bendtsen等对波罗的海缺氧进行数值模拟发现当温度升高3℃,氧气的溶解度降低,其对低氧的贡献为25%,同时生物的呼吸增强,导致发生缺氧的区域扩大并且缺氧发作的时间延长[42]。另一方面海水温度升高,使得温跃层更加稳定,水体垂直混合减弱,不利于氧的交换,底层海水消耗的溶解氧得不到上层及时的补充,从而导致缺氧区面积不断扩大。此外,Shaffer等研究表明随着大洋温度的不断升高,诱发更多甲烷从底泥中释放,这样会形成一种正反馈效应,推进全球变暖趋势,进一步加剧缺氧恶化趋势[43]。同时气候变暖导致冰川融化,海平面上升,进而导致底层水盐度的上升[44],从而增加水体的层化程度,降低了底部水体的垂直混合。未来全球变暖将进一步加速缺氧区域的扩张,尤其是温带至副极地区域。Keeling等通过海洋模型研究预测表明,到下个世纪,全球溶解氧的含量将下降1%—7%,并且溶解氧的含量在未来的一千年里将持续下降[45]。
总之,生化过程和物理过程共同控制着海洋中溶解氧的变化,缺氧现象是这两大过程相互作用的结果。生化过程控制着溶解氧的产生和消耗,主要包括光合作用产氧、大气复氧,有机物分解耗氧、硝化作用耗氧、底泥耗氧。物理过程控制着溶解氧的水平和垂直输运,水平输运主要受沿岸流、锋面、潮流等过程影响,垂直输运主要包括上升流,水体层化等过程。纵观这些缺氧事件,尽管具体发生时间、地点、生物地理环境不同,但相互之间却有共同的特征,海洋水体底层缺氧是由水体层化和有机物的生物氧化过程中大量耗氧共同作用形成的。
4 缺氧模型研究
目前对于缺氧的研究多是基于水文和生化要素调查资料分析的方法,但是此类方法存在一定局限性,如对缺氧空间范围和时间变化认识的全面性受限于调查资料,同时难以获取缺氧发生的物理机制。为了对水体缺氧的形成机理及其影响因素有更深入的认识,在进行长期、广泛的现场监测和实验研究的基础上,还要使用各种海洋数值模式来模拟和预测水体缺氧的机理、发展、影响等相关问题。目前,科学家已开发出了许多数值模式来研究海洋缺氧问题。伴随着海洋生物,物理海洋和化学海洋学的快速发展,并结合利用计算机技术的新成果,海洋生态动力学模型从零维模型逐渐发展到三维模型。
4.1箱式模型

图1 箱式模型示意图
箱式模型,又称零维模型。主要以研究各变量随时间的变化为目的,把所研究区域在空间上划分成一个或几个均匀的箱子。箱式模型的优点是简便易行,但也存在诸多不足之处,如不适用于动力机制研究,另外空间分辨率也较低等。Das等利用箱式模型来研究墨西哥湾中北部的巴拉塔里亚河口的碳预算以及缺氧现象[46]。他将研究的区域划分为6个箱子,见图1。每个箱子的质量平衡方程见式(5):

式中:Vi指每个箱子的体积,Fi指由于水位变化引起的水体积的输入及输出,Pi指降水,Ri指邻近湿地的河流输入,Ei指蒸发,Qi指密西西比河的河流输入。Das的研究结果表明巴拉塔里亚河口的碳输出对缺氧现象的影响很小。Officer等利用溶解氧箱式收支模型,定量分析了各个因素对缺氧形成的贡献及其相互之间的关系[47]。Officer等的工作无疑是具有开创性的,但他的箱式模型只考虑了时间的变化,而忽略了空间的变化,考虑的生态因子,物理过程及生物求化学过程也较简单。
4.2一维模型
一维模型是将生态模型与一维水动力模型耦合,但只考虑垂直方向的输运,而忽略水平输运引起的生态变化。这种模型适用于生态变量水平变化不明显的海区或是开阔的大洋区域,常用于研究生态变量的年际变化。Vanderborght等利用一维CONTRASTE(Coupled,Networked,Transport-Reaction Algorithm Strong Tidal Estuaries)模式对斯凯尔特河口O2、CO2、N2O等生源气体的通量进行了计算。CONTRASTE模式包含了潮流,淡水输入,物理化学及生态的输运过程。模式中含有盐度、悬浮物、无机碳、无机氮、有机碳、有机氮、浮游植物等因子。生态过程主要描述了异养细菌的呼吸作用,光合作用,硝化和反硝化作用[48]。CONTRASTE模式中变量的平衡方程见式(6):
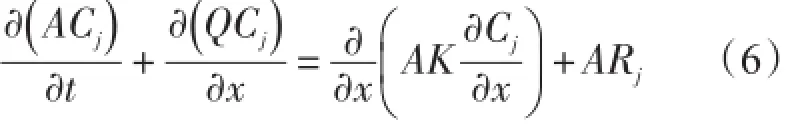
式中:Cj表示生态变量的浓度,A表示断面的面积,Q表示通过断面的流量,K表示扩散系数,Rj是指由生态过程引起的变量Cj的变化。Hofmann等通过建立一维模型来研究斯凯尔特河口的氮和碳收支,并估算了溶解氧的几个主要源汇过程,结果表明硝化作用消耗大量的溶解氧,是造成斯凯尔特河口底层水体缺氧的主要生化过程[49]。
4.3二维模型
二维模型是指生态模型与二维水动力模型耦合,只考虑垂直方向和一个水平方向上水动力或两个水平方向上水动力输运引起的状态变量的变化。二维模式方面,Valle-Levinson等用了一个二维混合模型来研究美国西部长岛海峡缺氧的机理,模式中溶解氧的平衡方程见式(7):

式中:Avo表示溶解氧的垂直扩散率,R表示溶解氧的产生量与消耗量的差值,溶解氧的瞬时变化受物理输运和生态过程共同影响。模拟结果揭示了生化反应,层化作用和被削弱的重力环流以及垂直混合作用的减弱致使水体底层出现缺氧现象,该模型,详尽的分析了缺氧形成的物理机理,然而对于生化耗氧只做简单的数值估计[50]。Ishikawa等也利用一个二维模型模拟了日本利根川(Tone River)河口水体停留时间和盐楔入侵等因素对水体缺氧形成的影响[51]。
4.4三维模型
三维模型更注重物理过程和生化过程相互作用下生态系统的变化,用来模拟生态系统在三维空间的分布特征,更加符合生态系统的实际情况。耦合了物理与生态过程的海洋生态动力学模型中,生态相关状态变量的浓度变化除了受到物理输运过程的控制,还受到生物、化学作用的影响,见式(8):

式中:v→代表三维的流速,kT代表混合系数,C代表生态相关的状态变量。第一项为对流项,表示由于水体流动造成的状态变量的水平和垂向的输运。第二项为混合项,表示由于湍流作用造成的水平与垂向扩散。第三项Bc代表生态过程对C浓度的变化率。Fennel等在区域海洋模式系统(Regional Ocean Modeling System,ROMS)基础上,耦合生态模式来研究不同的模型精度,物理边界条件,以及底泥耗氧过程对墨西哥湾北部缺氧区域的影响[52]。Fennel生态模式中影响溶解氧的过程有海气交换,浮游植物光合作用产氧,硝化作用耗氧,浮游动物新代谢耗氧,碎屑矿化分解耗氧以及海底沉积物再矿化耗氧,如图2所示。研究结果发现墨西哥湾北部缺氧区域的模拟对不同底泥耗氧过程很敏感,另外改变模型物理边界条件可以通过影响水体层化进而影响缺氧区域的模拟。Sohma等把河口生态模型应用到日本的Mikawa海湾中,在Sohma的模型中应用了3个模型,分别是新海洋生态模型,水力模型,潮汐水质模型,模拟系统能够较好揭示夏季Mikawa海湾的水体动力学以及水体中的碳、氮、磷和氧的生态系统动力学,从理论上说明缺氧现象形成的物理原因和生化原因[53]。罗琳等使用三维斜压水动力—生态耦合模式模拟分析了珠江口底层水体缺氧现象的形成及其原因,研究结果表明过量的营养盐、有机质的输入以及径流冲淡水引起的强化是珠江口底层水体缺氧的主要原因,而由潮汐和锋面提供的垂向混合控制着低氧水团的范围和强度[54]。Justić利用非结构化网格的三维水动力模型(Finite Volume Coastal Ocean Model,FVCOM)耦合经修正水质分析模拟程序模拟了德克萨斯州陆架处的缺氧的时空变化及其缺氧形成的机制[41]。生态动力模型能够用于表达缺氧发生的物理及生化过程,因此缺氧区的生态动力学模型开发是未来发展的重点。

图2 Fennel模式的缺氧形成过程
5 缺氧现象的研究展望
海洋缺氧区的形成是一系列自然和人为因素共同作用的结果,缺氧的存在和缺氧程度的恶化,必然会严重威胁生态系统的健康,对沿海地区的水产养殖产业造成重大的经济损失。缺氧的研究涉及的学科众多,覆盖了生物、化学和物理等诸多学科,它的发展应强调学科间的交叉、渗透与综合。目前,国外在缺氧形成机制,生态效应,影响因素以及防治等方面的研究更加成熟,国内对缺氧的研究比较落后,各个方面的技术有待提高。纵观我国缺氧的发展历史和研究现状,其发展趋势应在以下几个方面有所侧重:
(1)定量分析物理及生物化学过程对缺氧现象的影响。河口水体底层的缺氧现象是物理过程和生物化学过程综合作用的结果,物理过程调控着生物化学过程,这两者都是缺氧形成的必要条件,缺一不可。但在不同河口及近岸海域,二者的贡献有所不同。定量估算各物理过程、生化过程对溶解氧收支的贡献,找出导致缺氧的主导因素,有助于加深对缺氧形成机制的理解,为未来制定有效的治理方案提供科学依据;
(2)建立缺氧的生态系统动力学模型,开展缺氧的数值预报系统,提高缺氧区灾害的预警能力。虽然近几年来我国海洋生态动力数值模型研究取得了较大的进展,但由于受海洋观测调查资料、海洋环境认知不足等因素的限制,至今尚未开展业务化的缺氧生态动力学数值预报系统。而美国在数值预报方面已取得一定进展,美国通过政府机构与科研院所的广泛合作,针对墨西哥湾和切萨皮克湾两个缺氧最严重的区域开展监测,预报和研究,并于2002年开始了墨西哥湾的缺氧区的数值预报,利用硝酸盐的排放负荷来预测当年的缺氧区规模,预报结果较为准确。我国需要加强缺氧区水动力和生化要素的现场观测,通过对现场监测和实验研究的综合分析来确定模型所需生态参数、初始场、边界条件等,反过来再通过生态动力学模型来验证参数的可行性与适用性,从而完善和改进生态动力学模式,为缺氧预警提供科学依据;
(3)全球变暖与缺氧关系。我国沿海海洋环境要素变化,如海表温度升高、海平面变化等,与全球气候变化有着密不可分的联系。全球变暖引起的海水温度升高,导致水体层化加强、氧的溶解度降低、生物呼吸作用增强等进而促进近岸海域缺氧现象呈恶化趋势。目前全球气候变化与缺氧的研究还处于比较初级阶段,缺氧对全球气候变化响应的内在机理尚不清晰,相关的研究内容主要局限于气候变化通过营养盐和径流量的改变影响缺氧过程。未来随着全球气温上升,缺氧区域将进一步扩张,因此需要加强物理生态耦合过程模型研发,深入研究气候变化对缺氧的影响,提高预测未来全球变暖下缺氧发展趋势的能力。
近年来我国近海针对缺氧区的调查和监测,往往只是针对个别的研究课题,缺乏系统性和连续性的研究,对缺氧的情况尚未有一个全面深刻的认识,不同部门之间的数据共享机制尚未建立。美国的海洋缺氧区研究工作,有一部《赤潮和缺氧研究控制法案》作为总的原则,事实上不止这项工作,在很多领域我们可以看到美国都是法律和战略规划先行。我国可以借鉴这种思路,在海洋缺氧区研究领域上,站在战略高度上制定全盘规划,制定恰当的牵头部门,然后引入多部门多机构的合作,共同解决我国近海缺氧问题。
[1]Wei H,He Y C,Li Q J,et al.Summer hypoxia adjacent to the Changjiang Estuary[J].Journal of Marine Systems,2007,67(3-4): 292-303.
[2]Gray J S,Wu R S S,Or Y Y.Effects of hypoxia and organic enrichment on the coastal marine environment[J].Marine EcologyProgress Series,2002,238:249-279.
[3]Karlson K,Rosenberg R,Bonsdorff E,et al.Temporal and spatial large-scale effects of eutrophication and oxygen deficiency on benthic fauna in Scandinavian and Baltic waters-a review[J]. Oceanography and Marine Biology,2002,40:427-489.
[4]Yin K D,Lin Z F,Ke Z Y.Temporal and spatial distribution of dissolved oxygen in the Pearl River Estuary and adjacent coastal waters[J].Continental Shelf Research,2004,24(16):1935-1948.
[5]Diaz R J,Rosenberg R.Spreading dead zones and consequences for marine ecosystems[J].Science,2008,321(5891):926-929.
[6]Wang F F,Liu J,Qiu J D,et al.Historical evolution of hypoxia in the East China Sea off the Changjiang(Yangtze River)estuary for the last~13,000 years:evidence from the benthic foraminiferal community[J].Continental Shelf Research,2014,90:151-162.
[7]Naqvi S W A,Bange H W,Farías L,et al.Marine hypoxia/anoxia as a source of CH4and N2O[J].Biogeosciences,2010,7(7): 2159-2190.
[8]Lam P,Lavik G,Jensen M M,et al.Revising the nitrogen cycle in the Peruvian oxygen minimum zone[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(12):4752-4757.
[9]Vaquer-Sunyer R,Duarte C M.Thresholds of hypoxia for marine biodiversity[J].Proceedings of the National Academy of Sciences of the United States ofAmerica,2008,105(40):15452-15457.
[10]Obenour D R,Scavia D,Rabalais N N,et al.Retrospective analysis of midsummer hypoxic area and volume in the northern GulfofMexico,1985-2011[J].EnvironmentalScience& Technology,2013,47(17):9808-9815.
[11]Conley D,Björck S,Bonsdorff E,et al.Hypoxia-related processes in the baltic sea[J].Environmental Science&Technology,2009,43(10):3412-3420.
[12]Friligos N,Psilidou R,Xatzigewrgiou E,et al.Seasonal variations on nutrients and dissolved oxygen[M]//Tsiavos C.Oceanographic Study of the Amvrakikos Gulf.Chemical Oceanography Final Report 3.Athens,Greece:Hellenic Centre of Marine Research(HCMR),1989(in Greek).
[13]Kountoura K,Zacharias I.Temporal and spatial distribution of hypoxic/seasonal anoxic zone in Amvrakikos Gulf,Western Greece[J].Estuarine,Coastal and Shelf Science,2011,94(2): 123-128.
[14]Neira C,Sellanes J,Levin L A,et al.Meiofaunal distributions on the Peru margin:relationship to oxygen and organic matter availability[J].DeepSeaResearchPartI:Oceanographic Research Papers,2001,48(11):2453-2472.
[15]Glenn S,Arnone R,Bergmann T,et al.Biogeochemical impact of summertime coastal upwelling on the New Jersey Shelf[J]. Journal of Geophysical Research:Oceans,2004,109(C12): C12S02.
[16]Murphy R R,Kemp W M,Ball W P.Long-term trends in chesapeake bay seasonal hypoxia,stratification,and nutrient loading[J].Estuaries and Coasts,2011,34(6):1293-1309.
[17]Mallin M A,Johnson V L,Ensign S H,et al.Factors contributing to hypoxia in rivers,lakes,and streams[J].Limnology and Oceanography,2006,51(1):690-701.
[18]Lim H S,Diaz R J,Hong J S,et al.Hypoxia and benthic communityrecoveryinKoreancoastalwaters[J].Marine Pollution Bulletin,2006,52(11):1517-1526.
[19]李道季,张经,黄大吉,等.长江口外氧的亏损[J].中国科学D辑,2002,32(8):686-694.
[20]林洪瑛,刘胜,韩舞鹰.珠江口底层海水季节性缺氧现象及其引发CTB的潜在威胁[J].湛江海洋大学学报,2001,21(S1): 25-29.
[21]王丽芳,戴民汉,翟惟东.近岸、河口缺氧区域的主要生物地球化学耗氧过程[J].厦门大学学报(自然科学版),2007,46(S1): 33-37.
[22]Helly J J,Levin L A.Global distribution of naturally occurring marine hypoxia on continental margins[J].Deep Sea Research Part I:Oceanographic Research Papers,2004,51(9):1159-1168.
[23]雒文生,李莉红,贺涛.水体大气复氧理论和复氧系数研究进展与展望[J].水利学报,2003,34(11):64-70.
[24]李然,李嘉,李克锋.紊动水体大气复氧系数研究进展[J].上海环境科学,2000,19(4):176-179.
[25]张恒,李适宇.生化过程对夏季珠江口底层缺氧影响的模拟研究[C]//中国环境科学学会2009年学术年会论文集.武汉:中国环境科学学会,2009:376-382.
[26]王丽芳.珠江口水域硝化作用与无机氮分布特征[D].厦门:厦门大学,2007.
[27]Jia G D,Peng P A.Temporal and spatial variations in signatures of sedimented organic matter in Lingding Bay(Pearl estuary),southern China[J].Marine Chemistry,2003,82(1-2):47-54.
[28]Dagg M J,Ammerman J W,Amon R M W,et al.A review of water column processes influencing hypoxia in the northern Gulf of Mexico[J].Estuaries and Coasts,2007,30(5):735-752.
[29]Kemp W M,Smith E M,Marvin-DiPasquale M,et al.Organic carbon balance and net ecosystem metabolism in Chesapeake Bay[J].Marine Ecology Progress Series,1997,150:229-248.
[30]Cloern J E.Our evolving conceptual model of the coastal eutrophication problem[J].Marine Ecology Progress Series,2001,210:223-253.
[31]刘海霞,李道季,高磊,等.长江口夏季低氧区形成及加剧的成因分析[J].海洋科学进展,2012,30(2):186-197.
[32]Testa J M,Li Y,Lee Y J,et al.Quantifying the effects of nutrient loading on dissolved O2cycling and hypoxia in Chesapeake Bay using a coupled hydrodynamic-biogeochemical model[J].Journal of Marine Systems,2014,139:139-158.
[33]Justić D,Rabalais N N,Turner R E.Simulated responses of the GulfofMexicohypoxiatovariationsinclimateand anthropogenic nutrient loading[J].Journal of Marine Systems,2003,42(3-4):115-126.
[34]Li D J,Zhang J,Huang D J,et al.Oxygen depletion off the Changjiang(Yangtze River)Estuary[J].Science in China Series D:Earth Sciences,2002,45(12):1137-1146.
[35]Rabalais N N,Turner R E,Wiseman Jr W J.Gulf of Mexico hypoxia,A.K.A."The dead zone"[J].Annual Review of Ecology and Systematics,2002,33:235-263.
[36]Djakovac T,Supić N,Aubry F B,et al.Mechanisms of hypoxia frequency changes in the northern Adriatic Sea during the period 1972-2012[J].Journal of Marine Systems,2015,141:179-189.
[37]Farías L,Cornejo M.Effect of seasonal changes in bottom water oxygenation on sediment N oxides and N2O cycling in the coastal upwelling regime off central Chile(36.5°S)[J].Progress in Oceanography,2007,75(3):561-575.
[38]Feng Y,Fennel K,Jackson G A,et al.A model study of the response of hypoxia to upwelling-favorable wind on the northern Gulf of Mexico shelf[J].Journal of Marine Systems,2014,131: 63-73.
[39]Lin J,Xu H Z,Cudaback C,et al.Inter-annual variability of hypoxic conditions in a shallow estuary[J].Journal of Marine Systems,2008,73(1-2):169-184.
[40]Goñi M,Gordon E S,Monacci N M,et al.The effect of Hurricane Lili on the distribution of organic matter along the inner Louisiana shelf(Gulf of Mexico,USA)[J].Continental Shelf Research,2006,26(17-18):2260-2280.
[41]Justić D,Wang L X.Assessing temporal and spatial variability of hypoxia over the inner Louisiana-upper Texas shelf:application of an unstructured-grid three-dimensional coupled hydrodynamicwater quality model[J].Continental Shelf Research,2014,72: 163-179.
[42]Bendtsen J,Hansen J L S.Effects of global warming on hypoxia in the Baltic Sea-North Sea transition zone[J].Ecological Modelling,2013,264:17-26.
[43]Shaffer G,Olsen S M,Pedersen J O P.Long-term ocean oxygen depletion in response to carbon dioxide emissions from fossil fuels[J].Nature Geoscience,2009,2(2):105-109.
[44]Hilton T W,Najjar R G,Zhong L,et al.Is there a signal of sea-levelriseinChesapeakeBaysalinity?[J].Journalof Geophysical Research:Oceans,2008,113(C9):C09002.
[45]Keeling R F,Körtzinger A,Gruber N.Ocean deoxygenation in a warming world[J].Annual Review of Marine Science,2010,2(1): 199-229.
[46]Das A,Justić D,Swenson E.Modeling estuarine-shelf exchanges in a deltaic estuary:implications for coastal carbon budgets and hypoxia[J].Ecological Modelling,2010,221(7):978-985.
[47]Officer C B,Biggs R B,Taft J L,et al.Chesapeake bay anoxia: origin,development,and significance[J].Science,1984,223(4631):22-27.
[48]Vanderborght J P,Wollast R,Loijens M,et al.Application of a transport-reaction model to the estimation of biogas fluxes in the Scheldt estuary[J].Biogeochemistry,2002,59(1-2):207-237.
[49]Hofmann A F,Soetaert K,Middelburg J J.Present nitrogen and carbon dynamics in the Scheldt estuary using a novel 1-D model[J].Biogeosciences,2008,5(4):981-1006.
[50]Valle-Levinson A,Wilson R E,Swanson R L.Physical mechanisms leading to hypoxia and anoxia in western long island sound[J].Environment International,1995,21(5):657-666.
[51]Ishikawa T,Suzuki T,Qian X.Hydraulic study of the onset of hypoxia in the Tone River Estuary[J].Journal of Environmental Engineering,2004,130(5):551-561.
[52]Fennel K,Hu J T,Laurent A,et al.Sensitivity of hypoxia predictions for the northern Gulf of Mexico to sediment oxygen consumption and model nesting[J].Journal of Geophysical Research:Oceans,2013,118(2):990-1002.
[53]Sohma A,Sekiguchi Y,Yamada H,et al.Erratum to“a new coastalmarineecosystemmodelstudycoupledwith hydrodynamics and tidal flat ecosystem effect”[Marine Pollution Bulletin 43(2001)187-208][J].Marine Pollution Bulletin,2002,44(5):432-439.
[54]罗琳,李适宇,王东晓.珠江河口夏季缺氧现象的模拟[J].水科学进展,2008,19(5):729-735.
Review on the marine hypoxia
ZHENG Jing-jing1,2,LIU Gui-mei1,GAO Shan1
(1.National Marine Environmental Forecasting Center,Beijing 100081 China;2.State Key Laboratory of Marine Environmental Science,Xiamen University,Xiamen 361005 China)
Many semi-enclosed bays,estuaries and coasts of the world have different degrees of hypoxia. Influenced by the natural changes and human activities,the phenomenon of marine hypoxia has become increasingly serious,threatening the marine ecological environment.The problem of marine hypoxia has caused wide attention in recently years.In this paper,the domestic and world-wide situation and biochemical mechanism of marine hypoxia is reviewed.Meanwhile,the physical aspects,the effects of the factors such as runoff,upwelling,wind,climate warming and so on,are also analyzed.The development and situation of the numerical model of hypoxia are discussed respectively,including box model,one dimensional model,two dimensional model and three dimensional model.Based on the main study progress at present,this research puts forward the key points and directions of the future research of hypoxia in China.
hypoxia;mechanism;model
P731
A
1003-0239(2016)04-0088-10
10.11737/j.issn.1003-0239.2016.04.011
2015-06-01
国家自然科学基金(41222038);国家海洋局海洋公益性行业科研专项项目(201205018);中国科学院战略性先导科技专项(XDA11020104);国家重点基础研究发展计划“973计划”(2011CB403606)。
郑静静(1990-),女,硕士研究生在读,主要从事海洋生态动力学模型研究。E-mail:jingjing.zheng@foxmail.com

