柑橘类生物碱辛弗林的研究进展
刘 伟,袁洪燕,张 群,苏东林,单 杨
(1.湖南省农业科学院,湖南省农产品加工研究所,湖南 长沙 410125;2.中南大学隆平分院,湖南 长沙 410125)
柑橘类生物碱辛弗林的研究进展
刘 伟1,2,袁洪燕1,张 群1,苏东林1,单 杨1
(1.湖南省农业科学院,湖南省农产品加工研究所,湖南 长沙 410125;2.中南大学隆平分院,湖南 长沙 410125)
辛弗林是柑橘中主要活性成分和含量最高的生物碱,具有提高新陈代谢、增加热量消耗、提高能量水平、氧化脂肪、减肥的功效,已广泛应用于医药、食品、饮料等保健品行业。主要概述辛弗林的结构及功能特性、提取与分离纯化、检测技术与方法、安全性评价等方面的国内外研究进展,以期为辛弗林的开发利用提供新的思路与理论参考。
柑橘;生物碱;辛弗林;提取纯化;安全性
目前,肥胖已成为一个日益严重的公共卫生问题。超过10亿的成年人超重(体重指数BM I)约25~29.9 kg/m2),至少有300万人处于肥胖(BM IP 30 kg/m2)中[1],直接导致糖尿病、心血管疾病、高血压、癌症等疾病发病率和死亡率的增加[2-3]。因此,对于肥胖和高血脂的治疗引起了全球医学界的重视,寻找高效低毒的降血脂药物,特别是天然活性成分更成为研究的热点之一。
辛弗林(synephrine)又名对羟福林、交感醇、脱氧肾上腺素,存在于芸香科柑橘属植物中,其中以酸橙(Citrus anrantium L.)幼果中含量最高。辛弗林具有收缩血管、升高血压的作用,还有较强的扩张气管和支气管的作用,临床用于治疗支气管哮喘以及手术和麻醉过程中出现的低血压、虚脱、休克、体位性低血压等症状。同时,还具有提高新陈代谢、增加热量消耗、提高能量水平、氧化脂肪、减肥的功效[4-7]。由于结构和内源性神经递质和肾上腺素和去甲肾上腺素相似[8],辛弗林已广泛应用于医药、食品、饮料等保健品行业。
我国柑橘资源丰富,是世界柑橘主要起源中心和生产大国,2014年种植面积达242万hm2,产量达3 494.22 万t,面积和年产量均居世界第一位。我国每年产生柑橘皮渣超过1 000万t,其内含辛弗林5.5万t。目前,除少量柑橘皮渣用于陈皮(凉果)等加工外,基本上没有其他方面的利用,造成资源的巨大浪费[9]。与此同时,国内供应和生产辛弗林及其制品的公司很少,随着需求量的不断提高,每年需进口大量辛弗林及其制品。目前,国内外对柑橘中辛弗林的性质、提取分离、检测方法及活性评价等进行了大量的研究探索,这些成果有助于提高柑橘的综合利用率,拓宽柑橘产业链,提升柑橘的产品附加值;同时,也为辛弗林的开发利用提供了新思路。
1 辛弗林的结构及功能特性
辛弗林(synephrine),拟交感神经类生物碱,分子式C9H13NO2。辛弗林可能存在3个不同的结构或位置异构体形式(对位-p,间位-m,邻位-o),如图1所示。3个位置异构体有非等效的药理作用和新陈代谢机理[10]。p-和m-辛弗林(又称苯福林,phenylephrine)都是α-肾上腺素能受体激动剂,可收缩血管引起人体血压升高。m-辛弗林也用于治疗鼻子充血症、眼部疾病等[4,11]。p-辛弗林和m-辛弗林都可以通过化学方法合成,p-辛弗林的植物性来源主要是芸香科(Rutaceae)柑橘属植物,m-辛弗林在人体血液中微量存在。o-辛弗林只能化学合成,但很难在市场买到。而在植物源天然存在最广的是p-辛弗林[12-13]。
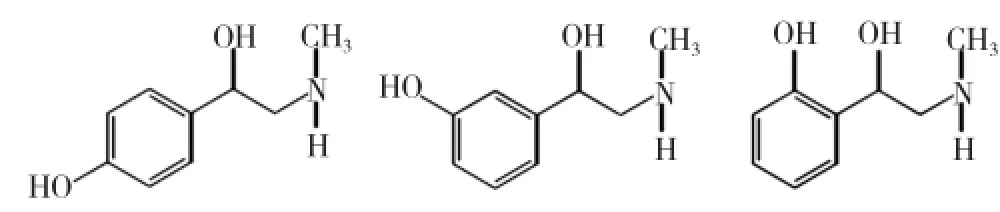
图1 辛弗林位置异构体形式
p-辛弗林,是苯乙醇胺衍生物,分子结构中同时存在酚羟基和氨基,具有两性性质,可分别与酸、碱结合成盐。游离的辛弗林易溶于有机溶剂,难溶于水;其酸式盐或碱式盐则易溶于水,难溶于有机溶剂。
p-辛弗林天然存在于芸香科柑橘属植物中,其中又以酸橙幼果中含量最高,最主要活性成分和含量最高的生物碱,含量约为10 mg/g。另外,酸橙中还检测到其他的苯乙胺生物碱,包括章鱼胺、酪胺、N-甲基酪胺和大麦芽碱,但这些生物碱的含量明显偏低[13]。
p-辛弗林的结构式中,存在一个手性碳原子,所以p-辛弗林存在2个对映异构体:R-(-)-辛弗林(左旋-辛弗林)和S-(+)-辛弗林(右旋-辛弗林),见图2。辛弗林在天然植物体中主要以R-(-)-辛弗林的形式存在,而在强酸强碱等提取条件下易发生外消旋作用,人工有机合成的p-辛弗林单体也为外消旋体[14]。据报道,R-(-)-辛弗林活性比S-(+) 对映体要高1~2个数量级,两个对映异构体在定性和定量上均表现不同的药理活性;还有报道指出R-(-)-辛弗林是p-辛弗林药物起药理作用的有效形式,S-(+)-辛弗林有可能有药效拮抗作用,甚至有可能引起不良反应[14-15]。
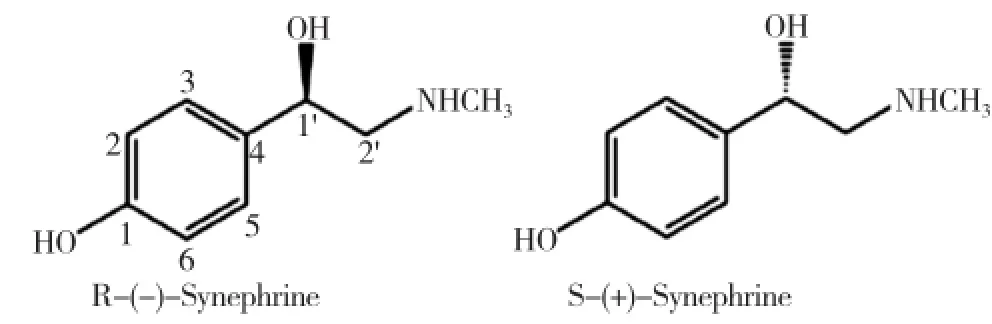
图2 p-辛弗林的2个对映异构体
p-辛弗林作为肾上腺素激动药主成分,已经收载于北欧三国药典和德国药典,能收缩血管、升高血压、扩张支气管、轻微兴奋剂,临床上主要用于治疗支气管哮喘及低血压、虚脱及休克、体位性低血压、改善新陈代谢,还可治疗消化问题如食积不化、化痰除痞、胃下垂等,在国外也用于治疗肥胖症,增加热量消耗、氧化脂肪等,在治疗因肥胖引起的中轻度抑郁症方面也取得了良好疗效[14-18]。现广泛用于医药、食品、饮料等行业,随着市场对辛弗林的需求量增加,其价值倍增;因此目前对于辛弗林的提取分离和检测等方面的研究也需要不断深入。
2 p-辛弗林提取与分离纯化工艺研究进展
柑橘类果实中均发现有p-辛弗林存在,其含量在幼果中较高,随着果实成熟有所降低,因品种不同含量也有差异[15]。研究数据表明,柑橘果肉中p-辛弗林含量约为0.20~0.27 mg/g,柑橘汁中辛弗林含量范围在53.6~158.1 μg/L[19],干燥橘皮中的含量为
1.2 ~19.8 mg/g[20]。
2.1 p-辛弗林的提取方法
关于中药枳实枳壳中辛弗林的提取方法报道较多,对柑橘皮渣中p-辛弗林的提取方法报道较少。目前,已报道的柑橘中辛弗林的提取方法有煎煮法、甲醇/乙醇稀溶液或弱酸溶液(稀盐酸、稀磷酸)温浸提取、渗漉提取、回流提取、超声辅助提取、微波辅助提取法等。辛弗林的提取效果主要取决于提取方法和溶剂,其中采用较多的是超声提取或回流加热提取。
吴崇珍等[21]采用乙醇溶液冷浸法和回流法提取枳实中的辛弗林,结果表明选用95%乙醇回流提取3次,每次1.5 h,得到枳实药材中辛弗林平均含量为4.38 mg/g。沈莲清等[22]比较了乙醇回流和盐酸超声两种方法对个青皮中辛弗林的提取效果,结果表明乙醇回流法的辛弗林得率最高为6.28 mg/g,而盐酸超声法的辛弗林得率最高是5.86 mg/g。蔡艳华等[23]用稀盐酸温浸后再进行渗漉提取,从枳实中获得辛弗林9.86 mg/g。李俊等[24]使用稀盐酸水溶液提取,强酸性离子交换树脂交换,乙酸乙酯洗脱方法提取分离枳实中的辛弗林,得率1.0 mg/g。肖荣国[25]采用浸泡后煎煮法醇沉提取枳壳中有效成分生物碱,最佳工艺提取总生物碱含量为5.972 %。王淳等[26]采用乙醇提取橙皮苷,发现乙醇提取效果明显优于水提取,最佳提取工艺条件为10倍量60%乙醇提取2次,每次1.0 h。贺冬秀等[27]比较了微波提取法、冷凝回流和超声提取法对陈皮中辛弗林的提取效果,结果表明,超声提取法不仅提取效率高而且提取时间短、溶剂用量少,选用80%甲醇溶液,微波功率300 W,时间2 m in,辛弗林产率为3.32±0.086 mg/g。陈志红等[28]采用水溶液微波破壁法提取枳实(检测辛弗林含量为9.36 mg/g)中的辛弗林,最终相对提取率达98.1%。张璐等[29]采用超声波辅助乙醇浸提法对枳实中辛弗林的提取工艺进行优化,枳实颗粒度30目、乙醇体积分数67.90%、液固比12∶1(mL/g)、提取时间16 min、超声功率420 W,在此最优条件下,辛弗林的提取量达5.87 mg/g。Fan等[30]使用分子印迹固相萃取技术(M ISPE)选择性提取枳实中的辛弗林,通过富集、纯化或洗脱得到87.5%辛弗林,其中分子印迹聚合物由辛弗林标准品、功能性单体甲基丙烯酸和乙二醇二甲基丙烯酸酯按摩尔比例1∶4 ∶20组合而成。
2.2 p-辛弗林的分离纯化方法
目前,p-辛弗林的分离纯化技术包括:水提醇沉阳离子树脂交换法、离子交换柱色谱-阳离子树脂交换法法、大孔吸附树脂、大孔离子树脂和滤膜工艺。
毛华荣等[31]采用HPLC法测定不同柑橘品种两次生理落果中辛弗林的含量,其中尾张品种的第一次生理落果时辛弗林含量高达20.50 ± 0.89 mg/g。张良华等[32]利用离子交换树脂-高速逆流色谱从芦柑、枳实粗提物中纯化制备辛弗林,经HPLC分析纯度为95.2%。廖茂梁等[33]比较了14种不同性质的大孔树脂对枳实提取液的吸附和解吸特性,同时对枳实中辛弗林的富集纯化工艺条件进行了研究,结果表明,通过D001-cc树脂纯化后产物中辛弗林的质量分数为46.3%,比原药材枳实中的含量提高了近百倍。袁干军等[34]选用AB-8大孔树脂纯化,20%乙醇洗脱,浓缩干燥后辛弗林含量为56.6%。李玉山[35]以732型强酸性阳离子树脂吸附辛弗林,以氨水洗脱,得白色结晶物0.25 g,纯度高达98.4%。蔡艳华[36]采用不同大孔树脂和离子交换树脂对辛弗林进行吸附,最终选用001×8强酸型阳离子树脂对辛弗林作进一步分离纯化,得辛弗林纯度为90.1%。
2.3 超临界CO2萃取技术用于p-辛弗林的提取分离
上述传统提取方法仍存在提取温度高、时间长、生产效率低、产物损失大、分离步骤多、排污量大等一个或多个缺点。例如,盐酸水溶液提取方法使用广泛,成本低,但分离纯化还需要使用弱碱回调,产物损失大;乙醇或甲醇冷浸法不需要加热,但是所需提取时间长,效率低;渗漉提取方法,得到的粗提液辛弗林浓度及提取率较高,但溶剂用量大,操作麻烦,不适合大规模提取;有机溶剂回流法提取效率较前两者都高,但也存在操作时间长,溶剂残留等缺点;微波萃取与传统的煎煮法相比较,具有成本低、产物收率高、可显著降低提取液中杂质含量的优点,但因选用甲醇溶液浓度高,容易产生溶剂残留;超声波辅助提取方法,操作简单,提取率较高,但也不适宜大规模提取。
超临界CO2萃取技术(CO2-SFE),具有工艺简单、提取效率高、无溶剂残留、操作条件温和、活性成分及热不稳定成分不易被破坏等优点,同时可以通过控制临界温度和压力实现选择性提取和分离纯化,满足药物开发生产和“绿色化学”的需要,适用于工业化生产和推广。
目前,国内外研究者多采用超临界CO2萃取技术提取中草药中不同种类的药用成份,如挥发油、黄酮类、萜类、多酚化合物、原花青素、生物碱、醌类及蒽衍生物等。但利用超临界CO2萃取法分离纯化辛弗林的研究较少,仅周鸣谦等[37]采用改装后的超声辅助CO2-SFE装置进行了辛弗林的提取参数优化研究。
3 p-辛弗林的检测技术与方法
早在1962年,通过色谱法就在人体尿液中检测出了p-辛弗林,到1964年,又在柑橘类水果中检测出了p-辛弗林和p-章鱼胺[10]。而随着辛弗林应用的日渐广泛,越来越多的检测方法被用来测定辛弗林的含量。目前,辛弗林含量测定方法主要HPLC[HPLCUV吸光法、反相高效液相色谱(RP- HPLC)、电喷射离子化质谱(ESI-MS)、质谱联用(MS/MS)检测、化学发光检测(CL)],毛细管电泳(CE),气相色谱技术(GC)薄层色谱法(TLC),填充柱超临界流体层析(pSFC)等。
3.1 高效液相色谱法(HPLC)检测
HPLC检测方法在测定柑橘属中草药(枳实、枳壳、青皮、陈皮等)中辛弗林含量时,因其操作方便、快速、准确、重现性好、样品需要量小、分析耗费低、柱效高等优点是目前使用最广、应用最多的色谱检测方法。大多数文献报道中关于辛弗林的含量检测都是采用的HPLC(或RP-HPLC)方法检测,联合其他检测器或检测手段用于柑橘属植物及其膳食补充剂制品中p-辛弗林的检测有着良好的应用前景。
Hashimoto等[38]使用HPLC法检测柑橘类天然中草药陈皮、枳实、枳壳的辛弗林含量,十二烷基磺酸钠(SDS)作为离子对试剂,水、乙腈、SDS、磷酸为流动相,检测到辛弗林含量为0.174%~0.566%,比之前文献报道的含量高1.3~2.2倍;Pellati等[39]建立了一种HPLC-DAD方法同步分析酸橙水果、提取物和草药制品中儿茶酚胺类化合物(dl-章鱼胺,dl-辛弗林和酪胺);Santana等[12]分别使用LC-UV和LCMS-MS测定了酸橙膳食补充剂产品中p-辛弗林和m-辛弗林的含量,LC/MS /MS 法的定量限达0. 02 ng;Putzbach等[40]采用LC-EI-MS方法检测多种膳食补充剂中辛弗林;任晶波等[41]采用微乳相色谱(MELC)分离测定了吴茱萸中的辛弗林含量,最佳微乳体系的组成为:3.0%SDS- 6.0%正丁醇-0.6%正辛烷-1.0%甲酸-1.2%乙腈-88.2%水,结果显示吴茱萸中辛弗林检测限为0.095 mg/L,定量限为0.32 mg/L。
化学发光(CL)检测常用于检测药理性化合物,与其他方法相比,CL分析具有高灵敏度、设备简单(没有单色器要求)、信号检测快速(一般0.1~10 s)等优点。Li等[42]在辛弗林基准溶液中加入了铁氰化钾和鲁米诺试剂的混合液后,增强了发光效果,提高了辛弗林检测的灵敏度,动态检测范围为0.008~1.000 mg/ m L,检出限为1.6 ng/m L,相对标准差仅2.6%(n=11)。
3.2 毛细管电泳(CE)检测
CE是一种非常重要的分析技术,因为样品检出限低、分析时间短、灵敏度高和分离效果好被用来分离检测多种样品,样品处理简单,无需预富集,在化学、药学和生命科学领域应用广泛。Chen等[43]采用毛细管电泳-电化学检测法(CE-ECD)测定传统中草药陈皮中的辛弗林,辛弗林浓度范围2.5×10-6~1.0×10-3mol/ L;Takei等[44]采用CE方法测得陈皮、枳实中的辛弗林含量分别为3.09±0.26 mg/g、2.22±0.17 mg/g;彭友元利用CE-ECD法同时测定样品中的辛弗林和3种黄酮的含量,在优化条件下,单次测定在20 min内完成;Avulal等[45]运用高效毛细管电泳(HPCE)法同时测定膳食补充剂中麻黄碱对映体和辛弗林的含量,9个麻黄碱和辛弗林样品在210 nm波长处23 min内分离。Liu等[46]采用毛细管电泳-间接电化学发光方法(CE-ECL)对人体尿液中去甲肾上腺素、辛弗林和异丙肾上腺素进行检测,结果表明此方法辛弗林的定量限为8.8×10-8mol/ L,糖尿病人尿液中去甲肾上腺素含量高于健康人。
3.3 气相色谱技术(GC)检测
Ibrahim[10]早在1984年就用毛细管柱气相色谱-阴离子化学电离质谱法定量测定了新鲜柑橘汁中p-辛弗林和章鱼胺的含量。Marchei等[47]采用一种GC-MS方法快速简单地检测酸橙原料的固态和液态膳食补充剂中辛弗林含量,该方法验证了添加0.1~50 mg/mg的辛弗林,液态和固态膳食补充剂中辛弗林平均回收率范围89.3%~90.5%,检出限为0.1 mg/mg或mg/m L。Andrade等[48]采用强阳离子交换柱SPE纯化和环己酮衍生化得到p-辛弗林的恶唑烷酮衍生物,由核磁共振(1H和 13C NMR)、GC-FID、GC-MS等方法分析,结果表明,GC验证法的线性范围在125~500 mg/g之间,日间和日内精密度分别为3.60%和3.59%,平均回收率为78.1%±3.64%,该方法灵敏度因辛弗林恶唑烷酮的衍生化而大大提高。
3.4 薄层色谱扫描法(TLC)测定
薄层色谱扫描法是色谱法应用最早最广泛的方法之一,主要优点是仪器简单、操作方便。在实际工作中它仍是一种极有用的分离分析方法[6],但由于灵敏度差、分辨率低、重复性不佳、分离效果差等缺点目前应用较少。
3.5 其他检测方法
陆晓峰等[49]利用填充柱超临界流体色谱法(pSFC)测定了枳实中辛弗林的含量,测得辛弗林在0.71~11.36 mg 范围内呈良好的线性关系。这种方法简便、快速、重复性好,辛弗林分离度高,主要的缺点是成本高昂,不宜推广。
4 p-辛弗林的安全性评价
p-辛弗林结构与麻黄碱类似(见图2),麻黄碱因对心血管系统有严重的副作用,在2004年4月已经被美国FDA禁止加入到膳食补充剂中[8],随后有减肥功效且不含麻黄碱成分的膳食补充剂受到广大消费者喜爱,其中含p-辛弗林的柑橘属果实提取物保健产品和膳食补充剂得到推广。
但近年来,有研究认为酸橙提取物可能存在安全性隐患,不宜用于膳食补充剂中,主要因为p-辛弗林与麻黄碱、去甲肾上腺素等拟交感神经药物的结构类似,有可能会对中枢神经系统(CNS)产生刺激作用,影响血液动力学升高血压和心率[50-51]。在酸橙保健产品和膳食补充剂对心血管有副作用或其他不良作用的研究中发现,p-辛弗林或者酸橙提取物可能是致病原[52]。还有临床案例表明p-辛弗林有严重的副作用,包括严重外侧壁心肌梗塞症[53]、运动性晕厥、缺血性中风、各种心绞痛、缺血性结肠炎[54-56]、冠状痉挛和中风[57]、血管痉挛和中风[58]、ST段抬高的心肌梗死[59]、心室纤维性颤动[60]、运动性横纹肌溶解症等[61]。
而另一方面研究认为,酸橙提取物和辛弗林非常安全,这些原料不会直接引起副作用[62]。大多数的临床医学研究证明,酸橙提取物(p-辛弗林)无论单独使用还是与咖啡因或其他药物结合使用均未发现其对血压或心率有影响[63-64]。少数研究表明,添加p-辛弗林后,咖啡因产品会升高血压和心率[65]。更有一篇文章报道,在摄入含有酸橙提取物的产品后心脏收缩压与舒张压明显下降[66]。
综上所述,目前在柑橘属果实提取物安全性的研究中存在较大争议,需要进一步开展动物试验对柑橘属果实提取物的药理作用和安全性进行综合评价。
5 前景与展望
我国柑橘资源丰富,是世界柑橘主要起源中心和生产大国,年种植面积和产量均居世界第一位。皮渣作为其主要副产物,占柑橘总量的20%~40%,即年产柑橘皮渣超过1 000万t,其内含辛弗林5.5万t,加以利用便会产生巨大的经济效益。
辛弗林作为柑橘中主要活性成分和含量最高的生物碱,由于其结构和内源性神经递质的性质与肾上腺素和去甲肾上腺素相似,具有提高新陈代谢、增加热量消耗、提高能量水平、氧化脂肪、减肥的功效,在2004年美国FDA禁止在膳食补充剂中添加麻黄碱的背景下,辛弗林广泛应用于医药、食品、饮料等保健品行业,成为国内外学者的研究热点。在提取分离技术方面,微波辅助提取、超声辅助提取、超临界CO2萃取等较传统方法具有明显优势,但由于成本及提取稳定性等因素的限制,多集中在实验室小试阶段,工业化大规模生产难以实现。
根据辛弗林的极性、稳定性等,探索新的提取技术,改善提取效果,以期达到更加节能、经济、环保的目的。在检测技术方面,HPLC方法联合其他检测器或检测手段在柑橘属植物及其膳食补充剂制品p-辛弗林的检测中有着良好的应用前景。在安全性评价方面辛弗林尚存在争议,需进一步完善动物亚慢性毒性实验和慢性实验,为安全性评价提供更加全面的依据。同时,也可针对性的开展辛弗林结构修饰的定量构效关系研究,筛选出生理活性高但毒性较低的化合物为药物先导物供后续药理研究。目前,对于辛弗林的成分研究多集中在p-辛弗林,其他的两种同分异构体m-辛弗林、o-辛弗林的研究较少,系统性研究开发其他两种结构体的生物活性、相关产品将成为未来的研究重点。
[1] WHO. World and Health Organization,Obesity and overweight [EB/ OL]. http://www.who.int/ mediacentre/ factsheets/fs311/en/,2016.
[2] Allison D B,Fontaine K R,Manson J E,et al. Annual deaths attributable to obesity in the United States[J]. JAMA,1999,282(16):1530-1538.
[3] Fontaine K R,Bartlett S J,Barofsky I. Health-related quality of life among obese persons seeking and not currently seeking treatment[J]. Int J Eat Disord,2000,27(1):101-105.
[4] Penzak S R,Jann M W,Gold J A,et al. Seville(sour)orange juice:Synephrine content and cardiovascular effects in normotensive adults[J]. Journal of Clinical Pharmacology,2001,41(10):1059-1063.
[5] Hashimoto K,Yasuda T,Ohsawa K. Determination of synephrine from Chinese medicinal drugs originating from citrus species by ion-pair high-performance liquid chromatography[J]. J Chromatogr A,1992,623:386-389.
[6] 王国荣. 薄层扫描法测定酸橙枳实(壳)中辛弗林和N-甲基酪胺的含量[J]. 药物分析杂志,1994,14(4):48-50.
[7] Nagao T,Tanimura T. Distribution of biogenic amines in the cricket central nervous system[J]. Anal Biochem,1988,171:33-40.
[8] Lane C S,Katherine E S,Mary B S,et al. Determination of ephedrine alkaloids in dietary supplement standard reference materials[J]. Anal Chem,2005,77:3101-3112.
[9] 单 杨. 中国柑橘工业的现状、发展趋势与对策[J]. 中国食品学报,2008,8(1):1-8.
[10] Ibrahim K E,Couch M W,Williams C M. Quantitative measurement of octopamines and synephrines in urine using capillary column gas chromatography negative ion chemical ionization mass spectrometry[J]. Anal Chem,1984,56:1695-1699.
[11] Brown C M,M cGrath J C,M idgley J M,et al. Activities of octopamine and synephrine stereoisomers on alpha-adrendoreceptors[J]. British Journal of Pharmacology,1988, 93:417-429.
[12] Santana J,Sharpless K E,Nelson B C. Determination of parasynephrine and meta-synephrine positional isomers in bitter orangecontaining dietary supplements by LC/UV and LC/MS/MS[J]. Food Chemistry,2008,109:675-682.
[13] Wheaton T A,Stewart I. The distribution of tyramine, Nmethyltyramine,hordenine, octopamine, and synephrine in higher plants[J]. Lloydia,1970,33:244-254.
[14] Bent S,Padula A,Neuhaus J. Safety and efficacy of Citrus aurantium for weight loss[J]. American Journal of Cardiology,2004,94:1359-1361.
[15] Fugh B A,Myers A. Citrus aurantium, an ingredient of dietary supplements marketed for weight loss:current status of clinical and basic research[J]. Exp Biol Med,2004,229: 698-704.
[16] 张文娟,陶 缘,王亚军. 柑橘属中生物碱辛弗林生理活性的研究进展[J]. 食品工业科技,2013,34(22):331-334.
[17] Haaz S,Fontaine K R,Cutter G,et al. Citrus aurantium and synephrine alkaloids in the treatment of overweight and obesity: an update[J]. Obes ReV,2006,7:79-88.
[18] Onakpoya I,Davies L, Ernst E. Efficacy of herbal supplements containing Citrus aurantium and synephrine alkaloids for the management of overweight and obesity:a systematic review[J]. Focus on Alternative and Complementary Therapies,2011,16(4):254-260.
[19] Dragull K,Breksa A P,Cain B. Synephrine content of juice from satsuma mandarins (Citrus unshiu Marcovitch)[J]. J Agric Food Chem,2008,56:8874-8878.
[20] Pellati F,Benvenuti S,M elegari M. Enantioselective LC analysis of synephrine in natural products on a protein-based chiral stationary phase[J]. J Pharm Biomed Anal,2005,37:839-849.
[21] 吴崇珍,王莉莉. 枳实的提取工艺研究及质量分析[J]. 郑州大学学报(医学版),2004,39(5):765-767.
[22] 沈莲清,张 超. 个青皮中辛弗林两种提取分离方法的比较研究[J].食品与生物技术学报,2008,27(6):14-17.
[23] 蔡艳华,赵红卫,钟本和. 中药中生物碱的提取与分离[J]. 四川化工,2005,8(1):39-42.
[24] 李 俊,余丽娟,李 建. 阳离子树脂交换法提取辛弗林的工艺研究[J]. 现代化工,1998,(2):25-26.
[25] 肖荣国. 枳壳中生物碱提取工艺的正交试验研究[J]. 湖南中医学院学报,2005,25(6):27-28.
[26] 王 淳,刘振丽,宋志前,等. 中药枳实提取工艺研究[J]. 中国实验方剂学杂志,2008,14(9):23-25.
[27] 贺冬秀,何小珍,刘 璐. 陈皮中黄酮和辛弗林的不同提取方法优化比较[J]. 食品科技,2011,36(8):206-210.
[28] 陈志红,苗 兵,李剑敏. 微波强化提取枳实中辛弗林的工艺研究[J]. 应用化工,2008, 27(6):589-591.
[29] 张 璐,范杰平,曹 婧,等. 响应面法优化枳实中辛弗林的超声辅助提取工艺[J]. 食品科学,2011,32(14):1-5.
[30] Fan J P,Zhang L,Zhang X H,et al. M olecularly im printed polymers for selective extraction of synephrine from Aurantii Fructus Immaturus[J]. Anal Bioanal Chem,2012,402:1337-1346.
[31] 毛华荣,傅虹飞,王鲁峰,等. 不同柑橘品种生理落果中橙皮苷和辛弗林含量测定[J].食品科学,2009,30(14):223-226.
[32] 张良华,杜琪珍. 高速逆流色谱法纯化制备辛弗林[J]. 食品研究与开发,2008,29(6):45-47.
[33] 廖茂梁,尚海花,胡 静,等. 树脂分离纯化枳实中辛弗林的工艺研究[J]. 现代药物与临床,2011,26(2):129-133.
[34] 袁干军,李沛波. 大孔吸附树脂分离纯化枳实中辛弗林的研究[J].离子交换与吸附,2010,26(5):415-423.
[35] 李玉山. 枳实中有效成分的综合提取工艺研究[J]. 现代化工,2010,30(4):57-59.
[36] 蔡艳华. 枳实中生物碱辛弗林的提取分离研究[D]. 成都:四川大学,2005.
[37] 周鸣谦,王仁才. 超临界萃取柑橘落果中的辛弗林[J]. 中国食品学报,2013,13(3):78-83.
[38] Hashimoto K,Yasuda T,Ohsawa K. Determ ination of synephrine from Chinese medicinal drugs originating from citrus species by ion-pair HPLC[J]. J Chromatogr,1992,623:386- 389.
[39] Pellati F,Benvenuti S,Melegari M, et al. Determination of adrenergic agonists from extracts and herbal products of Citrus aurantium L. var. amara by LC[J]. J Pharm Biomed Anal,2002, 29:1113-1119.
[40] Putzbach K,Sharpless K E,Sander L C. Development and evaluation of a liquid chromatography electrospray ionization mass spectrometry method for determination of bitter orange alkaloids in dietary supplement standard reference materials[J]. Anal Bioanal Chem,2007,389:197-205.
[41] 任晶波,戴 敏,李 宁. 微乳液相色谱法对吴茱萸中辛弗林、吴萸碱与吴茱萸次碱含量的测定[J]. 分析测试学报,2011,30(5):562-565.
[42] Li Q,Huang C,Huang Y. Sensitive determination of synephrine by flow-injection chem iluminescence[J]. Luminescence,2006,21:43-48.
[43] Chen G,Zhang L,Zhao J,et al. Determination of hesperidin and synephrine in Pericarpium Citri Reticulatae by capillary electrophoresis with electrochemical detection[J]. Anal Bioanal Chem,2002,373:169-173.
[44] Takei H,Hirabuki M,Yoshizaki F. Analysis of synephrine in the peel of citrus fruit,immature citrus fruit and decoctions of Chinese medicinal prescriptions containing these crude drugs by capillary electrophoresis[J]. Anal Sci,1999,15:1017-1020.
[45] Avulal B,Khan A. Separation and determination of ephedrine enantiom ers and synephrine by high performance capillary electrophoresis in dietary supplements[J]. Chromatogr,2004,59:71-77.
[46] Liu Y M,Cao J T,Zheng Y L,et al. Sensitive determ ination of norepinephrine,synephrine, and isoproterenol by capillary electrophoresis with indirect electrochemiluminescence detection[J]. J Sep Sci,2008,31:2463-2469.
[47] M archei E,Pichini S,Pacifici R. A rapid and simple procedure for the determination of synephrine in dietary supplements by gas chromatography-mass spectrometry[J]. J Phar Biomed Anal,2006,41:1468-1472.
[48] Andrade A S,Schmitt G C,Rossato L G,et al. Gas chromatographic method for analysis of p-Synephrine in Citrus aurantium L. products[J]. Chromatogr Supplement,2009,69:225-229.
[49] 陆晓峰,王如健,彭国平,等. 填充柱超临界流体色谱法测定枳实中辛弗林的含量[J].辽宁中医杂志,2006,33(2):222-223.
[50] M cGuffin M. Media spins numbers on bitter orange AERs based on erroneous information from FDA: review finds all but one “report”associated with ephedrine or caffeine[J]. HerbalGram,2006,1:52-55.
[51] Bui L T,Nguyen D T,Ambrose P J. Blood pressure and heart rate effects follow ing a single dose of bitter orange[J]. Ann Pharmacother,2006,40:53-57.
[52] Stohs S J. A review and assessment of the FDA adverse events reports and clinical case reports between April 2004 and October 2009[J]. J Funct Foods,2010,2:235-238.
[53] Nykamp D L,Fackih M N,Compton A L. Possible association of acute lateral-wall myocardial infarction and bitter orange supplement[J]. Ann Pharmacother,2004,38:812-816.
[54] Nasir J M,Durning S J,Ferguson M,et al. Exercise-induced syncope associated with QT prolongation and ephedra-free xenadrine[J]. Mayo Clinic Proc,2004,79:1059-1062.
[55] Bouchard N C,How land M A,Greller H A,et al. Ischemic stroke associated with use of an ephedra-free dietary supplement containing synephrine[J]. M ayo Clin Proc,2005,80:541-545.
[56] Gange C A,Madias C,Felix Gretzik E M,et al. Variant angina associated with bitter orange in a dietary supplement[J]. Mayo Clinic Proc,2006,81:545-548.
[57] Smedema J P,Muller G J. Coronary spasm and thrombosis in a bodybuilder using a nutritional supplement containing synephrine,octopam ine, tyramine and caffeine[J]. S A fr Med J, 2008,98:372-373.
[58] Holmes J R O,Tavee J. Vasospasm and stroke attributable to ephedrafree xenadrine: case study[J]. M il Med,2008,173:708-710.
[59] Thomas J E,Munir J A,McIntyre P Z,et al. STEM I in a 24-yearold man after use of a synephrine-containing dietary supplement. A case report and review of the literature[J]. Texas Heart Inst J,2009,36:586-590.
[60] Stephensen T A,Sarlay J R. Ventricular fibrillation associated with use of synephrine containing dietary supplement[J]. M il Med,2009,174:1313-1319.
[61] Burke J,Seda G,Allen D,et al. A case of severe exercise-induced rhabdomyolysis associated with a weightloss dietary supplement[J]. M il Med,2007,172:656-658.
[62] Sidney J S,Harry G P,Mohd S. The Safety of Citrus aurantium (Bitter Orange)and its Primary Protoalkaloid p-Synephrine[J]. Phytother Res,2011,25:1421-1428.
[63] Colker C M,Kalman D S,Torina G C,et al. Effects of Citrus aurantium extract,caffeine and St John's wort on body fat loss,lipid levels and mood states in normal weight and obese individuals[J]. Curr Ther Res,1999,60:145-153.
[64] Seifert J G,Nelson A,Devonish J,et al. Effect of acute adm inistration of an herbal preparation on blood pressure and heart rate in humans[J]. Int J Med Sci,2011,8:192-197.
[65] Bui L T,Nguyen D T,Ambrose P J. Blood pressure and heart rate effects follow ing a single dose of bitter orange[J]. Ann Pharmacother,2006,40:53-57.
[66] Oben J,Enonchong E,Kothari S,et al. Phellodendron and Citrus extracts benefit cardiovascular health in osteoarthritis patients: a doubleblind, placebocontrolled pilot study[J]. Nutr J,2008,7:16-21.
(责任编辑:成 平)
Research Progress of Citrus A lkaloid Synephrine
LIU Wei1,2,YUAN Hong-yan1,ZHANG Qun1,SU Dong-lin1,SHAN Yang1
(1. Hunan Agricultural Product Processing Institute, Hunan Academy of Agricultural Sciences, Changsha 410125, PRC;2. Longping Branch Graduate School, Central South University, Changsha 410125, PRC)
Synephrine is the main active ingredient and the highest alkaloid content in citrus, it provides with the increase of metabolism,increase energy consumption, improve energy levels, oxidation of fat, weight loss eff cacy, it has been w idely used in medicine, food,beverage and other health products industry. The paper summarized the structure and function of synephrine properties, extraction and purif cation, detection techniques and methods, safety evaluation and other aspects of the research progress at home and abroad, in order to provide new ideas and theoretical reference for the development and utilization of synephrine.
citrus; alkaloids; synephrine; extraction and purif cation; safety
R284
A
1006-060X(2016)09-0101-06
10.16498/j.cnki.hnnykx.2016.09.028
2016-07-18
湖南省自然科学联合培养基金项目(14JJ6066);国家科技支撑计划项目(2012BAD31B02)
刘 伟(1983-),男,陕西宝鸡市人,助理研究员,主要从事农产品精深加工研究。
单 杨

