大肠癌患者血清中硫氧还蛋白样蛋白—2表达水平及临床意义
陈细女
【摘要】目的:探讨大肠癌患者血清中硫氧还蛋白样蛋白-2(Txl-2)的表达及临床意义。方法:采用酶联免疫吸附法(ELISA)检测82例大肠癌患者和25例健康对照者外周静脉血清中Txl-2含量。结果:大肠癌患者血清中Txl-2含量明显高于健康对照者(P<0.05);血清中Txl-2表达与大肠癌肿瘤分化程度、Dukes分期、淋巴结及远处器官转移、3年内复发情况密切相关,而与患者性别、年龄及肿瘤大小无明显联系(P>0.05)。结论:Txl-2表达与大肠癌生物学行为存在联系,与大肠癌病情变化及预后密切相关(P<0.05),检测血清中Txl-2的表达水平对于大肠癌的诊断、恶性程度及预后判断具有良好的临床应用价值。
【关键词】 大肠癌;血清Txl-2;酶联免疫吸附法
【中图分类号】R446.11 【文献标志码】 A 【文章编号】1007-8517(2016)16-0093-03
Abstract:Objective To investigate the serum of patients with colorectal thioredoxin-like protein -2 (Txl-2) expression and clinical significance. Methods Using enzyme-linked immunosorbent assay (ELISA) to detect 82 cases of colorectal cancer patients and 25 healthy controls peripheral vein serum Txl-2 content. Results The serum of patients with colorectal Txl-2 were significantly higher than healthy controls (P<0.05); Txl-2 expression in serum and tumor differentiation degree of colorectal cancer, Dukes stage, lymph node and distant metastasis, recurrence within 3 years They are closely related(P<0.05), but not with sex, age and tumor size had no significant contact (P>0.05). Conclusion Txl-2 expression and the biological behavior of colorectal cancer there is a link, is closely related to changes in condition and prognosis of colorectal cancer, the expression levels of serum Txl-2 for diagnosis, degree of malignancy and prognosis of colorectal cancer have a good clinical application value.
Keywords:Colorectal Cancer; Serum Txl-2; ELISA
结肠癌为全球高发的恶性肿瘤,发病危险因素主要包括肥胖、吸烟、运动量少和膳食中缺乏蔬果等,西方发达国家如欧洲和北美是大肠癌高发地区,大肠癌在欧美国家位居致死恶性肿瘤第二位[1-2]。在我国,大肠癌发病率也呈现逐渐上升的趋势,筛选和鉴定大肠癌敏感标志物,对于早期诊断和准确判断预后具有重要意义[3]。硫氧还蛋白样蛋白2(Thioredoxin-like protein 2, Txl-2)是同时属于硫氧还蛋白家族和核苷二磷酸激酶家族成员的蛋白[4],有研究报道Txl-2在大肠癌组织中存在高表达,且促进大肠癌的恶性进展,调控结肠癌细胞增殖、侵袭和凋亡抵抗等多种恶性生物学行为[5],但Txl-2在大肠癌患者血清中的表达情况及其与临床特征间的关系尚未见明确报道。本研究则通过检测大肠癌患者外周血中Txl-2的表达水平,分析其表达与大肠癌患者临床病理参数的关系,探讨其在大肠癌诊断及预后中的作用。
1 资料与方法
1.1 一般资料 选取2010年11月至2014年2月82例经病理学检查确诊为大肠癌的患者进入本研究,其中男性49例,女性33例;>60岁45例,≤60岁37例;肿瘤直径>4cm 38例,≤4cm 44例;高分化8例,中分化53例,低分化21例;Dukes分期:A+B期40例,C+D期42例;有淋巴结转移者45例,无淋巴结转移者37例;有远处器官转移者33例,未见远处器官转移者49例;术后复查患者29例,其中3年内复发者16例,未复发者13例。选择25例健康体检者作为对照组。所有患者术前均未接受化疗和放疗,患者及健康对照组均签署知情同意书。患者一般资料差异无统计学意义(P>0.05),具有可比性。
1.2 检测方法 采集试验对象外周静脉血3mL,自然凝固后,3000rpm 离心5min,收集上层血清置-20℃储存备用。Txl-2 ELISA检测试剂盒购自上海联世生物科技有限公司,具体检测方法按试剂盒说明书进行。
1.3 统计学分析 用SPSS 19.0软件进行统计分析,计量资料以均数加减标准差(x[TX-*3]±s)表示,组间比较采用t检验,以P<0.05为差异具有统计学意义。
2 结果
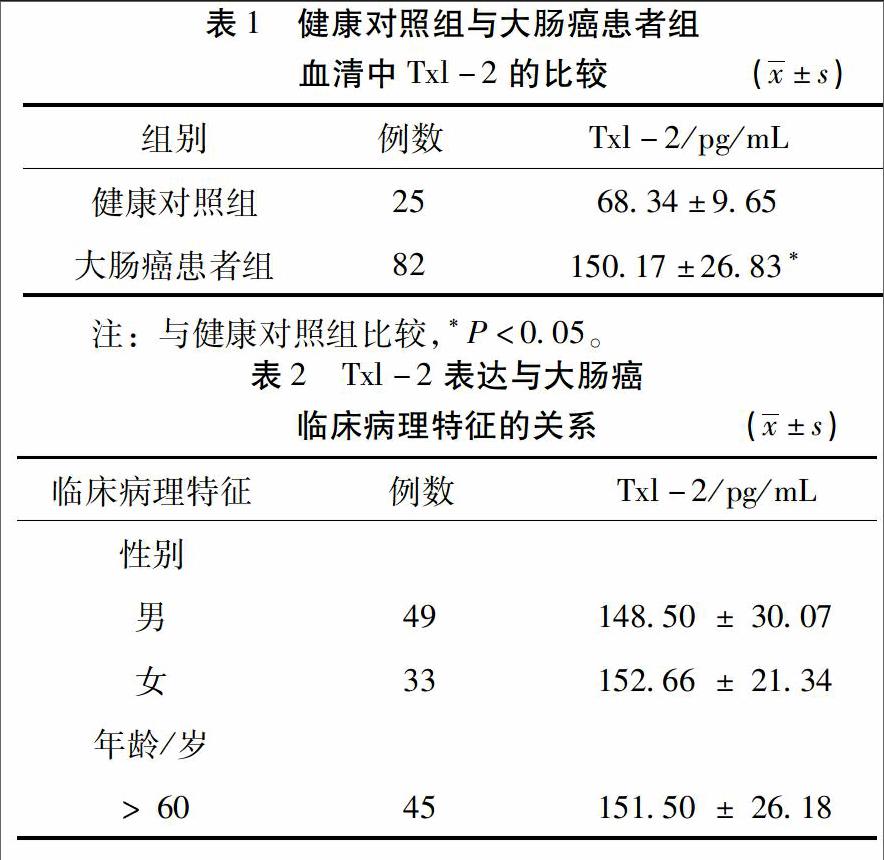
2.1 健康对照组与大肠癌患者组血清中Txl-2的表达差异 采用ELISA方法对健康对照者和大肠癌患者血清中Txl-2含量进行检测,Txl-2在大肠癌患者组血清中表达为(150.17±26.83)pg/mL,明显高于健康对照者血清中含量(68.34±9.65)pg/mL,差异具有统计学意义(P<0.05)。见表1。
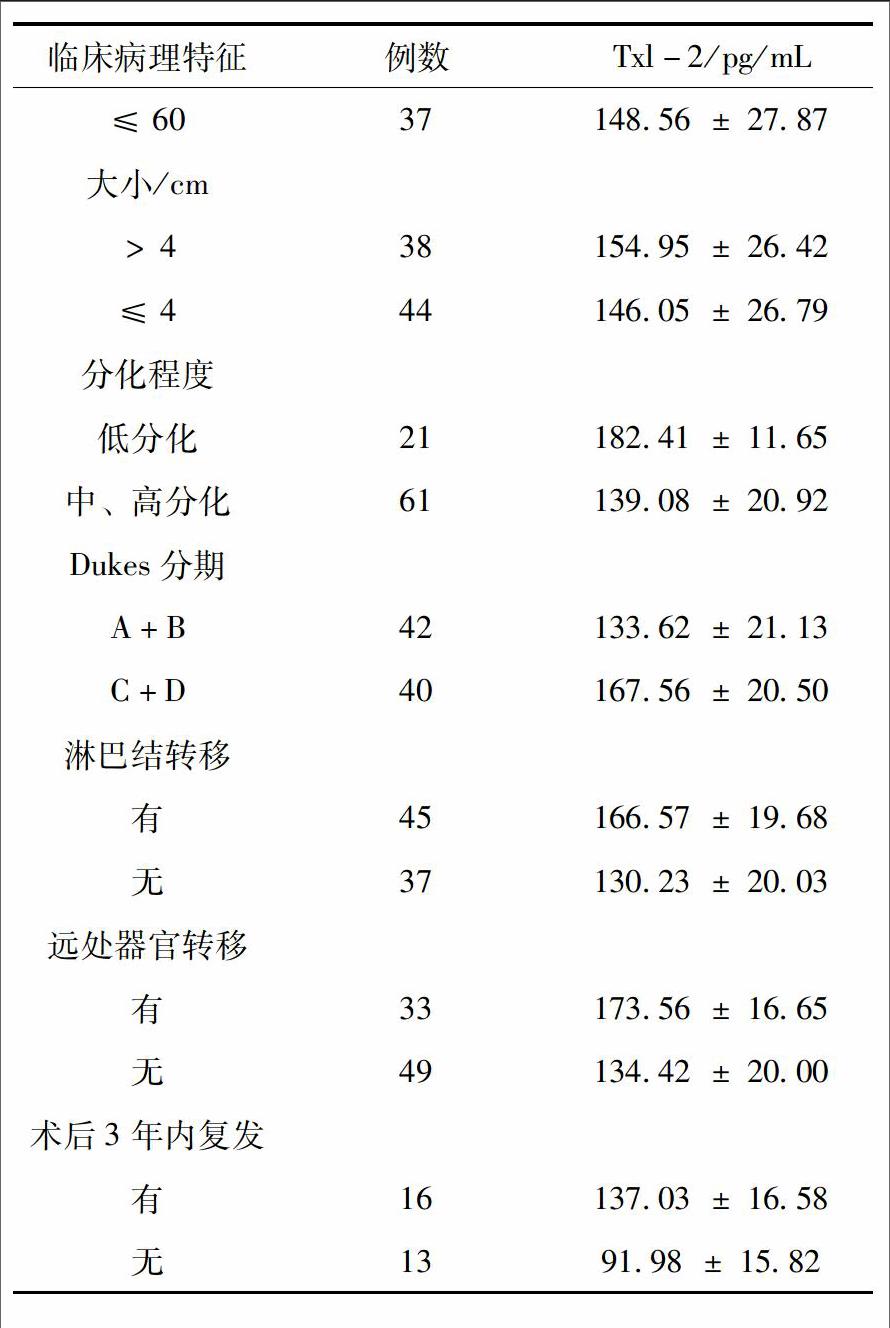
2.2 Txl-2表达与大肠癌临床病理特征的关系 Txl-2在大肠癌患者血清中的表达水平与患者性别、年龄及肿瘤大小均无明显相关(P>0.05);低分化大肠癌患者和Dukes C+D期患者血清中Txl-2的表达分别为(182.41 ± 11.65)pg/mL和(167.56±20.50)pg/mL,显著高于中、高分化组(139.08±20.92)pg/mL及Dukes A+B组(133.62 ± 21.13)pg/mL,Txl-2在有淋巴结和远处器官转移组大肠癌患者血清中的表达均高于无淋巴结和远处器官转移者(P<0.05);另外,术后复查患者中,3年内有复发者血清中Txl-2的表达水平高于无复发者,差异具有统计学意义(P<0.05)。
3 讨论
Txl-2在2003年被首次报道[4],全长编码330个氨基酸,N端有一个硫氧还蛋白(Thioredoxin,Trx)结构域,为硫氧还蛋白家族的新成员,Trx系统与谷胱甘肽系统一起,将生物体内众多蛋白质半胱氨酸残基保持在还原状态,是细胞内重要的氧化还原调节系统[6],同时,Trx家族参与多种肿瘤恶性生物学行为,Moon等的研究表明,Trx-1可促进结肠癌细胞生长,在结肠癌细胞HT-29中抑制Trx-1的表达可导致细胞周期阻滞,从而抑制细胞增殖[7],Ramanathan 等的研究结果显示,PX-12作为Trx-1的抑制剂,已进入临床Ⅱ期研究,与化疗联合用于治疗实体瘤患者,具有良好的应用前景[8];Trx家族成员还可以参与黏附分子和整合素相关的信号通路,促进肿瘤细胞增殖、侵袭,在肿瘤的发生发展中有重要作用[9]。Txl-2的C末端有一个核苷二磷酸激酶(Nucleoside diphosphate kinase,NDPK)结构域,为nm23家族的新成员。目前nm23家族在细胞发育中的作用尚未完全清楚,但是其在肿瘤中的作用却被广泛关注,nm23-H1可促进神经母细胞瘤、胰腺癌等的转移,并且与肿瘤的分期密切相关[10-12],nm23-H2则是潜在的肝细胞癌致癌因子[13]。另外,Qu等的研究报道表明,Txl-2可通过氧化还原平衡及NF-kB信号通路调控肿瘤细胞的增殖和转移[14],构建Txl-2 siRNA载体,稳定转染入SW620细胞,获得Txl-2表达抑制的细胞株;对其功能学进行研究发现,下调Txl-2的表达能够显著抑制结肠癌细胞的无限增殖、凋亡抵抗和侵袭转移等恶性表型 [15] 。
本研究结果显示,大肠癌患者血清中Txl-2表达为(150.17±26.83)pg/mL,其表达水平明显高于健康对照者血清中含量(68.34±9.65)pg/mL(P<0.05),而且,Txl-2在低分化组患者血清中的表达显著高于中、高分化组(P<0.05),说明Txl-2与大肠癌的恶性程度呈现正相关;Dukes A+B期和Dukes C+D期患者血清中Txl-2表达分别为(133.62±21.13)pg/mL和(167.56±20.50)pg/mL,差异有统计学意义(P<0.05),表明随着大肠癌临床分期的进展,Txl-2表达逐渐升高,Txl-2可能参与了大肠癌的发展。伴淋巴结转移及远处器官转移患者血清中Txl-2分别为(166.57±19.68)pg/mL和(173.56±16.65)pg/mL,均高于无淋巴结及远处器官转移患者(130.23±20.03)pg/mL和(134.42±20.00)pg/mL,(P<0.05)。而这些结果提示,Txl-2参与了结肠癌的发展,可能在肿瘤生长、侵袭转移方面发挥重要作用。对术后复查患者血清中Txl-2进行检测,复查患者血清中Txl-2水平与术前相比有所下降,且3年内无复发者血清中Txl-2表达较有复发者也存在降低趋势(P<0.05),同时,对大肠癌患者血清中Txl-2的表达与临床病理特征的分析比较与组织中的检测结果相一致[4]。
本研究结果表明,Txl-2在大肠癌患者血清中呈现高表达,其表达水平与患者体内肿瘤负荷程度密切相关,在治疗过程中,测定Txl-2水平有助于对大肠癌患者进行疗效评定、肿瘤复发监测和预后判断,同时也为大肠癌的靶向治疗提供新的思路和理论依据。
参考文献
[1]Center MM, Jemal A, Smith RA, et al. Worldwide variations in colorectal cancer [J]. CA Cancer J Clin, 2009, 59 (6):366-378.
[2] Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2007 [J]. CA Cancer J Clin, 2007,57:43-66.
[3] Deschoolmeester V, Baay M, Specenier P, et al. A review of the most promising biomarkers in colorectal cancer: one step closer to targeted therapy [J]. Oncologist, 2010, 15: 699-731.
[4] Sadek CM, Jiménez A, Damdimopoulos AE, et al. Characterization of human thioredoxin-like 2. A novel microtubule-binding thioredoxin expressed predominantly in the cilia of lung airway epithelium and spermatid manchette and axoneme [J]. J Biol Chem, 2003,278(15):13133-13142.
[5] 卢瑗瑗. 结直肠癌相关抗原MC3-Ag的鉴定和功能研究[D]. 西安:第四军医大学,2011.
[6] Lillig CH, Holmgren A. Thioredoxin and related molecules--from biology to health and disease[J]. Antioxid Redox Signal, 2007,9(1):25-47.
[7] Moon MS, Kim JS, Kim TL, et al. Polyamine depletion partially reduces the radiation induced cell death via cell cycle delay mediated by thioredoxin[J]. Cell Biol Toxicol, 2006,22:137-147.
[8] Ramanathan RK, Abbruzzese J, Dragovich T, et al. A randomized phase II study of PX-12, an inhibitor of thioredoxin in patients with advanced cancer of the pancreas following progression after a gemcitabine-containing combination[J]. Cancer Chemother Pharmacol, 2011,67(3):503-509.
[9] Yamawaki H, Pan S, Lee RT, et al. Fluid shear stress inhibits vascular inflammation by decreasing thioredoxin-interacting protein in endothelial cells[J]. J Clin Invest, 2005,115(3):733-738.
[10]Roymans D, Willems R, Van Blockstaele DR, et al. Nucleoside diphosphate kinase (NDPK/NM23) and the waltz with multiple partners: possible consequences in tumor metastasis[J]. Clin Exp Metastasis, 2002,19(6):465-476.
[11] Hailat N, Keim DR, Melhem RF, et al. High levels of p19/nm23 protein in neuroblastoma are associated with advanced stage disease and with N-myc gene amplification[J]. J Clin Invest, 1991,88(1):341-345.
[12] Conery AR, Sever S and Harlow E. Nucleoside diphosphate kinase Nm23-H1 regulates chromosomal stability by activating the GTPase dynamin during cytokinesis[J]. Proc Natl Acad Sci U S A, 2010, 107: 15461-15466.
[13] Lee MJ, Xu DY, Li H,et al. Pro-oncogenic potential of NM23-H2 in hepatocellular carcinoma[J]. Exp Mol Med, 2012, 44: 214-224.
[14] Qu Y, Wang J, Ray PS,et al. Thioredoxin-like 2 regulateshuman cancer cell growth and metastasis via redox homeostasisandNF-kappaB signaling[J]. J Clin Invest, 2011, 121: 212-225.
[15] Lu Y, Zhao X, Li K , et al. Thioredoxin-like protein 2 is overexpressed in colon cancer and promotes cancer cell metastasis by interaction with Ran[J]. Antioxid Redox Signal, 2013, 19(9):899-911.
(编辑:程鹏飞)

