土壤浸提液中硝酸盐氮氧同位素组成的反硝化细菌法测定
徐春英,李玉中,李巧珍,毛丽丽,林 伟,强晓晶,郑 欠
(中国农业科学院农业环境与可持续发展研究所/农业部旱作节水农业重点开放实验室,北京 100081)
土壤浸提液中硝酸盐氮氧同位素组成的反硝化细菌法测定
徐春英,李玉中*,李巧珍,毛丽丽,林伟,强晓晶,郑欠
(中国农业科学院农业环境与可持续发展研究所/农业部旱作节水农业重点开放实验室,北京 100081)
本研究优化了采用反硝化细菌法同时测定土壤浸提液中硝酸盐氮氧同位素组成的方法。在已有研究结果的基础上,通过采用5000~8000 r·min-1的转速离心、高纯氮气吹扫1 h、减少加样量及改造仪器自动进样器等措施对已发表方法进行了优化。对国际标准样品USGS34的分析表明,0.1~0.8 μg-N样品量即可以得到较稳定、准确的测定值和校正值;同一时间内制备的硝酸盐δ15N的SD介于0.05‰~0.09‰之间,δ18O的SD介于0.28‰~0.48‰之间;在三个月之内δ15N和δ18O的测定值基本一致,表明该方法具有较好的准确度、精密度和稳定性。通过研究浸提剂、保存条件以及加热对测定土壤浸提液中硝酸盐氮氧同位素组成的影响,结果表明:常用的去离子水、KCl、CaCl2可能都含有微量的硝酸盐,随着加样量增大,浸提剂中含有的硝酸盐可能就会影响δ15N和δ18O的测定;对于土壤硝酸盐的浸提液,冷冻保存效果较好,保证了土壤硝酸盐氮氧同位素的准确性和稳定性;尽管加热对硝酸盐标准样品USGS34和IAEA-NO3的δ15N没有显著影响,但δ18O显著升高,说明加热易引起氧同位素分馏;而土壤硝酸盐浸提液样品加热前后的δ15N和δ18O的测定值没有显著变化,因此为避免产生氧同位素分馏和节省测试时间,建议同时测定土壤浸提液硝酸盐δ15N 和δ18O时直接和反硝化细菌反应。应用本方法对不同肥料处理田间土壤浸提液硝酸盐的氮氧同位素组成进行了测定。
反硝化细菌法;土壤浸提液;硝酸盐;氮氧同位素组成
徐春英,李玉中,李巧珍,等.土壤浸提液中硝酸盐氮氧同位素组成的反硝化细菌法测定[J].农业环境科学学报,2016,35(9):1829-1836.
XU Chun-ying,LI Yu-zhong,LI Qiao-zhen,et al.Determination of15N and18O isotope abundance in the extractable soil nitrate by the denitrifier method[J]. Journal of Agro-Environment Science,2016,35(9):1829-1836.
我国农业生产中存在氮肥过量施用现象,这不仅造成氮肥利用率低,经济效益下降,而且长期过量施用氮肥会造成土壤氮素严重冗余[1-3]。土壤氮素形成的硝态氮极易通过淋溶作用进入水体,造成地表水富营养化、地下水的硝酸盐含量超标[4-8]及温室气体N2O排放[9]等问题。硝态氮是土壤氮循环及迁移转化过程的中心形态,已有研究表明硝态氮中的氮、氧同位素组成是识别其来源和主要氮循环过程的有用工具[10-11]。
国内硝酸盐氮氧同位素组成的同时分析主要前处理方法为离子交换树脂法和反硝化细菌法。尽管离子交换树脂法是收集和富集的一个重要发展[12],但是运用该方法分析硝酸盐氮氧同位素组成需要将样品富集、洗脱、中和过量的Cl-、冷冻干燥等,操作步骤繁琐,费时费力;另外,需要用到离子交换树脂、滤膜、Ag2O等耗材和试剂,前处理的费用很高,这也成为该方法使用的一个限制因子[13]。反硝化细菌法是近几年硝酸盐氮氧同位素测试技术的重要进展,最早由美国普林斯顿大学的Sigman等[14]提出用于海水和淡水的硝酸盐氮同位素自然丰度测定。该方法由自然存在的缺乏N2O还原酶的反硝化细菌将水中转化为N2O,再由质谱仪测定N2O气体的氮氧同位素组成,从而得到硝酸盐的氮氧同位素组成[14-15]。与离子交换树脂法相比,反硝化细菌法具有许多优点:(1)所需样品量低,该方法可同时分析浓度低至μg·L-1的硝酸盐氮氧同位素组成,同时也由于降低了样品量而降低了样品的空白,测试结果准确;(2)可在常温常压下进行,不受有机氮及其他离子的影响;(3)样品预处理简单,并且氮氧同位素可同时分析,分析时间明显缩短,测试成本也极大降低。反硝化细菌法的诸多优点,已成为目前国际上先进的硝酸盐氮氧同位素组成测试技术[16-18]。
国外研究者已经应用反硝化细菌法对土壤浸提液的硝酸盐氮氧同位素进行测定[19-21],并用于土壤硝酸盐溯源与氮转化过程研究[21];相比而言,国内土壤中硝态氮氮氧同位素自然丰度运用较少,尤其是氧同位素应用更少,其主要原因是缺乏合适有效的分析方法。尽管国内已经报道了反硝化细菌法测定水体硝酸盐氮氧同位素方法[22-24],但是用于土壤浸提液硝酸盐氮氧同位素分析的相关文献较少。本文在前期研究结果[23]的基础上进行了一些技术改进,使反硝化细菌法不但可以用于水体硝酸盐氮氧同位素的同时测定,而且适于土壤浸提液中硝酸盐氮氧同位素的同时测定。该方法的完善,有助于促进该方法在国内的推广和应用,从而加强土壤氮循环和迁移转化过程的研究。
1 材料与方法
1.1仪器
同位素比质谱仪Deltaplus(Thermo-Finnigan,美国),连接有PreCon痕量气体预浓缩装置(Thermo,美国),CTC-Combi PAL自动进样器(瑞士CTC Analytics AG),高速离心机(HITACHI,himac CR21G,High-Speed Refrigerated Centrifuge,日本HITACHI公司),氮气吹扫仪(美国Organomation公司),高压灭菌锅(日本SANYO公司),流动注射分析仪(Lachant QC8000,美国Lachant公司)。
1.2试剂
胰蛋白大豆琼脂培养基、胰蛋白胨大豆肉汤(美国BD公司),试剂(NH4)2SO4、K3PO4、KCl、KNO3(分析纯,国药集团化学试剂有限公司),CaCl2(分析纯,西陇化工股份有限公司)、H3PO4(优级纯,国药集团化学试剂有限公司),磺胺(美国Sigma公司),N-(1-萘基)乙二胺二盐酸盐(优级纯,国药集团化学试剂有限公司),国际同位素标准样品:USGS32、USGS34、USGS35(购自美国USGS),IAEA-NO3(购自IAEA)。
1.3溶液的配制
1.4实验方法
1.4.1菌株的培养
选用缺乏N2O还原酶活性的反硝化细菌,即致金色假单胞菌P.aureofaciens(ATCC13985,Pseudomonas aureofaciens购自美国农业部菌种保存中心),将该菌株接种并培养7 d待用。
称取10 g新鲜土壤样品,加入50 mL 2 mol·L-1的KCl溶液,振荡1 h,悬液静置3~5 min后过滤。取15 mL滤液上流动注射分析仪(Lachant QC8000)测定土壤硝态氮浓度。
将培养7 d的菌液在高速离心机5000~8000 r· min-1的转速下,18℃离心20 min,倒出上层清液,剩余菌体用无的TSB-B培养液悬浮,并浓缩成2倍浓度的菌液,然后加入几滴止泡剂。吸取2~3 mL浓缩菌液注入容积为20 mL的钳口顶空瓶后,用高纯氮气(流速为30~40 mL·min-1)吹扫1~3 h,然后用气密性注射器将0.4~3.5 μg的样品注入顶空瓶充分混匀,为避免瓶内压力过高,加样体积一般小于4 mL,最后将顶空瓶倒置放入恒温箱中26℃过夜培养。次日注入0.15 mL浓度为10 mol·L-1的NaOH,裂解细菌并终止反应,同时吸收产生的CO2。
1.4.4N2O氮氧同位素测定
采用PreCon痕量气体预浓缩装置、同位素比质谱仪(IRMS,Deltaplus)测定反硝化细菌反应产生的N2O气体氮氧同位素,PreCon配有CTC-Combi PAL自动进样器。载气为高纯氦气,流量为50~60mL·min-1,参考标准气体为校正过的99.9%N2O气体。通过CTC-Combi PAL自动进样器将顶空瓶中N2O气体输送至PreCon,经PreCon浓缩和捕集N2O气体,最后由同位素比质谱仪同时测定氮氧同位素组成。
1.4.5氮氧同位素测试结果的校正


氮同位素校正方程如下:

氧同位素校正方程如下:

根据以上标准样品的真实值(T)和测定值(M,meas),计算出m和b,得到校正方程,根据测定值和校正方程计算出样品的真实值。
1.5统计分析
所得数据采用SPSS20.0统计软件进行显著性分析。
2 结果与讨论
2.1实验过程优化
2.1.1离心转速
在初期的试验中[23],采用30 000 r·min-1的超高速离心,该步骤对于普通实验室较难操作,本实验中分别采用了3000、5000、8000 r·min-1的转速离心20 min进行菌液浓缩,对比各自上清液的OD600值发现,离心转速为3000 r·min-1时OD600值要显著高于5000 r·min-1和8000 r·min-1(表1),而5000 r·min-1和8000 r·min-1没有显著差异,这说明离心转速为5000 r·min-1时已经基本将所有的菌体离心沉淀,并且浓缩后菌量也满足后续试验要求,因此,菌液浓缩采用5000~8000 r·min-1转速离心均可,这对于普通实验室较易实现。
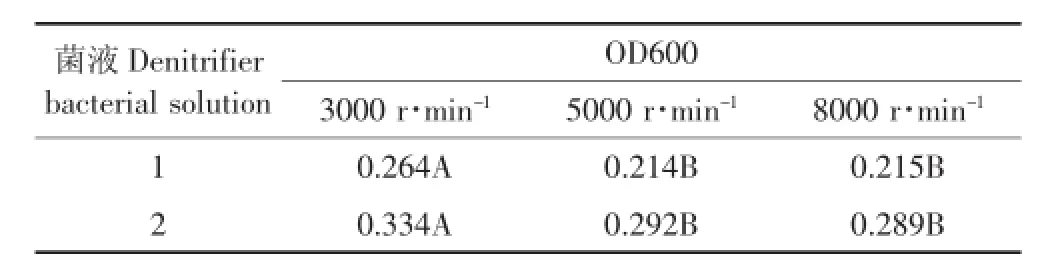
表1 离心转速对菌液OD600值的影响Table 1 Effect of centrifugal rotational speed on OD600 value for denitrifier bacterial solution
2.1.2吹扫时间


表2 不同吹扫时间对USGS34标样氮氧同位素实测值的影响(n=5)Table 2 Effect of purging time on δ15N and δ18O measured values in USGS34(n=5)
2.1.3自动进样系统的优化
在初期的试验中[23],TraceGas标准配置是Gilson自动进样器和容量为12 mL的样品瓶,但是该样品瓶不能直接作为反硝化细菌和样品的反应瓶,需要抽取2 mL反硝化产生的N2O气体注入到预抽真空的12 mL样品瓶中才能进行测定。本研究改用连接CTCCombi PAL自动进样器,通过设置仪器自动进样器参数及改造样品盘,采用20 mL的顶空钳口瓶进行反硝化反应,同时根据样品浓度加入0.4~3.5 μg,为避免瓶内产生过高的压力,加样体积应尽量小于4 mL,这个加样量低于前期试验样品量[23],更明显低于传统离线方式同位素测试所需6~20 μg的样品量[22]。这样采用20 mL的顶空钳口瓶可以反硝化反应后直接进样,无需将N2O气体另外进行转移[22-23],从而避免了因N2O气体转移而可能产生的同位素分馏及实验误差。
2.1.4进样量
为确定PreCon分析系统结合同位素比质谱仪合适的进样量,本研究考察了不同进样量下标准样品USGS34的硝酸盐氮氧同位素值(表3)。从表3结果可以看出,在0.1~0.8 μg-N样品量之间,PreCon预浓缩分析系统结合同位素比质谱仪分析,测定结果没有显著性差异,均能得到较稳定、准确的测定值和校正值,比传统离线方式同位素测试所需1.4~4.5 μg-N的样品量要低很多[14]。本研究推荐一般用量为0.2~0.4 μg-N。
2.2准确度、精密度、稳定性
表4对不同制备时间获得的USGS34的δ15N和δ18O实测值进行了比较。结果发现,δ15N和δ18O值非常稳定,从2014年9月12日—2015年3月16日测定的15N值非常接近,位于-2.32‰~-2.39‰之间;而δ18O测定值稳定性稍差一些,测定值位于-23.96‰~-24.23‰之间,测定值之间也没有显著差异,以上结果表明,在6个月内反硝化细菌法同时测定硝酸盐的δ15N和δ18O是准确的、稳定的、可行的。同样从表4可以看出,同一制备时间的5个平行样品之间δ15N的SD介于0.05‰~0.09‰之间,δ18O的SD介于0.28‰~0.48‰之间,均低于USGS34给定的δ15N和δ18O的标准偏差(σδ15N≤0.2‰,σδ18O≤0.6‰),表明该方法的准确度、精密度、稳定性较好。

表4 不同制备时间USGS34氮氧同位素比值测定的准确度、精密度、稳定性(n=5)Table 4 Precision and stability of δ15N and δ18O in USGS34 under different date of sample preparation(n=5)
表3 不同硝态氮进样量下δ15N和δ18O值(USGS34)(n=5)Table 3 Raw values of δ15N and δ18O of USGS34 solution with different amount of-N(n=5)

表3 不同硝态氮进样量下δ15N和δ18O值(USGS34)(n=5)Table 3 Raw values of δ15N and δ18O of USGS34 solution with different amount of-N(n=5)
δ15N/‰标准样品Nitrate standards加样量Amount of N/μg δ18O/‰实测值Raw values±SD/‰校正值Corrected values±SD/‰真实值True values±SD/‰实测值Raw values±SD/‰校正值Corrected values±SD/‰真实值True values±SD/‰0.1 -2.34±0.15 -1.85±0.15 USGS34 -23.81±0.30 -27.87±0.33 0.2 -2.30±0.07 -1.81±0.08 -23.96±0.40 -27.65±0.42 0.4 -2.26±0.07 -1.75±0.08 -23.98±0.25 -27.89±0.28 0.8 -2.36±0.04 -1.82±0.04 -24.01±0.31 -27.89±0.33 -1.80±0.2-27.9±0.6
但是需要指出的是,不同样品制备时间测定的氮氧同位素值仍然有差异,这可能主要与不同批次反应菌株的差异有关[15]。为减少此类误差,本研究建议尽量采用新活化或者转接代数较少的菌株进行反硝化反应。
2.3浸提剂对土壤硝酸盐氮氧同位素值的影响
目前国内较多采用2 mol·L-1KCl或者0.01 mol· L-1CaCl2溶液来浸提土壤中的硝酸盐,已有研究发现该两种浸提剂对土壤中硝酸盐的测定结果并无显著差异[25]。由于不同生产厂商及不同批次的去离子水、KCl以及CaCl2可能质量不同,难以保证研究人员采用的浸提剂和标准溶液的配置采用的试剂质量完全一致,因此,本研究比较了有代表性的去离子水(H2O)、2 mol·L-1KCl及0.01 mol·L-1CaCl2作为样品加入反硝化菌液后产生的N2O的丰度和面积,以此来探究浸提剂是否影响土壤浸提液中硝酸盐氮氧同位素值的测定(表5)。从表5可以看出,本研究所用的0.01 mol·L-1CaCl2中可以检测出微量硝酸盐,而去离子水(H2O)和2 mol·L-1KCl中未检出硝酸盐。PreCon结合同位素质谱仪进一步检测反应产生的N2O发现,无论是吹扫后的空白反硝化细菌菌液、去离子水(H2O)还是2 mol·L-1KCl和0.01 mol·L-1CaCl2都能检测到一个N2O峰,14N14N16O的丰度空白最低,面积也是空白最小。在本实验室通常的0.15 mL的加样量下,各个处理之间丰度和面积没有显著差异,但是随加样量增加一倍(0.30 mL),0.01 mol·L-1CaCl2产生N2O的丰度和面积要显著高于其他处理,其他处理之间没有显著差异,这说明此次试验的浸提剂CaCl2自身含有的硝酸盐可能会影响样品的测定,而本实验用KCl和H2O中的硝酸盐对样品测定不会产生影响。

表5 不同浸提剂对硝酸盐氮氧同位素比值测定的影响Table 5 Effect of different extracting agents on δ15N and δ18O of nitrate
本研究同时考察了去离子水和2 mol·L-1KCl分别配制的标准样品USGS32、USGS34、USGS35、IAEANO3的反硝化细菌法测定的氮氧同位素值(表6),从表6可以看出,尽管各个标准样品氮氧同位素测定值存在差异,但是差异不显著(α=0.05)。这表明2 mol· L-1KCl浸提剂自身并不影响反硝化细菌的生长和浸提液中硝酸盐氮氧同位素组成的测定,这点与Mørkved等[19]认为2 mol·L-1KCl通过改变反硝化效率而影响测定值的结果不同,但Rock等[20]通过测定2 mol·L-1KCl浸提液中硝酸盐的氮氧同位素组成来进行土壤硝酸盐溯源,也并未指出浸提剂对反硝化效率的影响。
尽管如此,空白试验数据表明,H2O、2 mol·L-1KCl及0.01 mol·L-1CaCl2溶液的反硝化反应可能也都产生了微量N2O气体(见表5,m/z 44面积),这说明H2O、KCl、CaCl2可能都含有微量的硝酸盐,这可能也是不同溶液的标准样品氮氧同位素测定值存在差异的原因。因此,为了减少系统和测定误差,一是建议购买纯度较高的浸提剂和去离子水,二是建议土壤硝酸盐浸提液统一采用去离子水配制的标准溶液来校正,且每一次测定都应采用标准样品重新做校正曲线。

表6 水配制及KCl配制标准样品的测定值(n=5)Table 6 Raw δ15N and δ18O values of NO-standards prepared with3H2O and KCl solution(n=5)
2.4保存条件对土壤中硝酸盐氮氧同位素值的影响
以2 mol·L-1的KCl溶液为浸提剂,考查了保存条件对土壤中硝酸盐氮氧同位素测定值的影响。结果显示,土壤浸提液的保存方式显著影响了土壤浸提液中硝酸盐的氮氧同位素值(表7)。由表7可见,-18℃冷冻保存效果较好,即使冷冻保存30 d,土壤浸提液硝酸盐的δ15N和δ18O实测值仍然与新鲜样品当日测定值相近,没有显著差异。在4℃冷藏条件下,各土层硝酸盐的δ15N在冷藏30 d内均与新鲜样品当日测定值相近,没有显著差异;但是,各层次土壤硝酸盐的δ18O在10 d之内没有显著变化,在20 d和30 d,除40~60 cm土层外,其余均显著低于新鲜样品当日测定值,δ18O最大降低了3.88‰,变化非常大,其比例范围为19.27%~213%。由此可见,土壤样品浸提后,为保证其δ15N和δ18O的准确性和稳定性,一方面应冷冻保存,另一方面应尽快测定。
2.5加热对土壤硝酸盐氮氧同位素组成测定的影响
土壤微生物组成复杂,其浸提液可能含有土壤原生反硝化细菌及其N2O还原酶,从而干扰反硝化细菌还原产生N2O的氮氧同位素测定。对此,Mørkved等[19]建议将土壤浸提液80℃加热1 h,以消除土壤原生反硝化细菌对其硝酸盐氮同位素测定的干扰。为考察加热对同时测定硝酸盐氮氧同位素的影响,同时鉴于每个研究者的土壤浸提液含有的原生反硝化细菌不尽相同,本研究比较了将USGS34、IAEA-NO3标准样品以及土壤样品加热与否的氮氧同位素测定值,结果发现,δ15N测定值没有显著差异(表8),表明加热与否对δ15N测定值没有显著影响,这与Mørkved等[19]的结果是一致的;但是加热后标准样品的δ18O测定值要显著升高(表8),这说明加热可能促使标样的O与空气中O2的氧发生了交换,导致反硝化作用产生的N2O气体产生了同位素分馏,而空气中的δ18O-O2为23.5‰,比USGS34(δ18O=-23.77‰)及IAEA-NO3 (δ18O=21.33‰)中δ18O的实测值都要高,所以加热过程可能导致标准样品的O与空气中的O2发生了交换,使其δ18O测定值显著升高,也说明了加热影响了标准样品δ18O的准确测定。与标准样品不同的是,土壤样品加热之后δ18O测定值有的升高(表8),有的降低,没有明显的规律性,这说明不加热时土壤原生反硝化细菌可能产生一定作用,但是加热又会产生同位素的热交换,所以加热前后δ18O测定值没有显著差异,δ15N测定值同样也没有显著差异。因此,为保证测定结果的准确性及节省测试时间,本研究建议对于土壤浸提液硝酸盐氮氧同位素的同时测定,浸提液可以直接和反硝化细菌反应,而无需加热,这也与Rock等[20]直接采用2 mol·L-1KCl土壤浸提液进行反硝化反应测定其硝酸盐氮氧同位素组成的方法是一致的。

表7 不同保存条件对不同土壤层次硝态氮氮氧同位素值的影响(n=4)Table 7 Effect of preservation condition on δ15N and δ18O values of soil nitrate in different depth(n=4)

表8 硝酸盐样品的氮氧同位素值(加热与否)Table 8 δ15N and δ18O values in the nitrate samples (heating or not heating)
2.6实际样品测定

3 结论
本研究优化了已发表的反硝化细菌结合Tracegas-同位素比质谱仪测定硝酸盐氮氧同位素的方法,并应用PreCon-同位素质谱仪测定。该方法具有较好的准确度、精密度和稳定性,且仅需很小的样品量,并且在普通实验室即可完成前处理过程,具有很好的推广应用前景。实验用去离子水及浸提试剂大多也含有微量的硝酸盐,随加样量增多,有可能会影响浸提液中氮氧同位素的测定,因此建议购买纯度较高的浸提剂和去离子水,二是建议土壤硝酸盐浸提液统一采用去离子水配制的标准溶液来校正,且每一次测定都应采用标准样品重新做校正曲线。冷冻保存效果较好,δ15N和δ18O值基本没有变化,因此土壤样品浸提后,一方面应冷冻保存,另一方面应尽快测定。加热对硝酸盐氮同位素测定没有显著影响,但会引起氧同位素的分馏,因此建议土壤浸提液直接和反硝化细菌进行反应来测定硝酸盐氮氧同位素组成。需要指出的是,反硝化细菌可以将土壤中硝酸盐()和亚硝酸盐(NO-2)同时还原为N2O气体,故测定结果实际为二者混合物的平均氮同位素组成,因此当亚硝酸盐同时存在时,可以预先从样品中除去。其方法是,加足够量的抗坏血酸使溶液的pH至3.5左右,抗坏血酸不与硝酸盐作用,而仅与亚硝酸盐选择性反应,使其转换为NO并被惰性气体氦气连续移走。抗坏血酸对反硝化细菌无毒,不影响后续硝酸盐的分析。因本研究土壤样品中未检测到亚硝酸盐,故省去该步骤。综上所述,反硝化细菌法适用于土壤浸提液中硝酸盐氮氧同位素组成的同时测定。
表9 不同肥料处理田间土壤浸提液硝酸盐的氮氧同位素校正值Table 9 Corrected δ15N and δ18O values ofof soil extract samples in different fertilizer fields

表9 不同肥料处理田间土壤浸提液硝酸盐的氮氧同位素校正值Table 9 Corrected δ15N and δ18O values ofof soil extract samples in different fertilizer fields
土壤提取液样品Soil extract samples δ15Nnitrate校正值Corrected values±SD/‰ δ18Onitrate校正值Corrected values±SD/‰有机肥田Applied organic fertilizer field 9.40±1.54 1.48±0.97施尿素田Applied urea field -3.26±0.74 -5.23±1.03农户施肥田Fertilized field as farmers -3.45±1.04 3.96±0.88
[1]巨晓棠,张福锁.中国北方土壤硝态氮的累积及其对环境的影响[J].生态环境,2003,12(1):24-28.
JU Xiao-tang,ZHANG Fu-suo.Nitrate accumulation and its implication to environment in North China[J].Ecology and Environment,2003,12(1):24-28.
[2]Ju X T,Kou C L,Zhang F S,et al.Nitrogen balance and groundwater nitrate contamination:Comparison among three intensive cropping systems ontheNorthChinaPlain[J].EnvironmentalPollution,2006,143:117-125.
[3]毕晓庆,山楠,杜连凤,等.氮肥用量对设施滴灌栽培番茄产量品质及土壤硝态氮累积的影响[J].农业环境科学学报,2013,32(11):2246-2250.
BI Xiao-qing,SHAN Nan,DU Lian-feng,et al.Effects of Nitrogen rates on tomato yield and quality and soil nitrate accumulation under drip irrigationinsolargreenhouse[J].JournalofAgro-EnvironmentScience,2013,32(11):2246-2250.
[4]Kol D C,Mayer B,Lee K S,et al.Land-use controls on sources and fate of nitrate in shallow groundwater of an agricultural area revealed by multiple environmental tracers[J].Journal of Contaminant Hydrology,2010,118(1/2):62-78.
[5]王庆锁,孙东宝,郝卫平,等.密云水库流域地下水硝态氮的分布及其影响因素[J].土壤学报,2011,48(1):141-150.
WANG Qing-suo,SUN Dong-bao,HAO Wei-ping,et al.Nitrate concentration distribution in groundwater of the Miyun Reservoir Water-shed[J].Acta Pedologica Sinica,2011,48(1):141-150.
[6]徐春英,李玉中,李巧珍,等.山东潍坊地下水硝酸盐污染现状及δ15N溯源[J].生态学报,2011,31(21):6579-6587.

[7]刘兴权,许晶玉,江丽华,等.山东省种植区地下水硝酸盐污染空间变异及分布规律研究[J].农业环境科学学报,2010,29(6):1172-1179.
LIU Xing-quan,XU Jing-yu,JIANG Li-hua,et al.Spatial variability and distribution pattern of groundwater nitrate pollution in farming regions of Shandong Province,China[J].Journal of Agro-Environment Science,2010,29(6):1172-1179.
[8]张丽娟,巨晓棠,刘辰琛,等.北方设施蔬菜种植区地下水硝酸盐来源分析:以山东省惠民县为例[J].中国农业科学,2010,43(21):4427-4436.
ZHANG Li-juan,JU Xiao-tang,LIU Chen-chen,et al.A study on nitrate contamination of ground water sources in areas of protected vegetables-growing fields:A case study in Huimin County,Shandong Province [J].Scientia Agricultura Sinica,2010,43(21):4427-4436.
[9]Senbayram M,Chen R,Budai A,et al.N2O emission and the N2O/(N2O+ N2)product ratio of denitrification as controlled by available carbon substrates and nitrate concentrations[J].Agriculture,Ecosystems&Environment,2012,147(15):4-12.
[10]Rock L,Ellert B H,Mayer B.Tracing sources of soil nitrate using the dual isotopic composition of nitrate in 2 M KCl-extracts[J].Soil Biology &Biochemistry,2011,43(12):2397-2405.
[11]Kelley C J,Keller C K,Evans R D,et al.Nitrate-nitrogen and oxygen isotope ratios for identification of nitrate sources and dominant nitrogen cycle processes in a tile-drained dryland agricultural field[J].Soil Biology&Biochemistry,2013,57:731-738.
[12]贾小妨,李玉中,徐春英,等.氮、氧同位素与地下水中硝酸盐溯源研究进展[J].中国农学通报,2009,25(14):233-239.
JIA Xiao-fang,LI Yu-zhong,XU Chun-ying,et al.Research advanced in N,O isotope and sources of nitrate in groundwater[J].Chinese Agricultural Science Bulletin,2009,25(14):233-239.
[13]李玉中,王利民,徐春英,等.地下水硝酸盐污染治理研究[M].北京:中国农业科学技术出版社,2014:113-121.
LI Yu-zhong,WANG Li-min,XU Chun-ying,et al.Research on study of nitrate pollution in groundwater[M].Beijing:China Agricultural Science and Technology Press,2014:113-121.
[14]Sigman D M,Casciotti K L,Andrean M,et al.A bacterial method for the nitrogen isotopic analysis of nitrate in seawater and freshwater[J],Analytical Chemistry,2001,73(17):4145-4153.
[15]Casciotti K L,Sigman D M,Hastings M G,et al.Measurement of the oxygen isotopic composition of nitrate in seawater and freshwater using the denitrifier method[J].Analytical Chemistry,2002,74(19):4905-4912.
[16]McIlvin M R,Casciotti K L.Technical updates to the bacterial method for nitrate isotopic analyses[J].Analytical Chemistry,2011,83(5):1850-1856.
[17]Révész K,Casciotti K L.Methods of the reston stable isotope laboratory [S].U.S.Geological Survey,Reston,Virginia 2007,http://www.usgs. gov/.
[18]Fenech C,Rock L,Nolan K,et al.The potential for a suite of isotope and chemical markers to differentiate sources of nitrate contamination:A review[J].Water Research,2012,46(7):2023-2041.
[19]Mørkved P T,Dörsch P,Søvik A K,et al.Simplified preparation for the δ15N-analysis in soilby the denitrifier method[J].Soil Biology& Biochemistry,2007,39(8):1907-1915.
[20]Rock L,Ellert B H.Nitrogen-15 and oxygen-18 natural abundance of potassiumchlorideextractablesoilnitrateusingthedenitrifiermethod[J]. Soil Science Society of America Journal,2007,71(2):355-361.
[21]Minet E,Coxon C E,Goodhue R,et al.Evaluating the utility of15N and18O isotope abundance analyses to identify nitrate sources:A soil zone study[J].Water Research,2012,46(12):3723-3736.
[22]张翠云,张俊霞,马琳娜,等.硝酸盐氮同位素反硝化细菌法测试技术的建立[J].核技术,2011,34(3):237-240.
ZHANG Cui-yun,ZHANG Jin-xia,MA Lin-na,et al.A technique for measuring nitrogen isotopic composition of nitrate using the denitrifier method[J].Nuclear Techniques,2011,34(3):237-240.
[23]徐春英,李玉中,郝卫平,等.反硝化细菌法结合痕量气体分析仪/同位素比质谱仪分析水体硝酸盐氮同位素组成[J].分析化学,2012,40(9):1360-1365.
XU Chun-ying,LI Yu-zhong,HAO Wei-ping,et al.Analysis of nitrogen isotopic composition of nitrate in water by denitrifier method and trace-gas/isotope ratio mass spectrometry[J].Chinese Journal of Analytical Chemistry,2012,40(9):1360-1365.
[24]岳甫均,李思亮,刘丛强,等.利用反硝化细菌法测试水体硝酸盐氮氧同位素[J].生态学杂志,2012,31(8):2152-2157.
YUE Fu-jun,LI Si-liang,LIU Cong-qiang,et al.Measurement of waters nitrate dual isotopes based on denitrifier method[J].Chinese Journal of Ecology,2012,31(8):2152-2157.
[25]陕红,张庆忠,张晓娟,等.保存、分析方法等因素对土壤中硝态氮测定的影响[J].分析测试学报,2013,32(12):1466-1471.
SHAN Hong,ZHANG Qing-zhong,ZHANG Xiao-juan,et al.Effect of preservation,analysis method on determination of nitrate in soils[J]. Journal of Instrumental Analysis,2013,32(12):1466-1471.
Determination of15N and18O isotope abundance in the extractable soil nitrate by the denitrifier method
XU Chun-ying,LI Yu-zhong*,LI Qiao-zhen,MAO Li-li,LIN Wei,QIANG Xiao-jing,ZHENG Qian
(Key Laboratory of Dryland Agriculture,Ministry of Agriculture in China,Institute of Environment and Sustainable Development in Agriculture,Chinese Academy of Agricultural Sciences,Beijing 100081,China)
A method has been established for determing simultaneouslyN andO isotope abundance in the extractable soil nitrate using denitrifier bacteria.The method was optimized by using 5000~8000 r·min-1centrifugal rotational speed,purging 1 h with high pure N2,reducing the amounts of samples and improving the autosampler based on the preliminary findings.Analysis of international standard of USGS34 showed that the method presented better accuracy,precision,and stability.The standard deviations(SD)of δ15N and δ18O were 0.05‰~0.09‰and 0.28‰~0.48‰respectively in the same sample at the same time within 3 months.Additionally,the effects of some factors such as the extracting agents,storage condition and heating on δ15N and δ18O of soil nitrate were analyzed.The results showed that the extracted solution such as KCl or CaCl2had no effect on the determination of δ15N and δ18O if sampling amount was small.Nevertheless,the significant difference would be found under bigger sampling amount with impure extracting agents.Moreover,the results also indicated that the cryopreservation method was better than the cold preservation for the δ15N and δ18O in the soil nitrate.Analysis of δ15N and δ18O shouldbe finished as soon as possible;on the other hand,the soil extracted solution should be cryopreserved.No significant effect of the heat treatment was observed for δ15N values of USGS34 and IAEA-NO3.However,the raw δ18O values showed that there were significant differences in heating,and this caused oxygen isotopic fractionation.But no significant differences were observed for δ15N and δ18O in the extracted soil nitrate samples.Therefore,we suggested that the soil nitrate extracts can directly react with denitrifier in order to avoid the oxygen isotopic fractionation and save the test time.Based on these,15N and18O isotope abundance in the extractable soil nitrate under the different fertilizer fields were investigated by using this method.
denitrifier method;soil extract;nitrate;15N and18O isotope abundance
S151.9
A
1672-2043(2016)09-1829-08doi:10.11654/jaes.2016-0551
2016-04-19
国家自然科学基金(41301553,41473004);中央级公益性科研院所基本业务费专项资金;中国农科院科技创新工程资助项目(农业水生产力与水环境创新团队)
徐春英(1978—),女,副研究员,博士,主要研究方向为农业水环境。E-mail:xuchuny@126.com
李玉中E-mail:liyuzhong@caas.cn

