盐胁迫对贯叶连翘种子萌发及幼苗POD的影响
胡真明,张雅君,沈天文,徐根娣,江丽,吕洪飞
(1.浙江省永康市舟山镇林业站,浙江金华321308;2.常熟理工学院生物与食品工程学院,江苏常熟215500;3.浙江师范大学化学与生命科学学院,浙江金华321004)
盐胁迫对贯叶连翘种子萌发及幼苗POD的影响
胡真明1,3,张雅君2,沈天文3,徐根娣3,江丽3,吕洪飞3
(1.浙江省永康市舟山镇林业站,浙江金华321308;2.常熟理工学院生物与食品工程学院,江苏常熟215500;3.浙江师范大学化学与生命科学学院,浙江金华321004)
为研究贯叶连翘的抗盐生理,本研究利用不同浓度的NaCl溶液及相同浓度不同比例、不同盐分的混合溶液处理贯叶连翘种子进行种子萌发试验.结果表明:盐胁迫对贯叶连翘种子萌发具有抑制作用,其中Na2CO3的抑制作用最显著.采用垂直平板聚丙烯酰胺凝胶电泳,研究了贯叶连翘幼苗在不同浓度NaCl溶液处理下不同时期过氧化物同工酶(POD)的变化情况.结果表明:不同时期的贯叶连翘在盐胁迫下,同工酶酶带有一定的差异.不同盐浓度下,同一时期贯叶连翘的同工酶酶带也有所差异.结论:盐胁迫对贯叶连翘种子萌发具有抑制作用,并对过氧化物同工酶(POD)有一定的影响.
贯叶连翘;盐胁迫;种子萌发率;幼苗;过氧化物酶同工酶
贯叶连翘(Hypericum perforatum L.)为藤黄科(Guttiferae)金丝桃属(Hypericum L.)多年生草本植物,种子黑褐色,花期7—8月,果期9—10月[1].贯叶连翘除作为传统的中药材外,其活性成分在治疗抑郁症、肝炎和艾滋病及抗癌等方面的重要利用前景使其成为近年来世界最畅销植物药之一[2].研究表明,贯叶连翘含有双蒽酮衍生物、黄烷酮醇类、黄酮及黄醇酮类、香豆素类、酚酸类、间苯三酚衍生物、挥发油类等物质.双蒽酮衍生物中的金丝桃素具有抑制中枢神经、抗病毒、增强免疫的功能[3-4].贯叶连翘在自然条件下主要分布于西北、中南、西南、华东,生长于海拔800~1200 m,喜向阳、湿润土壤,耐寒[5-6],除营养繁殖外,它主要靠种子繁殖,而自然条件下其种子萌发率较底,研究还表明,贯叶连翘是需光性种子,在萌发初期进行光预处理能有效提高萌发率[2].
盐胁迫是植物种子萌发和生长发育过程中经常遇到的一种胁迫,特别是在盐碱化较为严重的区域.盐胁迫对植物造成的主要影响表现在以下两方面:一是细胞质中金属离子(主要是Na+)的大量积累,它会破坏细胞内离子平衡并抑制细胞内生理生化代谢过程,使植物光合作用能力下降,最终因碳饥饿而死亡;二是盐碱土壤是一个高渗环境,它能阻止植物根系吸收水分,从而使植物因“干旱”而死亡.同时盐碱土壤pH值较高,这使得植物体与外界环境酸碱失衡,进而破坏细胞膜结构,造成细胞内溶物外渗而使植物死亡[7].
土壤盐碱化主要是土壤中的Na+、Ca2+、Mg2+3种阳离子和CO32-、HCO3-、Cl-、SO42-4种阴离子组成的盐分过多所造成的[8].国内外对星星草、棉花、甜菜等植物的抗盐性都有所研究,这些研究都促进了上述植物在盐碱地的适应性栽培[7].但至今尚未有研究报道贯叶连翘种子在盐胁迫下的萌发状况及生理生化变化过程.本文拟通过对不同浓度和组分的盐处理下贯叶连翘种子萌发和生理变化的研究,以期了解贯叶连翘的抗盐性,为人工栽培贯叶连翘提供科学依据.
1 材料与方法
1.1材料
本次实验所用的贯叶连翘种子采自浙江师范大学实验苗圃.
1.2方法
1.2.1种子发芽试验
选取颗粒饱满、颜色深(黑色)、有光泽的贯叶连翘种子,用0.1%HgCl2消毒1 min,蒸馏水清洗4~5次.以不同浓度及不同组合的盐溶液浸种处理36 h.单盐处理NaCl溶液浓度分别为50,100,150,200,250,300,350 mmol/L,设蒸馏水为对照(CK).混合盐处理中用以混合的各盐浓度均为为5 mg/ml,混合盐的配方分别为:NaCl(1),Na2SO4(1),Na2CO3(1),NaCl-Na2SO4(3:1)…….
在洗净、烘干的玻璃培养皿(d=120 mm)中放入滤纸,分别加入上述浓度溶液至滤纸饱和为止.然后摆入相应溶液浸种处理过的种子100颗,各3次重复.移入25℃±1℃的人工气候箱中进行萌发.开始10 d 24 h光照,随后进行24 h更替.以胚芽长度达到种子一半为种子发芽的判断标准[9].萌发过程中每24 h检测1次,记录发芽种子数,并补充蒸发的水分,使各种处理盐溶液浓度相对维持不变.

1.2.2幼苗生长过氧化物同工酶试验
让贯叶连翘种子先在培养皿(d=120 mm)中发芽,等发芽后(约7 d),将种子移入沙子(沙子洗净后用蒸馏水浸泡24 h,然后烘干)中,每天浇蒸馏水,使沙子湿度保持在80%左右,移栽一周后,每周定时浇1次营养液.当幼苗长至10对叶片时,开始用盐溶液处理幼苗,处理NaCl溶液浓度分别为50,100,150,200,250,300,350 mmol/L;设蒸馏水为对照(CK).采用将盐溶液喷到叶片上的方法,每天定时定量(每次15 ml)喷1次,处理7 d后,用于POD同工酶测定.
将实验苗圃中自然条件下生长的贯叶连翘幼苗(幼苗均具有20对叶片)移栽至实验室的洁净沙子中,每天浇蒸馏水,7 d后同样采用喷盐溶液的方法,每天定时定量(每次15 ml)喷1次,处理7 d后,用于POD同工酶测定.处理NaCl溶液浓度同样分别为50,100,150,200,250,300,350 mmol/L;设蒸馏水为对照(CK).
用聚丙烯酰胺凝胶垂直板电泳法[11-12]分离贯叶连翘POD同工酶.分离胶浓度7.5%,浓缩胶浓度3.3%,凝胶厚1.5 mm,浓缩胶电流强度1 mA/cm胶宽,分离胶电流强度2 mA/cm胶宽.Tris-甘氨酸缓冲液为电极缓冲液,pH值8.3.点样液(样品上清夜与400 mg/g蔗糖2∶1混合)每槽点样30 μl,以0.3 mg/g溴酚蓝水溶液作前沿指示剂.电泳约3~4 h,当指示剂达到凝胶底部0.5 cm时停止.Rf=酶带迁移距离/溴酚蓝迁移距离.
用抗坏血酸-联苯胺染色法.抗坏血酸0.0704 g,联苯胺溶液20 ml(2 g联苯胺溶于18 ml温热冰醋酸,再加蒸馏水72 ml),0.6%过氧化氢20 ml,蒸馏水60 ml.染色10 min,即可得酶谱,用去离子水冲洗,保存于7%冰醋酸中.凝胶采用THETMAL IMAGING FTI-500扫描记录,根据扫描记录再绘制模式图.
2 结果与分析
2.1盐胁迫对贯叶连翘种子发芽率的影响
贯叶连翘种子的发芽率在不同的盐浓度和不同的萌发时间下,有较大差异(图1).从图1中可以看出,随着盐浓度的增加,种子的萌发曲线越低,表明随着盐浓度的增加,发芽率呈降低趋势.贯叶连翘种子在CK、50 mmol/L和100 mmol/L盐浓度下最终萌发率变化不大,但起始萌发时间和萌发整齐度依次下降,从150 mmol/L盐浓度开始萌发率明显下降,150 mmol/L的最终萌发率为45%.当NaCl溶液的浓度为350 mmol/L时,发芽率接近0.贯叶连翘种子在相同浓度的单盐及相同浓度不同比例、不同盐分混合液中的发芽率见表1.其中以Na2CO3的抑制作用最显著,NaCl-Na2CO3次之,NaCl的抑制作用最小.各种盐溶液处理下种子的最终萌发率显著低于蒸馏水(CK)中的萌发率(见图1、表1).
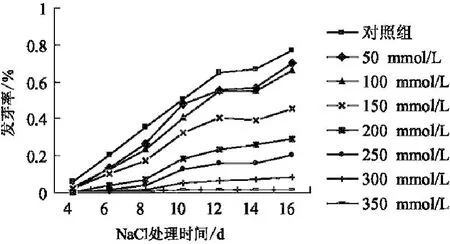
图1 单盐胁迫下贯叶连翘种子的萌发曲线
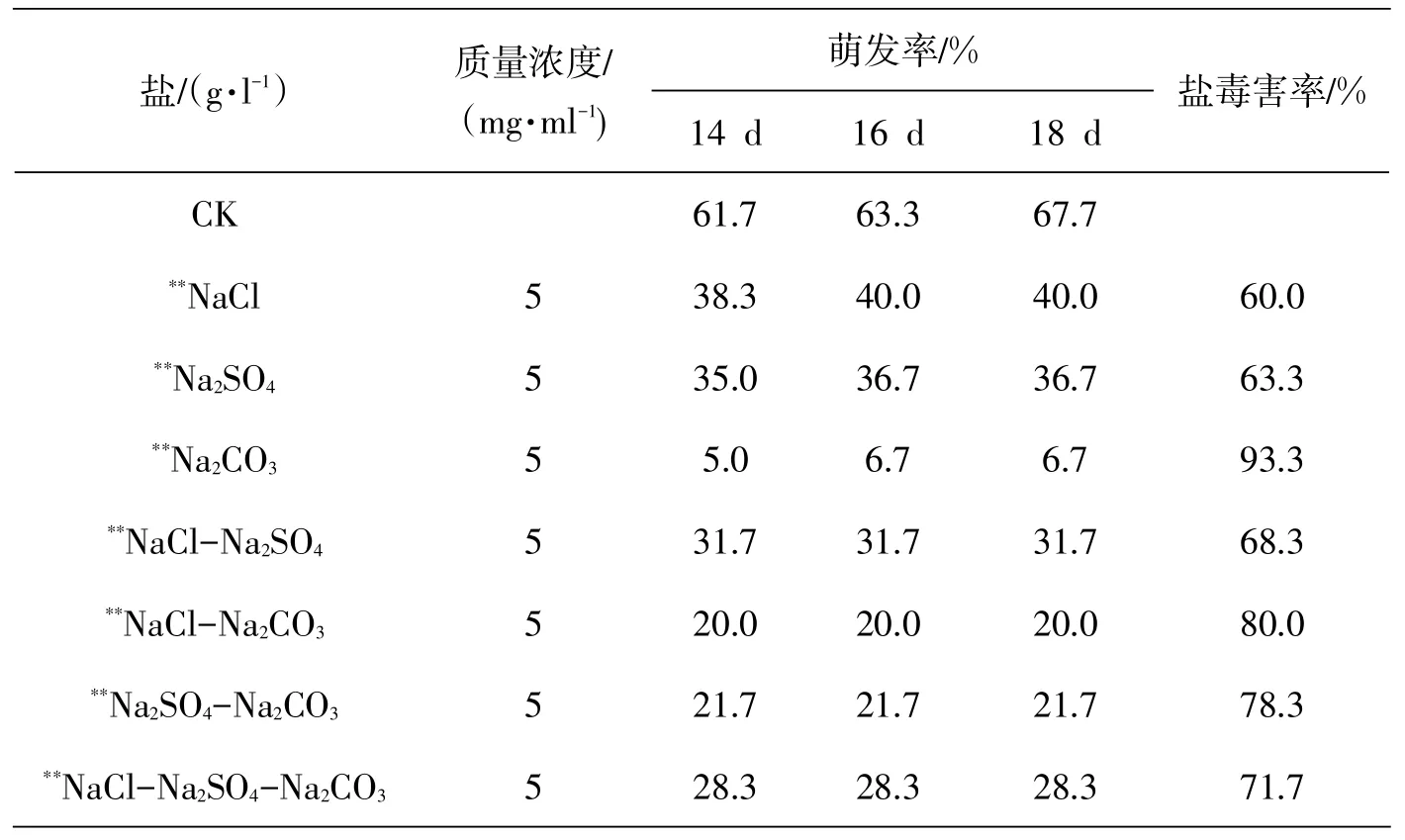
表1 混合盐胁迫对贯叶连翘种子发芽率的影响
2.2盐胁迫对贯叶连翘幼苗生长过氧化物同工酶的影响
图2和图3为盐胁迫对贯叶连翘10叶期和20叶期幼苗过氧化物同工酶的凝胶图.
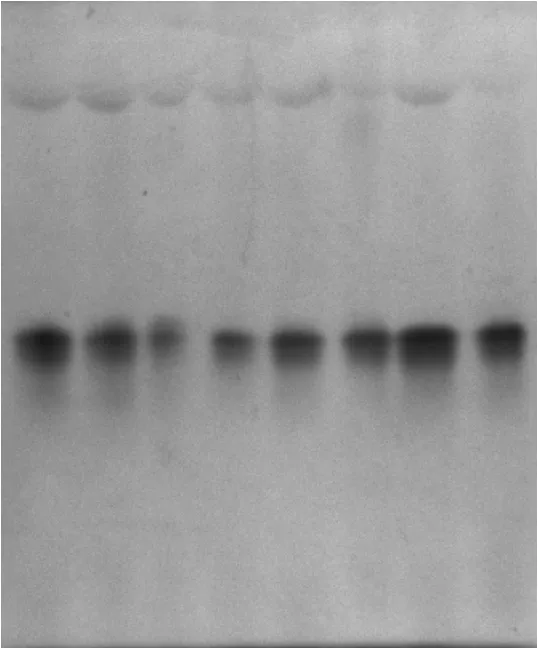
图2 盐胁迫对贯叶连翘10叶期幼苗过氧化物同工酶的影响

图3 盐胁迫对贯叶连翘20叶期幼苗过氧化物同工酶的影响
使用Image Master TotFelb软件分析,可获得盐胁迫处理的幼苗过氧化物同工酶的模式图(图4、图5).
从图2和图3可看出,20叶期的贯叶连翘植株的过氧化物同工酶的酶带数要明显多于10叶期时的,而且盐胁迫对20叶期植株的影响要大于10叶期的.虽然10叶期贯叶连翘的幼苗都只出现了一条酶带(见图4),但是酶的活性却不同,浓度为100 mmol/L的NaCl溶液对贯叶连翘幼苗过氧化物同工酶的影响最大,酶活性最低,浓度为300,350 mmol/L时的贯叶连翘植株POD同工酶却保持着较高的活性.从图5可看出,各浓度盐处理对贯叶连翘幼苗的影响变化较为明显.第3位的酶带每个处理都有;高盐浓度对贯叶连翘幼苗的抑制作用更为明显,用浓度为350 mmol/L的NaCl溶液处理的贯叶连翘幼苗过氧化物同工酶的酶带数和酶的活性明显低于对照组;而用150 mmol/L浓度处理的贯叶连翘幼苗过氧化物同工酶的3、4位酶带的活性要高于对照组,且为最高.
3 结果和讨论
3.1盐胁迫对贯叶连翘种子萌发率的影响
盐胁迫对植物整个生长发育时期都有很大的影响,盐分进入细胞中对参与代谢的酶活性产生影响,导致膜透性、光合作用、呼吸作用等生化过程混乱,从而使植物的生长受到抑制,尤其受到抑制的是细胞的分裂和分化[13].一般认为,中性盐(NaCl)胁迫的伤害作用主要是通过离子本身的毒性效应、高浓度盐的渗透效应和营养效应来完成的[14].
盐能抑制植物种子萌发,其抑制程度随盐浓度的增大而增大[15].在NaCl胁迫下,种子萌发过程中吸水受阻,将会进一步抑制细胞内正常的代谢活动,而且细胞内Na+的浓度要高于Cl-的浓度,从而引起种子萌发受阻[16-17].闫先喜[18]认为大麦在种子吸胀过程中盐胁迫会破坏细胞膜,膜透性增大导致溶液外渗,导致种子萌发受阻.本研究结果表明,盐胁迫处理对贯叶连翘种子发芽有很强的抑制作用,随着盐浓度的升高,种子的发芽率减小.混合盐处理,在一定程度上具有减轻Na2CO3的抑制作用.表现在混合盐处理的贯叶连翘种子发芽率均低于同浓度Na2CO3处理结果.

图4 盐胁迫对贯叶连翘10叶期幼苗过氧化物同工酶的影响的模式图

图5 盐胁迫对贯叶连翘20叶期幼苗过氧化物同工酶的影响的模式图
3.2盐胁迫对贯叶连翘幼苗过氧化物同工酶的影响
清除过氧化物的POD包括许多种类,其中AsAPOD是植物抗氧化胁迫中起重要作用的酶,类黄酮POD可利用植物体内普遍存在的类黄酮物质清除H2O2[19].一般认为,在盐胁迫条件下,植物通过吸收、积累无机盐和合成有机物质作用渗透剂进行渗透调节,以适应盐渍环境[20].SOD、POD、CAT等是酶促防御系统保护酶,它们协同作用,防御活性氧或其他过氧化自由基对细胞膜系统的伤害.盐胁迫下植物细胞内Na+、Cl-和其他离子如K+、Ca2+运输的动态平衡被破坏[21].细胞内过量的Na+还可以破坏体内活性氧产生和清除系统之间的动态平衡,启动膜脂过氧化或膜脂脱酯化作用,破坏膜脂和膜蛋白[22].
POD同工酶是一种对外界不良环境条件反应十分敏感的酶.Dash[23]在研究鹰嘴豆时发现随着NaCl浓度的增加POD的活性会降低,环境中高浓度的盐可以诱导或抑制某些同工酶的产生[24],一些学者把植物的这种特性称作“适应性”反应.植物在处于诸如高盐等不良生活环境时,通过诱导或抑制某些同工酶的产生来适应环境而使其得以生存.大量的胁迫处理试验和在分子水平上的基因调控研究证据已经证实大部分的POD合成属于诱导表达型[25].本研究中也观察到这一现象,从两张酶谱图中,当贯叶连翘植株为10叶期时,低浓度盐可以抑制POD的活性,而高浓度盐却增强POD的活性.可以推测:在高盐浓度下,贯叶连翘体内的一些调控基因启动,进行了表达,使得保护系统抗逆能力有所增强,表现在300 mol/L浓度处理时,POD的活性比对照组还要高.反之,当贯叶连翘植株为20叶期时,低浓度盐增强POD的活性,高浓度盐却抑制了POD的活性,据此推测,20叶期幼苗要比10叶期幼苗对盐更敏感.
[1]中国科学院中国植物志编委会.中国植物志:第50卷,第2分册[M].北京:科学出版社,1990:1.
[2]贺军民,李发荣,余小平,等.光、赤霉素和乙烯利对贯叶连翘种子萌发的影响[J].中草药,2002,33(9):840-843.
[3]吕洪飞,初庆刚,胡正海.金丝桃属植物的化学成分研究进展[J].中草药,2001,21(2):1135-1138.
[4]吕洪飞,胡正海.贯叶连翘分泌结构的发育及其内含物积累的研究[J].西北植物学报,2001,21(2):287-292.
[5]张林静,胡正海,赵桂仿.金丝桃属药用植物的研究开发现状及一些看法[J].中成药,1999,21(12):647-650.
[6]郑清明.金丝桃属药用植物的生药学研究[D].上海:第二军医大学,2002.
[7]屈芳芳.植物耐盐相关的生理生化机制[J].河南科技,2015,12:141-143.
[8]斯琴巴特尔,吴红英.盐胁迫对玉米种子萌发及幼苗生长的影响[J].干旱区资源与环境,2000,14(4):76-80.
[9]莫测辉,吴启堂,周友平,等.城市污染对作物种子发芽及幼苗生长影响的初步研究[J].应用生态学报,1997,8(6):645-649.
[10]邵秋玲,谢小丁,张方申,等.盐地碱蓬人工栽培与品系选育初报[J].中国生态农业学报,2004,12(1):47-49.
[11]孟学平,杨恒山,郭宏,等.盐胁迫对冬小麦过氧化物同工酶的影响[J].华北农学报,2000,15(4):62-67.
[12]SHAO Y,GAO J,WU X,et al.Effect ofsalt treatment on growth,isoenzymes and metabolites of Andrographis paniculata(Burm.f.)Nees[J].Acta Physiol Plant,2015,37:35.
[13]任昱坤,吴雪峰,谢亚军.植物抗盐性研究进展的综述[J].宁夏农学院学报,1995,16(4):60-66.
[14]RUIZ D,MARTINEZ V,CERDA A.Demarcatingspecific ion(NaCl,Cl-,Na+)and osmotic effects in the response of two citrus root-stocks tosalinity[J].Sci Hortic-Amsterdam,1999,80:213-224.
[15]王志才,牙库甫江·阿西木,王艳,等.水盐胁迫对花花柴种子萌发的影响[J].中国沙漠,2012,32(3):750-755.
[16]金兰,丁莉.盐胁迫下星星草种子萌发过程中淀粉酶活性及可溶性糖含量变化[J].青海师范大学学报(自然科学版),2003(1):86-97,90.
[17]JBIR N,AYADI A,AMARs,et al.Seed germination of two wheatspecies differing in theirsensitivity to NaCl,in response tosaltstress[J].J Trace Microprobe Techn,2002,20(4):625-637.
[18]闫先喜,马小杰,刑树平,等.盐胁迫对大麦种子细胞膜透性的影响[J].植物学报,1995,12(增刊):53-54.
[19]卢静君,多立安,刘祥君.盐胁迫下两草种SOD和POD及脯氨酸动态研究[J].植物研究,2004,24(1):115-119.
[20]周希琴,吉前华.盐胁迫下木麻黄幼苗抗氧化酶活性的变化及Ca2+对它的调控[J].植物生理学通讯,2004,40(2):184-186.
[21]NIU X,BRESSAN R A,HASEGAWA P M,et al.Ion homeostasis in NaClstress environment[J].Plant Physiol,1995,109:735-742.
[22]刘欣.植物的耐盐生物学机制研究进展[J].哈尔滨师范大学自然科学学报,2015,31(2):140-145.
[23]DASH M,PANDAs K.Saltstress induced changes in growth and enzyme activities in germinating Phaseolus mungoseeds[J]. Biol Plantarum,2001,44(4):587-589.
[24]王振英,郑坚瑜,陈瑞阳.盐胁迫、辐射条件下耐盐与不耐盐水稻POD同工酶、全蛋白变化的研究[J].南开大学学报(自然科学版),1999,32(1):23-27.
[25]田国忠,李怀方,裘维蕃.植物过氧化物酶研究进展[J].武汉植物学研究,2001,19(4):332-344.
The Effect ofsaltstress onseed Germination andseedling Growth of Hypericum perforatum L.
HU Zhenming1,3,ZHANG Yajun2,SHEN Tianwen3,XU Gendi3,JIANG Li3,Lü Hongfei3
(1.Zhoushan Town Forestrystation of Yongkang City,Zhejiang Province,Jinhua 321308;2.School of Biology and Food Engineering,Changshu Institute of Technology,Changshu 215500;3.College of Chemistry and Lifesciences,Zhejiang Normal University,Jinhua 321004,China)
In order to understand thesalt resistance of Hypericum perforatum L.,and to prove whether it issuitable forsaline alkalisoil cultivation,theseed was treated by different concentration NaClsolution or mixedsolution ofsame concentration with differentsalts.The resultshowed thatsaltstress inhibited H.perforatumseed germination.The effect of Na2CO3 inhibition was the mostsignificant in allsalt treatments.The effect ofsaltstress on isoenzymes of POD inseeding growth of H.perforatum was analyzed through polyacrylamide gel electrophoresis.The resultsshowed that there existsome differences in the isoenzymatic patterns of POD in differentstage.Andsome differences in the isoenzymatic patterns of POD also occurred in differentsalt concentrations on thesamestage.Therefore,a conclusion was reached thatsaltstress inhibited H.perforatumseed germination and effect on Peroxidase isoenzyme(POD)activities of theseedling.
Hypericum perforatum L.;salt-stress;seed germination;seedling;POD
Q945.78
A
1008-2794(2015)04-0120-05
2016-04-12
江苏省科技支撑计划项目“规模化生态鸡在循环经济体系中的应用及推广示范”(BE2012416)
吕洪飞,教授,博士,研究方向:植物学,E-mail:luhongfei0164@163.com.

