利卡汀联合肝动脉栓塞化疗治疗中晚期肝癌的效果及安全性的系统评价
秦文俊 徐细明武汉大学人民医院肿瘤科,湖北武汉430060
利卡汀联合肝动脉栓塞化疗治疗中晚期肝癌的效果及安全性的系统评价
秦文俊徐细明
武汉大学人民医院肿瘤科,湖北武汉430060
目的评价利卡汀(131I美妥昔单抗)联合肝动脉栓塞化疗(TACE)治疗中晚期肝癌的效果与安全性。方法计算机检索Medline、Cochrane、Embase、SCI、CNKI、万方数据库(截至2016年3月)。收集比较利卡汀联合TACE与单纯TACE的临床对照试验。采用Rev Man 5.2统计分析软件对所有收集数据进行统计分析。结果共纳入8篇文献,其中2篇随机对照试验,6篇非随机对照试验,共967例患者。分析结果显示,联合组的近期有效率(OR=3.07,95%CI[2.06,4.58])、半年生存率(OR=1.46,95%CI[1.25,1.70])、一年生存率(OR= 1.91,95%CI[1.41,2.57])、两年生存率(OR=2.19,95%CI[1.20,3.99])、疾病进展时间(MD=2.13,95%CI[1.88,2.38])与对照组比较,差异均有统计学意义(P<0.05)。两组不良反应发生率比较,恶心呕吐(OR=1.48,95%CI[1.09,2.01])、白细胞减少(OR=2.53,95%CI[1.84,3.47])、血小板减少(OR=2.12,95%CI[1.55,2.88])、ALT(OR= 1.59,95%CI[1.11,2.30])及胆红素(OR=1.76,95%CI[1.28,2.44])比较,差异有统计学意义(P<0.05),而发热、腹痛、AST、白蛋白比较,差异无统计学意义(P>0.05)。结论利卡汀联合TACE对于中晚期肝癌患者而言是一种安全且更有效的治疗手段,但仍需密切观察,积极预防处理不良反应。
利卡汀;肝动脉栓塞化疗;中晚期肝癌;系统评价
[Abstract]Objective To evaluate the efficacy and safety of licartin(131I-metuximab)combined with TACE for the treatment of advanced liver cancer.Methods Medline,Cochrane,Embase,SCI,CNKI and Wanfang Datebase were searched about clinical controlled trials of licartin combined with TACE for advanced liver cancer.All the data were analyzed with RevMan 5.2 software.Results Eight trials with 967 patients were in accordance with the inclusive criteria.There were two papers randomized controlled trials and other six papers were non-randomized controlled trials. Compared with the control group,the union group had higher effective rate(RR)(OR=3.07,95%CI[2.06,4.58]),half a year survival time(OR=1.46,95%CI[1.25,1.70]),one year survival time(OR=1.91,95%CI[1.41,2.57]),two years survival time(OR=2.19,95%CI[1.20,3.99])and time to progress(TTP)(MD=2.13,95%CI[1.88,2.38]),and all the difference was significant.However,the adverse reaction,including nausea and vomiting(OR=1.48,95%CI[1.09,2.01]),leucopenia(OR=2.53,95%CI[1.84,3.47]),thrombocytopenia(OR=2.12,95%CI[1.55,2.88]),ALT(OR=1.59,95%CI[1.11,2.30])and bilirubin(OR=1.76,95%CI[1.28,2.44]),with significant difference between the two groups(P<0.05). But the difference of fever,abdominal pain,AST and albumin had no statistical significance(P>0.05).Conclusion Compared with TACE alone,the licartin combined with TACE is a safe and effective treatment for advanced liver cancer.But the adverse reactions are also needed to observe closely and deal with actively.
[Key words]Licartin;TACE;Advanced liver cancer;Systematic review
最新统计数据显示,肝癌在我国男性恶性肿瘤中发病率排第四位,死亡率排第二位;在女性恶性肿瘤中发病率排第七位,死亡率排第五位[1]。高发病率及死亡率严重威胁着人类的身体健康。尽管肝癌的诊断、治疗技术不断提高,其预后仍不乐观,5年生存率仅有11%。目前肝癌的主要治疗方法包括手术、介入、射频消融、放化疗及肝移植等。肝动脉化疗栓塞(TACE)仍是主要治疗手段之一,但由于其术后易有癌细胞残留,导致复发、转移,患者的总体生存率仍未明显改善。因此,仍需探索新的治疗手段。
近年来,用放射性核素标记单克隆抗体的放射免疫疗法已成为肝癌的一种新的治疗手段[2]。利卡汀(131I美妥昔单抗)为一种新的用于治疗肝癌的放射免疫靶向药物,由131I标记美妥昔单抗构成。其中美妥昔单抗与肝癌细胞表面特异性表达的HAb18G/CD147抗原结合,一方面可以阻断HAb18G/CD147抗原介导的信号转导通路,抑制肝癌细胞的侵袭转移,另一方面抗原抗体结合使131I放射性核素在肿瘤部位集中,损伤肝癌细胞的DNA最终导致细胞死亡[3]。基于以上作用,自利卡汀研发以来,临床上常将其与TACE联合用于抑制TACE治疗后残留肝癌细胞的复发与转移,但联合应用的疗效与安全性到底如何呢?目前尚无定论。本研究就利卡汀联合TACE治疗肝癌的报道在国内外主要数据库进行检索,筛选出符合条件的文献进行系统分析评价,以期为利卡汀联合TACE治疗肝癌的临床应用提供一定依据。
1 资料与方法
1.1一般资料
经临床诊断或病理学确诊的不可手术的原发性肝癌患者;肝功能Child-Pugh评分为A、B级;4周内未进行过任何化疗。优先考虑纳入随机临床对照试验和半随机临床对照试验,若未能检索到相关的随机对照试验,则纳入非随机临床对照试验。干扰措施为利卡汀联合TACE和单纯TACE治疗不可手术的原发性肝癌。文献语种不限。
1.2排除标准
①非临床对照试验;②实验性文献、个案报道、重复文献;③样本量较少、质量较差、信息量少的文献。
1.3结局测量指标
①近期有效率;②生存率;③中位疾病进展时间;④不良反应。
1.4检索策略
计算机检索Medline、Cochrane、Embase、SCI、CNKI、万方数据库(截至2016年3月)。英文检索词为Licartin、131I-metuximab、transcatheter arterial chemoembolization、TACE、liver cancer、hepatocellular carcinoma。中文检索词为利卡汀、131I美妥昔单抗、肝动脉栓塞化疗、肝癌、临床对照试验。
1.5资料提取与质量评价
所有文献均由本研究作者独立检索审查,按事先设计的表格提取资料。由2位评价人对文献质量进行评价,若有分歧通过讨论解决或咨询原作者。随机对照试验质量评价主要涉及以下几个方面:①是否随机,方法是否合理;②是否隐蔽分组;③是否合理采用盲法;④是否全程随访、报告失访人数及其处理。非随机对照试验质量评价主要从以下几个方面进行:①分组方法原则;②研究设计是否有平衡各组基线情况的方法;③对影响预后因素的描述;④统计分析阶段有无减少偏倚的方法[4]。
1.6统计学方法
所有数据资料均采用RevMan 5.2软件进行分析。χ2检验各研究间数据的异质性,若结果显示异质性较小(P>0.05,I2≤50%),则采用固定效应模型进行分析,反之,采用随机效应模型。计数资料应用优势比(odd ratio,OR)及95%可信区间(95%confidence intervals,95%CI)表示,连续性资料应用均数差值(MD)及95%CI表示。绘制漏斗图分析发表偏倚。对无法合并的研究结果、统计量及相关参数作描述性分析评价。以P<0.05为差异有统计学意义。
2 结果
2.1纳入文献的一般情况及质量评价
根据以上检索策略通过计算机进行检索,共检索出52篇文献,阅读标题及摘要后排除重复文献和与本研究无关的文献31篇,进一步阅读全文后剔除单臂研究或病例数较少的研究13篇,最终纳入8个研究,其中2个为RCT[5-6],6个为nRCT[7-12],3篇英文,5篇中文,共967例患者。2个RCT均未报道具体随机方法以及是否采用了盲法,但在治疗后均进行了随访并报道了失访,质量评价为B级。纳入研究的一般情况及nRCT的质量评价见表1~2。
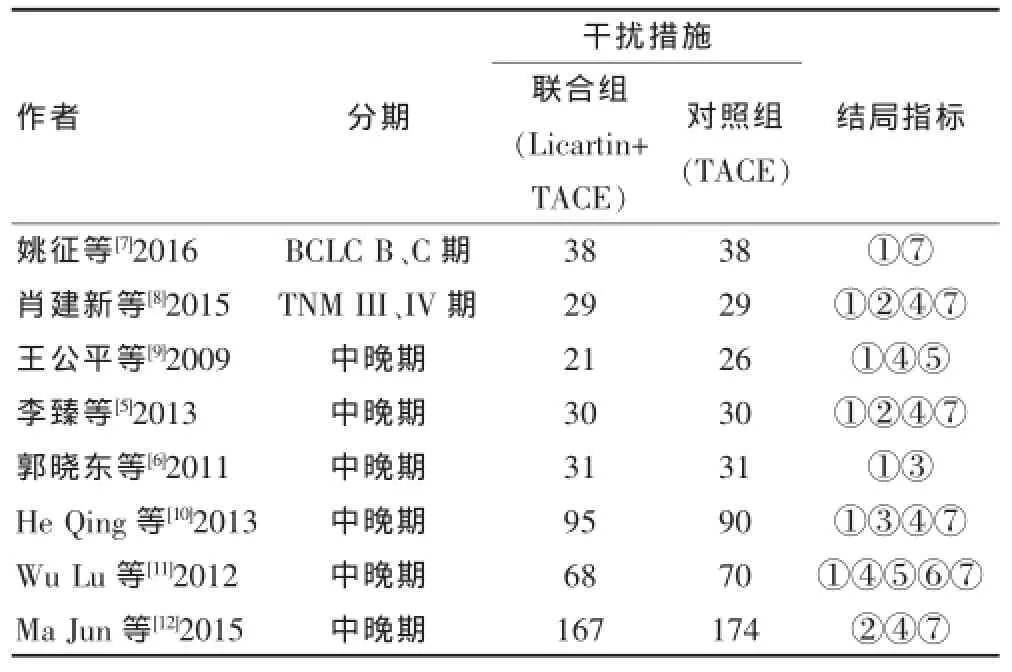
表1 纳入研究的一般情况(例)

表2 纳入nRCT的方法学质量评价
2.2 Meta分析结果
2.2.1近期有效率(RR)
7个研究[5-11]报道了近期有效率,将RCT与nRCT进行了亚组分析,亚组间无异质性(I2=0%,P= 0.35),各研究间异质性较小(I2=17%,P=0.30),故采用固定效应模型,结果显示联合组与对照组比较,差异有统计学意义(OR=3.07,95%CI[2.06,4.58],P<0.01)。见图1。
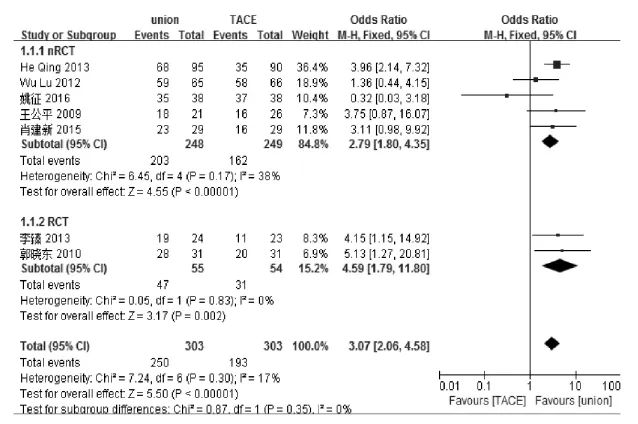
图1 联合组与对照组近期有效率比较的meta分析
2.2.2生存率
①半年生存率:2个研究[6,10]报道了半年生存率,联合组与对照组比较,差异有统计学意义(P<0.01)。②一年生存率:6个研究[5,8-12]报道了一年生存率,亚组间及各研究间均无异质性(I2=0%),故采用固定效应模型进行分析,结果显示联合组与对照组比较,差异有统计学意义(P<0.01)。③两年生存率:2个研究[9,11]报道了两年生存率,组间异质性较小(I2=37%,P= 0.21),采用固定效应模型,结果显示两组比较差异有统计学意义(P=0.01)。见表3。
2.2.3疾病进展时间(TTP)与总生存时间
3个研究[5,8,12]报道了疾病进展时间,亚组间及各研究间无明显异质性(I2=0%),采用固定效应模型分析,结果显示两组比较差异有统计学意义(P<0.01)。见表3。仅一个研究[11]报道了平均总生存时间,联合组与对照组分别为26.7月(95%CI 20.7~31.3个月)、20.6个月(95%CI 15.3~24.7个月),差异有统计学意义(P=0.038)。
2.2.4不良反应
2.2.4.1临床症状①发热,4个研究[7,10-12]报道了治疗后发热情况,各组间同质性良好(I2=0%),采用固定效应模型进行分析,结果显示联合组与对照组,发热情况比较,差异无统计学意义(P=0.68)。②腹痛,4个研究[7,10-12]报道了治疗后腹痛发生率,各研究间异质性较小(I2=33%,P=0.22),故采用固定效应模型进行统计分析,结果联合组与对照组比较,差异无统计学意义(P=0.56)。③恶心呕吐4个研究[7,10-12]报道了治疗后恶心呕吐情况,各研究间同质性较好(I2=0%),采用固定效应模型进行分析,结果显示与对照组比较,联合组恶心呕吐发生率较高,差异有统计学意义(P= 0.01)。见表3。
2.2.4.2血液毒性①白细胞减少,5个研究[5,7,8,11,12]报道了白细胞减少,亚组间及各研究间均无明显异质性(I2=0%),采用固定效应模型进行分析,结果显示联合组白细胞减少发生率明显高于对照组,差异有统计学意义(P<0.01)。②血小板减少,5个研究[5,7,8,11,12]报道了血小板减少,组间无明显异质性(I2=0%),结果显示联合组血小板减少发生率明显高于对照组,差异有统计学意义(P<0.01)。③ALT、AST、胆红素、白蛋白4个研究[7,8,11,12]均报道了ALT、AST、胆红素和白蛋白的变化,各研究间均无明显异质性(I2=0%),均采用固定效应模型进行分析。结果显示,联合组的ALT和胆红素异常率与对照组比较,差异均有统计学意义(P<0.05)。而AST和白蛋白异常率与对照组比较,差异均无统计学意义(P>0.05)。见表3。
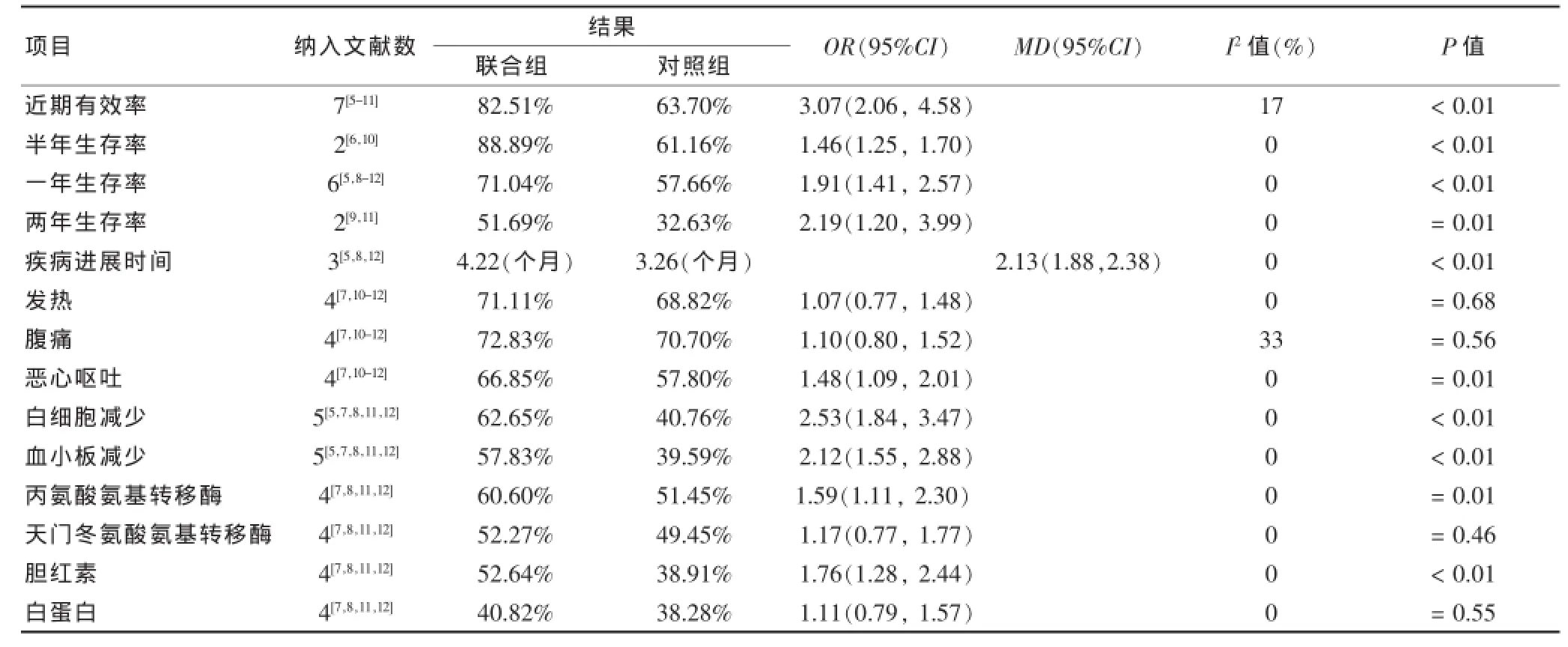
表3 联合组与对照组治疗肝癌的结果比较
2.3敏感性分析与发表偏倚
逐一删除纳入研究进行敏感性分析以评价单一研究对总体结果的影响,结果表明无单一研究可显著影响原始分析和亚组分析结果的差异。对以上指标分别通过绘制漏斗图观察其发表偏倚,结果显示各个漏斗图的所有点均位于95%CI内,均匀分布在虚线两侧,未发现明显的发表偏倚。见图2。
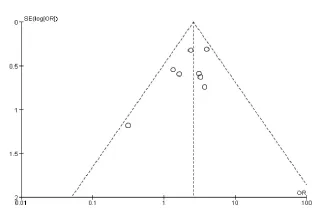
图2 发表偏倚的漏斗图
3 讨论
原发性肝癌是一种高发病率、高死亡率的恶性肿瘤。对于不可手术切除的肝癌而言,尽管TACE是最主要的介入治疗方法,但受栓塞剂性质的影响其疗效受到限制[13]。此外,由于TACE常需要多次重复治疗,导致患者肝功能恶化,疗效也受到限制[14]。因此我们仍需探索更有效的治疗手段。目前临床已证实经皮无水乙醇注射、射频消融、分子靶向治疗、基因治疗联合TACE可以提高进展期肝癌患者的生存期,降低肝衰竭的风险。然而,对于肝内多发病灶、肿瘤占据率较大或远处转移的肝癌患者,以上所有治疗手段预后均不理想。
近年来,人们又发现了一种新的治疗方法——放射免疫治疗。利卡汀是一种由放射性元素131I标记美妥西单抗而成的药物。美妥西单抗可以与肝癌细胞表面高表达的抗原HAb18G/CD147特异性结合,使与其结合的131I在肝癌组织处凝聚,然后直接杀死肿瘤细胞[15]。此外HAb18G/CD147抗原是一个有着多种功能的细胞黏附分子,与肿瘤的转移密切相关。它不仅参与了肿瘤细胞的黏附与运动、血管生成、信号转导,还可以介导纤维母细胞产生基质金属蛋白酶(MMPs)促进细胞转移[16-17]。因此,利卡汀可以定向杀灭肝内外携带HAb18G/CD147抗原的肿瘤细胞,抑制转移。鉴于以上作用,近年来越来越多的临床医生在TACE的基础上联合利卡汀治疗进展期肝癌。本研究将对TACE联合利卡汀治疗中晚期肝癌的疗效与安全性进行系统评价,以期为其更广泛地应用于临床提供理论依据。
本研究共纳入了8篇文献,其中2篇随机对照研究,6篇非随机对照研究,并对两者进行亚组分析。既往关于TACE治疗肝癌的研究结果显示,RR大约范围为12.0%~57.9%,中位生存时间范围为7~19个月,一年生存率和两年生存率范围分别为42%~72%、0%~55%,与本研究中单纯TACE治疗肝癌的结果基本一致。而TACE与利卡汀联合组的有效率、中位生存时间、生存率等结果都显著提高,提示TACE与利卡汀联合治疗肝癌可能起协同作用。一方面,肝动脉栓塞使肝癌组织的血供大幅减少,利卡汀在肿瘤中保留时间延长,作用增强;另一方面,肿瘤组织内的化疗药物对利卡汀可起到放疗增敏作用;此外,利卡汀的持续放射作用可以消灭TACE后残留的肝癌细胞[18]。因此,利卡汀联合TACE治疗肝癌疗效优于单纯TACE。本研究结果还显示,不论TACE还是联合治疗术后均有部分患者出现恶心呕吐、发热寒战、肝区疼痛等症状,其中两组恶心呕吐比较,差异有统计学意义,但大部分患者为Ⅰ/Ⅱ度胃肠道反应,经过常规处理症状可缓解。而对于血液毒性,联合组白细胞、血小板降低更为明显,且肝功能损伤也较对照组明显,尤其是ALT和胆红素,但仅有极少数病例发生Ⅲ/Ⅳ度不良反应。国内有统计[19]显示,利卡汀联合TACE治疗肝癌引起的转氨酶和胆红素升高,绝大多数不超过正常值上限的1.5~2.5倍,仅有极少数患者达正常值上限的2.5~5.0倍,与本文纳入的研究及Dai等[20]报道结果基本一致。联合组以上不良反应可能主要由131I引起的放射性损伤,而美妥西单抗主要与肝癌细胞结合,对正常组织损伤较小。因此利卡汀联合TACE治疗肝癌相对安全,大部分患者均可耐受,但仍需密切观察,积极预防处理不良反应。
综上所述,利卡汀联合TACE对于中晚期肝癌患者而言是一种安全且更有效的治疗手段。但由于医疗道德和伦理方面的原因,对中晚期肝癌患者实施随机双盲对照试验较为困难。本系统评价的文献仅有2篇为随机对照试验,其余均为非随机对照试验,可能存在偏倚因素或检验效能不足影响评价结果。因此尽管本研究得出一些初步结论,但受文献质量等因素的影响,对于本系统评价得出的结论仍应慎重对待。期待未来能够开展较多大样本、多中心、完全随机双盲的临床试验,这样才能得到更为可靠的结论指导临床工作。
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2]Kassis AI,Adelstein SJ.Radiobiologic principles in radionuclide therapy[J].J Nucl Med,2005,46(Suppl 1):4S-12S.
[3]Zhang Y,Fang L,Zhang Q,et al.An oncolytic adenovirus regulated by a radiation-inducible promoter selectively mediates hSulf-1 gene expression and mutually reinforces antitumor activity of131I-metuximab in hepatocellular carcinoma[J].Mol Oncol,2013,7(3):346-358.
[4]Deeks JJ,Dinnes J,D'Amico R,et al.Evaluating non-randomisedinterventionstudies[J].HealthTechnolAssess,2003,7(27):1-173.
[5]李臻,周进学,任建庄,等.131I美妥昔单克隆抗体灌注联合经肝动脉化疗栓塞术治疗中晚期肝癌介入术后复发的临床价值[J].中华肝脏病杂志,2013,21(10):728-733.
[6]郭晓东,孙婷,李珊珊.碘[131I]美妥昔单抗注射液联合TACE治疗原发性肝癌的效果分析[J].中国现代医学杂志,2011,21(10):1206-1208.
[7]姚征,陈玉堂,罗君,等.(131)I美妥昔单抗注射液联合TACE治疗76例中晚期原发性肝癌的疗效及安全性研究[J].介入放射学杂志,2016,25(1):65-69.
[8]肖建新,陈雷.TACE联合131I美妥昔单克隆抗体治疗介入术后复发的肝细胞癌患者疗效及安全性分析[J].实用肝脏病杂志,2015,18(6):655-658.
[9]王公平,冯笑山,单探幽,等.肝动脉栓塞与(131)I美妥昔单抗注射液灌注治疗原发性肝癌的临床对比研究[J].中华肿瘤防治杂志,2009,30(13):1022-1024.
[10]He Q,Lu WS,Liu Y,et al.131I-labeled metuximab combined with chemoembolization for unresectable hepatocellular carcinoma[J].World J Gastroenterol,2013,19(47):9104-9110.
[11]Wu L,Yang YF,Ge NJ,et al.Hepatic artery injection of131I-labelled metuximab combined with chemoembolization for intermediate hepatocellular carcinoma:a prospective nonrandomized study[J].Eur J Nucl Med Mol Imaging,2012,39(8):1306-1315.
[14]陈加俊,何玉梅,侯玲玲,等.通透Ca2+酸敏感离子通道1a的激活在糖尿病鼠局灶脑缺血损伤中的作用[J].中华老年医学杂志,2013,32(10):1106-1109.
[15]袁娜娜,陈余清.慢性阻塞性肺疾病患者认知功能与抑郁、焦虑及BODE指数的关系[J].蚌埠医学院学报,2015,40(5):578-581.
[16]赵雅宁,景丽伟,张盼,等.以“感觉统合”为理念的认知训练联合身心调节对颅脑损伤认知障碍患者执行功能及焦虑抑郁情绪的影响[J].中国实用护理杂志,2014,30(23):1-5.
[17]王艳,李攀,张淼,等.急性缺血性卒中后认知功能障碍及其相关因素的横断面研究[J].中国现代神经疾病杂志,2013,13(4):279-285.
[18]徐梅松,陶华英.基于复杂度分析阿尔茨海默病、轻度认知功能障碍患者的脑电特点[J].中华神经科杂志,2013,46(10):687-691.
[19]陈毅刚,梁辉,罗本燕,等.心房颤动与认知功能障碍相关性的研究进展[J].中国介入心脏病学杂志,2015,23(7):406-408.
[20]刘千朔,周环,田沈,等.房颤对卒中后认知功能损害影响分析[J].中国医师杂志,2014,16(11):1561-1563.
[21]吴跃文,李战辉.肉桂联合阿司匹林治疗短暂性脑缺血发作的效果观察[J].中国医药科学,2016,6(3):75-78.
[22]袁莲芳,高影,刘利宁等.脉血康胶囊对脑卒中后伴不同程度血管性认知功能障碍患者认知功能和非认知功能的干预效果[J].中国医药,2015,10(1):85-89.
[23]岳莉莉,杨彦春.脑器质性精神障碍患者认知功能障碍研究进展[J].医学综述,2016,22(6):1138-1140.
[24]王芳.短暂性脑缺血发作后短期内发生脑梗死的风险分析[J].中国医药科学,2015,5(6):168-170.
[25]张薇,张临洪,张媚,等.奥拉西坦治疗血管性认知功能障碍的效果及安全性评价[J].中国医药,2016,11(5):675-679.
[26]周曙初.和肽素、血清热激蛋白70联合检测对急性脑梗死患者认知功能障碍的预测价值[J].医学综述,2015,21(12):2243-2245.
Efficacy and safety of licartin combined with TACE for the treatment of advanced liver cancer
QIN WenjunXU Ximing
Department of Oncology,Renmin Hospital of Wuhan University,Hubei Province,Wuhan 430060,China
R735.7
A
1674-4721(2016)09(a)-0046-05
2016-04-28本文编辑:程铭)
湖北省自然科学基金项目(2012FKC14301)。
秦文俊(1979.12-),男,武汉大学人民医院2011级生物医学工程专业在读硕士研究生;研究方向:消化系统肿瘤基础与临床。
徐细明(1976.8-),男,博士,硕士研究生导师,教授;研究方向:消化系统肿瘤基础与临床。

