QuEChERS—HILIC—MS/MS法快速测定蔬菜中3种强极性植物生长延缓剂
周纯洁 刘欢 赵博 邓美林 黄思瑜

摘要 为了完善植物生长延缓剂残留检测技术,建立了快速测定蔬菜中3种强极性植物生长延缓剂(矮壮素、缩节胺和丁酰肼)的QuEChERS-HILIC-MS/MS方法。考察了不同提取剂对蔬菜中这3种植物生长延缓剂的提取效果以及不同吸附剂的净化效果,并以提取后添加法评估了黄瓜、番茄、萝卜、白菜及四季豆中各化合物的基质效应。样品经QuEChERS方法净化后,采用BEH HILIC色谱柱为分析柱,乙腈和10 mmol/L乙酸铵水溶液作流动相进行梯度洗脱。质谱分析采用电喷雾正离子电离,多反应监测模式,以基质匹配标准曲线外标法定量。3种植物生长延缓剂在各自浓度范围内线性良好,回收率在80.5%~109.0%之间,相对标准偏差(RSD)在1.1%~8.6%之间。方法操作简便、快速、灵敏度和准确性较好,可满足蔬菜中植物生长延缓剂残留量快速测定的需要。
关键词 植物生长延缓剂;蔬菜;QuEChERS;HILIC
中图分类号 TQ452.2 文献标识码 A 文章编号 1007-5739(2016)06-0268-04
Determination of Three Extremely Polar Plant Growth Retardators in Vegetables by QuEChERS-HILIC-MS/MS
ZHOU Chun-jie LIU Huan ZHAO Bo DENG Mei-lin HUANG Si-yu
(Chongqing Institute for Food and Drug Control,Chongqing 401121)
Abstract A new method for the rapid determination of three extremely polar plant growth retardators(chlormequat chloride,mepiquat chloride and daminozide)residues in vegetables was developed by using QuEChERS-HILIC-MS/MS,in order to improve determination method for plant growth retardators residues. Both the extraction effect and clean-up effect for the three plant growth retardators in vegetables were studied by using different extracting agents and sorbents. The addition method after extraction was used to evaluate the matrix effects(ME)of the compounds in matrix of cucumber,tomato,radish,cabbage and kidney bean. The analytes were extracted by QuEChERS and chromatographic analysis was carried out on a BEH HILIC column using a mobile phase comprised of acetonitrile and 10 mmol/L ammonium acetate solution in gradient program. The plant growth retardators were analyzed by positive electrosprary ionization(ESI+)tandem mass spectrometry under multiple reaction monitoring mode. Quantification was achieved using matrix-matched external standard method. The calibration curves showed good linearity in each concentration range,and the recoveries of the three plant growth retardators were between 80.5% and 109.0%,with the relative standard deviation(RSD)ranging from 1.1% to 8.6%. The method is simple,convenient,sensitive and accurate,and suitable for the rapid determination of plant growth retardators residues in vegetables.
Key words plant growth retardator;vegetable;QuEChERS;HILIC
植物生長延缓剂是指能够延缓植物亚顶端分生组织的细胞分裂和生长的一类人工合成的植物生长调节剂,可有效控制植物徒长,提高农产品质量,但如果施用不当,可能会在农作物中残留,从而给人体带来危害。随着人们对植物生长调节剂在蔬菜中残留问题的关注度不断提高,其残留限量标准也在不断被加强[1-3]。矮壮素、缩节胺和丁酰肼是3种常见的植物生长延缓剂,由于其极性都非常强且无生色基团,采用气相色谱法或液相色谱法测定往往需要衍生化,操作繁琐,无法满足保质期普遍较短的蔬菜中的测定需求。因此,有必要建立蔬菜中这3种强极性植物生长延缓剂残留量的快速测定方法。
目前,针对矮壮素和缩节胺测定方法的研究相对较多,主要是液相色谱—串联质谱法,但针对丁酰肼测定方法的研究相对较少[4-7]。本试验将简便、快速且有效的QuEChERS样品前处理技术与对强极性化合物有良好保留能力的亲水作用色谱(HILIC)分离技术相结合,建立了同时测定蔬菜中矮壮素、缩节胺和丁酰肼的QuEChERS-HILIC-MS/MS方法。在叶菜类、瓜类、茄果类、豆类、块茎类五大类蔬菜中各选择1种代表基质,考察了方法的基质效应、回收率、精密度、线性关系、检出限及定量限等。通过QuEChERS-HILIC-MS/MS方法进行测定,可有效缩短蔬菜中3种强极性植物生长延缓剂的检测周期,提高检测效率。
1 材料与方法
1.1 试验材料
1.1.1 试验仪器。TSQ Endura型三重四级杆质谱(配电喷雾离子源,Thermo-Fisher公司);U3000型高效液相色谱仪(Thermo-Fisher公司);VORTEX GENIUS 3型旋涡振荡器(IKA公司);Allegra X-30R Centrifuge型台式离心机(Beckman Coulter公司)。
1.1.2 试验试剂。无水硫酸镁(分析纯)、氯化钠(分析纯)均购于成都市科龙化工试剂厂;无水乙酸钠(分析纯),天津市大茂化工试剂厂;C18粉、乙二胺-N-丙基硅烷(PSA)和石墨化炭黑(GCB)均购于美国Welch公司;乙酸铵(色谱纯),CNW公司;乙酸(色谱纯),Thermo-Fisher公司;甲酸(色谱纯),ACS公司;乙腈(色谱纯),Merck公司;试验用水均为超纯水。
1.1.3 试验用植物生长延缓剂。矮壮素(纯度>97.2%,Sigma-Aldrich公司),缩节胺(纯度>99.0%)和丁酰肼(纯度>97.0%)均购于德国Dr. Ehrenstorfer公司。分别准确称取3种植物生长延缓剂对照品,用甲醇配成浓度各为1 mg/mL的标准储备液,-18 ℃储存。
1.2 样品前处理
准确称取5.00 g已均质的蔬菜样品于50 mL具塞离心管中,加入10 mL含1%乙酸的乙腈,旋涡1 min混匀。加入4 g无水硫酸镁,迅速振摇,旋涡振荡1 min,以4 000 r/min离心5 min。转移2 mL上清液至QuEChERS净化管(含无水硫酸镁200 mg、C18粉50 mg和GCB 20 mg)中,旋涡混合1 min,以10 000 r/min离心2 min。取上清液过0.22 μm有机系滤膜,待测。
1.3 色谱条件
ACQUITY UPLC BEH HILIC色谱柱(50 mm×2.1 mm,1.7 μm);流动相:A为乙腈,B为10 mmol/L乙酸铵水溶液;柱温40 ℃;流速0.3 mL/min;进样量5 μL;梯度洗脱程序:0~0.5 min,95% A~60% A;0.5~3.0 min,60% A;3.0~3.5 min,95%A;3.5~5.0 min,95%A。
1.4 质谱条件
电喷雾离子源,正离子模式(ESI+),电喷雾电压:3 500 V,鞘气:35 Arb,辅助气:10 Arb,吹扫气:1 Arb,离子传输管温度:350 ℃,雾化温度:300 ℃,定性离子对、定量离子对、射频透镜电压(RF Lens)和碰撞能(CE)见表1。
2 结果与分析
2.1 流动相的选择
由于矮壮素、丁酰肼和缩节胺都是强极性化合物,常见的反相色谱柱对其保留非常弱,因此本试验采用对强极性化合物有良好保留能力的亲水作用色谱(HILIC)柱作为分析柱[8-10]。试验考察了乙腈-水、乙腈-0.1%甲酸水溶液、乙腈-10 mmol/L乙酸铵水溶液以及乙腈-10 mmol/L乙酸铵水溶液(含0.1%甲酸)为流动相时,3种植物生长延缓剂的分离效果(图1)。试验发现,乙腈-水作流动相时,3种化合物均未出峰;当加入缓冲盐乙酸铵时,3种化合物的峰形和分离度均较理想;但当在流动相中引入甲酸时,丁酰肼的色谱峰展宽严重,且矮壮素和缩节胺分离效果较差。因此,本试验选择乙腈-10 mmol/L乙酸铵水溶液作为流动相。
2.2 QuEChERS样品前处理条件的优化
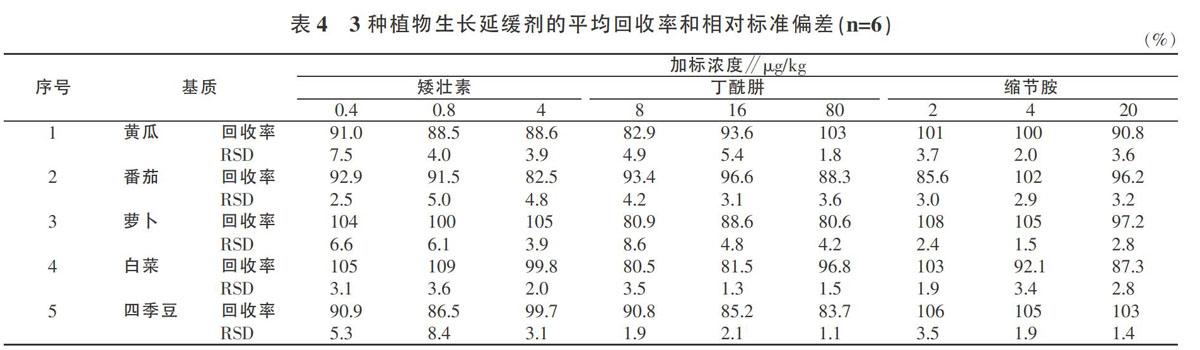
2.2.1 萃取。乙腈对不同极性的物质均具有一定的溶解能力,且提取出的色素等干扰物较少,因此QuEChERS方法中常采用乙腈作为提取溶剂。由于丁酰肼分子结构中含有羧基,乙酸的加入有利于其形成结合态从而增加其在乙腈中的溶解度,本试验考虑采用酸化乙腈作为提取剂。以黄瓜、番茄、萝卜、白菜、四季豆为代表基质,分别考察了用乙腈和1%乙酸乙腈作为提取剂时各化合物的回收率(图2)。结果表明,乙酸的加入使丁酰肼在5种代表基质中的回收率均有较大程度的提高。因此,试验选择用1%乙酸乙腈作为提取剂。
此外,由于蔬菜中含有大量的水分,QuEChERS方法常在萃取过程中加入一定量的无水硫酸镁-氯化钠或无水硫酸镁-无水乙酸钠盐析及除水。如图2所示,虽然无水硫酸镁-氯化钠及无水硫酸镁-无水乙酸钠的加入均使得缩节胺的回收率有一定程度的提高,但丁酰肼的回收率大大降低。當加入无水硫酸镁-无水乙酸钠时,5种基质中丁酰肼的回收率均低于10%,这可能是由于水溶性无机盐的引入使得提取液中杂质增多。为除去提取液中的水分,本试验直接在萃取过程中加入无水硫酸镁。
2.2.2 净化。QuEChERS方法中常用的吸附剂主要有乙二胺-N-丙基硅烷(PSA)、C18粉及石墨化炭黑(GCB)等。PSA主要用于吸附基质中的有机酸、酚类等,C18粉可去除脂肪等非极性干扰,GCB去除色素及甾醇等干扰物的能力较好[11]。本试验考察了黄瓜、番茄、萝卜、白菜、四季豆5种基质提取液中分别加入PSA、C18粉和GCB的净化效果,结果见图2。试验发现,3种吸附剂的加入均可提高矮壮素和缩节胺的回收率,但PSA作为吸附剂时丁酰肼的回收率大大降低。因此,本试验选择C18粉和GCB作为吸附剂,并加入适量无水硫酸镁除水。
2.3 基质效应的校正
采用提取后添加法评价基质效应(ME),结果如表2所示。5种基质对矮壮素和缩节胺均表现出明显的基质抑制效应,而对丁酰肼则表现出很强的基质增强效应。因此,在进行定量分析时需采用空白基质配制标准工作溶液,以校正基质效应。
2.4 线性方程、方法检出限及定量限
采用空白基质溶液配制3种化合物的混合标准溶液,以峰面积(Y)对质量浓度(X)进行线性回归分析,这3种化合物在相应的质量浓度范围内线性关系良好(R2>0.99),以3倍信噪比(S/N=3)浓度估算方法检出限(LOD),以10倍信噪比(S/N=10)所对应浓度作为方法定量限(LOQ)(表3)。
2.5 方法回收率和精密度
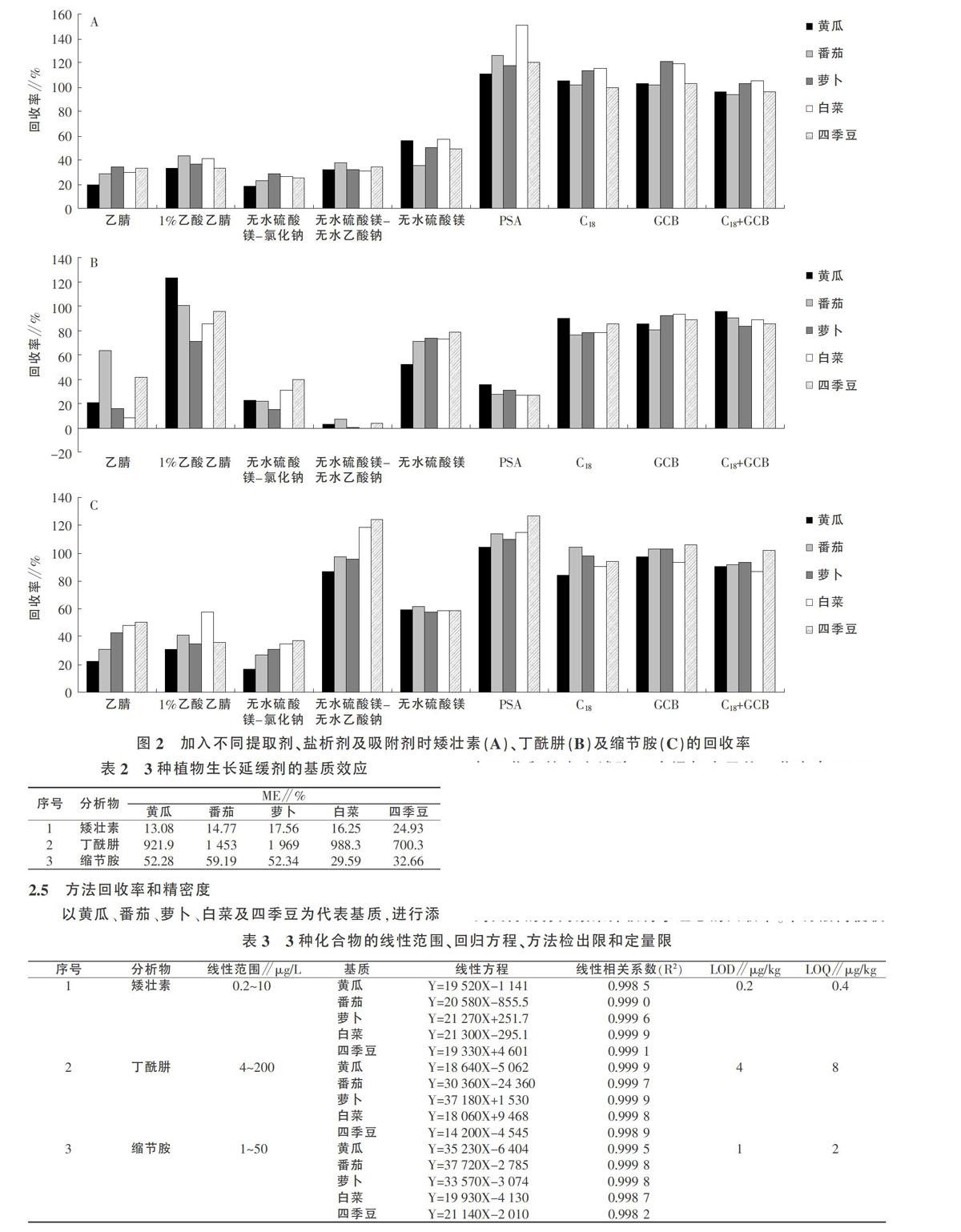
以黄瓜、番茄、萝卜、白菜及四季豆为代表基质,进行添加回收和精密度试验。3个添加水平的回收率在80.5%~109.0%之间,相对标准偏差(RSD)均不大于8.6%(表4)。
3 结论与讨论
本试验采用QuEChERS样品前处理技术,建立了蔬菜中3种强极性植物生长延缓剂的HILIC-MS/MS快速检测方法。对色谱分离条件及样品前处理方法均进行了优化,达到良好的分离效果并获得了理想的回收率。本方法简便快速,灵敏度和准确性高,应用于日常检测可以缩短检测周期,降低检测成本,对于完善蔬菜中植物生长延缓剂残留检测方法具有重要意义。
4 参考文献
[1] 张锋,潘康标,田子华.植物生长调节剂研究进展及应用对策[J].现代农业科技,2012(1):193-195.
[2] 朱杰丽,杨柳,柴振林,等.国内外植物生长调节剂限量标准分析研究[J].生物灾害科学,2013,36(2):232-237.
[3] 王岚,林海丹,徐娟,等.国内外植物生长调节剂残留限量标准的比对分析[J].广东农业科学,2015,42(3):70-73.
[4] 张洪霞,李锋格,李学文,等.加速溶剂萃取-固相萃取/超高效液相色谱-串联质谱法测定育苗基质中矮壮素与助壮素[J].分析测试学报,2012,31(5):559-563.
[5] 曹慧,陈小珍,张东雷,等.液相色谱-串联质谱法快速测定粮谷中矮壯素和敌草快残留量[J].理化检验:化学分册,2013,49(4):425-427.
[6] 粟有志,李芳,沙力,等.QuEChERS-液相色谱/串联质谱法测定果蔬及其制品中矮壮素和缩节胺残留[J]. 分析科学学报,2014(3):352-356.
[7] 楼飞,章寅,何亚斌,等.液相色谱-串联质谱法对蔬菜和水果中丁酰肼残留量的测定[J].现代农业科技,2012(16):307-308.
[8] PERIAT A,BOCCARD J,VEUTHEY J L,et al. Systematic comparison of sensitivity between hydrophilic interaction liquid chromatography and reversed phase liquid chromatography coupled with mass spectrometry[J].Journal of Chromatography A,2013,1312:49-57.
[9] 李瑞萍,袁琴,黄应平.硅胶色谱柱的亲水作用保留机理及其影响因素[J].色谱,2014,32(7):675-681.
[10] MELNIKOV S,HOLTZEL A,SEIDEL-MORGENSTERN A,et al.How ternary mobile phases allow tuning of analyte retention in hydrophilic interaction liquid chromatography[J].Analytical Chemistry,2013,85(18):8850-8856.
[11] KLINSUNTHORN N,PETSOM A,NHUJAK T.Determination of steroids adulterated in liquid herbal medicines using QuEChERS sample preparation and high-performance liquid chromatography[J].Journal of Pharmaceutical & Biomedical Analysis,2011,55(5):1175-1178.

