心血管疾病的基因治疗
丁秋蓉,陈彦好
(中国科学院上海生命科学研究院营养科学研究所,上海200031)
心血管疾病的基因治疗
丁秋蓉,陈彦好
(中国科学院上海生命科学研究院营养科学研究所,上海200031)
基因治疗在先天遗传性以及后天获得性心血管疾病治疗中均具有广阔的发展前景.对心血管疾病致病机理的深入认识和疾病基因组学研究的发展,进一步促进了临床前基因治疗的研究进展.但基因治疗过程中存在的机体细胞免疫反应、外源基因表达水平不足、在体基因转导效率低下等因素都成为基因治疗临床应用转化的瓶颈.近年来,基因导入载体和基因组编辑技术的发展为上述问题的改善和解决提供了新的思路.目前成族规律间隔短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)/Cas9基因组编辑技术已经成功应用于动物模型的在体基因编辑,达到了显著改善血脂指标的疗效.进一步研究体内组织特异和高效的基因导入方式,提高基因编辑的靶向效率和特异性,并建立全面有效的安全评估实验体系,将推动基因治疗向临床应用的转化.针对心血管疾病基因治疗中基因导入载体的研究以及CRISPR/Cas9基因组编辑技术的应用展开讨论.
心血管疾病;基因治疗;基因导入载体;CRISPR/Cas9基因组编辑技术
心血管疾病(cardiovascular disease,CVD)的发生严重危害着人类健康,每年有超过1 730万人死于CVD,占全球死亡总数的31%;并且患病人数呈持续上升趋势,预计到2030年,全球每年死于CVD的人数将会超过2 360万[1].虽然药物[2]和介入性治疗能有效缓解和改善CVD症状,但目前仍然迫切需要研发新的治疗方法来全面防治心血管疾病的发生.近年来,对CVD发生的致病基因及其分子机制的深入解析[3],使得通过基因治疗手段来调控特定基因表达水平和改善基因分子功能,从而达到防治CVD的策略成为一种可能.目前针对CVD的基因治疗方案的研究已取得很多进展,多项研究已经处于临床试验阶段[4].基因材料的选择、体内特定的导入方式、目的细胞类型、靶向基因等是影响基因治疗效果的主要方面[5-7].由于篇幅限制,本工作将针对不同基因载体在CVD基因治疗中的研究进行综述.此外,随着基因组编辑技术的飞速发展,通过基因组编辑技术直接在体内修复致病突变或者敲除特定基因进行CVD防治的潜在新基因方法也得到广泛关注,本工作也将就此展开讨论.
1 基因治疗载体
不同基因治疗载体如表1所示,表中AAV表示腺相关病毒(adeno-associated virus).
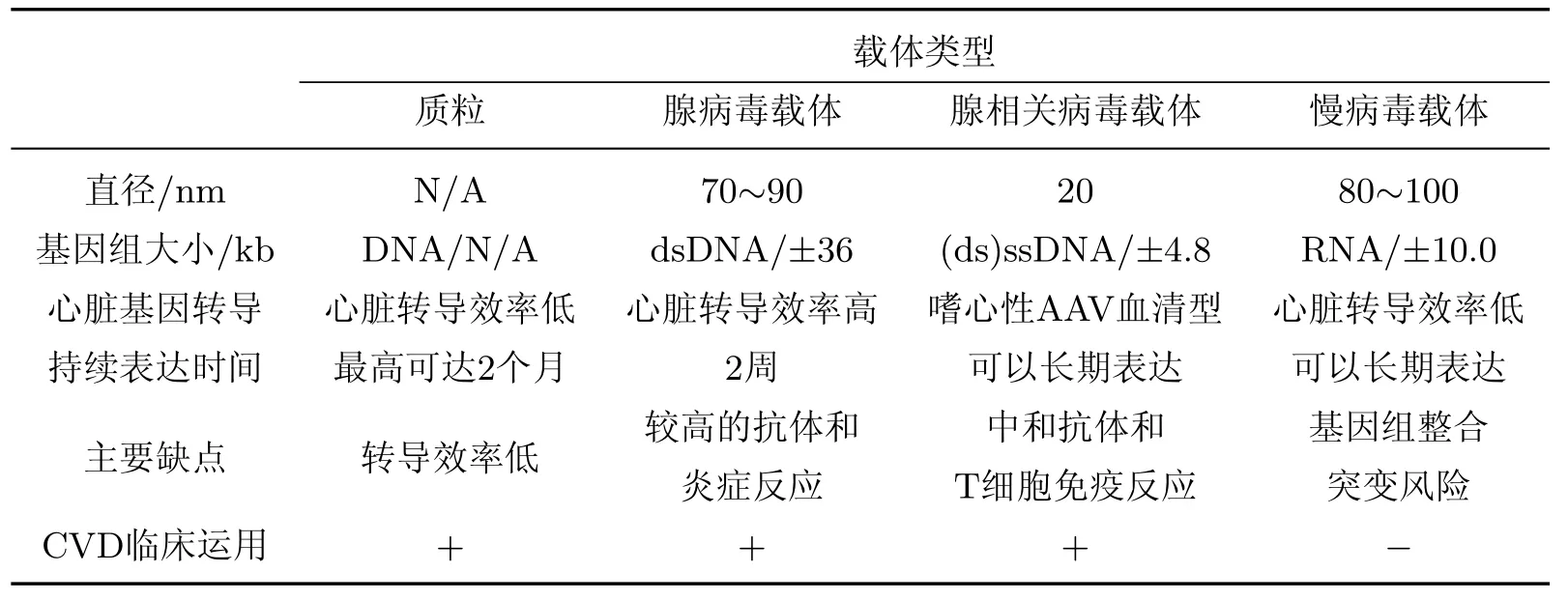
表1 不同基因治疗载体Table 1 Different gene delivery systems
1.1非病毒载体
非病毒载体导入由于避免了病毒载体潜在的安全隐患而具有独特的优势.但由于非病毒载体体内导入效率低下,因而基因治疗效果并不十分明显[8-9].目前已有多种研究策略用于提高非病毒载体的导入效率:例如相对单独的DNA导入、脂质体-DNA复合体的形成可以增加DNA稳定性,防止DNA被机体循环迅速清除[10];而以多聚L-赖氨酸和聚乙烯亚胺等聚合物为基础的多聚DNA复合体也能够保护DNA不被核酸酶消化,促进细胞对DNA的摄取[8].此外,超声波靶向微泡(ultrasound-targeted microbubbles,UTM)技术作为一种可行的质粒运载技术,具有低毒性和低免疫原性的特点,引起了更多学者的兴趣[11].尤其是在啮齿类动物模型中,进行冠状动脉结扎后,利用脂质微泡运输血管内皮生长因子(vascular endothelial growth factor,VEGF)和干细胞因子(stem cell factor,SCF)可以显著提高心室和心肌灌输的能力[12].相似地,在心梗大鼠模型中反复利用UTM运载SCF和干细胞衍生因子1a基因可以实现血管密度的增加、心肌功能的提高和梗死面积的减小[13].由于UTM没有明显的毒性,因此可以很好地适用于将微小RNA(microRNAs,miRNAs)运载入心肌细胞.在体外试验中,用UTM把miR-133运载到心肌细胞中可以实现心肌肥大的逆转[14].非病毒载体所面临的问题是相对较低的效率和较短的基因表达期,如何将这些研究成果运用到大型动物模型中并最终运用到临床是目前科学家们面临的一大挑战.
1.2病毒载体
病毒载体由遗传物质和环绕遗传物质的蛋白质衣壳或脂质囊膜组成.病毒载体通过识别并结合细胞表面的特异性受体进入细胞,最终将治疗基因运载到靶细胞中[15].衣壳和囊膜蛋白可以直接将治疗基因转运到细胞核并保护治疗基因不受溶酶体的降解[16].总体来说,病毒载体的效率比非病毒载体要高,具有长期表达治疗基因的潜力.并且,工程化的病毒载体已经剔除了核酸骨架上原有的病毒基因,除了早期的腺病毒载体仍然保留了一些残余的病毒基因外,其他病毒载体都完全不存在病毒基因,有效避免了病毒基因表达带来的安全隐患.但是,病毒载体的临床应用也面临诸多挑战[17],其中之一是机体对病毒载体和基因修饰后细胞发生的免疫反应[18],这种免疫反应会引起载体二次给药后的基因转移受到阻碍,基因体内表达时间缩短,甚至导致基因修饰的细胞被免疫清除.
目前主要的病毒载体包括以下3种.
1.2.1腺病毒载体
腺病毒(adenoviral,Ad)载体是无囊膜包被的、非整合性的双链DNA载体.Ad载体主要通过与柯萨奇-腺病毒受体(Coxsackie-adenovirus receptor,CAR)结合,由网格蛋白介导的内吞作用进入细胞,并随后将双链DNA运送到细胞核.Ad载体可以在大多数分裂和非分裂的细胞中高效转导外源基因,包括心肌细胞、骨骼肌细胞和平滑肌细胞等[19-21].Ad载体感染心脏细胞后转导基因的表达能力很强,但是表达的持续时间较短(1~2周)[22-23],限制了Ad载体在CVD中的应用.然而在缺血性心脏病[24]、外周动脉闭塞性疾病和肢体缺血[25]等疾病中,利用Ad载体能够短期促进血管生成,起到很好的治疗作用.Ad载体的一个主要缺点是会引发机体的炎症反应,继而影响Ad载体在临床试验中的导入效率和安全性[26-27].尤其在早期的Ad载体中,由于依然残留Ad病毒基因,从而在体内触发T细胞介导的免疫反应,使得基因修饰后的细胞被机体大量清除.最新一代的Ad载体通过清除载体中所有残留的Ad基因,降低了T细胞介导的免疫反应[28],但仍然会迅速激活先天免疫系统,造成显著的剂量限制性毒性[29].虽然通过导管介导的心肌内局部载体运输可以大大降低这种风险[30],但是与免疫系统激活相关的潜在风险依然存在[31],因此在人体中最终运用Ad载体进行基因治疗还需要进一步仔细评估.
1.2.2腺相关病毒(AAV)载体
AAV载体是一种单链DNA载体,具有良好的安全性,被认为是目前最具临床应用前景的病毒载体.AAV载体能够在包括心脏组织的在内的多种组织中持续表达转导基因[32-33].与Ad载体相比,AAV载体引起的机体炎症反应较弱,而这一优势让AAV载体在心脏疾病的基因治疗方面引起人们的广泛关注.目前已经发现了超过100种不同血清型的AAV载体[34].不同血清型的AAV由于独特的衣壳蛋白结构而表现出了独特的组织感染特异性[3],如AAV1,AAV6,AAV8和AAV9被认为是具有较高心脏特异性的血清型[35],主要用来感染心肌细胞,但是它们感染其他心脏细胞的能力(如心脏中成纤维细胞)还没有被系统评估.目前已经证明至少在小鼠中,AAV9是感染心脏细胞最有效的血清型[33,36-37].近期的研究利用小鼠模型报道了在单剂量静脉注射后,AAV9比AAV1增加了超过200倍的心肌转导效率[37],这证明了AAV9在心脏中转导基因的优越性.
1.2.3慢病毒载体
典型的慢病毒(lentivirus,LV)载体起源于Ⅰ型人类免疫缺陷病毒[38].LV载体是囊膜单链RNA载体,可以将自身基因组逆转录成互补DNA,并稳定整合到分裂和非分裂细胞的染色体上,因此LV载体非常适用于长期表达治疗基因[39].LV载体已经被成功运用于治疗单基因造血障碍症,并且获得了长期稳定的治疗效果[40-41].但由于LV载体体内感染心肌细胞的效率相对较低,因而限制了其在CVD治疗中的应用.这可能受到物种、年龄或导入方式等多种因素影响[42].因为LV载体可以将外源基因整合到靶细胞基因组上,存在触发插入癌变的内在风险,所以其安全性一直备受关注[43],但是这种风险也许可以通过优化载体的设计和靶细胞的类型来降低.
2 基于CRISPR/Cas9基因组编辑技术的基因治疗方案
2.1CRISPR/Cas9简介
成簇规律间隔短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)/Cas系统作为近年来发展迅速的新一代基因组编辑工具,由于其易于载体构建、靶向位点选择灵活、基因组编辑效率高,已成为潜在的用于基因治疗的新方案[44-46]. CRISRP/Cas系统中的Cas9和单链向导RNA(single guide RNAs,sgRNAs)复合体可以特异识别特定目标基因组序列,进行切割后形成DNA双链断裂(DNA double-stranded break,DSB).细胞继而通过非同源末端接合(non-homologous end-joining,NHEJ)或同源模板修复(homology-directed repair,HDR)对断裂DNA进行修复.利用这一生物学过程,研究人员可以:①通过在基因编码区引入移码突变对致病突变基因进行靶向敲除;②通过外源模板(单链或双链DNA)对致病基因突变进行定点修复;③通过同时靶向多个位点引入染色体结构变异,包括染色体区域缺失(deletion)、插入(insertion)、重复(duplication)、易位(translocation)和倒位(inversion)等,对染色体结构变异引起的遗传疾病进行针对性修复[47].相对于传统的化合物、单抗、RNAi以及基于基因过表达的基因治疗方案,基于基因组编辑技术的基因治疗方案由于可以从根本上修改基因组遗传信息,因此可能达到通过一次治疗彻底治愈疾病的疗效.
2.2体内导入载体
腺病毒载体能够在体内细胞中高效转导外源治疗基因,可以作为运载CRISPR/Cas9的备选载体.但如前所述,腺病毒存在较高的免疫原性,以及潜在基因组整合风险,是否能安全用于临床仍有待评估.相比之下,AAV载体由于其低免疫原性、低整合风险,以及基于特有血清型的较高组织特异性,在临床应用中具有较高的安全性,是CRISPR/Cas9系统体内导入的潜在载体.但是AAV载体能包装的外源DNA较小(约4.8 kb),而目前常用的Cas9核酸内切酶为来源于酿脓链球菌的SpCas9(Streptococcus pyogenes Cas9),大小约为4.2 kb,加上启动子、polyA终止序列,以及sgRNAs表达框,已远远超过了AAV载体的装载上限.解决该问题主要有两种策略:一种是将SpCas9进行功能域拆分,分别包装入2个AAV病毒,同时感染细胞后行使靶向切割功能;另一种是寻找新的分子量较小的Cas9核酸内切酶.Ran等[48]从金黄色葡萄球菌中筛选出分子量约为3.2 kb的相对较小的SaCas9(Staphylococcus aureus Cas9),能成功包装入AAV载体(见图1),从而进行有效的在体细胞编辑.图1中的ITR为末端反向重复序列(inverted terminal repeat);LP1为肝脏特异启动子(liver specific promoter 1);NLS为核定位序列(nuclear localization sequence);pA为多聚腺苷酸(poly A).此类载体目前已被成功用于肝脏和肌肉组织的在体基因编辑[48-51].此外,研究人员也在尝试利用脂质纳米载体(lipid nano particle)的非病毒载体方式进行Cas9信使RNA(messenger RNAs,mRNAs)的在体导入,协同AAV载体介导的sgRNAs和同源修复模板导入,可以针对小鼠肝脏细胞的致病突变进行一定比率的在体修复[52].
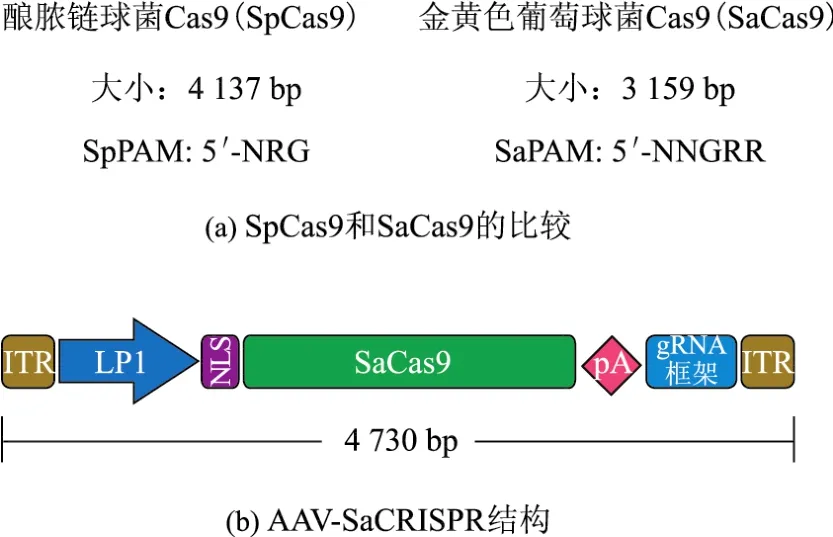
图1 AVV-SaCas9用于潜在的基因治疗Fig.1 AVV-SaCas9 for potential gene therapeutics
2.3靶向基因
基于基因组编辑技术的基因治疗方案期望从根本上改善基因组遗传信息,从而达到治疗效果.该技术对基因组遗传信息的改变是永久性的,因而靶向基因的选择尤为重要,基因信息的改变可能导致的副作用也需要进行充分评估.
本工作认为可作为基因组编辑治疗CVD的靶向基因或者基因组位点大致可以分为两大类.一类是诱发心血管疾病的遗传突变基因位点,这类突变大多会导致先天性心脏病的发生,利用CRISPR/Cas9技术进行在体基因突变修复是一种潜在的基因治疗方案.如长QT综合征(long QT syndrome,LQTS)是一种常染色体显性遗传先天性心脏病,多个基因的杂合突变均可能导致LQTS,其中一些基因突变位点和分子机制已经相对清晰,如编码钾离子电压门控通道的成孔亚基α蛋白的hERG基因突变.hERG基因主要在心肌、平滑肌等细胞类型中表达和行使功能,其突变会引发致命性的室性心律失常[53],利用CRISPR技术在体靶向修复心肌细胞中的hERG基因突变,可能成为治疗此类LQTS的一种有效策略.遗憾的是,由于目前利用CRISPR基因组编辑技术诱发同源重组进行点突变修复的效率仍然相对低下,且CRISRP技术在体导入心肌细胞的方式和效率也有待进一步摸索,因而此类研究仍处于初期探索阶段,尚未见相关报道.
另一类潜在的基因靶点同样来自人类遗传学研究,和上述致病基因突变位点不同的是,此类突变对心血管系统具有明显的保护作用.如PCSK9基因无义突变携带者血液中低密度胆固醇(low-density lipoprotein cholesterol,LDL-C)水平与正常人相比显著降低(一个等位基因的突变对应血液LDL-C含量降低30%~40%)[54-55];APOC3基因无义突变携带者血液中甘油三酯(triglyceride,TG)含量与正常人相比显著降低(一个等位基因突变对应血液TG含量降低约40%)[56];两种突变同时携带者的心脏病发病率比正常人降低80%以上,并且临床其他各项生理指标正常,提示抑制PCSK9和APOC3基因表达可以作为防治心血管疾病的潜在治疗方案.由于这两种基因主要在肝脏细胞中表达,一种设想是通过基因组编辑技术直接在体靶向肝脏细胞中的APOC3或者PCSK9基因,引入无义突变,继而从根本上抑制蛋白合成,达到长期稳定的治疗效果.作为验证性实验,已有研究通过腺病毒[7]或者AAV[48]在体导入CRISPR直接靶向小鼠肝脏的PCSK9基因,发现一次导入便能引起血液中分泌的PCSK9蛋白和血液胆固醇含量明显下降,提示该治疗方案的可行性.
2.4脱靶效应
由于基于基因组编辑技术的基因治疗方案可以从根本上改变基因组信息,非预期基因的永久性突变可能带来严重的副作用,因而对该方案可能存在的脱靶效应的全面评估显得尤为重要.关于CRISPR/Cas9技术可能存在的脱靶效应,研究人员进行了充分的研究和评估,结果表明影响脱靶效应高低的因素主要包括靶向DNA序列、Cas9在细胞内的表达时间和强度、靶向细胞类型等.目前已经研发出多种方法来降低CRISPR脱靶率,最常见的是对Cas9蛋白的改造,如将FokⅠ内切酶融合到无催化活性的dCas9蛋白上,以增加DNA识别特异性[57].同时,也可以通过优化sgRNAs序列设计、构建特异性表达启动子、利用非病毒载体降低表达时间等方式来进一步降低CRISPR的脱靶率.
值得一提的是,脱靶率的检测结果受检测方法敏感性和全面性的影响,现有的认识还不足以对具体的CRISRP靶向可能存在的脱靶效应作出准确预测,因而对CRISRP用于临床基因治疗可能存在的脱靶效应,需要有针对性地在所采用的具体靶向体系设置(如特定靶向DNA序列、靶向细胞、靶向导入方式等)中进行全面检测.由于临床前实验往往不能在人体中进行,基于人源小鼠的在体实验可以作为一个实验体系检测CRISRP体内靶向人类细胞的特异性和靶向效率,如大于70%的肝脏组织为人类肝脏细胞重建而成的肝脏人源小鼠可以被用于检测CRISPR在体靶向人肝脏组织中PCSK9基因的效率和可能存在的脱靶效应[58],继而对其向临床的转化作出更直接的评估.此外,全面的无偏向性的脱靶位点检测体系的建立也至关重要.如GUIDE-seq(genome-wide,unbiased identification of DSBs enabled by sequencing)体系可以通过捕获插入DSBs的双链寡核苷酸在全基因组范围内检测CRISPR导入后诱发的DSBs,以此评估CRISPR的脱靶效应[59].
3 展望
随着心血管疾病病理分子生物学、人类遗传学、合成生物学等多学科的快速发展,研究人员有望鉴定出新的有效靶向基因,研发出更安全的基因载体用于心血管疾病的基因治疗.同时,基因组编辑技术提供了一种新的潜在的基因治疗方案,可有针对性地提高该技术序列靶向效率和特异性,寻找体内组织和细胞特异、高效的导入方式,以及建立全面有效的安全评估实验体系,这将实际推动基因治疗向临床应用的转化.
[1]MOZAFFARIAN D,BENJAMIN E J,GO A S,et al.Heart disease and stroke statistics—2016 update a report from the American Heart Association[J].Circulation,2016,133(4):447-545.
[2]GHEORGHIADE M,PANG P S.Acute heart failure syndromes[J].J Am Coll Cardiol,2009,53(7):557-573.
[3]TILEMANN L,ISHIKAWA K,WEBER T,et al.Gene therapy for heart failure[J].Circ Res,2012,110(5):777-793.
[4]YEREVANIAN A,YEREVANIAN A,HAJJAR R J.Progress in gene therapy for heart failure[J].J Cardiovasc Pharm,2014,63(2):95-106.
[5]GAO M H,LAI N C,MIYANOHARA A,et al.Intravenous adeno-associated virus serotype 8 encoding urocortin-2 provides sustained augmentation of left ventricular function in mice[J]. Hum Gene Ther,2013,24(9):777-785.
[6]LAI N C,TANG T,GAO M H,et al.Improved function of the failing rat heart by regulated expression of insulin-like growth factorⅠvia intramuscular gene transfer[J].Hum Gene Ther,2012,23(3):255-261.
[7]DING Q R,STRONG A,PATEL K M,et al.Permanent alteration of PCSK9 with in vivo CRISPRCas9 genome editing[J].Circ Res,2014,115(5):488-492.
[8]SU C H,WU Y J,WANG H H,et al.Nonviral gene therapy targeting cardiovascular system[J]. Am J Physiol Heart C,2012,303(6):H629-H638.
[9]GYONGYOSI M,KHORSAND A,ZAMINI S,et al.NOGA-guided analysis of regional myocardial perfusion abnormalities treated with intramyocardial injections of plasmid encoding vascular endothelial growth factor A-165 in patients with chronic myocardial ischemia—subanalysis of the EUROINJECT-ONE multicenter double-blind randomized study[J].Circulation,2005,112(9):1157-1165.
[10]SCIMIA M C,CANNAVO A,KOCH W J.Gene therapy for heart disease:molecular targets,vectors and modes of delivery to myocardium[J].Expert Rev Cardiovasc Ther,2013,11(8):999-1013.
[11]FERRARA K,POLLARD R,BORDEN M.Ultrasound microbubble contrast agents:fundamentals and application to gene and drug delivery[J].Annu Rev Biomed Eng,2007,9:415-447.
[12]FUJII H,SUN Z,LI S H,et al.Ultrasound-targeted gene delivery induces angiogenesis after a myocardial infarction in mice[J].JACC Cardiovasc Imaging,2009,2(7):869-879.
[13]FUJII H,LI S H,WU J,et al.Repeated and targeted transfer of angiogenic plasmids into the infarcted rat heart via ultrasound targeted microbubble destruction enhances cardiac repair[J]. Eur Heart J,2011,32(16):2075-2084.
[14]GILL S L,O'NEILL H,MCCOY R J,et al.Enhanced delivery of microRNA mimics to cardiomyocytes using ultrasound responsive microbubbles reverses hypertrophy in an in-vitro model[J].Technol Health Care,2014,22(1):37-51.
[15]PETRUS I,CHUAH M,VANDENDRIESSCHE T.Gene therapy strategies for hemophilia:benefits versus risks[J].J Gene Med,2010,12(10):797-809.
[16]KAY M A.State-of-the-art gene-based therapies:the road ahead[J].Nat Rev Genet,2011,12(5):316-328.
[17]SCHNEIDER C K,SALMIKANGAS P,JILMA B,et al.Challenges with advanced therapy medicinal products and how to meet them[J].Nat Rev Drug Disc,2010,9(3):195-201.
[18]MINGOZZI F,HIGH K A.Immune responses to AAV vectors:overcoming barriers to successful gene therapy[J].Blood,2013,122(1):23-36.
[19]WASALA N B,SHIN J H,DUAN D S.The evolution of heart gene delivery vectors[J].J Gene Med,2011,13(10):557-565.
[20]PARKER A L,NICKLIN S A,BAKER A H.Interactions of adenovirus vectors with blood:implications for intravascular gene therapy applications[J].Curr Opin Mol Ther,2008,10(5):439-448.
[21]DU L,DRONADULA N,TANAKA S,et al.Helper-dependent adenoviral vector achieves prolonged,stable expression of interleukin-10 in rabbit carotid arteries but does not limit early atherogenesis[J].Hum Gene Ther,2011,22(8):959-968.
[22]HAJJAR R J.Potential of gene therapy as a treatment for heart failure[J].J Clin Invest,2013,123(1):53-61.
[23]WRIGHT M J,WIGHTMAN L M L,LATCHMAN D S,et al.In vivo myocardial gene transfer:optimization and evaluation of intracoronary gene delivery in vivo[J].Gene Ther,2001,8(24):1833-1839.
[24]KILIAN E G,SADONI S,VICOL C,et al.Myocardial transfection of hypoxia inducible factor-1 alpha via an adenoviral vector during coronary artery bypass grafting—a multicenter phaseⅠand safety study[J].Circ J,2010,74(5):916-924.
[25]MUONA K,MAKINEN K,HEDMAN M,et al.10-year safety follow-up in patients with local VEGF gene transfer to ischemic lower limb[J].Gene Ther,2012,19(4):392-395.
[26]GAHERY-SEGARD H,FARACE F,GODFRIN D,et al.Immune response to recombinant capsid proteins of adenovirus in humans:antifiber and anti-penton base antibodies have a synergistic effect on neutralizing activity[J].J Virol,1998,72(3):2388-2397.
[27]KRAUSE A,JOH J H,HACKETT N R,et al.Epitopes expressed in different adenovirus capsid proteins induce different levels of epitope-specific immunity[J].J Virol,2006,80(11):5523-5530.
[28]SCHIEDNER G,MORRAL N,PARKS R J,et al.Genomic DNA transfer with a high-capacity adenovirus vector results in improved in vivo gene expression and decreased toxicity[J].Nat Genet,1998,18(2):180-183.
[29]RAPER S E,CHIRMULE N,LEE F S,et al.Fatal systemic inflammatory response syndrome in aornithine transcarbamylase deficient patient following adenoviral gene transfer[J].Mol Genet Metab,2003,80(1/2):148-158.
[30]KASKI J C,CONSUEGRA-SANCHEZ L.Evaluation of ASPIRE trial:a phaseⅢpivotal registration trial,using intracoronary administration of Generx(Ad5FGF4)to treat patients with recurrent angina pectoris[J].Expert Opin Biol Ther,2013,13(12):1749-1753.
[31]CHUAH M K,COLLEN D,VANDENDRIESSCHE T.Biosafety of adenoviral vectors[J].Curr Gene Ther,2003,3(6):527-543.
[32]MINGOZZI F,HIGH K A.Therapeutic in vivo gene transfer for genetic disease using AAV:progress and challenges[J].Nat Rev Genet,2011,12(5):341-355.
[33]VANDENDRIESSCHE T,THORREZ L,ACOSTA-SANCHEZ A,et al.Efficacy and safety of adenoassociated viral vectors based on serotype 8 and 9 vs.lentiviral vectors for hemophilia B gene therapy[J].J Thromb Haemost,2007,5(1):16-24.
[34]GAO G P,VANDENBERGHE L H,ALVIRA M R,et al.Clades of adeno-associated viruses are widely disseminated in human tissues[J].J Virol,2004,78(12):6381-6388.
[35]ZINCARELLI C,SOLTYS S,RENGO G,et al.Comparative cardiac gene delivery of adeno-associated virus serotypes 1—9 reveals that AAV6 mediates the most efficient transduction in mouse heart[J].Cts Clin Transl Sci,2010,3(3):81-89.
[36]INAGAKI K,FUESS S,STORM T A,et al.Robust systemic transduction with AAV9 vectors in mice:efficient global cardiac gene transfer superior to that of AAV8[J].Mol Ther,2006,14(1):45-53.
[37]PACAK C A,MAH C S,THATTALIYATH B D,et al.Recombinant adeno-associated virus serotype 9 leads to preferential cardiac transduction in vivo[J].Circ Res,2006,99(4):E3-E9.
[38]COORAY S,HOWE S J,THRASHER A J.Retrovirus and lentivirus vector design and methods of cell conditioning[J].Method Enzymol,2012,507:29-57.
[39]MATRAI J,CHUAH M K L,VANDENDRIESSCHE T.Recent advances in lentiviral vector development and applications[J].Mol Ther,2010,18(3):477-490.
[40]AIUTI A,BIASCO L,SCARAMUZZA S,et al.Lentiviral hematopoietic stem cell gene therapy in patients with Wiskott-Aldrich syndrome[J].Science,2013,341(6148):1233151.
[41]BIFFI A,MONTINI E,LORIOLI L,et al.Lentiviral hematopoietic stem cell gene therapy benefits metachromatic leukodystrophy[J].Science,2013,341(6148):1233158.
[42]VANDENDRIESSCHE T,THORREZ L,NALDINI L,et al.Lentiviral vectors containing the human immunodeficiency virus type-1 central polypurine tract can efficiently transduce nondividing hepatocytes and antigen-presenting cells in vivo[J].Blood,2002,100(3):813-822.
[43]PAPAYANNAKOS C,DANIEL R.Understanding lentiviral vector chromatin targeting:working to reduce insertional mutagenic potential for gene therapy[J].Gene Ther,2013,20(6):581-588.
[44]CONG L,RAN F A,COX D,et al.Multiplex genome engineering using CRISPR/Cas systems[J]. Science,2013,339(6121):819-823.
[45]MALI P,YANG L H,ESVELT K M,et al.RNA-guided human genome engineering via Cas9[J]. Science,2013,339(6121):823-826.
[46]CERMAK T,DOYLE E L,CHRISTIAN M,et al.Efficient design and assembly of custom TALEN and other TAL effector-based constructs for DNA targeting[J].Nucleic Acids Res,2011,39(12):e82.
[47]韦余达,李爽,刘改改,等.基因组编辑技术在干细胞疾病模型建立和精准医疗中的应用[J].遗传,2015(10):983-991.
[48]RAN F A,CONG L,YAN W X,et al.In vivo genome editing using Staphylococcus aureus Cas9[J].Nature,2015,520(7546):186-198.
[49]LONG C,AMOASII L,MIREAULT A A,et al.Postnatal genome editing partially restores dystrophin expression in a mouse model of muscular dystrophy[J].Science,2016,351:400-403.
[50]NELSON C E,HAKIM C H,OUSTEROUT D G,et al.In vivo genome editing improves muscle function in a mouse model of Duchenne muscular dystrophy[J].Science,2016,351:403-407.
[51]TABEBORDBAR M,ZHU K,CHENG J K,et al.In vivo gene editing in dystrophic mouse muscle and muscle stem cells[J].Science,2016,351:407-411.
[52]YIN H,SONG C Q,DORKIN J R,et al.Therapeutic genome editing by combined viral and nonviral delivery of CRISPR system components in vivo[J].Nat Biotechnol,2016,34(3):328-333.
[53]VANDENBERG J I,PERRY M D,PERRIN M J,et al.hERGK(+)channels:structure,function,and clinical significance[J].Physiol Rev,2012,92(3):1393-1478.
[54]JONATHAN C,PERTSEMLIDIS A,KOTOWSKI I K,et al.Low LDL cholesterol in individuals of African descent resulting from frequent nonsense mutations in PCSK9[J].Nat Genet,2005,37(2):161-165.
[55]COHEN J C,BOERWINKLE E,MOSLEY T H,et al.Sequence variations in PCSK9,low LDL,and protection against coronary heart disease[J].New Engl J Med,2006,354(12):1264-1272.
[56]JORGENSEN A B,FRIKKE-SCHMIDT R,NORDESTGAARD B G,et al.Loss-of-function mutations in APOC3 and risk of ischemic vascular disease[J].New Engl J Med,2014,371(1):32-41.
[57]WYVEKENS N,TOPKAR V V,KHAYTER C,et al.Dimeric CRISPR RNA-guided FokI-dCas9 nucleases directed by truncated gRNAs for highly specific genome editing[J].Hum Gene Ther,2015,26(7):425-431.
[58]WANG X,RAGHAVAN A,CHEN T,et al.CRISPR-Cas9 targeting of PCSK9 in human hepatocytes in vivo[J].Arterioscler Thromb Vasc Biol,2016,pii:ATVBAHA.116.307227.
[59]TSAI S Q,ZHENG Z,NGUYEN N T,et al.GUIDE-seq enables genome-wide profiling of off-target cleavage by CRISPR-Cas nucleases[J].Nat Biotechnol,2015,33(2):187-197.
Gene therapy for cardiovascular disease
DING Qiurong,CHEN Yanhao
(Institute for Nutritional Sciences,Shanghai Institutes for Biological Sciences,Chinese Academy of Sciences,Shanghai 200031,China)
Gene therapy shows great promise in the treatment of both inherited and acquired cardiovascular diseases.Identification of key molecule players in pathophysiology of cardiovascular disease and development of human disease genomic research lead to encouraging preclinical gene therapy studies in animal models.However,the presence of cellular immune responses,insufficient gene expression level and overall limited in vivo gene transduction efficiencies have hampered the translational progress to clinical use of gene therapy.In recent years,improvements in gene delivery system and discovery of advanced genome editing technologies open new therapeutic perspectives,with clustered regularly interspaced short palindromic repeats(CRISRP)/Cas9 genome editing technology already being successfully used in animal models to treat hypercholesterolemia.Further improvement in gene delivery efficiency,increase in targeting specificity of genome editing tools,and establishment of experimental systems for a thorough analysis of potential safety problems would help eventually bring gene therapy for heart disease to reality.In this review,recent advances in the use of different delivery vectors and CRISPR/Cas9 genome editingtechnology in gene therapy research to treat cardiovascular diseases are discussed.
cardiovascular disease;gene therapy;gene delivery vector;CRISPR/Cas9 genome editing technology
Q 789
A
1007-2861(2016)03-0270-10
10.3969/j.issn.1007-2861.2016.03.013
2016-04-19
上海市浦江人才计划资助项目(15PJ1409200)
丁秋蓉(1981—),女,教授,博士生导师,博士,研究方向为干细胞与转化医学. E-mail:qrding@sibs.ac.cn

