生物表面活性剂产生菌的筛选及产物性能研究
石金礼,张言诚,张力浩,周 静,周丽娜,李辉信,胡 锋,徐 莉
(南京农业大学资源与环境科学学院,南京 210095)
生物表面活性剂产生菌的筛选及产物性能研究
石金礼,张言诚,张力浩,周静,周丽娜,李辉信,胡锋,徐莉*
(南京农业大学资源与环境科学学院,南京 210095)
筛选获得一株生物表面活性剂产生菌,经生理生化与16S rDNA鉴定,获得菌株为铜绿假单胞菌147(Pseudomonas aeruginosa 147)。发酵产物经过薄层色谱、红外扫描分析其发酵产物为糖脂类生物表面活性剂(Biosurfactant,BS),单因素最佳发酵条件优化为碳源、氮源和碳氮比分别为花生油、硫酸铵和25∶1,最佳培养温度为30℃,pH值为8,NaCl浓度为5 g·L-1。在最佳条件下培养36 h,发酵液的表面张力值比原来降低了42.08 mN·m-1,且能平稳保持至144 h。在108 h细菌生物量最大,为2.63 g·L-1,此时产生的糖脂最多,可达2.02 g·L-1。生物表面活性剂对不同环数的多环芳烃类物质(荧蒽、芘、苯[a]芘)的增溶效果实验表明:随生物表面活性剂添加量的增大,不同PAHs溶解度均增大;相同浓度生物表面活性剂添加条件下,高环多环芳烃(苯[a]芘)的增溶效果低于低环多环芳烃(荧蒽、芘)。
生物表面活性剂;多环芳烃;发酵条件优化;增溶
石金礼,张言诚,张力浩,等.生物表面活性剂产生菌的筛选及产物性能研究[J].农业环境科学学报,2016,35(9):1717-1726.
SHI Jin-li,ZHANG Yan-cheng,ZHANG Li-hao,et al.Screening of a biosurfactant-producing bacterium and biosurfactant characteristics[J].Journal of Agro-Environment Science,2016,35(9):1717-1726.
多环芳烃(Polycyclicaromatichydrocarbons,PAHs)是一类由2个或2个以上苯环组成的稠环化合物。其水溶性低,易吸附于固体颗粒,能够长期存在于环境中,是一类持久性有机污染物[1-2],也是美国国家环境保护局(U.S.Environmental Protection Agency)确定的优先控制的污染物。由于PAHs高脂溶性,低生物可利用性,使得人们将其用于环境中的修复措施和效果存在局限。因此通过利用表面活性剂的胶团化作用,显著提高疏水性有机化合物在水相中的表观溶解度,从而提高其生物有效性,促进修复效果的表面活性剂强化修复技术(Surfactant enhanced remediation,SER)引起人们的关注[3-5]。
目前在有机污染修复过程中使用的多为化学表面活性剂。由于化学表面活性剂不易降解、易造成二次污染、对土壤微生物产生毒害风险,限制了其在环境修复中的应用[6]。生物表面活性剂以其具有降低表面张力、稳定乳化液等的作用,其主要成分糖脂、磷脂、脂蛋白或脂肽类化合物、高分子化合物和脂多糖,能够被生物完全降解,安全无毒,且用量少,发酵成本低,逐渐成为研究热点[7]。已有文献报道通过筛选产表面活性剂的细菌,并将其应用于多环芳烃污染的修复[8]。
生物表面活性剂合成方式包括动植物细胞内提取法、酶合成法、微生物发酵法。然而,动植物细胞内提取法受到原料来源的制约,难以大规模生产,酶合成法所用酶制剂的价格亦极大限制了其发展。相比而言,微生物发酵以其生产工艺简单、经济安全的特点,成为重要的生物表面活性剂来源。目前,已有很多微生物被发现能够产生生物表面活性剂,如细菌类球拟酵母(Torulopsis bombicola)、枯草芽孢杆菌(Bacillus subtilis)、铜绿假单胞菌(Pseudomonas aerug-inosa)[9],其中铜绿假单胞菌已有Pseudomonas cepacia CCT6659[10]、Pseudomonas aeruginosa S6[11]等见诸报道。它们产生的生物表面活性剂是目前在多环芳烃污染土壤修复,石油污染修复等应用较多[12],生物表面活性剂在增溶多环芳烃时具有生物降解性、低毒性、适应极端环境的优势[13]。
本研究以PAHs为目标污染物,筛选产生物表面活性剂的菌株,并分析发酵产物为生物表面活性剂,优化发酵条件,探讨菌株产生的生物表面活性剂对典型多环芳烃荧蒽、芘、苯[a]芘的增溶作用,研究结果将为PAHs污染环境的修复技术研究提供菌株资源和基础理论支撑。
1 材料与方法
1.1供试土壤
采集南京炼油厂附近土样、北京某加油站附近土样、南京某河底淤泥和南京某湖底淤泥为土壤样品。
1.2供试培养基与试剂
富集培养基:(NH4)2SO410.00 g,KCl 1.10 g,KH2PO43.40 g,K2HPO44.40 g,MgSO40.50 g,EDTA 1.00 g,酵母粉0.50 g,液体石蜡5.00 mL,pH 7.0~7.4,FeSO4·7H2O 0.01 g,用蒸馏水定容到1.00 L。
LB液体培养基:10.00 g蛋白胨,5.00 g酵母粉,10.00 g氯化钠,用无菌水定容至1.00 L。
LB固体培养基:在LB液体培养基加入15.00~ 20.00 g琼脂粉。
无机盐培养基:(NH4)2SO41.00 g,NaCl 10.00 g,KH2PO40.20 g,K2HPO40.80 g,MgCl20.50 g,CaCl20.05 g,FeCl20.01 g。
血平板培养基:购自南京便诊生物科技有限公司。
实验试剂:甲醇为色谱纯,花生油为食用级,其他试剂均为分析纯。
1.3细菌筛选和鉴定
1.3.1表面活性剂产生菌血平板初筛
取5.00 g新鲜土样置于装有45 mL富集培养基的250 mL三角瓶中,28℃、150 r·min-1摇床培养7 d,待培养液混浊后,吸取5 mL培养液重新转接入新的富集培养基中,按上述条件培养,转接3次。后经浓度梯度稀释,100μL涂布于血平板,30℃培养48h,选择透明圈较大的菌落,分离纯化,4℃保存。
1.3.2表面张力仪复筛
将上述纯化的菌种接种于LB液体培养基中,200 r·min-1、30℃培养96 h后,用表面张力仪测定细菌发酵液的表面张力[14]。
1.3.3细菌鉴定
基于细菌形态与生理生化结果,根据《伯杰氏细菌鉴定手册》做出初步鉴定。同时将菌株用LB液体培养基培养至对数生长期,离心法收集菌体,并采用SDS-CTAB法提取总基因组DNA,以细菌通用引物27F和1492R进行16S rDNA的PCR扩增,运用分子学鉴定菌株[15]。
1.4生物表面活性剂的提取、鉴定和临界胶束浓度测定
取培养72 h的细菌发酵液在4℃、5000×g离心30 min,取上清液用1 mol·L-1HCl调节pH为2.0,然后加入等体积的三氯甲烷/甲醇(2∶1,V∶V)混匀,萃取三次合并有机相,用无水硫酸钠干燥后,45℃旋转蒸发除去有机溶剂,得到浅黄色浆状物,即为生物表面活性剂粗产物[10]。
薄层色谱:取0.2 g提取的上述粗产物溶于1 mL的氯仿中,点样于硅胶G板进行薄层色谱分析,三氯甲烷/甲醇/水(65∶15∶1,V∶V)为展开剂,用不同的显色剂显色。(1)苯酚-硫酸试剂:3 g苯酚与5 mL硫酸溶解于95 mL乙醇中,如果显棕色斑点,则有糖脂存在,反之糖脂不存在;(2)茚三酮显色剂:0.5 g茚三酮溶于100 mL丙酮中,如果斑点显红色,则有脂肽存在,反之脂肽不存在[16-17]。
红外扫描分析(Fouriertransforminfraredspectrometer,FT-IR):将生物表面活性剂粗产品溶于三氯甲烷后,在制备型硅胶薄板上进行分离,依照显色带位置刮下目的硅胶层,用三氯甲烷/甲烷(1∶1,V∶V)提取后于40℃下减压蒸干,得到部分纯化的生物表面活性剂。将上述生物表面活性剂溶于甲醇,采用KBr压片法(1~2 mg样品+200 mgKBr,干燥处理后研细),混合压成透明薄片后红外扫描分析测定[18-20]。
发酵产物临界胶束浓度测定(Critical micelle concentration,CMC):精确称取上述提取所得的产物粗品溶于蒸馏水中,配制成不同浓度梯度(0~500 mg·L-1)的产物溶液,测定溶液的表面张力,并依据表面活性剂浓度-表面张力曲线求得临界胶束浓度值。
1.5细菌发酵条件优化
1.5.1测定指标
发酵液表面张力值以吊环法测定[21],乳化性能采用超声体积比法测定[22]。发酵液培养后,离心收集菌体,于105℃烘干至恒重后称重,以菌体干重表示生物量。发酵液培养后,离心收集上清液,用等体积乙酸乙酯萃取2次后,45℃减压蒸干,将残余物溶于等体积的0.05 mol·L-1NaHCO3中,以硫酸苯酚法[23]测定糖脂含量。
1.5.2碳源对菌株生长及产生表面活性剂的影响
取150 mL三角瓶,每瓶中加入50 mL无机盐培养基,分别加入10 g·L-1的葡萄糖、甘油、花生油、可溶性淀粉、液体石蜡、麦芽糖、乳糖、蔗糖(对照组不加碳源)。3 d后分别测定发酵液的表面张力值、乳化性、生物量、糖脂含量。每个处理三次重复。
1.5.3氮源对菌株生长及产生表面活性剂的影响
以碳源实验中获得的最优碳源作为选定碳源,取10 g碳源加入1 L不含(NH4)2SO4无机盐培养基中。取150 mL三角瓶,每瓶中加入50 mL上述培养基,分别加入2 g·L-1的硝酸钠、硫酸铵、脲、硝酸铵(对照组不加氮源)。3 d后分别测定发酵液的表面张力值、乳化性、生物量、糖脂含量。每个处理三次重复。
1.5.4碳氮比对菌株生长及产生表面活性剂的影响
取150 mL三角瓶,每瓶中加入50 mL含不同碳氮源的无机盐培养基。固定氮源为2 g·L-1,分别加入已优化的碳源,控制比例为1、5、10、15、20、25、30、35、40(对照组不加氮源)。3 d后分别测定发酵液的表面张力值、乳化性、生物量、糖脂含量。每个处理三次重复。
1.5.5温度对菌株生长及产生表面活性剂的影响
取150 mL三角瓶,每瓶中加入50 mL上述已优化的无机盐培养基。控制摇床温度在15℃、20℃、25℃、30℃、35℃、40℃。3 d后分别测定发酵液的表面张力值、乳化性、生物量、糖脂含量。每个处理三次重复。
1.5.6 pH对菌株生长及产生表面活性剂的影响
取150 mL三角瓶,每瓶中加入50 mL上述已优化的无机盐培养基。控制培养基pH为4、5、6、7、8、9、10、11、12、13。3 d后分别测定发酵液的表面张力值、乳化性、生物量、糖脂含量。每个处理三次重复。
1.5.7NaCl浓度对菌株生长及产生表面活性剂的影响
取150 mL三角瓶,每瓶中加入50 mL上述已优化的无机盐培养基。控制培养基NaCl浓度为0、5、10、15、20、25、30、50、80、120、160 g·L-1。3 d后分别测定发酵液的表面张力值、乳化性、生物量、糖脂含量。每个处理三次重复。
1.5.8菌株147发酵动态图
取150 mL三角瓶,每瓶中加入50 mL上述已优化的无机盐培养基。在12、24、36、48、60、72、84、96、108、120、132、144 h后分别测定发酵液的表面张力值、乳化性、生物量、糖脂含量。每个处理三次重复。
1.6生物表面活性剂对多环芳烃增溶效果
25 mL三角瓶中加入过量的苯并[a]芘、芘、荧蒽和10 mL不同浓度的生物表面活性剂粗产物溶液,然后加入0.02%的叠氮化钠抑制微生物的生长。盖好塞子并用封口膜封口后,25℃、50 r·min-1振荡48 h后,将溶液转移至离心管中5000 r·min-1离心15 min,取上清液加入等体积的二氯甲烷∶正己烷=1∶1(V∶V)萃取3次,收集洗脱液并于40℃浓缩至干,用甲醇定容到2 mL,过0.22 μm孔径滤膜后HPLC分析[24]。
2 结果与讨论
2.1生物表面活性剂产生菌的筛选和鉴定
经过血平板初筛得到25株菌株,表1是表面张力仪复筛结果。可以发现147号细菌发酵液的张力值明显低于其他菌株,选择147细菌作为目标菌株。
观察菌株培养特征及形态特征,可见菌体细长且长短不一,菌落较小,为扁平、湿润的菌落。部分生理生化指标如表 2。经 16S rDNA测试并与GenBank中已登录的核苷酸序列号进行同源性比较,发现菌株147与Pseudomonas aeruginosa DSM50071同源性为99%,采用MEGA 5.10软件NJ方法构建147的16S rDNA系统发育树见图1。结合生理生化特征结果,将菌株147鉴定为铜绿假单胞菌(Pseudomonas aeruginosa),该菌株 GenBank登录号为KU921686。

表1 细菌复筛结果Table 1 Bacterium screening
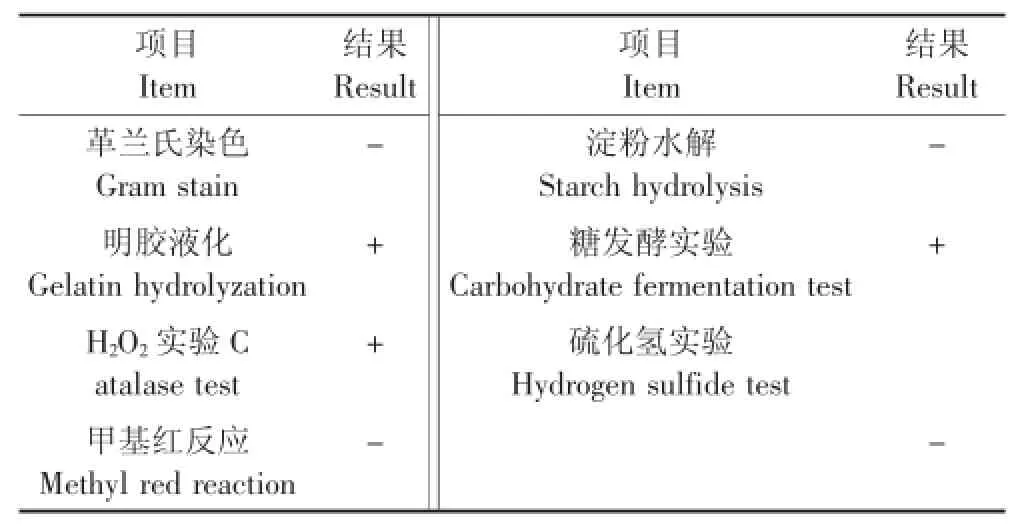
表2 147菌株的生理生化特性Table 2 Physiological characteristics of strain 147
2.2147细菌产生表面活性剂的物质结构鉴定
通过薄层色谱分析显示,苯酚-硫酸试剂有棕色斑点,加入茚三酮显色剂则无明显变化。这说明该菌株主要产糖脂类生物表面活性剂,不产生或者产生少量的脂肽类物质。
将菌株147产物提纯,红外光谱仪(FT-IR)分析物质结构,结果如图2。该物质在3701.72cm-1处有吸收峰,表明分子中有羟基存在;2 858.77~2 927.56 cm-1处的吸收峰表明存在糖类C-H的伸缩振动,1400~1200 cm-1处是C-H变角振动,1 734.39 cm-1处是C=O的双键振动,而1 070.04 cm-1处为C-O-C键伸缩振动,因此该物质中有一个五元环状内酯和糖苷键存在。由此进一步证明该生物表面活性剂含糖脂类物质。
发酵产物临界胶束浓度是指分子在溶剂中缔合形成胶束的最低浓度。临界胶束浓度(Critical micelle0.005 concentration,CMC)可以作为表面活性剂表面活性的一种度量,CMC越小,改变表/界面性质,起到增溶、乳化等所需的浓度就越低。从图3可以看出:糖脂在0~300 mg·L-1时,表面张力值随着糖脂浓度的升高而降低,且在300 mg·L-1时达到最小值;在300~500 mg·L-1时,表面张力值变化不大。可得发酵粗提产物的CMC为300 mg·L-1,明显低于普通化学表面活性剂十二烷基磺酸钠(SDS)的2200 mg·L-1[25],能在较低浓度下使用,因而在医药、食品、化工等行业具有广阔应用前景。

图1 147菌株16S rDNA基因序列系统发育树Figure 1 Phylogenetic tree established using the neighbor-joining method,based on 16S rDNA sequence of strain 147 and the related strains

图2 147菌株产的生物表面活性剂红外光谱图Figure 2 Fourier transform infrared spectrum of biosurfactant produced by strain 147

图3 不同浓度生物表面活性剂溶液的表面张力Figure 3 Surface tensions of biosurfactant solution at different concentrations
2.3147细菌发酵条件优化
2.3.1碳源的影响
碳源对细菌的生长与发酵产物量有重要影响。铜绿假单胞菌(Pseudomonas aeruginosa)可在多种类型碳源下产生生物表面活性剂,包括甘油、乙醇、植物油等。由表3可知,以花生油为碳源,细菌发酵液的降低值为39.12 mN·m-1,明显高于其他碳源类型;乳化值为34.17%,稍高于其他碳源,此时细菌生物量最大,糖脂含量最高,为0.30 g·L-1。虽然花生油作为碳源,能够促进菌株产生更多生物表面活性剂,但如果用于实际生产,成本相对较高,近年来一些研究者尝试使用成本较低的工业副产物如糖蜜、废润滑油等作为碳源,发现也具有很好的促进微生物产生生物表面活性剂的作用[26]。因此,后期会考虑选择用一些低成本碳源进行发酵。
2.3.2氮源的影响
细胞表面的物质合成需要氮源,氮源的种类会对细菌细胞的生长和发酵产物的产量产生很大影响[27]。由表4可以看出,不同氮源对细菌发酵过程中表面张力降低值的影响较小,可能与发酵液中的生物表面活性剂含量已经达临界胶束浓度(CMC)有关[28-29]。当氮源为硫酸铵时发酵液表面张力降低值最大,同时乳化性、细菌干重、糖脂含量均达到最大值。这与钱晓勇等[30]研究结果一致,硫酸铵是促进生物表面活性剂生成的较好氮源。

表3 碳源对147细菌生长以及生物表面活性剂产量的影响Table 3 Effect of carbon sources on growth and biosurfactant production by strain 147

表4 氮源对147细菌生长以及生物表面活性剂产量的影响Table 4 Effect of nitrogen source on growth and biosurfactant production by strain 147
2.3.3碳氮比的影响
由表5可以发现当碳氮比在5以上时,表面张力降低值与乳化性变化不大,而细菌干重与生物表面活性剂含量却明显不同,说明当碳氮比大于5时,该菌株生物表面活性剂产量已经超过临界胶束浓度。细菌干重在碳氮比为25时最大,为2.58±0.09 g·L-1,同时生物表面活性剂含量也达到最大,为1.74±0.01 g·L-1。这与Saimmai等[26]研究结果一致,25是147菌株的最适生长碳氮比,此时细菌的生物量达到最高,生物表面活性剂产量也最高。
2.3.4温度的影响
温度是影响菌株发酵产物产量的重要环境因素之一。不同细菌的最适生长温度不同。一般细菌在4℃停止生长,在30℃左右生长良好。已报道的铜绿假单胞菌(Pseudomonas aeruginosa)最适温度一般在27~37℃[31-32]。由图4可以看到,表面张力值、生物量和生物表面活性剂产量都随着温度的升高呈现先升高后降低的趋势,在30℃时达到最大。乳化性在15℃到30℃时保持相对稳定,在30℃到40℃时乳化性降低。实际上大多数铜绿假单胞菌的最佳培养温度都在27~37℃[31],与实验结果相符。

图4 温度对147细菌生长以及生物表面活性剂产量的影响Figure 4 Effect of temperature on growth and biosurfactant production by strain 147

表5 碳氮比对147细菌生长以及生物表面活性剂产量的影响Table 5 Effect of C∶N ratio on growth of and biosurfactant production by strain 147
2.3.5pH的影响
pH值也是影响菌株发酵产物产量的因素之一。由图5可见,细菌的生物量在pH=8的时候达到最大,且在pH8~10的时候基本平稳;表面张力值、生物表面活性剂含量与乳化性均在pH=8的时候达到最大值,两侧均有不同程度的下降。因此该菌株倾向偏碱性的条件生存,与强婧等[11]筛选的Pseudomonas aeruginosa S6最适pH一致。综合其他报道的生物表面活性剂产生菌的最适pH范围,大部分微生物都在pH6.2~8之间。
2.3.6NaCl浓度的影响

图5 pH对147细菌生长以及生物表面活性剂产量的影响Figure 5 Effect of pH on growth of and biosurfactant production by strain 147
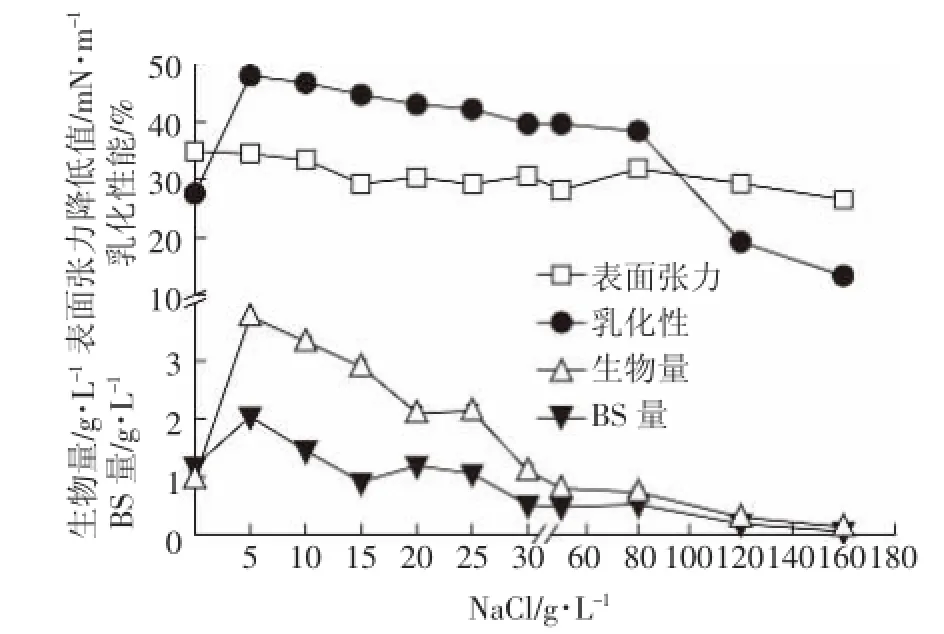
图6 NaCl浓度对147细菌生长以及生物表面活性剂产量的影响Figure 6 Effect of NaCl concentrations on growth of and biosurfactant production by strain 147
NaCl浓度通过改变细胞渗透压影响微生物的生长与代谢[33-34],从而影响发酵产物的产量。由图6可见,盐浓度在0~5 g·L-1之间,细菌生长受到促进,而当盐浓度大于5 g·L-1时,细菌的生长受到抑制,糖脂量与生物量趋势一致。菌株的生物量、生物表面活性剂量、表面张力值与乳化性均在盐浓度为5 g·L-1时呈现最大,说明该菌株具有一定的耐盐性,与强婧等[11]研究的生物表面活性剂产生菌Pseudomonas aeruginosa S6也能够耐盐相似。此外,本菌株在最高为25 g·L-1的盐浓度条件下依然能够存活,但此时已不能产生更多的生物表面活性剂。
2.3.7细菌发酵动态
在上述花生油25 mL·L-1为碳源、硫酸铵1 g·L-1为氮源、NaCl浓度为5 g·L-1、pH=8、温度保持为30℃的最佳培养条件下,追踪细菌147的发酵动态(图7)。菌株经过短暂的延滞期后进入对数生长期,108 h后进入稳定增长期,此时菌体所产生的生物表面活性剂含量达到最大,此后生物表面活性剂含量减少,可能是因为后期培养基内的碳源已经用尽,细菌开始以胞外分泌物糖脂为碳源维持生命。而表面张力值与乳化性在24 h后达到最大,之后维持在稳定水平,说明细菌在24 h后产生的生物表面活性剂已到达生物表面活性剂的临界胶束浓度,此后生物表面活性剂产量还会增加,但是表面张力降低值与乳化性只维持在一定范围内波动。

图7 铜绿假单胞菌147菌株的发酵动态Figure 7 Dynamic curves of Pseudomonas aeruginosastrain 147 fermentation
最佳培养条件下,本实验细菌生物量最高能达到5.22 g·L-1(表6),生物表面活性剂量达到5.09 g·L-1。相对已报道的几株铜绿假单胞菌(Pseudomonas aeruginosa)合成生物表面活性剂的产率在2.12~15.92 g·L-1范围内,本菌株的产表面活性剂能力居中。

表6 几株铜绿假单胞菌合成生物表面活性剂的产率比较Table 6 Comparison of biosurfactant production by several Pseudomonas aeruginosa strains
2.4生物表面活性剂对多环芳烃增溶效果
图8是水相中多环芳烃(苯并[a]芘、芘、荧蒽)的表观溶解度随着生物表面活性剂浓度的变化曲线,当生物表面活性剂浓度大于300 mg·L-1时,各多环芳烃的浓度随生物表面活性剂浓度增大而增大。这是由于生物表面活性剂在CMC(临界胶束浓度)以上时会形成胶束,而胶束内的疏水性微环境对疏水性有机溶剂具有较强的分配作用,可显著增大溶质的表观溶解度[40];当生物表面活性剂浓度低于CMC时,生物表面活性剂分子以单体形式存在,单分子的表面活性剂对被增溶物的分配作用很弱,因而各多环芳烃在水中的溶解度变化不大或者轻微增加。
此外,由图8可得生物表面活性剂对三种多环芳烃均具有增溶效果,且在0~300 mg·L-1增溶效果不明显,在300~500 mg·L-1增溶明显;四环荧蒽、四环芘、五苯环苯并[a]芘的增溶效果随着环数的增加而降低,与杨建刚等[41]的研究结果一致。这可能的原因是与多环芳烃的正辛醇-水分配系数(Octanol-water partioning coefficient,Kow)相关,荧蒽Kow<芘Kow<苯并[a]芘Kow[42],即Kow值越大的多环芳烃,增溶效果越低。

图8 生物表面活性剂多环芳烃的增溶作用Figure 8 Solubilization of polycyclic aromatic hydrocarbons by biosurfactant
3 结论
本研究筛选获得了一株产生生物表面活性剂的147菌株,经鉴定为铜绿假单胞菌(Pseudomonas aeruginosa),该菌株的发酵产物主要为糖脂类生物表面活性剂。以产生物表面活性剂量的能力为指标,在本研究的发酵条件下,该菌株的最适碳、氮源分别为花生油与硫酸铵,最适碳氮比为25∶1,最适发酵温度为30℃,最适盐浓度为5 g·L-1,最适pH值为8。在上述最适培养条件下,该菌株的细菌生物量最高达到5.22 g·L-1,生物表面活性剂量达到5.09 g·L-1,而且该细菌能够在偏碱性(pH值为8~13)条件下生存,具有耐盐碱的特性。多环芳烃的溶解度随表面活性剂的浓度增大而增大,生物表面活性剂对三环荧蒽、四环芘、五环苯并[a]芘的增溶效果随着环数的增加而降低。实验表明,147菌株产生物表面活性剂性能突出,可进一步研究用于大规模工业生产。生物表面活性剂对多环芳烃污染土壤具有增溶效果,该菌株可接入多环芳烃污染的土壤增溶多环芳烃促进土著微生物修复。该菌株具有耐盐、耐碱等特性,应用前景广阔。
[1]Hadibarata T,Kristanti R A.Fate and cometabolic degradation of benzo [a]pyrene by white-rot fungus Armillaria sp.F022[J].Bioresource Technology,2012,107:314-318.
[2]Quilliam R S,Rangecroft S,Emmett B A,et al.Is biochar a source or sink for polycyclic aromatic hydrocarbon(PAH)compounds in agricultural soils[J].GCB Bioenergy,2013,5(2):96-103.
[3]程国玲,李培军,王凤友,等.多环芳烃污染土壤的植物与微生物修复研究进展[J].环境污染治理技术与设备,2003,4(6):30-36.
CHENG Guo-ling,LI Pei-jun,WANG Feng-you,et al.The progress of phytoremediationandmicrobialremediationonPAHscontaminatedsoil[J]. Techniques and Equipment for Environmental Pollution Control,2003,4(6):30-36.
[4]Zhu L,Zhang M.Effect of rhamnolipids on the uptake of PAHs by ryegrass[J].Environmental Pollution,2008,156(1):46-52.
[5]郭利果,苏荣国,梁生康,等.鼠李糖脂生物表面活性剂对多环芳烃的增溶作用[J].环境化学,2009,28(4):510-514.
GUO Li-guo,SU Rong-guo,LIANG Sheng-kang,et al.Solubilization of polycyclic aromatic hydrocarbons by rhamnolipid biosurfactant[J].Environmental Chemistry,2009,28(4):510-514.
[6]李玉瑛,李冰.假单胞菌L-01产表面活性剂的性能分析[J].环境工程学报,2010,4(11):2575-2578.LI Yu-ying,LI Bing.Performance analysis of surfactant produced by Pseudomonas strain L-01[J].Chinese Journal of Environmental Engineering,2010,4(11):2575-2578.
[7]Kiran G S,Thomas T A,Selvin J.Production of a new glycolipid biosurfactant from marine Nocardiopsis lucentensis MSA04 in solid-state cultivation[J].Colloids and Surfaces B:Biointerfaces,2010,78(1):8-16.
[8]Liu H,Wang H,Chen X,et al.Biosurfactant-producing strains in enhancing solubilization and biodegradation of petroleum hydrocarbons in groundwater[J].Environmental Monitoring and Assessment,2014,186 (7):4581-4589.
[9]Reis R S,Pacheco G J,Pereira A G,et al.Biosurfactants:Production and applications[J].Biodegradation:Life of Science,2013,2(5):953-978.
[10]Silva E J,E Silva N M P R,Rufino R D,et al.Characterization of a biosurfactant produced by Pseudomonas cepacia CCT6659 in the presence of industrial wastes and its application in the biodegradation of hydrophobic compounds in soil[J].Colloids and Surfaces B:Biointerfaces,2014,117:36-41.
[11]强婧,尹华,彭辉,等.铜绿假单胞菌S6分泌的生物表面活性剂特性[J].环境科学学报,2009,29(1):102-110.
QIANG Jing,YIN Hua,PENG Hui,et al.Characteristics of a biosurfactant produced by Pseudomonas aeruginosa S6[J].Acta Scientiae Circumstantiae,2009,29(1):102-110.
[12]马满英,施周,刘有势.生物表面活性剂修复HOCs污染土壤的研究进展[J].生态学杂志,2008,27(5):835-840.
MA Man-ying,SHI Zhou,LIU You-shi.Research advances in biosurfactant remediation of hydrophobic organics contaminated soil[J].Chinese Journal of Ecology,2008,27(5):835-840.
[13]Souza E C,Vessoni-Penna T C,de Souza Oliveira R P.Biosurfactantenhanced hydrocarbon bioremediation:An overview international[J]. Biodeterioration&Biodegradation,2014,89:88-94
[14]Jain D K,Collins-Thompson D L,Lee H,et al.A drop-collapsing test for screening surfactant-producing microorganisms[J].Journal of Microbiological Methods,1991,13(4):271-279.
[15]Monis P T,Giglio S,Saint C P.Comparison of SYTO9 and SYBR Green I for real-time polymerase chain reaction and investigation of the effect of dye concentration on amplification and DNA melting curve analysis[J]. Analytical Biochemistry,2005,340(1):24-34.
[16]Zhang X,Xiang T.Review on microbial enhanced oil recovery technology and development in China[J].International Journal of Petroleum Science&Technology,2010,4(1).
[17]Liu H,Wang H,Chen X,et al.Biosurfactant-producing strains in enhancing solubilization and biodegradation of petroleum hydrocarbons in groundwater[J].Environmental Monitoring and Assessment,2014,186 (7):4581-4589.
[18]Saimmai A,Onlamool T,Sobhon V,et al.An efficient biosurfactantproducing bacterium Selenomonas ruminantium CT2,isolated from mangrove sediment in south of Thailand[J].World Journal of Microbiology and Biotechnology,2013,29(1):87-102.
[19]赵辉,闫华晓,杨腾,等.高效生物表面活性剂产生菌筛选及其性质研究[J].生物技术,2010,20(1):76-78.
ZHAO Hui,YAN Hua-xiao,YANG Teng,et al.Screening and characterization analysis of one strain of bacterium producing high-effect biosurfactant[J].Biotechnology,2010,20(1):76-78.
[20]梁艳玲,骆永明,刘五星,等.生物表面活性剂产生菌的筛选及其发酵条件的初步优化[J].土壤,2009,41(2):243-247.
LIANG Yan-ling,LUO Yong-ming,LIU Wu-xing,et al.Screening and primaryoptimizingofculturalmediumofbiosurfactantproducingstrain[J]. Soils,2009,41(2):243-247.
[21]Jain D K,Collins-Thompson D L,Lee H,et al.A drop-collapsing test for screening surfactant-producing microorganisms[J].Journal of Microbiological Methods,1991,13(4):271-279.
[22]薛燕芬,王修垣.石蜡酪杆菌B126产生的糖脂的理化性质[J].微生物学报,1996,36(2):121-125.
XUE Yan-fen,WANG Xiu-yuan.Physical and chemical properties of a glycolipid produced by Caseobacter paraffinicum B126[J].Acta Microbiogica Sinica,1996,36(2):121-125.
[23]Zhang Y,Miller R M.Effect of a Pseudomonas rhamnolipid biosurfactant on cell hydrophobicity and biodegradation of octadecane[J].Applied and Environmental Microbiology,1994,60(6):2101-2106.
[24]Gao Y,Zhu L.Plant uptake,accumulation and translocation of phenanthrene and pyrene in soils[J].Chemosphere,2004,55(9):1169-1178.
[25]王世荣,李相高,刘东志,等.表面活性剂化学[M].第二版.北京:化学工业出版社,2010:17.
WANG Shi-rong,LI Xiang-gao,LIU Zhi-dong,et al.Chemistry of surfactants[M].2th Edition.Beijing:Chemical Industry Press,2010:17.
[26]Saimmai A,Udomsilp S,Maneerat S.Production and characterization of biosurfactant from marine bacterium Inquilinus limosus KB3 grown onlow-costrawmaterials[J].AnnalsofMicrobiology,2013,63(4):1327-1339.
[27]Mata-Sandoval J C,Karns J,Torrents A.Influence of rhamnolipids and Triton X-100 on the biodegradation of three pesticides in aqueous phase and soil slurries[J].Journal of Agricultural and Food Chemistry,2001,49(7):3296-3303.
[28]马满英,刘有势,施周.生物与化学表面活性剂对多氯联苯的协同增溶作用[J].生态环境,2008,17(2):466-470.
MA Man-ying,LIU You-shi,SHI Zhou.Solubilization of polychlorinated biphenyls synergistically solubilized by biosurfactant and chemical surfactants[J].Ecology and Environment,2008,17(2):466-470.
[29]李琦,黄廷林,宋进喜.生物表面活性剂对疏水性有机物的增溶特性[J].化学工程,2011,39(9):1-5.
LI Qi,HUANG Ting-lin,SONG Jin-xi.Solubilization of hydrophobic organic compounds by biosurfactant[J].Chemical Engineering(China),2011,39(9):1-5.
[30]钱晓勇,刘国庆,宗凯,等.一株生物表面活性剂产生菌筛选及其条件优化[J].安徽农业科学,2009,37(13):5848-5850.
QIAN Xiao-yong,LIU Guo-qing,ZONG Kai,et al.Study on the isolation of a biosurfactant-producing microorganism and its condition optimization[J].Journal of Anhui Agricultural Sciences,2009,37(13):5848-5850.
[31]Haba E,Espuny M J,Busquets M,et al.Screening and production of rhamnolipids by Pseudomonas aeruginosa 47T2 NCIB 40044 from waste frying oils[J].Journal of Applied Microbiology,2000,88(3):379-387.
[32]Guerra-Santos L H,Käppeli O,Fiechter A.Dependence of Pseudomonas aeruginosa continous culture biosurfactant production on nutritional and environmental factors[J].Applied Microbiology and Biotechnology,1986,24(6):443-448.
[33]杨乐.产表面活性剂解烃菌的筛选及其降解条件研究[J].环境工程,2015(6):153-157.
YANG Le.Screening of biosurfactant-producing by bacteria for degradation of petroleum hydrocarbon and its degradation conditions[J].Environmental Engineering,2015(6):153-157.
[34]刘摇畅.一株产生物表面活性剂低温细菌的筛选与鉴定[J].生态学杂志,2013,32(4):1075-1082.
LIU Yao-chang.Isolation and identification of a cold-adapted biosurfactant-producing bacterium[J].Chinese Journal of Ecology,2013,32 (4):1075-1082.
[35]李琳,赵朝成,刘其友,等.Pseudomonas sp.LKY-5产生的表面活性剂提取及其稳定性研究[J].石油炼制与化工,2015,46(2):18-21.
LI Lin,ZHAO Chao-cheng,LIU Qi-you,et al.Study on biosurfactant produced by Pseudomonas sp.LKY-5 and its stability[J].Petroleum Processing and Petrochemicals,2015,46(2):18-21.
[36]王大威,张健,吕鑫,等.一株铜绿假单胞菌及其产生的鼠李糖脂特性研究[J].生物技术通报,2012,7:163-169.
WANG Da-wei,ZHANG Jian,LU Xin,et al.Study on characteristics of a rhamnolipid biosurfactant producing bacterium and rhamnolipid biosurfactant[J].Biotechnology Bulletin,2012,7:163-169.
[37]Petrikov K,Delegan Y,Surin A,et al.Glycolipids of Pseudomonas and Rhodococcus oil-degrading bacteria used in bioremediation preparations:Formation and structure[J].Process Biochemistry,2013,48(5):931-935.
[38]Prieto L M,Michelon M,Burkert J,et al.The production of rhamnolipid by a Pseudomonas aeruginosa strain isolated from a southern coastal zone in Brazil[J].Chemosphere,2008,71(9):1781-1785.
[39]Wei Y,Chou C,Chang J.Rhamnolipid production by indigenous Pseudomonas aeruginosa J4 originating from petrochemical wastewater[J]. Biochemical Engineering Journal,2005,27(2):146-154.
[40]Doong R,Lei W.Solubilization and mineralization of polycyclic aromatic hydrocarbons by Pseudomonas putida in the presence of surfactant[J].Journal of Hazardous Materials,2003,96(1):15-27.
[41]杨建刚,刘翔,余刚,等.非离子表面活性剂溶液中多环芳烃的溶解特性[J].环境科学,2003,24(6):79-82.
YANG Jian-gang,LIU Xiang,YU Gang,et al.Characterization of polycyclic aromatic hydrocarbons dissolved in non-ionic surfactants[J].Environmental Science,2003,24(6):79-82.
[42]黄超胜.贵屿及周边地区农业土壤中多环芳烃的空间分布研究和生态风险评价[D].广州:暨南大学,2012.
HUANG Chao-sheng.Spatial distribution and ecological risk assessment of PAHs in agricultural soil of Guiyu and surrounding areas[D]. Guangzhou:Jinan University,2012.
Screening of a biosurfactant-producing bacterium and biosurfactant characteristics
SHI Jin-li,ZHANG Yan-cheng,ZHANG Li-hao,ZHOU Jing,ZHOU Li-na,LI Hui-xin,HU Feng,XU Li*(College of Resources and Environment Science,Nanjing Agricultural University,Nanjing 210095,China)
A biosurfactant-producing bacterium was isolated and identified as Pseudomonas aeruginosa 147 by physiological and biochemical characteristics and 16S rDNA sequencing.The fermentation products were assigned to glycolipid by Thin Layer Chromatography(TLC)and Fourier Transform Infared Spectroscopy(FT-IR)analysis.The optimal conditions for the strain to produce biosurfactants were peanut oil as initial carbon source,(NH4)2SO4as nitrogen source,carbon to nitrogen ratio of 25∶1,pH 8,temperature of 30℃,and 5 g·L-1NaCl.Under these conditions,the surface tension of the fermentation broths could be reduced by 42.08 mN·m-1,compared with the control,and stayed stable for 144 hours.During 108 hours of incubation,the bacterium achieved the maximum biomass(2.63 g·L-1)and had the maximum fermentation product(2.02 g·L-1).The solubilization of different polycyclic aromatic hydrocarbons(PAHs)(fluoranthene,pyrene,benzene[a]pyrene)was increased with the addition of the fermentation products.At the same rates of fermentation products,enhanced solubilization of PAHs with high-ring(benzene[a]pyrene)was lower than that with low-ring(fluoranthene,pyrene).
bio-surfactant;polycyclic aromatic hydrocarbons(PAHs);fermentation optimization;solubilization
X53
A
1672-2043(2016)09-1717-10doi:10.11654/jaes.2016-0204
2016-02-21
国家自然科学基金青年科学基金资助项目(41101292,41371469);公益性行业(农业)科研专项经费(201503121);安徽省博士后研究人员科研活动资助经费项目(2015 B057);中国博士后科学基金面上项目(2016M591856);南京农业大学青年科技创新基金资助项目(y201056);以及江苏省优势学科项目和江苏省有机固体废弃物资源化协同创新中心的资助
石金礼(1989—),男,山东潍坊人,硕士研究生,从事多环芳烃污染土壤的修复。E-mail:2013130303@njau.edu.cn
徐莉 E-mail:xuli602@njau.edu.cn

