高纯度藻胆蛋白的分离纯化研究进展
谷洋洋, 刘 冰, 杜 虹, 张允允, 秦 松
高纯度藻胆蛋白的分离纯化研究进展
谷洋洋1, 刘 冰2, 杜 虹1, 张允允2, 秦 松2
(1. 汕头大学理学院生物系, 广东汕头 515041; 2. 中国科学院烟台海岸带研究所, 山东烟台 264003)
藻胆蛋白在食品、化妆品等领域中具有广泛的应用前景, 同时也可以作为医学研究中的荧光标记物和氧化应激疾病的潜在治疗药物。高纯度藻胆蛋白的分离纯化一直是国内外的研究热点。目前, 蓝藻中的螺旋藻和红藻中的微藻紫球藻是研究较多的材料, 龙须菜近年来的广泛种植, 扩大了原材料的来源。藻胆蛋白的粗提主要是由物理破碎和化学沉淀组成, 破碎的方法因原料的不同而具有一定的差异。高纯度的藻胆蛋白获取主要是通过离子交换, 疏水层析等方法, 这些方法耗时长, 回收率低; 双水相萃取, 利凡诺沉淀, 壳聚糖和活性碳吸附沉淀为人们分离纯化藻胆蛋白提供了新的思路。
藻胆蛋白; 提取原料; 粗提; 分离纯化
藻胆蛋白(phycobiliprotein, PBP)是除叶绿素a之外的另一类光合色素蛋白, 存在于蓝藻、红藻、隐藻和少数甲藻中。根据藻胆蛋白紫外吸收光谱的特点藻胆蛋白可以分为三类: 藻蓝蛋白(phycocyanin, PC, λmax610~620 nm), 别藻蓝蛋白(allophycocyanin, APC, λmax650~655 nm)和藻红蛋白(phycoerythrin, PE, λmax540~570 nm); 通常PE根据来源和光谱特性的不同又可分为B-PE, R-PE和C-PE[1]。藻胆蛋白是由脱辅基蛋白和以四毗咯为基本结构的几种色基组成, 其蛋白部分是一类寡聚蛋白, 基本构建单位是和亚基, 在PE中还存在少量的亚基[2]。藻胆蛋白在光合作用中作为捕光色素系统进行吸收和传递能量, 在藻体细胞中还作为储存蛋白能够使藻类在氮源缺乏的季节得以生存[3]。
藻胆蛋白作为一种水溶性的色素蛋白, 用途极为广泛。一般合成的着色剂具有毒性和致癌等不安全因素, 因此藻胆蛋白做为天然色素可以广泛应用于食品工业(糖果、口香糖、冰激凌、乳制品、软饮料、芥末酱等), 在亚洲一些国家藻胆蛋白也被用于化妆品行业(眼脸膏、眼线膏、口红); 藻胆蛋白尤其是PE具有吸收系数大, 荧光量子产率高, 斯托克位移宽, 稳定性强等特性常做为荧光试剂应用于生物医学分析(流式细胞仪、荧光活细胞分选、荧光免疫分析、荧光显微镜等)[4-6]; 同时藻胆蛋白还是一种重要的生理活性物质, 如抗氧化, 抗肿瘤, 抗病毒, 提高人体免疫力等[7-14](如表1), 可制成食品和药品用于医疗保健上; 此外, 藻胆蛋白也是一种最具有开发潜力的光敏剂, 可介导肿瘤光动力学治疗等[15]。
表1 藻胆蛋白生理特性和机制
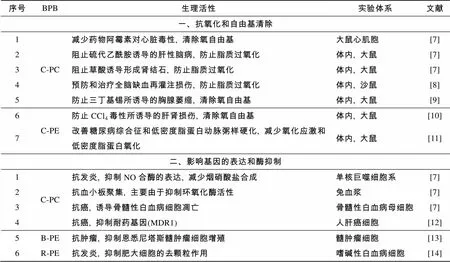
Tab.1 Physiological property and mechanisms of phycobiliprotein
注: 此表是根据Eriksen等[7]修改后的表
藻胆蛋白在不同领域应用时对其纯度(Aλmax/ A280)要求不同[16-17], 一般纯度大于0.7是食品级, 大于3.0是医药级, 大于3.9是反应级, 试剂级大于4.0。藻胆蛋白在不同领域中应用时, 因其纯度要求不同, 所以藻胆蛋白的价格也不尽相同。2014年Sigma公司生产的试剂级R-PE的价格为1572.48元/mg, APC的价格为1233.76元/mg; C-PC(A620/A280>3.5)的价格为1590.03元/mg。基于藻胆蛋白较强的生理活性和荧光特性, 以及在其强大的经济利益驱动下, 使藻胆蛋白尤其高纯度的藻胆蛋白分离纯化方法成为国内外研究的热点。
本文主要基于近年来已发表的文献对高纯度藻胆蛋白的分离纯化方法的研究进行了综述, 以期为读者提供一个完整的有关藻胆蛋白分离纯化发展趋势的构架。
1 高纯度藻胆蛋白的制备
用于分离纯化藻胆蛋白的材料很多, 它们在细胞结构, 藻胆蛋白种类和含量等方面差别很大, 以至今日都没有形成一个标准的方法来分离纯化藻胆蛋白[5]。一般藻胆蛋白的分离纯化流程为三步(图1), 首先是植物组织体的破碎, 浸提获得粗提液; 其次是粗提, 此步主要为进一步的分离纯化做准备; 最后就是分离纯化制备出高纯度的藻胆蛋白。
1.1 提取原料
目前, 分离纯化比较多的藻胆蛋白主要为来自于蓝藻中的PC, APC及来自红藻中R-PE和B-PE; 蓝藻中的螺旋藻和红藻中的微藻紫球藻是研究较多的材料[1, 18]。
螺旋藻自20世纪80年代初引入我国, 经过近30年的快速发展, 在我国螺旋藻养殖业已占据重要地位; 我国的沿海大部分地区和部分内陆地区都有大规模的螺旋藻养殖基地。张学成等[19]统计我国螺旋藻养殖面积约750万m3, 养殖基地多达60余家, 年产量高达9600 t, 经济价值约40亿元。螺旋藻当中生物活性物质含量多且比较丰富, 干细胞中蛋白质的含量达到50%以上, 其中藻蓝蛋白占10%~15%, 这为人们提取PC提供了充足的原材料。除此之外, Miyamoto等[20-23]利用,,,等来分离纯化藻蓝蛋白; Parmar等[24-27]从sp.A32DM,sp. KC45,和sp.中分别分离纯化得到了高纯度的C-PE。红藻作为提取PE的主要原材料, 在我国也有广泛的种植。紫球藻是我们分离纯化PE的理想材料, 但其目前在我国还没有取得大规模的种植; 而红藻中的龙须菜在我国具有广泛的种植。自2000年, 张学成等[28]选育的国家水产新品种“龙须菜良种981”在广东汕头南澳岛示范栽培获得成功以来, 龙须菜栽培面积不断扩大, 目前南澳龙须菜养殖已形成规模化, 平均达到5kg/m2, 养殖周期从原产地春秋两季各45天延长至5个月以上。全国龙须菜的栽培面积超过1.3万hm2, 年产量15万t干品, 成为继海带和紫菜之后第三大海藻栽培业, 这为大规模分离纯化PE提供了可能。Rossano等[29-31]从和等红藻中也分离纯化得到高纯度的R-PE。
Zhao等[32]利用裂解酶(PecE和PecF)催化体外重组的藻蓝蛋白亚基与藻蓝胆素结合, 获得了具有荧光特性的重组亚基。这使得转基因和酶催化相结合的方法生产具有荧光活性的藻胆蛋白成为可能, 此方法为获取藻胆蛋白提供了新的来源。
1.2 藻胆蛋白的粗提
藻胆蛋白是水溶性的胞内蛋白, 要获得高纯度、高回收率的藻胆蛋白, 对藻体的破碎显得尤为重要。目前用于藻体破碎的方法主要是物理法破碎。Gantar等[21-22, 33-36]将藻体在–20℃和4℃到30℃之间进行反复冻融, 此方法利于蛋白溶出并且易于放大。Liao等[37-41]利用超声波破碎的方法对藻体进行破碎, 发现可以大大提高藻胆蛋白的溶出率, 但此方法不利于大规模制备藻胆蛋白, 并且生产的过程会产生热量, 这对藻胆蛋白活性有很大影响, 应用范围有限。Patil等[42]利用从渗透压破碎法破碎, 该操作简单, 是比较理想的细胞破碎法, 但该方法对处理的样品有要求, 一般大型藻类很难直接运用此方法对藻体进行破碎。除此之外, 还有液氮研磨破碎等方法。上述方法都有一定的局限性, 实际生产中, 常常几种方法经常混合使用, 以最大的限度破碎使藻胆蛋白溶出。
破碎后的藻体按一定的物料比与不同的提取液混合浸提获得藻胆蛋白的粗提液。由于此粗提液里常含有其他蛋白和多糖等成分, 一般在传统的藻胆蛋白分离纯化前多先经过粗提, 传统的粗提方法有(NH4)2SO4盐析, 丙酮沉淀等[26], 进年还来出现了利凡诺沉淀, 壳聚糖和活性碳吸附等新方法处理粗提液[33, 41-49], 为下进一步的分离纯化做准备。
1.3 藻胆蛋白的分离纯化
1.3.1 传统分离纯化藻胆蛋白的方法
对于不同藻类藻胆蛋白的分离纯化方法有很多种(表2), 传统上都是通过数次的羟基磷灰石柱层析结合离子交换层析或凝胶过滤层析来进行的。
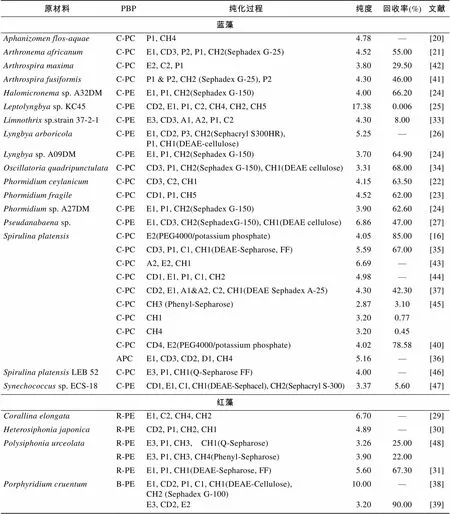
表2 不同藻类的藻胆蛋白分离纯化方法比较
注: 1、细胞破碎(Cell disruption, CD): 液氮研磨(CD1), 超声波破碎(CD2), 反复冻融(CD3), 渗透压破碎法(CD4); 2、抽提(Extraction, E): 缓冲液(E1), 双水相萃取(E2), 水抽提(E3); 3、沉淀(Precipitation, P): (NH4)2S04盐析(P1), 利凡诺沉淀(P2), 丙酮沉淀(P3); 4、杂质吸附(Impurity adsorption, A): 活性碳吸附(A1), 壳聚糖吸附(A2); 5、浓缩(Concentration, C): 透析(C1), 膜超滤(C2); 6、色谱层析(Chromatography, CH): 离子交换色谱(CH1), 凝胶层析(CH2), 膨胀床吸附层析(CH3), 羟基磷灰石层析(CH4), 疏水层析(CH5)
Miyamoto等[20]通过硫酸铵盐析并结合羟基磷灰石柱层析对中的PC进行纯化, 获得了纯度超过大于4.0的PC; Liu等[31]用DEAE-Sepharose FF进行PH梯度洗脱(pH 5.6~4.0), 最终获得藻红蛋白的纯度达到5.6, 回收率达到67.33%。Mishra等[27]利用两步色谱技术分离纯化假鱼腥藻中的C-PE, 首先将粗提液用硫酸铵分级盐析(25%~60%); 然后用Sephadex G-150层析柱(35cm× 1 cm, 柱床高25cm)分离, 收集样品; 最后用DEAE- cellulose层析柱进行NaCl(0~0.5 mol/L)梯度洗脱, 洗脱速度为0.5 ml/min获得的藻红蛋白纯度为6.8, 回收率为46%。膨胀床吸附技术也常常被用于分离纯化藻红蛋白, Bermejo等[49]探究了膨胀床结合离子交换技术对螺旋藻藻蓝蛋白分离纯化的效果, 并在不同水平上进行了研究; 在实验室水平上, 其能够获得纯度大于4.0, 回收率为69%的藻蓝蛋白, 在中试水平上, 生产出来的藻蓝蛋白纯度大于4.0, 回收率为59%。
目前, 使用羟基磷灰石柱层析分离时间长, 易使蛋白变性; 而离子交换柱虽然成本高, 但有处理量大, 分离时间短, 效果好等特点; 膨胀床吸附层析技术兼有流化床和填充床层析的优点, 不需预先除去料液中的颗粒而可以直接从料液中吸附目标产物。现多采用一步离子交换层析法, 并且常常是其他分离方法与离子交换相结合。
文献中报道的藻胆蛋白常用提纯方法在实际工业化生产过程中存在操作步骤复杂, 动力能耗高以及操作周期长等缺点; 据文献报道, 分离纯化的成本占产品成本的50%~90%[43], 此外, 由于步骤过多而导致产量损失大, 通常每增加一步层析过程目标蛋白就会减少20%, 这对工业化生产来说成本无疑是十分昂贵的。因此, 一种高效, 经济, 易于放大的分离纯化方法对于生产高纯度和高回收率的藻胆蛋白来说是十分必要的。
1.3.2 新型分离纯化藻胆蛋白的方法
随着技术的进步, 近年来出现了一些分离纯化藻胆蛋白的新方法, 如: 双水相萃取法分离纯化藻胆蛋白具有操作步骤少, 时间短, 回收率高等优点, 分离纯化的同时还能使藻胆蛋白在一相中浓缩, 因此, 近年该方法获得了许多学者的青睐。
Patil等[16, 43]采用12.28%的聚乙二醇和11.63%的磷酸钾缓冲液形成的双水相体系对藻胆蛋白进行分离, 研究发现, 在PH 7.2时萃取C-PC, 一次萃取后, 其纯度从3.96提高到5.22, 经双水相萃取的C-PC再经 DEAE-Sephadex 离子交换柱纯化, 达到6.69。对双水相萃取过程进行放大, 提取的C-PC纯度为5.22, 回收率为66%, 证实了该方法具有现实可行性。后来, Patil等[40]研究了双水相结合膜超滤技术分离纯化新鲜螺旋藻的藻蓝蛋白, 在PEG4000/磷酸钾双水相体系中, 当系线长度为18.64%, 相比1.45时, 藻蓝蛋白的纯度由起始是的1.18 达到3.23, 别藻蓝蛋白纯度由0.41 升到0.74; 在经过三步萃取后藻蓝蛋白的纯度达到了4.02, 最后作者利用膜超滤技术除盐, 不仅将盐除去, 而且别藻蓝蛋白的纯度由0.74升到了1.5, 回收率分别达到78.58%和51.73%。刘杨等[50]利用磷酸钾-PEG6000双水相体系同时分离纯化APC和PC, 在pH 7.0系线长度为34%的时候, PC和APC的纯化系数分别为10.64和0.57, 此方法可以同时达到分离PC和APC的目的。
双水相萃取技术具有原料丰富廉价、溶剂黏度小、易回收、传质和分相速度快、操作简单、设备要求低、节约能耗等优点, 已经在众多领域展现出工业化前景。但目前该技术在藻胆蛋白提纯的工业化中还没有被广泛利用, 阻碍双水相萃取技术走向工业化的最大问题是构成双水相成相组分的价格昂贵。随着对双水相体系研究的不断深入, 性能优良的新型成相物质不断发现以及相关技术的发展, 双水相萃取技术必将在生物下游产业中起到越来越重要的作用[51]。
除了双水相萃取之外, 利凡诺沉淀, 壳聚糖和活性碳吸附沉淀也为人们分离纯化藻胆蛋白提供了新的思路。Minkova等[41]在细胞破碎液中加入利凡诺试剂反复沉淀重复4次得纯度为3.90的C-PC。Minkova等[21]后来对该方法还对该法进行改良, C-PC最终纯度达4.52, 回收率为55.00%。Gantar等[33]向获得的粗提液中加入活性炭和壳聚糖, 离心获得的C-PC溶液纯度为3.60, 随后对C-PC溶液进行盐析和超滤最终纯度达到4.30, 含量占干重的8.00%。
利凡诺沉淀, 壳聚糖和活性碳吸附沉淀分离纯化藻胆蛋白能避免层析纯化过程中的繁杂步骤, 提高了纯化效率, 而且产量高, 成本低, 易于扩大。
2 展望
藻胆蛋白是一种具有广泛用途的活性物质, 当前藻胆蛋白的应用正由食品, 化妆品行业逐渐延伸到医学诊断, 光疗和药物领域中去。现已有公司在从事与藻胆蛋白相关的生产, 2008年, Sekar和Chandramohan两家公司就已经有了297项与藻胆蛋白有关的专利[52]。我国拥有丰富的螺旋藻和龙须菜等海藻植物资源, 这为藻胆蛋白的来源提供丰富的原材料。但藻胆蛋白的分离纯化过程较为繁杂, 回收率低, 耗时长, 目前还没有一种高效的分离纯化方法应用到高纯度藻胆蛋白的纯化中去, 这使得高纯度藻胆蛋白的大范围使用受到了很大的限制, 如何开发出短时高效, 纯度高和回收率高的提取纯化技术仍然是今后研究的重点。
[1] Román R B, Alvárez-Pez J M, Fernández F G A , et al. Recovery of pure B-phycoerythrin from the microalga[J]. Journal Biotechnology, 2002, 93(1): 73-85.
[2] Ma S Y, Wang G C, Sun H B, et al. Characterization of the artificially covalent conjugate of B-phycoerythrin and R-phycocyanin and the phycobilisome from[J]. Plant Science, 2003, 164: 253- 257.
[3] Boussiba S, Richmond A E. C-phycocyanin as a storage protein in the blue-green alga[J]. Archives of Microbiology, 1980, 125(1): 143-147.
[4] Antelo F S, Anschau A, Costa J A V, et al. Extraction and Purification of C-phycocyanin fromin Conventional and Integrated Aqueous Two-Phase Systems[J]. Journal of Brazilian Chemical Society, 2010, 21(5): 921-926.
[5] Sekar S, Chandramohan M. Phycobiliproteins as a commodity: Trends in applied research, patents and commercialization[J]. Journal of Applied Phycology, 2008, 20: 113-136.
[6] Adiba B D, Salem B. Preliminary characterization of food tablets from date (L.) and(sp.) powders[J]. Powder Technology, 2011, 208: 725-730.
[7] Eriksen N T. Production of phycocyanin-a pigment with applications in biology, biotechnology, foods and medicine[J]. Applied Microbiology and Biotechnology, 2008, 80: 1-14.
[8] Giselle P R, Javier M P, Gilberto P A, et al. C-Phycocyanin is neuroprotective against global cerebral ischemia/reperfusion injury in gerbils[J]. Brain Research Bulletin, 2011, 86: 42-52.
[9] Gupta M, Dwivedi U N, Khandelwal, S. C-Phycocyanin: An effective protective agent against thymic atrophy by tributyltin[J]. Toxicology Letters, 2011, 204: 2-11.
[10] Soni B, Visavadiya N P, Madamwar D. Ameliorative action of cyanobacterial phycoerythrin on CCl4-induced toxicity in rats[J]. Toxicology, 2008, 248: 59-65.
[11] Soni B, Visavadiya N P, Madamwar D. Attenuation of diabetic complications by C-phycoerythrin in rats: antioxidant activity of C-phycoerythrin including copper-induced lipoprotein and serum oxidation[J]. British Journal of Nutrition, 2009, 102: 102-109.
[12] Nishanth R P, Ramakrishna B S, Jyotsna R G, et al. C-Phycocyanin inhibits MDR1 through reactive oxygen species and cyclooxygenase-2 mediated pathways in human hepatocellular carcinoma cell line[J]. European Journal of Pharmacology, 2010, 649: 74-83.
[13] Minkova K M, Toshkova R A, Gardeva E G, et al. Antitumor activity of B-phycoerythrin from[J]. Journal of Pharmacy Research, 2011, 4(5): 1480-1482.
[14] Sakai S, Komura Y, Nishimura Y, et al. Inhibition of Mast Cell Degranulation by Phycoerythrin and Its Pigment Moiety Phycoerythrobilin, Prepared from[J]. Food Science and Technology Research, 2011, 17(2): 171-177.
[15] Paul B T, Patel A, Selvam G S, et al. Photodynamic action of C-phycocyanins obtained from marine and fresh water cyanobacterial cultures: A comparative study using EPR-spin trapping technique[J]. Free Radical Research, 2006, 40(8): 821-825.
[16] Patil G, Raghavarao K S M S. Aqueous two phase extraction for purification of C-phycocyanin[J]. Biochemical Engineering Journal, 2007, 34(2): 156-164.
[17] Spolaore P, Joannis-Cassan C, Duran E, et al. Commercial Applications of Microalgae[J]. Journal of Bioscience and Bioengineering, 2006, 101(2): 87–96.
[18] Viskari P J, Colyer C L. Rapid extraction of phycobiliproteins from cultured cyanobacteria samples[J]. Analytical and Bioanalytical Chemistry, 2003, 319: 263-271.
[19] 张学成, 薛命雄. 我国螺旋藻产业的现状和发展潜力[J]. 生物产业技术, 2012, 2: 47-53. Zhang Xuecheng, Xue Mingxiong. Present situation and development potential of Spirulina industry in China[J]. Biotechnology&Business, 2012, 2: 47-53.
[20] Miyamoto E, Tanioka Y, Nakao T, et al. Purification and characterization of phycocyanin from the blue-green alga[J]. Journal of Chromatography B, 2006, 833(1): 12-18.
[21] Minkova K, Tchorbadjieva M. Improved procedure for separation and purification phycobiliproteins of[J]. Biotechnology Letters, 2007, 29: 647-651.
[22] SinghN K, Parmar A, Madamwar D. Optimization of medium components for increased production of C-phycocyanin fromand its purification by single step process[J]. Bioresource Technology, 2009, 100(4): 1663-1669.
[23] Soni B, Trivedi U, Madamwar D. A novel method of single step hydrophobic interaction chromatography for the purification of phycocyanin fromand its characterization for antioxidant property[J]. Bioresource Technology, 2008, 99(1): 188-194.
[24] Parmar A, Singh N K, Kaushal A, et al. Purification, characterization and comparison of phycoerythrins from three different marine cyanobacterial cultures[J]. Bioresource Technology, 2011, 102: 1795-1802.
[25] Pumas C, Peerapornpisal Y. Purification and Characterization of a Thermostable Phycoerythrin from Hot Spring CyanobacteriumKC45[J]. International Journal of Agriculture & Biology, 2012, 14: 121-125.
[26] Tripathi S N, Kapoor S, Shrivastava A. Extraction and purification of an unusual phycoerythrinin in a terrestrial desiccation tolerant cyanobacterium[J]. Journal of Applied Phycology, 2007, 19: 441- 447.
[27] Mishra S K, Shrivastav A. Preparation of highly purified C-phycoerythrin from marine cyanobacterium[J]Protein Expression and Purification, 2011, 80: 234-238.
[28] 张学成, 费修绠, 王广策, 等. 2009.江蓠属海藻龙须菜的基础研究与大规模栽培[J]. 中国海洋大学学报(自然科学版), 39(5): 947-954. Zhang Xuecheng, Fei Xiugeng, Wang Guangce, et al. Genetic studies and large scale cultivation of[J]. Journal of Ocean University of China (Social Sciences) , 39(5): 947-954.
[29] Rossano R, Ungaro N, Ambrosio A D, et al. Extracting and purifying R-phycoerythrin from Mediterranea red algaeEllis & Solander[J]. Journal of Biotechnology, 2003, 101: 289-293.
[30] Sun L, Wang S M, Gong X Q, et al. purification and characteristics of R-phycoerythrin from a marine macroalga[J]. Protein Expression and Purification, 2009, 64: 146-154.
[31] Liu L N, Chen X L, Zhang X Y, et al. One-step chromatography method for efficient separation and purification of R-phycoerythrin from[J]. Journal of Biotechnology, 2005, 116: 91-100.
[32] Zhao K H, Deng M G, et al. Novel activity of a phycobiliprotein lyase: both the attachment of phycocyanobilin and the isomerization to phycoviolobilin are catalyzed by the proteins PecE and PecF encoded by the phycoerythrocyanin operon[J]. Federation of European Biochemical Societies, 2000, 469(1): 9-13.
[33] Gantar M. Isolation, characterization and antioxidative activity of C-phycocyanin fromsp. strain 37-2-1[J]. Journal of Biotechnology, 2012, 159: 21-26.
[34] Soni B, Kalavadia B, Trivedi U, et al. Extraction, purification and characterization of phycocyanin fromisolated from the rocky shores of Bet-Dwarka, Gujarat, India[J]. Process Biochemistry, 2006, 41(9): 2017-2023.
[35] Yan S G, Zhu L P, Su H N, et al. Single-step chromatography for simultaneous purification of C-phycocyanin and allophycocyanin with high purity and recovery from()[J]. Journal of Applied Phycology, 2011, 23(1): 1-6.
[36] Fan C D, Jiang J, Yin X, et al. Purification of selenium-containing allophycocyanin from selenium-enrichedand its hepatoprotective effect against t-BOOH-induced apoptosis[J]. Food Chemistry, 2012, 134: 253-261.
[37] Liao X X, Zhang B H, Wang X Q, et al. Purification of C-phycocyanin fromby single-step ion-exchange chromatography[J]. Chromatographia, 2011, 73: 291-296.
[38] Bermejo R, Talavera E M, Alvarez-Pez J M. Chromatographic purification and characterization of B-phycoerythrin fromSemipreparative high-performance liquid chromatographic separation and characterization of its subunits[J]. Journal of Chromatography A, 2001, 917: 135-145.
[39] Benavides J, Rito-Palomares M. Simplified two-stage method to B-Phycoerythrin recovery from[J]. Joumal of Chromatography B, 2006, 844: 39-44.
[40] Patil G, Chethana S, Madhusudhan M C, et al. Fractionation and purification of the phycobiliproteins from[J]. Bioresource Technology, 2008, 99: 7393-7396.
[41] Minkova K M, Tchernov A A, Tchorbadjieva M I, et al. Purification of C-phycocyanin from()[J]. Journal Biotechnology, 2003, 02(1): 55-59.
[42] Rito-Palomares M, Nuñez L, Daniel Amador. Practical application of aqueous two phase systems for the development of a prototype process for C-phycocyanin recovery from[J]. Journal of Chemical Technology and Biotechnology, 2001, 76(12): 1273- 1280.
[43] Patil G, Chethana S, Sridevi A S, et al. Method to obtain C-phycocyanin of high purity[J]. Journal of Chromatography A, 2006, 1127(1-2): 76-81.
[44] Bhaskar S U, Gopalaswamy G, Raghu R. A simple method for efficient extraction and purifiation of C-phycocyanin fromGeitler[J]. Indian Journal of Experimental Biology, 2005, 43(3): 277-279.
[45] Niu J F, Wang G C, Lin X Z, et al. Large-scale recovery of C-phycocyanin fromusing expanded bed adsorption chromatography[J]. Journal of Chromatography B, 2007, 850(1-2): 267-276.
[46] Moraes C C, Kalil S G. Strategy for a protein purification design using C-phycocyanin extract[J]. Bioresource Technology, 2009, 100: 5312-5317.
[47] Kim J J, Jeon Y M, Noh J H. Isolation and characterization of a new phycoerythrin from the cyanobacteriumsp. ECS-18[J]. Journal of Applied Phycology, 2011, 23: 137-142.
[48] Niu J F, Wang G C, Tseng C K. Method for large-scale isolation and purification of R-phycoerythrin from red algaGrev[J]. Protein Expression and Purification, 2006, 49: 23-31.
[49] Bermejo R, Ramos A. Pilot Scale Recovery of Phycocyanin from Spirulina platensis Using Expanded Bed Adsorption Chromatography[J]. Chromatographia, 2012, 75: 195-204.
[50] Aqueous two-phase countercurrent distribution for the separation of c-phycocyanin and allophycocyanin from Spirulina platensis[J]. Food and Bioproducts Processing, 2012, 90: 111-117.
[51] Ruiz-Ruiz F, Benavides J, Aguilar O. Aqueous two-phase affinity partitioning systems: Current applications and trends[J]. Journal of Chromatography A, 2012, 1244: 1-13.
[52] Grewe C B, Pulz O. Ecology of Cyanobacteria II: Their Diversity in Space and Time[M]. B.A.Whitton: Springer Science+Business Media B.V., 2012: 707-739.
The research progress on isolation and purification of high- purified phycobiliprotein
GU Yang-yang1, LIU Bing2, DU Hong1, ZHANG Yun-yun2, QIN Song2
(1. College of science, Shantou University, Shantou 515041, China; 2. Yantai institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China)Received:Oct. 12, 2015
phycobiliprotein; raw material; crude extract; isolation and purification
Phycobiliprotein has promising applications in nutrient ingredient and natural color for food and cosmetics. It is also used as potential therapeutic agent in oxidative stress-induced diseases and as fluorescent markers in biomedical research. Recently, more and more reseachs are concentrated on isolation and purification of high-purified phycobiliprotein. Currently,andare used primarily to extract phycobiliprotein. The extensive cultivation ofexpanded the sources of raw materials. Crude extract of phycobiliprotein is used by physical fragmentation and chemical deposition. Several methods have been developed for purification of phycobiliprotein such as ion exchange chromatography and hydrophobic interaction chromatography. However, theses methods are time consuming and the recovery of phycobiliprotein is low. Aqueous two phase extraction, rivanol precipitation, chitosan-active carbon adsorption and precipitation are the potential purification techniques.
Q949.2
A
1000-3096(2016)07-0170-08
10.11759/hykx20121216001
2015-10-12;
2016-03-09;
海洋公益性行业科研专项经费资助(200905021, 201105008-9, 201205027); 广东省中国科学院全面战略合作项目(2011A090100040)
[Foundation: Public Science and Technology Research Funds Projects of the Ocean, No.200905021, No.201105008-9, No.201205027; Guangdong province comprehensive strategic cooperation project of the Chinese Academy of Sciences, No. 2011A090100040]
谷洋洋(1986-), 男, 安徽阜阳人, 硕士研究生, 主要从事海洋天然活性物质研究, 电话: 15914795189, E-mail: yygu-1022@126.com; 秦松,通信作者, 山东莱州人, 研究员, 博士, 主要从事海岸带生物技术研究, E-mail: sqin@yic.ac.cn.
(本文编辑: 梁德海)

