流式细胞术用于鲍曼不动杆菌体外药敏试验的研究
赵旭鸿,沈菊英,蔡惠萍,陈鲁艺,李 智,徐 龙
(同济大学附属杨浦医院检验科,上海 200090)
·论著·
流式细胞术用于鲍曼不动杆菌体外药敏试验的研究
赵旭鸿,沈菊英,蔡惠萍,陈鲁艺,李智,徐龙△
(同济大学附属杨浦医院检验科,上海 200090)
目的探讨流式细胞术(FCM)方法快速检测鲍曼不动杆菌体外药敏试验的临床应用价值。方法选用碘化丙啶(PI)作为荧光染料,用FCM检测大肠埃希菌标准菌株和66株鲍曼不动杆菌临床菌株对舒氨西林、左氧氟沙星、美罗培南、头孢噻肟钠的敏感性。根据细菌培养物在不同浓度药物作用后所检测到的荧光强度来判断细菌存活率,从而推断MIC值。并与微量稀释法和VITEK仪检测结果进行比较。结果66株鲍曼不动杆菌流式细胞荧光法抗菌药物敏感试验(FCST)结果测得舒氨西林耐药35株,左氧氟沙星耐药30株,美罗培南耐药13株,头孢噻肟钠耐药38株。采用χ2检验,分别比较与微量稀释法、VITEK仪检测判断的敏感性结果,差异均无统计学意义(P>0.05)。结论鲍曼不动杆菌流式细胞荧光法药敏试验与常规方法检测结果具有一致性,并且更快速、灵敏、客观。
流式细胞荧光法抗生素敏感试验;鲍曼不动杆菌;舒氨西林;左氧氟沙星;美罗培南;头孢噻肟钠
通过抗菌药物体外药敏试验检测最低抑菌浓度(MIC)是临床判断细菌对抗菌药物敏感性、合理使用抗菌药物的重要依据。目前临床上MIC的检测方法包括微量稀释法、纸片扩散法、试管肉汤稀释法、琼脂稀释法和Q试验等。这些方法通常能提供细菌群体对抗菌药物敏感性的均值,但不能发现细菌个体间药敏反应的异质性,且操作烦琐、耗时较长。鲍曼不动杆菌是引起医院内感染的重要病原菌之一,其耐药性日益严重,尤其多重耐药鲍曼不动杆菌,在临床上选用抗菌药物十分棘手。现有抗菌药物药敏试验难以对多重耐药鲍曼不动杆菌提供有价值的药敏结果,不利于及时、有效地指导抗菌药物使用[1-2]。自1982年有学者探索用FCM对大肠埃希菌进行抗菌药物药敏试验,流式细胞荧光法抗菌药物敏感试验(FCST) 逐渐得到研究和发展[3]。FCST可以检测到细菌群体中具有药敏异质性的菌细胞,可为细菌药敏试验提供一种更为简便快速、灵敏可靠的诊断方法[4]。本研究应用FCST检测鲍曼不动杆菌MIC,并与常规药敏试验结果进行比较,探讨其临床应用价值。
1 资料与方法
1.1菌株大肠埃希菌标准菌株ATCC 25922由北京中国药品生物制品检定所提供;鲍曼不动杆菌临床分离株收集至2013年4月至2014年9月本院细菌室,均经过VITEK全自动微生物鉴定仪鉴定。
1.2仪器与试剂流式细胞仪为美国Beckman-coulter公司EPICS-XL型;全自动微生物鉴定和药敏系统为法国生物梅里埃公司VITEK32型。舒氨西林、左氧氟沙星、美罗培南、头孢噻肟钠标准品来自北京中国药品生物制品检定所;碘化丙啶(PI)为美国Sigma公司产品。
1.3方法
1.3.1FCST检测挑取血琼脂平板上单个待检菌落,接种于MH液体培养基并用VITEK仪加以鉴定。将接种于MH液体培养基的待检菌置于37 ℃水浴2 h孵育后,调整菌液浓度至0.5号麦氏浊度(相当于1.5×108cfu/mL)。在各FCST测定管中按抗菌药物浓度梯度分别加入相应抗菌药物和待检菌液,制成终浓度为7.5×106cfu/mL、每管总体积为1 mL的细菌悬液,轻轻混匀,置37 ℃水浴孵育3 h后加入PI 10 μL/每管,摇匀并室温避光15 min后上流式细胞仪进行检测。FCST检测每管至少获取104个菌细胞。设置FCST数据收集分析方案,通过检测散射光信号(SC)和碘化丙啶荧光信号(PI)对样本进行分析。散射光信号包括前向散射光(FS)和侧向散射光(SS),FS强度与细胞大小呈正相关,SS强度与细胞颗粒度呈正相关。分别设置FS-SS双参数图和前向散射光/碘化丙啶荧光(FS/PI)双参数图。在FS-SS双参数图中调整电压使拟进行分析的细菌群密集出现,并设门圈定菌细菌群,使其荧光信号出现在FS/PI双参数图中。FS/PI双参数图中PI表示PI的荧光信号强度(在X轴上以对数值表示),分别以活菌和死菌作为阴性对照和阳性对照在图上设定十字门,可提供阳性区域内PI阳性的细胞百分率(PI%)和X轴平均荧光强度(MFIx)等多种参数。检测不同抗菌药物浓度作用下菌株的PI%每株菌,同时以无药活菌为阴性对照、以加热死菌为阳性对照,其中敏感菌株的PI%随着药物浓度增加显著增高,而耐药菌株的PI%并不随药物浓度增高而有明显变化,从而可推断菌株的药物敏感性和MIC。本文共检测了66株鲍曼不动杆菌分离株及1株大肠埃希菌标准菌株。
1.3.2微量稀释法参照卫生部《全国临床检验操作规程》进行[5]。正式试验前选择部分菌株与试管稀释法进行比较,敏感性结果相符。
1.3.3VITEK仪器检测使用GNS-448检测卡,微孔板中舒氨西林、左氧氟沙星、美罗培南、头孢噻肟钠的浓度分别为:8、32、64 μg/mL,1、4、8 μg/mL,2、4、8 μg/mL,6、24 μg/mL,菌液浓度为1.5×107cfu/mL。次日仪器报告结果。
1.4统计学处理应用SPSS18.0统计软件对试验数据作χ2检验,P<0.05表示差异有统计学意义。
2 结 果
2.1无菌空白MH液体培养基FCM检测结果仅在FS-SS图左下角显示少量肉汤颗粒,见图1。
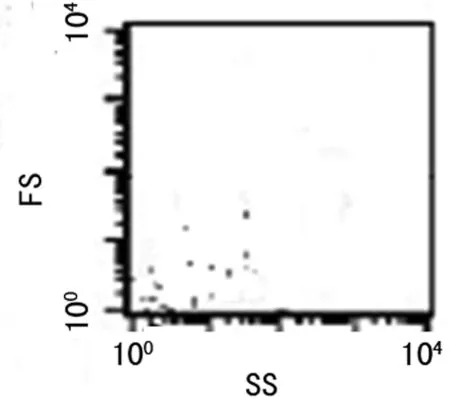
图1 无菌MH培养液
2.2不同生活状态细菌FCM检测结果取不加抗菌药物正常生长的细菌作为阴性对照,用加热处死的细菌作为阳性对照,用PI染色,上机检测。活菌悬液(不含药物)的结果显示,一群集中较小的菌细胞处于荧光阴性的区域,死菌悬液的结果显示,一群大小一致的细菌(92.15%)处于荧光强度很高的区域,表示大多数细菌已死亡,见图2。
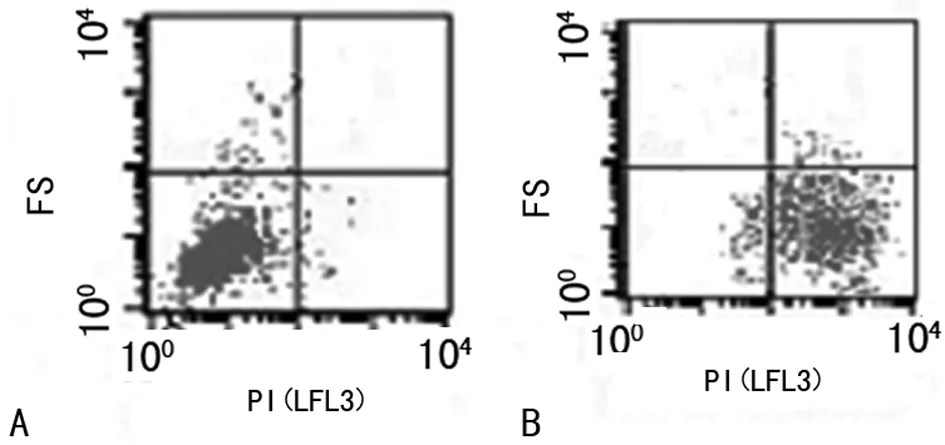
注:A表示活菌悬液;B表示死菌悬液。
图2活菌悬液和死菌悬液FS-PI双参数荧光图
2.3不同浓度抗菌药物作用细菌FCM检测结果当抗菌药物敏感菌株在各药物浓度作用后,随药物浓度成倍增加,FS-SS图中PI阴性区域内细胞渐少,PI荧光阳性区细胞渐多,如图3。而抗菌药物耐药菌株在各个药物浓度作用后,随药物浓度增加,FS-SS图中PI阴性区域内细胞减少并不明显,如图4。
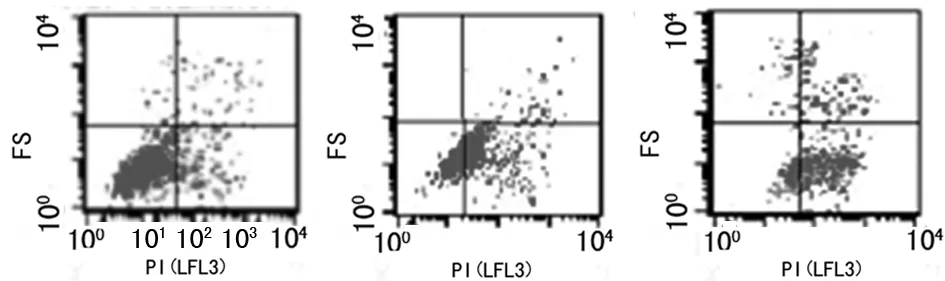
图3 敏感菌株经抗菌药物作用后PI%

图4 耐药菌株经抗菌药物作用后PI%
2.4FCM药敏试验MIC判断值的设定分别检测大肠埃希菌标准菌株不加抗菌药物阴性对照活菌和已知MIC浓度抗菌药物作用细菌的PI%,据此结果,将PI%逐渐增高达到80%以上时的药物浓度判为MIC值,表明该菌株对药物敏感。若被测菌株PI%值不随药物浓度增加而明显上升,说明其MIC值大于试验药物的最高浓度,则可判为菌株耐药[6-7]。
2.5常规药敏试验与FCST结果比较本文用常规方法和FCST双盲法对临床分离的66株鲍曼不动杆菌分别检测MIC,用χ2检验比较FCST与微量稀释法、VITEK仪检测判断的敏感性结果,差异无统计学意义(P>0.05),见表1。

表1 FCST与常规方法检测耐药性的情况(n=66,n)
注:与微量稀释法比较,*P>0.05;与VITEK仪检测比较,#P>0.05。
3 讨 论
鲍曼不动杆菌原本是一种自然界广泛存在的条件致病菌,但随着近年来广谱抗菌药物的广泛使用和抗菌药物选择性压力的不断增加,它逐渐成为了机会感染和医院感染的主要菌种之一。多中心研究已表明,鲍曼不动杆菌是目前引起医院感染的重要病原菌之一[8]。许多医院出现鲍曼不动杆菌分离率逐年上升,尤其多重耐药的鲍曼不动杆菌,已成为医院内感染暴发流行的重要病原菌,是重症监护病房及老年患者呼吸道感染的主要致病菌之一[9-10]。
抗菌药物体外药敏试验是指导临床合理进行抗感染治疗的重要依据,但微量稀释法等常规检测方法通常需要20 h以上,耗时较长。而引起感染的鲍曼不动杆菌往往多重耐药,对于这类菌株常规药敏检测不仅周期长,而且受试验药物有限,往往不能满足临床需要,给临床治疗带来很大困难。FCM能够对细胞(或微粒)的生物学性状及功能状态进行快速、大量地定性或定量检测,在细胞研究上应用广泛。近年来,有研究将FCM用于细菌检测,FCST也逐渐得到了研究和发展[11]。建立一种FCM快速检测鲍曼不动杆菌MIC的方法可以为临床选择抗菌药物提供快速、准确的参考,并且可以扩大药敏试验抗菌药物选择的范围,为临床合理应用抗菌药物更好地提供参考。此外,建立该检测方法具有加强对多重耐药鲍曼不动杆菌监测的意义。
经抗菌药物处理后的细菌,以PI等特定的荧光染料染色,并通过FCM检测荧光强度,可以判断其存活状态,进而推断MIC。PI属于膜非渗透性荧光染料,价格较低,是FCST检测理想的荧光染料。PI相对分子质量较大,正常情况下不能进入细胞膜完整的活细菌体内,然而当细胞受损害或坏死、外膜完整性破坏,PI即可进入细胞、嵌入到DNA的碱基对中,并且荧光强度明显增强。本研究选择PI作为荧光染料对66株鲍曼不动杆菌进行FCST检测,并与常规方法进行比较。药物敏感细菌因受抗菌药物作用而损伤或坏死,导致细胞膜缺损,可被PI染色。PI进入菌细胞内嵌入细菌DNA中。FCM检测时,PI在激光的激发下可发出红色荧光(激发光谱300~380、440~580 nm,发光光谱560~680 nm)。本研究使用EPICS-XL型流式细胞仪,激发光为488 nm的氩离子激光,仪器中第3个光电倍增管能检测PI发出的荧光信号(FL3)。既往研究多采用MFIx推断MIC来反映细菌对药物的敏感性。但培养基中颗粒状物质荧光干扰、仪器工作状态等多种因素均可影响MFIx,使其欠稳定。本试验选择检测细菌在抗菌药物作用后PI%的变化来推断MIC、判断细菌对药物的敏感性。结果显示,所有66株被检鲍曼不动杆菌的药敏结果与微量稀释法及临床使用的VITEK仪检测结果完全一致。常规药敏试验细菌与药物共同孵育培养20 h以上才能判读结果,而FCST不依赖细菌大量繁殖,仅需5 h左右即可获得结果,大大缩短了试验时间。并且,由于被测菌与药物共同孵育时间较短,药敏结果不易受抗菌药物诱导耐药的影响。此外,由于是通过流式细胞仪逐个测定药物对采集的菌细胞个体生长的影响、了解细菌的存活状态,FCST还可以检测到细菌群体中具有药敏异质性的菌细胞。本试验表明,FCST用于鲍曼不动杆菌体外抗菌药物药敏检测具有快速、敏感的优点。
FCST精确、客观,便于自动化和标准化。近年来随着国内FCM在临床检验多个领域的广泛应用,相信该技术在快速细菌药敏试验方面也将发挥其应有价值。
[1]卢雅敏,邹安庆,侯佳惠,等.鲍曼不动杆菌对头孢哌酮/舒巴坦的体外药敏试验结果评价[J].中国抗生素杂志,2011,36(11):872-874.
[2]崔俊昌,宋秀杰.不同MH琼脂对于替加环素对鲍曼不动杆菌药敏结果的影响[J].中国药物应用与监测,2012,9(2):84-86.
[3]Suller MT,Lloyd D.Fluorescence monitoring of antibiotic-induced bacterial damage using flow cytometry[J].Cytometry,1999,35(3):235-241.
[4]Favel A,Peyron F,De Méo M,et al.Amphotericin B susceptibility testing of Candida lusitaniae isolates by flow cytofluorometry:comparison with the Etest and the NCCLS broth macrodilution method[J].J Antimicrob Chemother,1999,43(2):227-232.
[5]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版.南京:东南大学出版社,2006:890-920.
[6]朱永泽,胡庆丰,吕火烊,等.FCM快速检测假丝酵母菌药物敏感性方法的建立及应用[J].中华微生物和免疫学杂志,2013,33(11):850-855.
[7]夏晓华,陆淼泉.流式细胞术应用于金黄色葡萄球菌体外药敏试验的初步研究[J].中国人兽共患病杂志,2003,19(4):50-53.
[8]倪语星,糜琛蓉.细菌耐药现状与耐药细菌的预防控制策略[J].中华检验医学杂志,2012,35(8):682-684.
[9]董杰,叶晓光.泛耐药鲍曼不动杆菌感染临床治疗的研究进展[J].广东医学,2010,31(17):2312-2314.
[10]王振,黄文祥,辛小娟,等.泛耐药鲍曼不动杆菌医院感染流行病学研究[J].第三军医大学学报,2011,33(21):2244-2248.
[11]Steen HB.Flow cytometry of bacteria:glimpses from the past with a view to the future[J].J Microbiol Methods,2000,42(1):65-74.
Preliminary study on the sensitivity test of Acinetobacter baumannii in vitro by flow cytometry
ZHAOXuhong,SHENJuying,CAIHuiping,CHENLuyi,LIZhi,XULong△
(DepartmentofClinicalLaboratory,YangpuHospital,TongjiUniversity,Shanghai200090,China)
ObjectiveTo investigate the clinical application significance of flow cytofluroometric(FCM) antibiotic susceptibility test for A.baumannii in vitro.MethodsThe sensitivity to Ampicillin/Sulbactam,Levofloxacin,Meropenem,Cefotaxime of an Escherichia coli standard strain and 66 isolates of A.baumannii were tested with FCM by using propidium iodide as a fluorescent probe.The survival rates of the bacteria in the culture after treatment with different dosages of the antibiotics were determined according to the fluorescence strength.The MIC value of the antibiotics against the 66 strains were judged with FCM,compared with microdilution and VITEK methods.ResultsThe antibiotic resistant strains number of sultamicillin,levofloxacin,meropenem and cefotaxime sodium were 35,30,13 and 38 respectively in flow cytofluorometric antibiotic sensitivity test(FCST) of 66 strains of A.baumannii.There was no significant difference(P>0.05) compared with the antibiotic susceptibility results by the methods of VITEK instrument and microdilution by measuring withχ2test respectively.ConclusionThe established method of FCST for A.baumannii is suitable for dectecting bacterial drug-sensitivity,which is more rapid,accurate and objective.
flow cytofluorometric antibiotic test(FCST);acinetobacter baumannii;sultamicillin;levofloxacin;meropenem;cefotaxime
赵旭鸿,女,主管技师,主要从事临床实验室诊断研究。△
,E-mail:ypxulong@163.com。
10.3969/j.issn.1673-4130.2016.18.019
A
1673-4130(2016)18-2555-03
2016-03-14
2016-05-22)

