吉林地区猪链球菌的分离及快速检测方法的建立
宋永利,尹柏双,付连军,刘立明,沙万理,王 奔,李静姬
(吉林农业科技学院动物科技学院,吉林吉林 132101)
吉林地区猪链球菌的分离及快速检测方法的建立
宋永利,尹柏双,付连军,刘立明,沙万理,王 奔,李静姬
(吉林农业科技学院动物科技学院,吉林吉林 132101)
从吉林市周边地区8个猪场收集病料,采集疑似猪链球菌的猪样品,进行病原菌的分离、生化试验、动物致病性试验和毒力因子的PCR检测。共分离到8株分离株,其中3株有致病性,5株无致病性。PCR能够高效、快速诊断出该病菌是否有致病性。该试验结果可为正确及时诊断治疗链球菌病提供理论依据。
猪链球菌;分离;生化试验;动物致病性试验;PCR检测
猪链球菌病是我国常见的猪传染病,危害严重,并且出现人感染猪链球菌的报道,引起人们的极大关注。猪链球菌血清型较多,防治较为困难。针对猪链球菌病的防治,国内外大多采用药物治疗和免疫相结合的方法。在发病初期一般采用抗生素治疗,但由于没有进行有效的药敏试验,导致抗生素的滥用,延误了最佳的治疗时间,并且有畜产品抗生素残留的隐患[1]。因此,应致力于筛选广谱、高效、低残留的抗菌药物,在疾病发生早期及时控制疫情的蔓延。猪溶血素使细菌产生致病力,是许多细菌产生的重要毒力因子[2-3]。研究表明,GAPDH与猪链球菌对宿主细胞的黏附有关[4]。GAPDH具有结合白蛋白的能力,并且猪链球菌结合白蛋白后能增强菌株的毒力。Chen C等[5]研究表明在我国猪链球菌流行株中存在1个86 kb大小的基因组毒力岛,含有2个双组分信号转导系统,通过调控多种毒力因子的表达参与致病过程。李干武等[6]利用PCR技术首次从我国江苏分离株HA9801中检测到浑浊因子(orf2),同时发现orf2还存在于其他血清型的链球菌猪源分离株中。猪链球菌在血清肉汤和THB液体培养基中有白色絮状沉淀产生[7]。生化试验可用于猪链球菌的鉴定,但是不同血清型的猪链球菌或同一血清型不同菌株间的生化结果差异较大,因此生化鉴定只能作为补充性鉴定方法[8]。徐敏等[9]利用纯化的原核表达猪链球菌高保守的GDH蛋白的表位区域作为抗原,建立间接ELISA方法,该方法特异、敏感,能够准确检测出所有亚血清型猪链球菌的抗体,为流行病学调查提供了一个有效的诊断方法。倪艳秀等[10]根据猪链球菌2型的荚膜多糖基因cps2J设计合成了1对引物,建立了检测猪链球菌2型的PCR法,该方法不需要进行细菌的分离纯化,检测时间短,适合实验室对大批样本进行检测诊断,为流行病学调查提供依据。笔者从吉林市周边地区8个猪场收集病料,进行病原菌的分离,并进行生化试验、动物致病性试验和毒力因子的PCR检测,对当地养猪业的发展和链球菌病的预防具有积极意义。
1 材料与方法
1.1样品采集从吉林市周边地区8个猪场收集病料,采集疑似感染猪链球菌病猪的样品。
1.2试剂与仪器PCR mix购自Tiangen公司;DNA Marker购自中科瑞泰(北京)生物科技有限公司;常用培养基购自Oxoid公司。试验仪器有PCR仪(ABI9700)。
1.3试验方法
1.3.1致病原分离。无菌采集疑似链球菌感染的病死猪肝、肾、脾,淋巴结,接种于马丁肉汤培养基中,在37 ℃下培养1 d后,在培养基中挑选生长出的可疑菌落,将可疑菌落用记号笔进行标记,在低倍镜下观察,挑取每一个菌落少许,革兰氏染色。将革兰氏阳性、成双或短链状球菌的肉汤培养物接种于血清平板上,经过培养、镜检确定为链球菌后,接种于含有血清的马丁肉汤、普通营养琼脂培养基THB培养基中,无菌检验合格者,加入甘油于-20 ℃下保存。如果是可疑菌落,经过纯培养后,进一步进行其他试验鉴定。
1.3.2生化试验。将上述纯化的肉汤培养物接种于马丁琼脂斜面,培养后用灭菌盐水冲洗,将菌液收集于灭菌试管,供生化试验用。待测菌株分别用接种针接种到生化编码鉴定管。将接种后的生化鉴定管置于37 ℃恒温箱中培养24 h后,观察并记录结果。重复3次。混合,37 ℃下作用18~24 h后观察结果。
1.3.3动物致病性试验。取每个菌株18 h血清马丁肉汤培养物稀释成1∶15匀浆悬液,对3只小鼠进行腹腔注射,0.3 mL/只,同时取3只小鼠腹腔注射同剂量的血清马丁肉汤,作为对照。将注射后的小鼠单独饲养,观察发病及死亡情况,对死亡的小鼠进行解剖,条件下摘取无菌肝脏和脾脏,革兰氏染色,并在鲜血琼脂平板上分离培养。
1.3.4猪链球菌分离株毒力因子的PCR检测。参照朱子洁[11]的方法设计1对引物F(GCTACGACCTCAGGCTGAAAC)和R(TGGATCCAAGTGTCACTGTAC),对ef进行PCR扩增。PCR反应体系如下:引物各1 μL、mix 6 μL、模板1 μL、水3 μL。PCR反应条件如下:95 ℃ 30 s;95 ℃4 min,52 ℃ 30 s,72 ℃ 1 min;72 ℃延伸7 min,35个循环。
2 结果与分析
2.1分离菌的培养特性通过镜检发现,致病原为革兰氏阳性球菌,多数为圆形,少数呈短链状,有荚膜。在血清肉汤中先均匀混浊,后在试管底部形成沉淀,血清肉汤培养物涂片,可见革兰氏染色阳性,多呈长链状的球菌。致病菌的培养特性如表1所示,符合链球菌的培养特性。
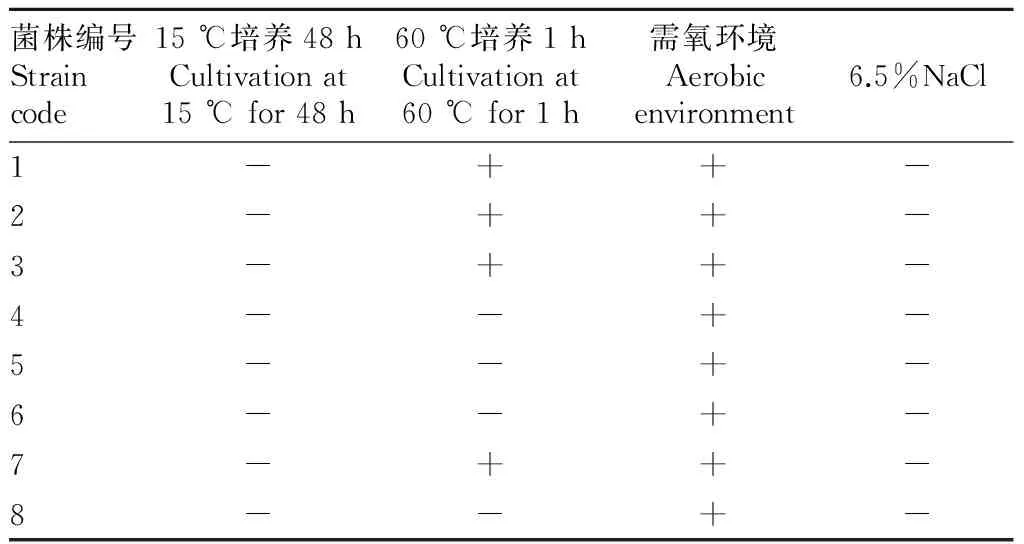
表1 致病原的培养特性观察
注:-表示生长不好;+表示生长良好。
Note:- indicated poor growth;and + indicated good growth.
2.2生化试验结果菌株5、6、8可发酵乳糖,不发酵山梨醇;菌株1、2、3、4、7不产生H2S。生化试验结果表明,分离菌株符合猪链球菌的生化特性(表2),证实了猪链球菌病的存在。
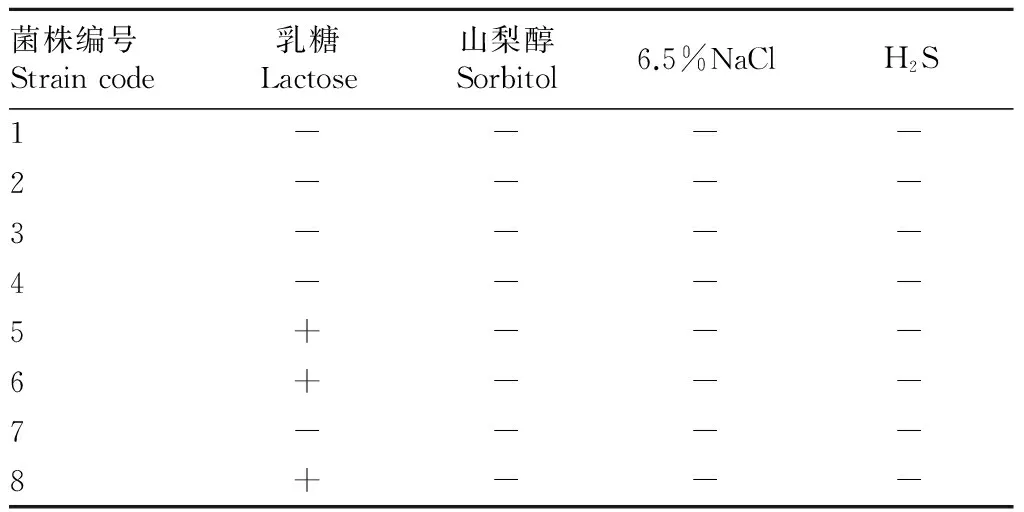
表2 致病原的生化试验结果
2.3致病性试验结果将分离培养的菌液经纯化培养后,接种于小鼠体内,在不同时间内小鼠的表现不同,在不同时间内小鼠发生死亡,接种菌液5、6、8后在24 h内小鼠死亡,接种1、2、3、4、7号菌液的小鼠没有发生死亡。死亡小鼠经剖检发现肾脏肿大、关节肿大,肝脏、肺脏有出血点。
2.4分离株毒力因子的PCR检测从图1可以看出,5、6、8号菌液扩增出606 bp大小的ef条带,而1、2、3、4、7号菌液没有扩增出条带,说明1、2、3、4、7号菌液无致病性。经测序比对,与NCBI上的ef序列相一致,且5、6、8号菌液也符合链球菌的培养特性。这验证了PCR在鉴定致病性链球菌方面的准确性。
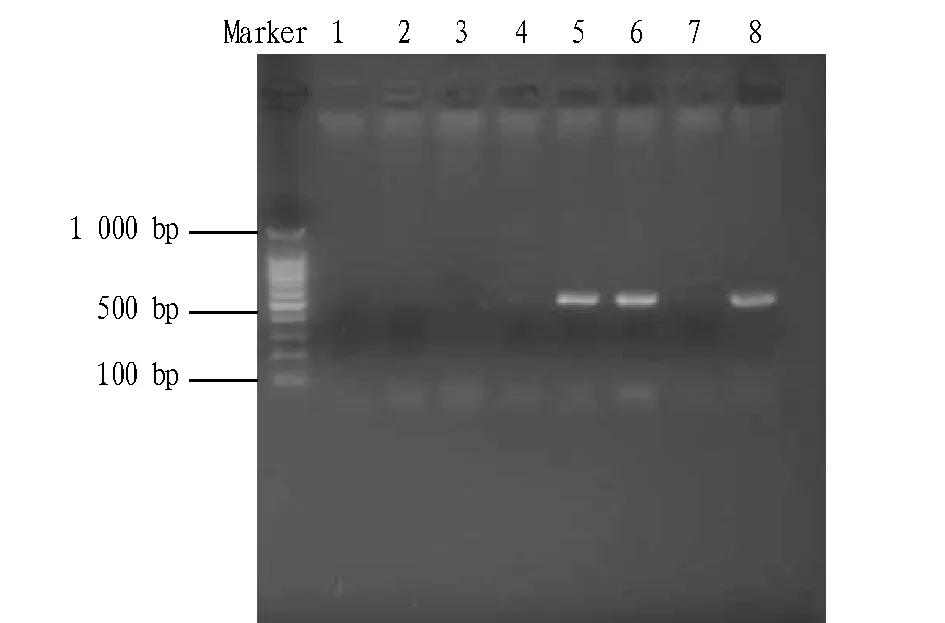
图1 分离株毒力因子ef的PCR检测Fig.1 PCR detection of virulence factor ef in isolated strain
3 小结
猪链球菌的致病性与其毒力因子密切相关,鉴于毒力因子检测在该病临床诊断及流行病学监测中的重要价值,笔者从吉林市周边地区8个猪场收集病料,进行病原菌的分离以及生化试验、动物致病性试验和毒力因子的PCR检测,旨在实现对吉林市地区猪链球菌分离菌株的毒力相关因子的检测,以期为该地区快速诊断该疾病提供实验室诊疗方法,减少猪链球菌病给吉林周围地区养猪业带来的损失。
[1]闫若潜,赵明军,张志凌,等.河南省致病性猪链球菌血清型及耐药性状况调查[J].河南畜牧兽医,2007,28(5):25-27.
[2]陈希,索占伟,许剑琴,等.细菌溶血素的分类及代表性溶血素研究进展[J].中国农学通报,2008,24(8):16-22.
[3]杨杨,郭晓奎.细菌成孔毒素研究进展[J].微生物与感染,2008,3(1):47-49.
[4]BRASSARD J,GOTTSCHALK M,QUESSY S.Cloning and purification of the Streptococcus suis serotype 2,glyceraldehyde-3-phosphate dehydrogenase and its involvement as an adhesin[J].Vet Microbiol ,2004,102(1/2):87-94
[5]CHEN C,TANG J,DONG W,et al.A glimpse of streptococcal toxic shock syndrome from comparative genomics of S.suis 2 Chinese isolates[J].PLoS One ,2007,2(3):315.
[6]李干武,姚火春,陆承平.在猪链球菌 2 型江苏分离株中发现新的 orf2 毒力相关基因[J].农业生物技术学报,2003,11(3):295-298.
[7]陆承平.兽医微生物学[M].3版.北京:中国农业出版社,2001:204-212.
[8]赵华梅,潘秀珍,唐家琪.猪链球菌毒力因子和鉴定方法的研究进展[J].微生物学杂志,2006,26(1):77-80.
[9]徐敏,王淑杰,蔡雪辉,等.猪链球菌重组 GDH 蛋白间接 ELISA 检测方法的建立[J].中国预防兽医学报,2009,31(8):623-626.
[10]倪艳秀,何孔旺,王继春,等.猪链球菌 2 型的 PCR 快速检测[J].中国兽医学报,2002,22(5):474-476.
[11]朱子洁.石家庄地区猪链球菌的分离鉴定及其快速检测方法的建立和应用[D].保定:河北农业大学,2008.
Isolation and Rapid Detection of Streptococcus suis in Jilin District
SONG Yong-li,YIN Bai-shuang,FU Lian-jun et al
(College of Animal Science and Technology,JILin Agriculture Science and Technology College,Jilin,Jilin 132101)
Suspected samples of Streptococcus sui were collected from 8 pig farms in the surrounding areas of Jilin City.The isolation,biochemical test,animal pathogenicity test and the virulence factor PCR test of pathogenic bacteria were carried out.A total of eight strains were isolated.And among them,3 strains had pathogenicity,others were non-pathogenic.RCR could rapidly and efficiently diagnose whether the strain had pathogenicity.This research provided theoretical basis for the correct and timely treatment of Streptococcus suis.
Streptococcus suis;Isolation;Biochemical test;Animal pathogenicity test;PCR detection
吉林农业科技学院重点学科培育项目[吉农院合字(2013)第X028号]。
宋永利(1983- ),男,内蒙古呼和浩特人,讲师,硕士,从事分子生物学与胚胎工程研究。
2016-07-03
S 851.34+7
A
0517-6611(2016)25-131-02

