携带重组腺病毒 BMP-2 的巨噬细胞对 C3H10 细胞成骨分化的影响
周少怀,杜谢琴,金 静,卞 峰,方红育
(武汉市第三医院,武汉 430060)
携带重组腺病毒 BMP-2 的巨噬细胞对 C3H10 细胞成骨分化的影响
周少怀,杜谢琴,金 静,卞 峰,方红育
(武汉市第三医院,武汉 430060)
目的:探讨携带BMP-2(Bone Morphogenetic protine-2)腺病毒的巨噬细胞对小鼠 C3H10 细胞的增殖和成骨分化的作用。方法:感染重组腺病毒 BMP-2的巨噬细胞与小鼠C3H10 细胞共培养。MTT 方法检测共培养体系中 C3H10 细胞的增殖能力;共培养 7 d 对C3H10细胞进行 ALP 染色和活性检测;细胞培养至 21 d,进行标茜素红染色检测矿化结节;定量PCR实验验证过表达腺病毒载体 BMP-2 有效性并且检测Runx2的表达;Western blot检测细胞中磷酸化 Smad1/5/8蛋白表达。结果:与对照组相比,巨细胞过表达BMP-2与 C3H10细胞共培养后,可以促进C3H10细胞增殖;ALP 染色程度和活性上升;矿化结节增多;定量 PCR结果显示 Ruxn2 RNA表达增加,Western blot 结果显示 Ruxn2 蛋白表达上升。结论:过表达 BMP-2 的巨噬细胞可以促进小鼠 C3H10 细胞的增殖,并且可能通过 BMPs 经典途径促进 C3H10 细胞的成骨分化。
成骨分化;巨噬细胞;BMP-2
骨折发生后,骨结构和血供破坏,单核细胞侵入受损组织分化为巨噬细胞[1],巨噬细胞分泌像转化生长因子、肿瘤坏死因子、成纤维生长因子等因子,这些因子募集骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs),促进其增殖、分化,并且合成胞外基质蛋白促进骨折愈合[2]。另外巨噬细胞可以通过影响钙化的血管细胞促进血管钙化[3]。越来越多的证据显示,巨噬细胞可以分泌骨形态发生蛋白-2(BMP-2)参与到体内的多重病理生理过程[4]。最近一些研究开始关注到骨折中巨噬细胞的多重作用[5]。研究发现巨噬细胞既可以调节破骨细胞活性,又能促进成骨分化。
BMP-2 是转化生长因子超家族成员之一[6],是一种多功能生长因子,对胚胎骨形成及出生后骨生长有重要作用[7-9]。BMP-2 因为具有很强的成骨分化能力,所以已经被批准用于临床治疗骨折、骨质疏松等疾病引起的大面积骨缺损的修复[10]。BMP-2 主要通过激活Smads 信号传导和调节成骨基因转录而发挥作用[11]。
本实验旨在探讨在巨噬细胞中过表达 BMP-2 然后与 C3H10 细胞共培养,检测共培养体系中 C3H10 细胞的增殖和分化能力。
1 资料与方法
1.1 材料 小鼠 C3H10 细胞购于美国菌种保藏中心,小鼠巨噬细从 C57 小鼠腹腔分离。重组腺病毒Ad-RFP 和Ad-BMP-2 由本实验室构建保存。 DMEM高糖培养基和胎牛血清(Hylcone公司);Transwell 小室(Millipore公司)。 PCR逆转录试剂、定量PCR试剂(TakaRa公司);PCR引物和TRZIOL(Invitrogen公司);碱性磷酸酶(ALP)活性检测试剂盒(Sigma 公司);抗 Runx2(Runt related transcription factor 2)抗体(Abcam公司)及内参β-actin抗体(中杉金桥);Western blot 发光试剂盒(北京英格恩公司)。
1.2 方法
1.2.1 小鼠巨噬细胞分离及病毒感染 C57 小鼠脱臼处死后,腹部消毒。用注射器抽取5 mL含双抗的DMEM高糖培养基注入腹腔,用绵球轻揉腹部1-2 min,解剖小鼠,用吸管吸取细胞悬液,移入离心管中离心,并重复洗涤 3 次,铺板。在37 °C、5 % CO2的饱和湿度培养箱中培养 6 h,去除非粘附细胞。消化细胞后以 2×106/ mL密度接种细胞,待细胞贴壁后,加入合适浓度重组腺病毒,10 h 后,消化细胞,接种于 Tranwell 小室。
1.2.2 共培养体系的建立 小鼠 C3H10 细胞培养于含有100 U/ mL 青霉素、100 μg / mL链霉素和10%胎牛血清的DMEM高糖培养基。C3H10 细胞按2.0×105个/孔的密度接种于6 孔板,待细胞融合度达60% 时,将接种了巨噬细胞的 Transwell 小室置于 6 孔板上,开始共培养。24 孔板的共培养体系以此类推。
1.2.3 实验分组 实验组分为空白组(Blank)、对照组(Ad-RFP)、过表达BMP-2(Ad-BMP-2)组。 病毒感染效率在 50% 左右适宜。
1.2.4 MTT 检测细胞增殖能力 将共培养后 1-5 d 的 C3H10 细胞加入 500 µL MTT(5 mg/ mL),放入孵箱继续培养 4 h,小心吸弃孔内培养基,每孔加入 4 mL DMSO 溶液,避光震荡 10 min。将溶液转移到 96 孔板(200 µL/孔),于 490 nm 处检测吸光度 OD 值。
1.2.5 ALP 活性和染色测定 24孔板接种 30% 密度的 C3H10 细胞进行共培养。分别培养至第第 7 d,按照ALP 测定试剂盒说明书进行检测。
1.2.6 茜素红染色 按 1.2.5 所述接种细胞,进行共培养,下层培养基换为成骨诱导培养基(50 μM 维生素 C,10 mm β-磷酸甘油和100 nm地塞米松)。21 d 后取出细胞,吸弃培养基,PBS 洗涤 3 次,0.1 % 戊二醛固定10 min,ddH2O洗涤 3 次;吸弃去ddH2O,加入 0.4% 茜素红S,在显微镜下观察,待出现红色物质堆积时,弃去孔内染液,ddH2O 终止反应和洗涤,显微镜下拍照保存。
1.2.7 实时荧光定量PCR(qRT-PCR)实验 各组细胞使用TRIZOL提取RNA,然后逆转录成cDNA。定量PCR 反应体系如下:cDNA 2 µL,上下游引物各0.4 µL,SYBR Premix Ex Taq 10 µL,ddH2O 6.4 µL,Total 20 µL。
1.2.8 Western blot 实验 共培养 5 d 后的 C3H10 细胞裂解后使用 10% SDS-PAGE 胶进行凝胶电泳。电泳完成后,将目标蛋白转膜至 PVDF 膜,5% 脱脂奶粉封闭 1 h,用1:1000 稀释 p-Smad1/2/8 和 β-actin抗体4℃ 封闭过夜。TBST 洗膜 3 次,每次 3 min,1:5000的二抗 37℃ 孵育 1 h。TBST 再次洗膜 3 次,发光显影。
1.2.9 统计学 统计学处理数据用均数±标准差表示,统计学数据均用SPSS16.0软件包处理,P<0.05 为差异具有统计学意义。
2 结果
2.1 验证病毒有效性 巨噬细胞感染腺病毒 36 h 后,提取细胞总 RNA。qRT-PCR 结果显示,与 Ad-RFP 组相比,Ad-BMP-2 组 BMP-2 的 RNA 升高了约 10 倍左右(P<0.01)(图 1)。说明过表达 BMP-2 腺病毒可以用于后续实验。
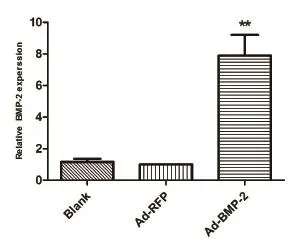
图 1 BMP-2 mRNA 在各组细胞间的表达。**P<0.01。
2.2 过表达 BMP-2 的巨噬细胞促进 C3H10 细胞增殖
MTT 结果显示,C3H10 细胞与感染了过表达 BMP-2腺病毒的巨噬细胞共培养后,从第 3 d 起,C3H10 细胞增殖明显比对照组增快,一直持续到第 5 d 到达一个平台期(P<0.05)(图 2)。

图 2 过表达 BMP-2 的巨噬细胞促进 C3H10 细胞增殖。*P<0.05,**P<0.01。
2.3 过表达BMP-2 的巨噬细胞促进 C3H10 细胞ALP 活性 C3H10 细胞与巨噬细胞共培养 7 d 后,利用 ALP 染色和活性检测 C3H10 细胞的一个成骨分化指标。结果显示,Ad-BMP-2 组的 ALP 活性比对照组明显升高(P<0.01)(图 3 a)。化学染色结果也显示,Ad-BMP-2 组 ALP 染色加深(图 3 b)。说明过表达 BMP-2的巨噬细胞能够增强 C3H10 细胞的 ALP 活性。
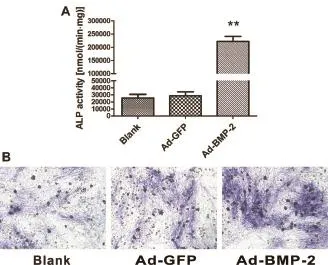
图 3 过表达 BMP-2 的巨噬细胞促进 C3H10 细胞的 ALP 活性.**P<0.01。
2.4 过表达 BMP-2 的巨噬细胞促进 C3H10 细胞矿化
C3H10 细胞共培养至 21 d 进行茜素红染色。结果表明,相比对照组,Ad-BMP-2 组矿化结节显著升高(图4)。说明在巨噬细胞中过表达 BMP-2 后与 C3H10 细胞共培养,可以促进 C3H10 细胞的钙盐沉积。
2.5 过表达 BMP-2 的巨噬细胞促进 C3H10 细胞成骨分化基因表达 共培养的 C3H10 细胞分别提取总 RNA和总蛋白。qRT-PCR 结果显示,Ad-BMP-2 组 Runx2 mRNA 表达明显上升(图 5 a)。Western blot 也显示 Ad-BMP-2 组 Runx2 蛋白表达升高(图 5 b)(P<0.05)。
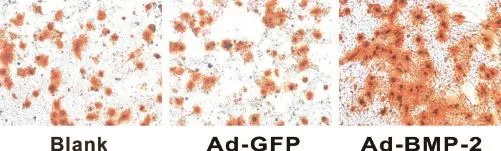
图 4 过表达 BMP-2 的巨噬细胞促进 C3H10 细胞的钙盐沉积

图5 过表达 BMP-2 的巨噬细胞促进 C3H10 细胞 Runx2 mRNA 和蛋白表达。*P<0.05。
3 讨论
研究骨损伤和损伤后骨重建对于骨组织工程来说是非常重要的[12]。它可以帮助研究者设计更为合理的组织工程微环境;也可以帮助临床医生预测患者预后,制定更好的治疗策略。
骨损伤后,单核细胞被招募到受损组织分化为巨噬细胞,从而分泌多种因子,参与到骨重建过程当中[13]。BMP-2 就是这些因子中的一个[14]。而 BMP-2是当今研究最为透彻,也是成骨能力最强的 BMPs 家族成员。BMP-2 具有强大的成骨作用,所以它已经被开发用于临床治疗骨缺损骨不愈合[15]。但是具体机制却不是很清楚。
骨重建过程中离不开骨损伤周围的微环境[16],所以本研究把微环境中重要的巨噬细胞、成骨细胞以及重要的成骨因子 BMP-2 一起纳入研究,使其更加接近体内真正的微环境。在巨噬细胞中过表达 BMP-2 后,与 C3H10 细胞共培养。实验结果显示,C3H10 细胞的增殖能力上升;成骨相关指标(ALP、矿化结节)都明显高于对照组。此外,作为转化生长因子家族中成骨分化中重要的转录因子 Runx2(Runt related transcription factor 2)基因水平和蛋白水平在巨噬细胞中的 BMP-2刺激下表达也明显升高。因此推测,共培养体系中C3H10 细胞增殖能力和成骨分化能力的提高可能是通过激活 Runx2,再启动相关基因活化导致,其具体机制还有待探讨。
[1] Hume D A, Ross I L, Himes S R, et al. The mononuclear phagocyte system revisited[J]. J Leukoc Biol, 2002, 72(4): 621-627.
[2] Pallotta I, Sun B, Wrona E A, et al. Bmp protein-mediated crosstalk between inflammatory cells and human pluripotent stem cell-derived cardiomyocytes[J]. J Tissue Eng Regen Med, 2015.
[3] Tintut Y, Patel J, Territo M, et al. Monocyte/macrophage regulation of vascular calcification in vitro[J]. Circulation, 2002, 105(5): 650-655.
[4] 刘翔, 李源, 郑亿庆, 等. 巨噬细胞和骨形成蛋白 2 在鼓室硬化中的定位和表达[J]. 临床耳鼻咽喉头颈外科杂志, 20097): 298-301.
[5] Raggatt L J, Chang M K, Alexander K A, et al. Osteomacs: Osteoclast precursors during inflammatory bone disease but regulators of physiologic bone remodeling[J]. Bone, 2009, 44(Meeting abstract): S136-S137.
[6] 李林, 熊涛. Bmp6 对小鼠骨髓基质细胞定向成骨分化的影响[J].临床和实验医学杂志, 2010, 9(7): 481-483.
[7] Yoshikawa Y, Yoshizawa T, Domae E, et al. Rna interference-mediated knockdown of smad1 inhibits receptor activator of nuclear factor kappab ligand expression induced by bmp-2 in primary osteoblasts[J]. Arch Oral Biol, 2015, 60(9): 1319-1326.
[8] Chen X D, Deng M, Zhou J S, et al. Bone morphogenetic protein-2 regulates in vitro osteogenic differentiation of mouse adipose derived stem cells[J]. Eur Rev Med Pharmacol Sci, 2015, 19(11): 2048-2053.
[9] 孙翊夫, 康明阳, 候婷婷, 等. Bmp-2 和 vegf 在大鼠骨缺损修复过程中的表达和意义[J]. 临床和实验医学杂志, 2014, 13(6): 432-435.
[10] Haversath M, Catelas I, Li X, et al. Pge(2) and bmp-2 in bone and cartilage metabolism: 2 intertwining pathways[J]. Can J Physiol Pharmacol,2012, 90(11): 1434-1445.
[11] Sanchez-Duffhues G, Hiepen C, Knaus P, et al. Bone morphogenetic protein signaling in bone homeostasis[J]. Bone, 2015.
[12] Pirraco R P, Reis R L, Marques A P. Effect of monocytes/macrophages on the early osteogenic differentiation of hbmscs[J]. J Tissue Eng Regen Med, 2013, 7(5): 392-400.
[13] Takahashi F, Takahashi K, Shimizu K, et al. Osteopontin is strongly expressed by alveolar macrophages in the lungs of acute respiratory distress syndrome[J]. Lung, 2004, 182(3): 173-185.
[14] Chang M K, Raggatt L J, Alexander K A, et al. Osteal tissue macrophages are intercalated throughout human and mouse bone lining tissues and regulate osteoblast function in vitro and in vivo[J]. J Immunol,2008, 181(2): 1232-1244.
[15] Sun J, Li J, Li C, et al. Role of bone morphogenetic protein-2 in osteogenic differentiation of mesenchymal stem cells[J]. Mol Med Rep, 2015.
[16] Cianferotti L, Gomes A R, Fabbri S, et al. The calcium-sensing receptor in bone metabolism: From bench to bedside and back[J]. Osteoporos Int, 2015.
Macrophage carrying BMP-2 promote C3H10 cell osteogenic differentiation
Zhou Shao-huai,Du Xie-qin,Jin Jing,Bian Feng,Fang Hong-yu.
(Department of Orthopedics,Wuhan Third Hospital,Wuhan 430060,China)
Objective To investigate effects of macrophage carrying BMP-2 on C3H10 cell osteogenic differentiation. Methods macrophage cell which was infected recombinant adenovirus BMP-2 co-culture with C3H10 cells. MTT was used to detect the proliferation capacity of C3H10 cell. C3H10 cell was performed ALP histochemical stain and activity detection at 5 and 7 days. mineralized nodules were exa mined by alizarin red staining, after 21 days. Real-time quantitative PCR was used to confirm the recombinant adenovirus BMP-2 availability and analyze Runx2 expression level. p-smad1/5/8 was analyzed by Western blot. Results Compared with control group, overexpression of BMP-2 in macrophage cell in co-culture system, the proliferation of C3H10 cells was promoted, ALP activity was significantly stimulated,and matrix mineralization increased。Real-time quantitative PCR results showed that the mRNA level of Runx2 was increased, and Western blot results show that the Rxun2 was increased in BMP-2 overexpression group. Conclusion Proliferation and osteogenic differentiation of C3H10 cell was promoted in co-culture system of over-expressing BMP-2 in macrophage cell, and the mechanism is potential achieved via stimulating typical BMP signal pathway.
Osteogenic differentiation; Macrophage; BMP-2
R329.2
A
1673-016X(2016)02-0031-04
2015-08-20
武汉市卫生计生委医学科研项目(武卫(2011)98 NO WX11C16)
方红育,E-mail:389672635@qq.com

