两种含杂环的氨基萘醌化合物的合成
王 建, 刘玮炜*, 丰 敏, 王赪胤, 陶传洲王 丽, 高广林, 陶 玲, 史天智
(1. 淮海工学院 化工学院,江苏 连云港 222005;2. 江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005;3. 淮海工学院 药学院,江苏 连云港 222005;4. 江苏省环境材料与环境工程重点实验室,江苏 扬州 225002)
两种含杂环的氨基萘醌化合物的合成
王建1,刘玮炜2,3*,丰敏3,王赪胤4,陶传洲1王丽3, 高广林1, 陶玲1, 史天智3
(1. 淮海工学院 化工学院,江苏 连云港 222005;2. 江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005;3. 淮海工学院 药学院,江苏 连云港 222005;4. 江苏省环境材料与环境工程重点实验室,江苏 扬州 225002)
以2,3-二氯-1,4-萘醌为主要原料,分别与吗啡啉和糠胺在一定条件下反应生成2种含杂环的氨基萘醌类化合物。2,3-二氯-1,4-萘醌与吗啡啉及2,3-二氯-1,4-萘醌与糠胺物质的量比均为1∶2,反应温度为60℃,溶剂为乙醇。2,3-二氯-1,4-萘醌与吗啡啉反应时间为1 h,产物2-氯-3-吗啡啉基萘-1,4-二酮(a)收率为93.5%;2,3-二氯-1,4-萘醌与糠胺反应时间为4 h,产物N2,N3- 二(2-呋喃甲基)-1,4-二((2-呋喃甲基)亚胺)-1,4- 二氢化萘-2,3-二氯化铵(d)收率为46.7 %。对产物进行IR、Uv、MS和H-NMR等分析表征。
2,3-二氯-1,4-萘醌;吗啡啉;糠胺;2-氯-3-吗啡啉基萘-1,4-二酮;N2,N3-二(2-呋喃甲基)-1,4-二((2-呋喃甲基)亚胺)-1,4-二氢化萘-2,3-二氯化铵
萘醌类化合物是自然界中广泛存在的小分子化合物,分为α-(1,4)萘醌、β-(1,2)萘醌、amphi-(2,6)萘醌三种类型。天然存在的大多数萘醌类化合物为α-萘醌(1,4-萘醌)类。许多高等植物如柿科、紫葳科、紫草科、蓝雪科等二十科中富含较多萘醌类化合物[1]。在一些藻类、地衣类低等植物也分布萘醌类化合物。研究证明,萘醌类化合物有明显的生物活性。比如蓝雪醌有止咳、抗菌和祛痰的作用[2];胡桃醌具有抗菌、抗癌以及中枢神经镇静的作用[3];紫草素及异紫草素类衍生物具有抗菌、抗炎、止血、抗病毒及抗肿瘤的作用[4];维生素K1及K2在促进血液凝固的方面有很大的作用,维生素K在体内的活性形式是2-甲基-1,4-萘醌[5];竹红菌甲素,具有较显著的光敏活性,可发展成为新型的治疗线虫、艾滋病、肿瘤的光疗药物[6]。近年的研究还显示氨基萘醌类化合物具有对抗结核分枝杆菌(结核杆菌)能力[7]。
本文以2,3-二氯-1,4-萘醌为主要原料,分别与吗啡啉和糠胺反应生成2种含杂环的氨基萘醌类化合物,为研究新型抗结核药物提供帮助。
1 实验
1.1试剂与仪器
2,3-二氯-1,4-萘醌,A.R,阿拉丁;吗啡啉,A.R,天津市福晨化学试剂厂;糠胺,A.R,上海达瑞精细化学品有限公司;乙醇,95%,天津市福晨化学试剂厂。
WRX-1S显微热分析仪,上海精密仪器有限公司物理化学仪器厂制造;红外光谱仪Nicolet-iS10,美国Thermo;紫外分光光度计(型号:UV-Vis 2550),日本岛津公司;GCMS-QP2010 Plus,岛津质谱仪;AVANCE600核磁共振波谱仪,瑞士布鲁克拜厄斯宾有限公司。
1.2实验步骤
1.2.1 2,3-二氯-1,4-萘醌与吗啡啉的反应
称取0.114g(0.5 mmol)2,3-二氯-1,4-萘醌,加入80 mL 95%的乙醇。水浴加热至温度60℃,使之完全溶解。称0.087g(1.0 mmol)吗啡啉,加入10 mL 95%的乙醇稀释,将稀释后的吗啡啉滴加到2,3-二氯-1,4-萘醌溶液中,溶液颜色由浅黄色变为酒红色。以薄层层析法(展开剂为乙酸乙酯/石油醚=1∶3)跟踪反应进程,反应1 h后结束。将反应液旋转蒸发(50℃),除去大部分溶剂后,将少量溶液放入冰箱中静置30 min,有红色结晶生成。过滤,干燥后得到0.07g红色针状晶体产物。待滤液中的溶剂挥发完全时,又有0.06g红色结晶生成,经检验与上述晶体产物相同,均为2-氯-3-吗啡啉基萘-1,4-二酮(a)(2-chloro-3-morpholinonaphthalene-1,4-dione),故产物总重0.13g,产率93.5%。熔点:145.7~152.5℃
1.2.2 2,3-二氯-1,4-萘醌与糠胺的反应
称取0.227g(1.0 mmol)2,3-二氯-1,4-萘醌,加入95%的乙醇80 mL,水浴加热至温度60℃,使之完全溶解。称量0.194g(2.0 mmol)糠胺,加入10 mL95%的乙醇稀释后,滴加于2,3-二氯-1,4-萘醌溶液中。溶液颜色由浅黄色变为酒红色。以TLC(展开剂为乙酸乙酯/石油醚=1∶3)跟踪反应进程,反应4 h后结束。将反应液过滤。用少量乙醇淋洗滤渣,晾干后,称量为0.22g。取样点板表明产物较纯。将滤液静置使结晶慢慢析出,待滤液中溶剂挥发后,将析出物称重为0.05g,经点板确认与上述晶体产物相同,故获得产物总重0.27g。通过表征确定为N2,N3-二(2-呋喃甲基)-1,4-二((2-呋喃甲基)亚胺)-1,4-二氢化萘-2,3-二氯化铵(d)[N2,N3-bis(furan-2-ylmethyl)-1,4-bis((furan-2-ylmethyl)imino)-1,4- dihydronaphthalene-2,3 -diaminium chloride]。产率:46.7%,熔点:144.0~146.8℃。
2 结果与讨论
2.1实验原理
图1是2,3-二氯-1,4-萘醌分别与吗啡啉和糠胺反应产物的合成路线。

图1 2,3-二氯-1,4-萘醌分别与吗啡啉和糠胺反应的合成路线
由图式1可知,2,3-二氯-1,4-萘醌与吗啡啉反应产物可能有两种,通过控制反应物物质的量比,使a为主要产物;2,3-二氯-1,4-萘醌与糠胺反应产物可能比较复杂,除了c和e两种取代物外,还可能有加成缩合反应产物d。
2.2产物的表征
2.2.1 红外光谱分析图2、图3分别是产物(a)、(d)的红外光谱图。

图2 产物(a)红外光谱图
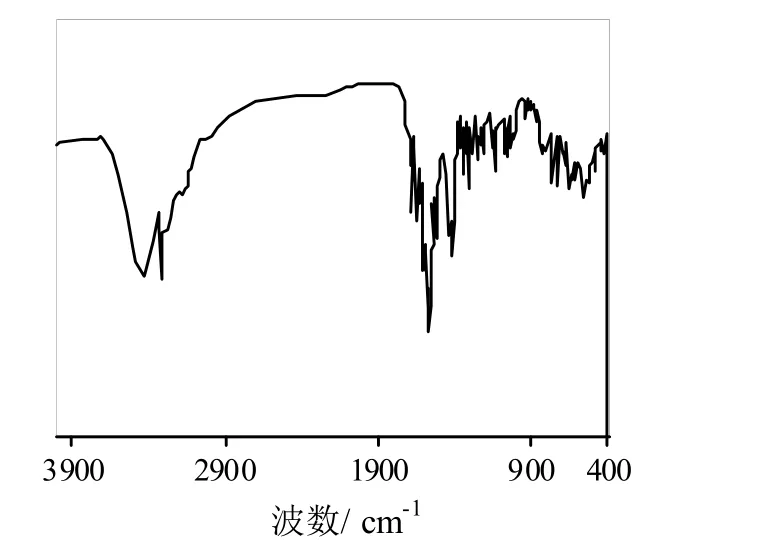
图3 产物(d)红外光谱图

表1 实验数据分析
2.2.2 紫外光谱分析
图4、图5分别是产物(a)、(d)的紫外光谱图。

图4 产物(a)的紫外光谱图

图5 产物(d)的紫外光谱图
由图4可知产物(a)λmax=327 nm属于270~350 nm范围内,如图中吸收峰2,吸收强度较弱,说明有醛酮π→π*和n→π*跃迁所产生的R带;λmax=281 nm属于250~300 nm范围内,如图中的吸收峰3,有中等强度的吸收峰,说明在芳环处有特征吸收,属于π→π*跃迁。
由图5得知产物(d)在270~350 nm范围内吸收强度很弱,说明有醛酮π→π*和n→π*跃迁所产生的R带基本消失;λmax=286 nm,如图中的吸收峰2,在250~300 nm范围内有较强吸收峰,说明在芳环处有特征吸收,属于π→π*跃迁。
2.2.3 核磁
图6为产物(a)的1H-NMR图谱。

图6 产物(a)的1H-NMR图谱
1H-NMR(400 MHz, CDCl3)δ 8.20~8.08(m, 1H, H-4),8.07~7.95(m, 1H, H-5),7.70(m, J=14.6, 7.4, 1.5 Hz, 2H, H-3和H-6),3.93~3.82(m, 4H, H-14, H-17),3.67~3.56(m, 4H, H-15, H-16)。1

图7 产物(d)的1H-NMR图谱
H-NMR(400 MHz, CDCl3)δ 8.15(dd, J = 7.7, 1.0 Hz, 1H,H-6或H-3),8.04(dd, J = 7.7, 1.0 Hz, 1H,H-4或H-5),7.73(td, J = 7.6, 1.3 Hz, 1H,H-20或H-24),7.63(td, J = 7.6, 1.3 Hz, 1H,H-14或H-34),7.40(dd, J = 1.8, 0.8 Hz, 1H,H-19或H-25),6.35(dt, J = 6.9, 2.6 Hz, 2H,H-22或H-29),6.21(s, 1H,H-13或H-33),5.05(d, J = 4.2 Hz, 2H,H-16或H-36),3.72(dd, J = 14.1, 7.2 Hz, 1H,H-18或H-26),1.24(t, J = 7.0 Hz, 1H,H-12或H-32)。
2.2.4 质谱
图8是产物(a)的质谱图。由图8可以看出,最大质荷比分子量为m/z=277.056 2,与目标产物的分子量277.05相同,可以判定产物结构为(a)。还有一个离子峰为m/z=328.0213,与双取代的物质分子量328.14相似,可以判断为该物质为反应过程中的另一产物(b)。

图8 产物(a)的质谱图
图9是产物(d)的质谱图。由图9可以看出,质荷比为m/z=577.088 6,与目标产物的分子量578.15相差1,故为M-1峰,可以判定产物结构为(d)。

图9 产物(d)的质谱图
2.3两个反应的异同做对比分析
吗啡啉和糠胺对1,4-萘醌的2,3位的取代存在不同程度上的空间位阻作用。吗啡啉基相当于仲氨基,空间位阻较大,亲核取代能力减弱,所以在醌环的2位或3位较容易取代一个氯原子,但较难将两个氯全部取代。尤其在反应条件较温和时,在醌环上很难进行双取代反应。而糠胺属伯胺,空间位阻较小,亲核取代反应活性较高,不仅可在醌环的2位和3位进行双取代反应,还可在醌环的两个羰基上进行亲核加成及缩合反应。
3 结论
1)吗啡啉和糠胺对1,4-萘醌的2,3位的取代存在差异。在醌环的2位或3位只取代一个吗啡啉基,而在醌环的2位和3位不仅能双取代糠氨基,而且糠氨基在两个羰基上还能进行加成缩合反应。
2)由于合成的产物在结构中具有较多个活性基团和亲水性,可能具有生物活性,所以值得在新药的研究开发方面做进一步探索。
[1] 刘玉梅. 紫草中羟基萘醌总色素的分光光度定量方法研究[J]. 药物分析杂志, 2011, 31(6): 1140-1144.
[2] 冯筱巍, 任玉芳. 中药成分蓝雪醌的药理作用研究进展[J]. 医学综述, 2015, 21(9): 1659-1660.
[3] 李秀凤, 张艳舫, 刘淑萍. 碱提酸沉淀法提取核桃青皮中胡桃醌的研究[J]. 食品科技, 2014, 39(3): 173-175.
[4] 杨磊, 刘婷婷, 卫蔚, 等. 响应面法优选新疆紫草总萘醌的匀浆提取工艺研究[J]. 中草药, 2010, 41(4): 568-573.
[5] 李梓民, 胡余明, 潘丽莉, 等. 人体维生素 K 需要量及安全摄入量范围的研究进展[J]. 卫生研究, 2011, 40(5): 674-678.
[6] Vishnu K Tandon, Dharmendra B Yadav, a Ravindra V Singh, et al. Synthesis and biological evaluation of novel (L)-a-amino acid methyl ester, heteroalkyl, and aryl substituted 1,4-naphthoquinone derivatives as antifungal and antibacterial agents[J]. Bioorganic & Medicinal Chemistry Letters, 2005, 15: 5324-5328.
[7] Alka Mital, Mukesh Sonawane, Sachin Bindal, et al. Substituted 1,4-naphthoquinones as a new class of antimycobacterial agents[J]. Der Pharma Chemica, 2010, 2(3): 63-73.
Synthesis of Two Kinds of Amino Naphthoquinones of Containing Heterocyclic
WANG Jian1,LIU Wei-wei2,3*,FENG Min3,
WANG Cheng-yin4,TAO Chuan-zhou1,WANG Li3,
GAOguang-lin1,TAO Ling1,SHI Tian-zhi3
(1. School of Chemical Engineering,Huaihai Institute of Technology, Lianyungang 222005, China;
2. Co-Innovation Center of Jiangsu Marine Bio-industry Technology, Lianyungang 222005, China;
3. School of Pharmacology, Huaihai Institute of Technology, Lianyungang 222005, China;
4. The Key Laboratory of Environmental Material and Engineering of Jiangsu Province, Yangzhou 225002, China)
The experiments had used 2,3-dichloro-1,4-naphthoquinone as the main raw material under certain conditions, so as to react with morpholino and furfurylamine reactrespectively to obtain amino naphthoquinone compounds containing heterocyclic. The reaction temperature is 60℃. The solvent is ethanol. The molar ratio of 2,3-dichloro-1,4-naphthoquinone to morpholine and 2,3-dichloro-1,4- naphthoquinone to furfurylamine were 1∶2 respectively. The yield of 2-chloro-3- morpholinonaphthalene-1,4-dione attain to 93.5% with reaction time 1 hour. The yield of N2,N3-bis(furan-2-ylmethyl)-1,4-bis((furan-2-ylmethyl)imino)-1,4-dihydronaphthalene-2,3- diaminium chloride attain to 46.7% with reaction time 4 hours. IR, UV, MS and HNMR have been determined to characterize the structure of the products.
2,3-dichloro-1,4-naphthoquinone; morpholino; furfurylamine; 2-chloro-3-morpholinonaphthalene-1,4-dione; N2,N3-bis(furan-2-ylmethyl)-1,4-bis((furan-2-ylmethyl)imino)-1,4- dihydronaphthalene-2,3-diaminium chloride
O626.42
A
1009-220X(2016)02-0026-06 DOI: 10.16560/j.cnki.gzhx.20160213
2016-01-14
江苏省自然科学基金(BK20130404);江苏省优势学科建设工程资助项目(BK20130404);海洋公益性行业科研专项经费项目;江苏省环境材料与环境工程重点实验室开放研究课题(K12029);连云港市科技攻关计划项目-农业攻关(CN1401);连云港市科技攻关项目(CG1303)。
王 建(1962~),男,江苏淮安人,博士,教授;主要从事有机合成的研究。wjsxhwhp@aliyun.com
刘玮炜(1965~),女,江苏滨海人,博士,教授;主要从事药物合成的研究。liuww@hhit.edu.cn

