磁性壳聚糖硅胶复合微球的制备及其吸附Cu2+的性能研究
吕浩永, 赵亚菲, 胡静荣, 张慧娟*
(中南民族大学化学与材料科学学院,湖北武汉 430074)
壳聚糖(CTS)是一种安全、环保的天然高分子材料,因其分子结构中具有大量的氨基和羟基,使其可通过静电、氢键和配位作用吸附多种金属离子。此外壳聚糖良好的生物亲和性和可降解性,使其在环境有害金属检测及污染处理中具有独特的优势[1 - 4]。固体壳聚糖在酸性条件下能表现出较好的吸附性,但在酸性溶液中壳聚糖上的氨基易质子化造成溶解度增加,不利于回收再利用[5]。交联改性常用于降低壳聚糖的溶解性、结晶度和提高其机械强度,但交联剂会占据部分活性位点,导致交联后壳聚糖上氨基和羟基的数量减少,使其吸附能力降低。较为常用的交联剂,例如戊二醛、乙二醛和乙二醇二缩水甘油醚等还具有一定的毒性,有害健康[6 - 9]。因此,改变壳聚糖基材料制备方法对扩展壳聚糖应用领域具有重要意义。无机材料因其强度高、耐磨损及特有的物理性质等特点,可以有效改善壳聚糖的物理机械性能。目前已经报道的有壳聚糖与坡缕石、膨润土等天然无机矿物复合的材料,还有与石墨烯、沸石A、二氧化钛和硅胶等的无机有机复合材料,这些复合材料在吸附染料及有害金属处理等方面显示出良好性能[10 - 15]。硅胶无机材料的前驱体硅氧烷在酸性条件下能够与壳聚糖溶液均匀混合,形成溶胶凝胶,易于得到两相分散均匀的复合材料。另一方面,硅胶材料同样具有生物相容性好且稳定性好等特点,因此发展壳聚糖硅胶复合材料在环境、生医及化工等领域的应用更具前景。
近年来,关于磁性材料的发展迅速,通过共聚或者包覆能有效改变磁性材料的表面电性质、功能性和材料形状大小,其表现出的超顺磁性等磁学特性,还可以在外加磁场作用下迅速与液体样品分离,大大简化了分离回收的步骤[16 - 19]。Monier等人制备的磁性壳聚糖类树脂材料,对Cu2+、Co2+和Ni2+的吸附性良好,材料回收率可达到84%[19]。因此,将磁性材料和壳聚糖复合材料的优点相结合,既改善壳聚糖材料的机械强度,又具有壳聚糖良好的吸附性能,同时引入内层的磁核,使整个材料能快速、有效地和水体基质分离,便于回收再生。基于此,本文以Fe3O4硅胶微球为核,采用溶胶-凝胶法进行包覆,合成了磁性壳聚糖硅胶复合微球。通过扫描电镜(SEM)、红外(IR)光谱和X-射线衍射(XRD)对磁性壳聚糖硅胶复合微球的结构形貌进行了表征,并以Cu2+为研究对象,考察磁性壳聚糖硅胶复合微球对金属离子的吸附性能。
1 实验部分
1.1 仪器与试剂
CTS及复合材料的红外光谱表征采用美国Nicolet公司的NEXUS 470型智能傅立叶红外光谱仪(KBr压片);材料晶型及物相分析采用德国布鲁克公司的Bruker D8型X射线衍射仪;材料的形貌采用日本Hitachi公司的X-650型扫描电子显微镜直接观察;对于Cu2+的定量分析采用日本岛津公司的AA-6300型原子吸收分光光度计。
Fe3O4纳米粒子(粒径为50 nm),壳聚糖(CTS,脱乙酰度80%~95%),正硅酸乙酯(TEOS,含量以SiO2计>28.4%),十六烷基三甲基溴化铵(CTAB,99%),25%戊二醛溶液(含量25%~28%),磷酸(>85%),NaH2PO4·2H2O,Na2HPO4·12H2O,NaOH等试剂均为分析纯,以上试剂均购自国药集团化学试剂有限公司。实验用水为二次蒸馏水。
1.2 实验步骤
1.2.1磁性壳聚糖硅胶复合微球(Fe3O4@SiO2@CTS+SiO2)的制备硅胶包覆Fe3O4磁核的制备参照文献报道的方法[20,21]。称取制备的硅胶包覆Fe3O4磁核,置于三口烧瓶中,然后加入一定量的CTAB溶液,超声30 min,将CTS和TEOS混合的2%HAc水溶液缓慢滴加入烧瓶中,60 ℃恒温水浴下机械搅拌24 h。反应停止后,产物通过磁性分离后,加入到0.5%的戊二醛乙醇溶液中固化一定时间。产物用无水乙醇洗涤后,真空干燥10 h。
1.2.2Cu2+吸附实验准确称取一定量的磁性壳聚糖硅胶复合微球,加入到25 mL Cu2+标准溶液中,一定pH值的0.2 mol/L的磷酸盐缓冲液调节,25 ℃下振荡一定时间后取样,用火焰原子吸收分光光度法测定吸附后溶液中Cu2+浓度,依公式计算吸附容量QT:QT=V(c0-cT)/W。式中:V为Cu2+溶液体积(mL);W为吸附剂重量(mg);c0、cT为吸附前、吸附tmin后Cu2+浓度(mg/L)。
1.2.3Cu2+浓度测定方法火焰原子吸收分光光度法测定Cu2+,检测波长325 nm,灯电流2 mA,燃烧头高度5 mm,空气流量2.5 L/min,乙炔流量0.5 L/min,狭缝宽度0.2 nm。分别配制浓度为0.1、0.5、1.0、2.0、3.0和4.0 mg/L的Cu2+溶液,并用火焰原子吸收分光光度法测定溶液的吸光度(A),以A对Cu2+浓度作图得到Cu2+工作曲线。线性方程为:A=0.1407c-0.0111,相关系数R为0.9983。在吸附实验后,可通过测定的吸光度,由线性方程计算对应的Cu2+浓度。通过Cu2+的浓度利用公式计算磁性壳聚糖硅胶复合微球的吸附容量Qt。
2 结果与讨论
2.1 磁性壳聚糖硅胶复合微球的红外表征
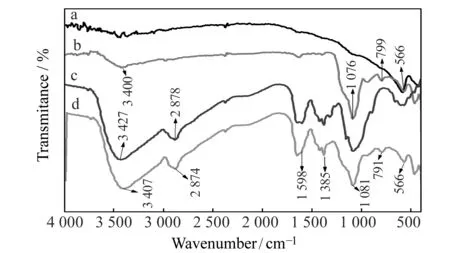
图1 Fe3O4(a)、Fe3O4@SiO2(b)、壳聚糖(c)和Fe3O4@SiO2@CTS+SiO2(d)的红外光谱图Fig.1 Infrared spectra of Fe3O4(a),Fe3O4@SiO2(b),CTS(c) and Fe3O4@SiO2@CTS+SiO2(d)
由图1红外光谱图所示,与谱图(a)相比,在谱图(b)中,除了Fe-O的特征吸收峰566 cm-1外,1 076 cm-1和799 cm-1是Si-O键的特征吸收峰,且3 400 cm-1是-OH的伸缩振动峰,说明SiO2已包覆在磁核上;在磁核壳聚糖硅胶复合微球的谱图(d)中,除了有Si-O键的特征吸收峰外,还出现了壳聚糖谱图(c)的特征吸收峰,例如2 878 cm-1为C-H的伸缩振动峰,1 385 cm-1是-CH3的振动吸收峰,1 598 cm-1是-NH2的振动吸收峰,由于戊二醛交联了部分氨基,所以此峰强度相对壳聚糖谱图(c)有所减弱。综上分析说明,通过溶胶-凝胶法成功制备了磁核壳聚糖硅胶复合微球。
通过扫描电镜(SEM)对制备的磁性硅胶微球和磁性壳聚糖硅胶复合微球的表面形貌进行了观察。由图2(a)和2(b)可以发现,磁性硅胶微球表面光滑、无孔。由图2(c)和2(d)可以看出,磁性壳聚糖硅胶复合微球与硅胶微球相比具有明显不同的形貌,表面明显更为粗糙,有孔且粒径仍然保持较好的均匀性,这说明硅胶与壳聚糖已经相互交联且复合均匀。由于在相似制备条件下,无法制备出磁性壳聚糖微球,因而我们将制备的磁性壳聚糖硅胶复合微球与文献报道的磁性壳聚糖微球形貌[22]进行了比较,发现本文所制备的磁性壳聚糖复合微球形状更为规则,且由于采用较少的交联剂,故而表面明显看出更为粗糙且有孔。

图2 Fe3O4@SiO2微球(a和b)及Fe3O4@SiO2@(CTS+SiO2)微球(c和d)SEM电镜图Fig.2 SEM images of magnetic silica microspheres(a and b);SEM images of composite microspheres(c and d)
磁性壳聚糖硅胶复合微球的X-射线衍射图如图3所示,其中图3(a)中30.2°、35.5°、43.3°、57.3°和62.5°是Fe3O4的特征衍射峰;图3(b)中18.6°,22.1°的峰是SiO2的特征衍射峰;图3(c)中20.5°的峰是壳聚糖的特征衍射峰。图3(d)磁性壳聚糖硅胶复合微球的X-射线衍射图中可以发现除了出现了18.6°是Fe3O4和SiO2的特征峰外,同样出现了壳聚糖的特征衍射峰20.5°。相较于纯壳聚糖和SiO2的特征衍射峰来说,两类特征峰的强度都有所减弱。究其原因可能是由于形成了复合材料,导致了无机硅胶与壳聚糖各自结晶度的降低,从而峰强度减弱。
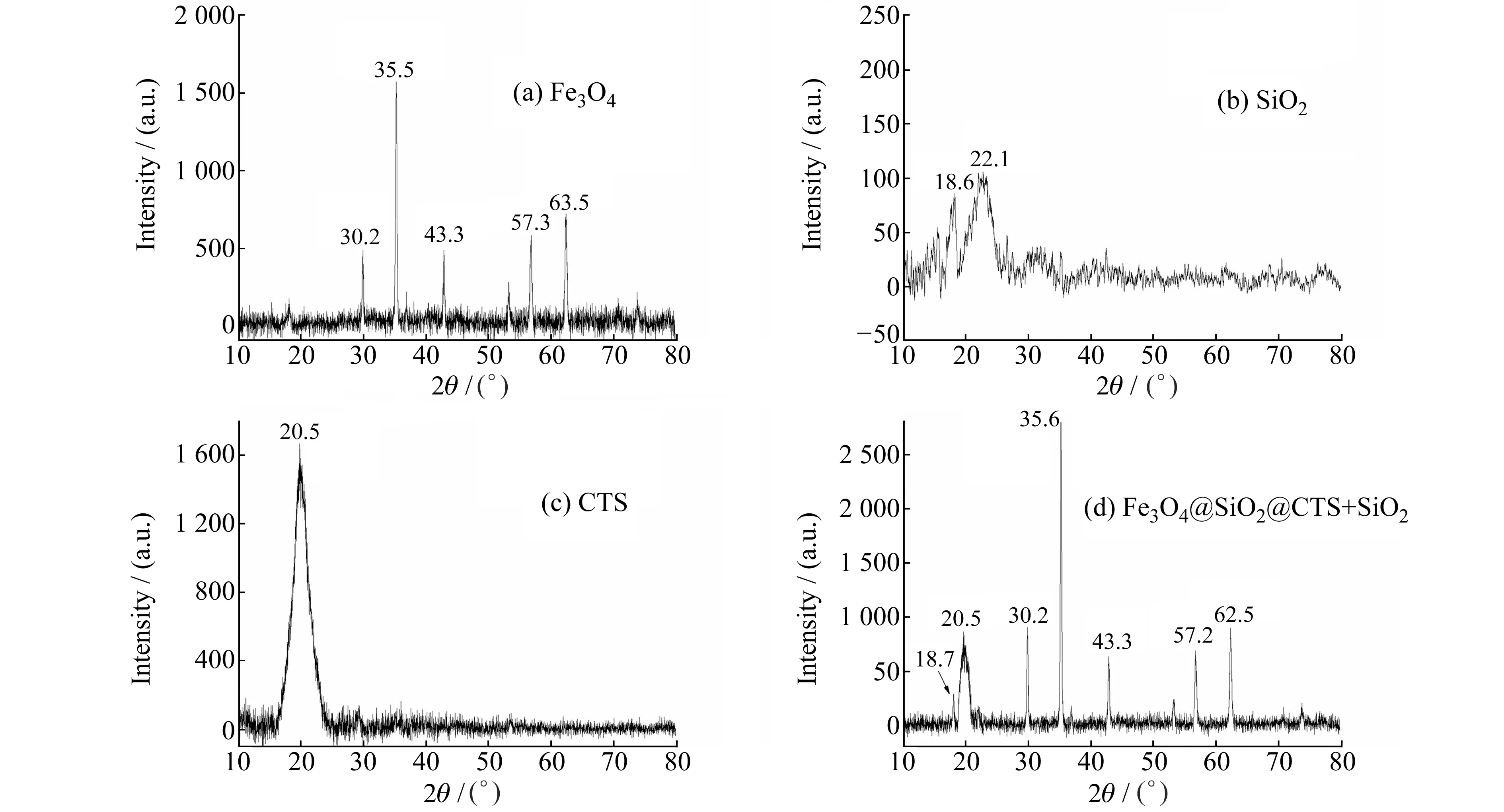
图3 Fe3O4(a)、SiO2(b)、壳聚糖(c)和Fe3O4@SiO2@CTS+SiO2(d)的X-射线衍射图Fig.3 XRD pattern of Fe3O4(a),SiO2(b),CTS(c) and Fe3O4@SiO2@CTS+SiO2(d)
2.2 磁性壳聚糖硅胶复合微球吸附性能的考察
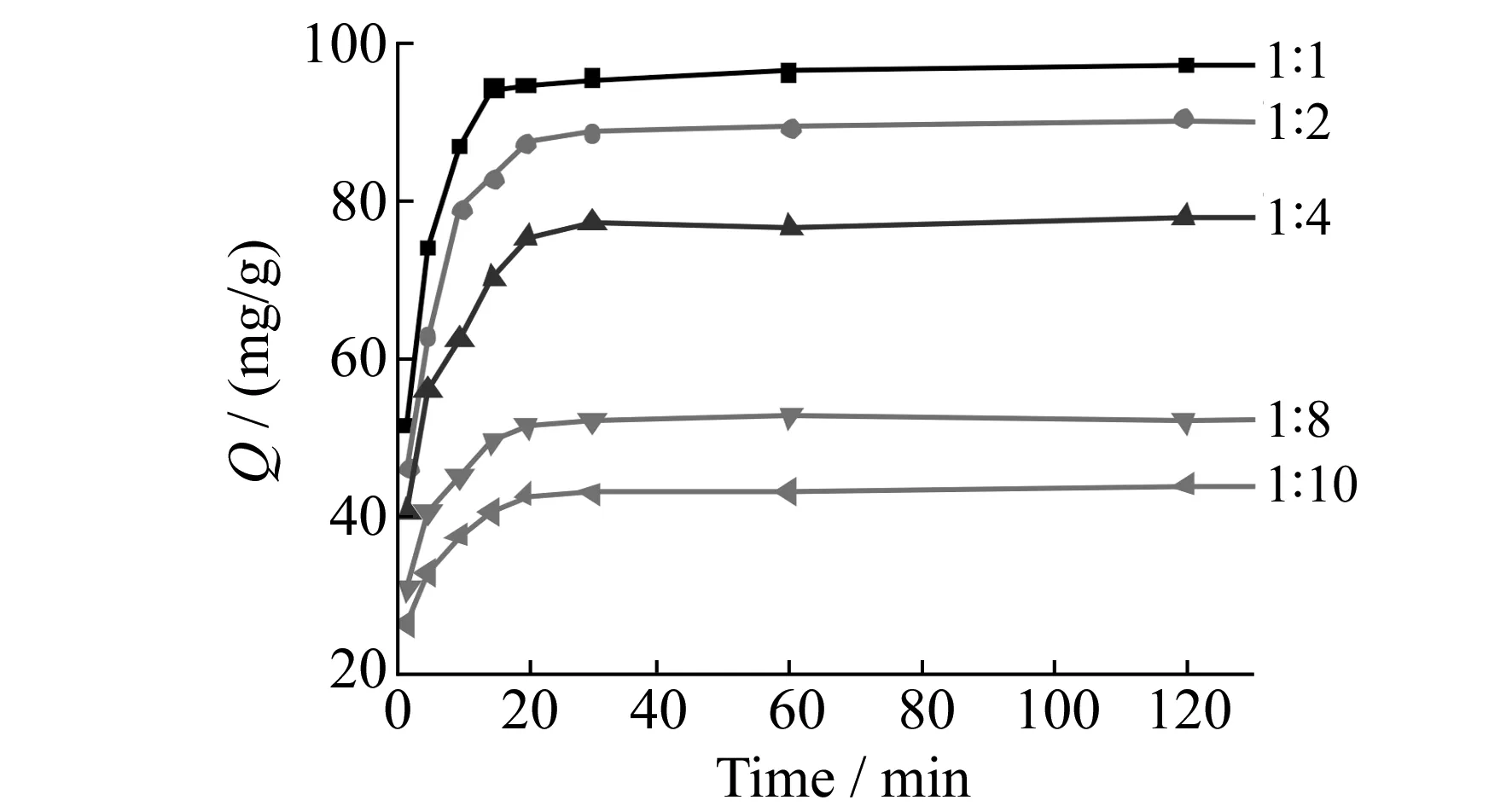
图4 不同比例CTS和TEOS对Cu2+吸附容量的影响Fig.4 Effect of different ratios of CTS and TEOS on the adsorption capacity for Cu2+10 mg magnetic composite microspheres;10 mL,100 mg/L Cu2+;0.2 mol/L phosphate buffer solution(pH=7);25 ℃.
2.2.1反应条件对吸附性能的影响磁性壳聚糖硅胶复合微球中壳聚糖比例大,材料上氨基与羟基数目增多,有利于提高材料吸附重金属的能力,相应的无机材料的比例降低可能导致材料的交联度减小,使微球结构趋于松散,微球的机械强度也会降低。因此,考察了在不同n(CTS)∶n(TEOS)比例条件下制备的磁性壳聚糖硅胶复合微球对Cu2+的吸附能力。由图4可看出,随着TEOS用量增大,磁性壳聚糖硅胶复合微球对Cu2+的吸附容量逐渐减小。由此可见,TEOS的比例增大可能导致微球结构更加紧凑,不利于Cu2+在微球中的扩散并与氨基、羟基络合,从而导致吸附容量下降。为了优先考虑吸附性能,实验选择n(CTS)∶n(TEOS)=1∶1为最佳制备用量。
实验中改变致孔剂CTAB用量,制备了n(TEOS)∶n(CTAB)分别为1∶3.5、1∶7和1∶14的磁核壳聚糖硅胶复合微球。结果发现,随着CTAB用量的增大,磁核壳聚糖硅胶复合微球对Cu2+吸附容量逐渐增大。但当n(TEOS)∶n(CTAB)为1∶14时,吸附振荡会产生蓝色固体物质,可能是由于致孔剂CTAB用量过大,导致微球孔径大,结构松散,机械强度变差,导致吸附了Cu2+的材料脱落。因此,综合考虑吸附容量和机械强度,实验选择n(TEOS)∶n(CTAB)为1∶7。
戊二醛的交联,能够协助增强磁性壳聚糖硅胶复合微球的机械强度。考察了交联时间对于磁性壳聚糖硅胶复合微球对Cu2+的吸附容量的影响。由图5可以看出,随着交联时间增加,磁性壳聚糖硅胶复合微球的吸附容量呈降低趋势。当交联时间为2 h时,磁核壳聚糖硅胶复合微球对Cu2+的吸附容量最大。原因可能是由于交联时间较短时,微球的结构较为疏松,Cu2+扩散进入微球的阻力小,易于接近-NH2,同时与戊二醛发生反应的-NH2数量较少,有更多的活性位点用于吸附。随着交联时间的增加,由于交联反应使壳聚糖分子链上的-NH2数量减少而且微球的结构也更加紧实,Cu2+难于接近-NH2从而引起吸附容量降低。故微球制备时选择交联时间为2 h。
2.2.2溶液pH及温度对吸附性能的影响通过调节溶液的pH值对复合微球的吸附性能进行了考察。由图6可看出,随着pH的增大,复合微球对Cu2+的吸附容量逐渐增大,在pH=5~8之间,吸附容量基本趋于稳定。这是因为酸性条件下壳聚糖中的-OH和-NH2易发生质子化,对Cu2+有静电排斥作用,从而降低了磁核壳聚糖硅胶复合微球对Cu2+的吸附。随着pH逐渐增大,基团质子化程度降低,氨基和羟基与Cu2+配位的机会增加,从而复合微球对Cu2+吸附容量增大。在本实验中,选择pH=7作为后续实验条件。
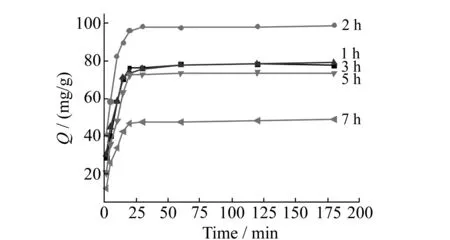
图5 戊二醛交联时间对Cu2+吸附容量的影响Fig.5 Effect of different crosslinking time of glutaraldehyde on the adsorption capacity for Cu2+10 mg magnetic composite microspheres;10 mL,100 mg/L Cu2+;0.2 mol/L phosphate buffer solution(pH=7);25 ℃.
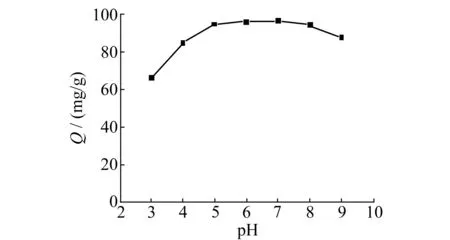
图6 pH对吸附容量的影响Fig.6 Effect of different pH on the adsorption capacity for Cu2+ 10 mg magnetic composite microspheres;10 mL,100 mg/L Cu2+;0.2 mol/L phosphate buffer solution,25 ℃,adsorption time is 15 min.
在温度25 ℃、35 ℃和45 ℃时振荡30 min取样测定溶液中Cu2+浓度,其结果显示随着温度的升高,复合微球对Cu2+的吸附容量逐渐增大。因此本实验选择45 ℃作为吸附实验的操作温度。
将所制备的磁性壳聚糖硅胶复合微球与文献中已报道的壳聚糖材料的Cu2+吸附性能进行了比较。见表1,本文制备的复合微球对Cu2+的吸附容量可达到98.7 mg/g。三个不同批次制备的材料吸附容量都在98 mg/g以上,说明复合微球的吸附性能稳定。由于具有磁性,材料更容易回收。
2.3 吸附动力学研究
分别在1、25、50、75和100 mg/L的Cu2+溶液中测定复合微球对Cu2+的吸附容量。由图7可看出,磁性壳聚糖硅胶复合微球对Cu2+的吸附能力随着Cu2+初始浓度的增大而增大,其原因可能是随着初始Cu2+浓度的增大,溶液中可被吸附的金属离子比例相应地增大,从而吸附容量也增大。在最初的15 min内,吸附容量急剧地增加,15 min后随着时间的延长,吸附容量缓慢地增加,吸附逐渐达到饱和。

表1 本法与文献已报道壳聚糖类材料对Cu2+吸附容量比较
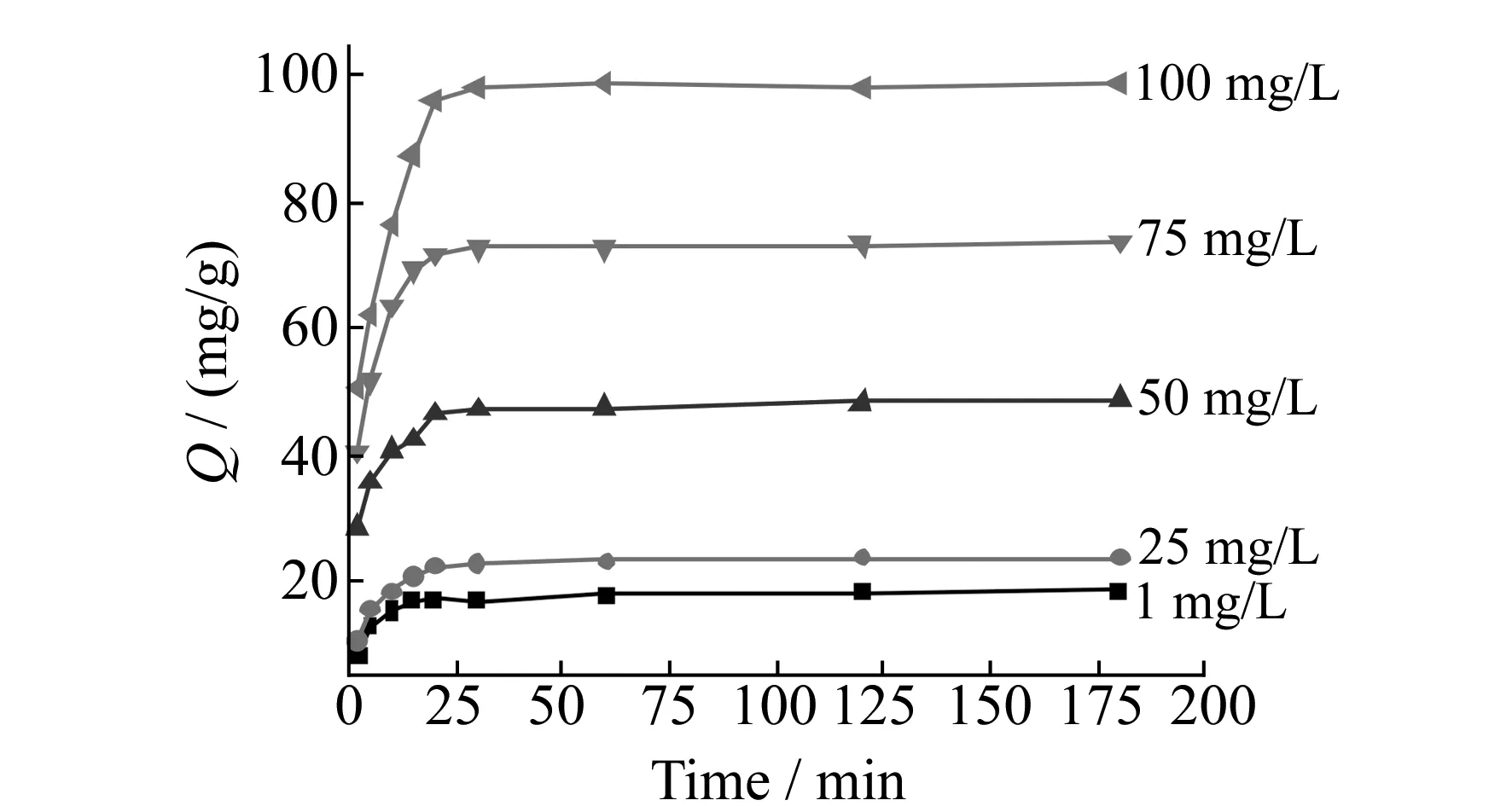
图7 Cu2+的初始浓度对磁性壳聚糖硅胶复合微球吸附能力的影响Fig.7 Effect of different initial concentration on the adsorption capacity for Cu2+ 10 mg magnetic composite microspheres;10 mL,100 mg/L Cu2+; 0.2 mol/L phosphate buffer solution,pH=7;25 ℃.
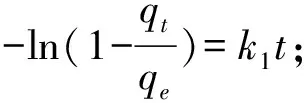
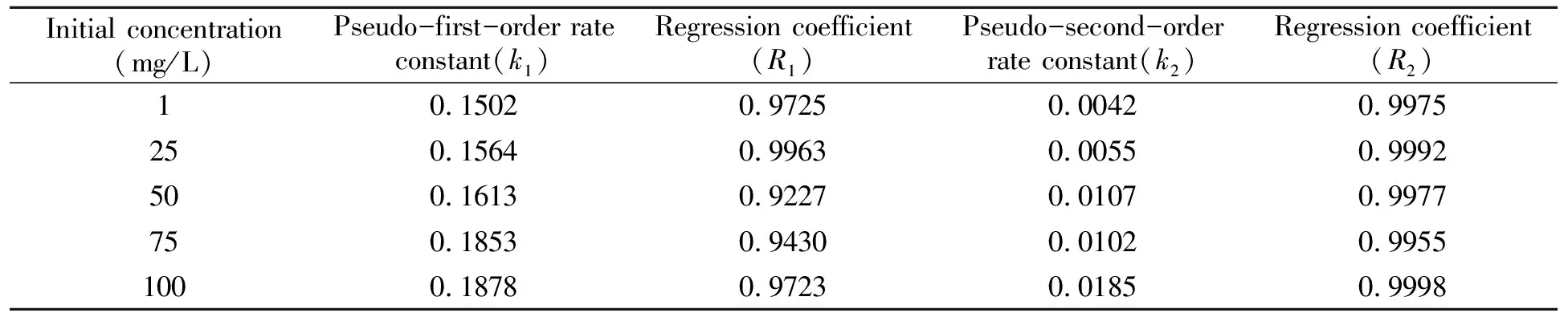
表2 磁性壳聚糖硅胶复合微球对Cu2+的吸附动力学参数
3 结论
实验以壳聚糖与正硅酸乙酯为原料,采用溶胶-凝胶法,用戊二醛辅助交联成功制备了磁性壳聚糖硅胶复合微球。通过扫描电镜,红外光谱和X-射线衍射作为表征手段对所制备的磁性壳聚糖硅胶复合微球进行了表征。结果显示壳聚糖与硅胶材料复合均匀,且复合微球粒径大小均匀,约2 μm,具有一定的机械强度,对Cu2+有良好的吸附性,吸附容量可达到98.7 mg/g。通过对复合微球的吸附动力学研究表明,复合微球对Cu2+的吸附性能对准二级动力学方程具有较好的拟合程度,说明准二级动力学方程能更好地描述磁性壳聚糖硅胶复合微球对Cu2+的吸附过程。

