三峡库区栽培重楼属药用植物根际土壤微生物数量和酶活性的变化
张静,肖国生,周浓,丁博,赵学巧,郭冬琴,祁俊生
重庆三峡学院生命科学与工程学院,重庆 404000
三峡库区栽培重楼属药用植物根际土壤微生物数量和酶活性的变化
张静,肖国生,周浓,丁博,赵学巧,郭冬琴,祁俊生
重庆三峡学院生命科学与工程学院,重庆 404000
目的研究不同产地、不同品种重楼属药用植物对其根际土壤微生物数量和酶活性的影响。方法实地调查与采集三峡库区重楼属药用植物根际土壤,采用微生物稀释平板培养法对重楼根际土壤微生物数量、土壤酶活性及其相关性进行研究。结果不同产地重楼根际土壤微生物各生理类群数量差异显著,土壤微生物区系中细菌为优势类群,放线菌次之,真菌很少。土壤微生物数量的变化趋势与土壤微生物多样性指数的变化趋势不一致。不同产地重楼根际土壤磷酸酶、蔗糖酶和蛋白酶活性各异。相关分析显示,根际土壤酶活性与土壤微生物数量之间存在相关关系。结论选择合适的重楼品种和栽培基地,有利于根际土壤微生物数量和酶活性的提高,从而为重楼生长发育创造良好的微生态环境。
重楼;三峡库区;根际土壤;微生物数量;多样性;酶活性;相关性
随着医药行业对重楼药材需求量的日益增加,重楼野生资源蕴藏量的急剧减少,现已列为国家二级濒危药用植物[1]。开展人工驯化栽培,是解决重楼资源问题的重要途径[2-3]。三峡库区为重楼资源的传统分布区,适宜重楼的人工驯化栽培[4]。目前各地推进引种驯化栽培时,普遍存在选择栽培品种和基地盲目的问题。而重楼生长周期较长,在其生长发育过程中与其土壤微生物尤其是根际土壤微生物数量有着密切的相互关系。药用植物根际是药用植物根系与微生物交流比较活跃的土壤微区,是药用植物-土壤-微生物相互作用的特殊微生态系统,维持着土壤生态功能的发挥[5-6]。土壤微生物是土壤中物质的转化和养分循环的驱动力,参与一系列土壤有机质分解、腐殖质形成、土壤养分转化和循环等过程[7]。土壤酶是具有特殊生物化学催化活性的一类生理物质,参与土壤生物化学反应的重要过程[8]。根际土壤微生物数量和酶活性的高低可用来指示土壤中物质代谢的旺盛程度,是衡量土壤质量状况、维持土壤肥力和药材品质形成的一个重要指标,对于发挥药用植物根际微生态的功能起着重要的作用[9]。
目前,对重楼根际土壤的研究主要集中在滇重楼根际土壤理化性质、微生物数量和酶活性与滇重楼品质的相关性评价方面[2,10-12],重楼属植物根际微域土壤微生物状况研究尚未见报道。本试验探讨不同重楼栽培品种根际土壤微生物和酶活性及其相互关系,旨在为三峡库区选择合适的重楼品种,创造以有益微生物占优势的土壤微生态环境,实现重楼根际土壤生态的动态平衡,为重楼的优质丰产提供依据。
1 材料与方法
1.1根际土壤的采集与处理
本课题组于2012年8月-2013年10月期间,在重庆市开县满月乡马营村等地采集重楼根际土壤,并经中国科学院昆明植物研究所李恒研究员鉴定,样品来源信息见表1。分别在重楼驯化栽培区采用S形线路采样法和随机多点混合的原则[13],选取长势一致的重楼10株,轻轻抖动根系并去掉根系上黏附的较大颗粒土壤,收集根系及黏附其上的土壤即为根际土,将混合均匀的根际土壤放入无菌塑料袋中,放入户外保鲜箱后立即带回实验室。1份放入 4 ℃冰箱保存,用于分析根际土壤微生物的数量;另 1份自然风干,去杂,过1 mm土壤筛后用于测定根际土壤酶的活性。

表1 重楼根际土壤样品来源
1.2土壤微生物数量测定
采用稀释平板计数法测定根际土壤中微生物数量[14]。细菌采用牛肉膏蛋白胨培养基、真菌采用马丁氏培养基、放线菌采用改良高氏Ⅰ号培养基、解有机磷细菌采用有机磷细菌培养基、解无机磷细菌采用无机磷细菌培养基,分别进行各微生物类群的分离与计数,并计算每克干土中的微生物数量(CFU/g干土)。
1.3土壤微生物多样性指数
土壤微生物多样性指数的计算公式[15]:Shannon指数H=-ΣPilnPi。式中,Pi为i类群个体数占总数的比例。
1.4土壤酶活性的测定
各土壤酶活性的测定主要参照关氏[16]方法并稍加改进,用离心(5 000 r/min,6 min)代替过滤。蔗糖酶活性采用3,5-二硝基水杨酸比色法,磷酸酶活性采用磷酸苯二钠法,蛋白酶活性采用改良茚三酮比色法。
1.5统计学方法
采用SPSS18.0统计软件和Microsoft Excel 2007软件所测数据进行分析。采用Pearson相关分析法检验变量之间的相关性,相关性水平设为:∣r∣=1.0为绝对相关,0.8<∣r∣<1.0为高度相关,0.5<∣r∣<0.8为中度相关,0.3<∣r∣<0.5为低度相关,0<∣r∣<0.3为不相关,∣r∣=0为绝对不相关。
2 结果与分析
2.1不同产地重楼根际土壤微生物数量
土壤微生物数量可直接反映其生物化学活性和土壤养分的组成与转化水平,为衡量土壤质量的一项重要指标[17]。细菌、真菌、放线菌为土壤微生物中三大主要微生物类群,其类群组成和数量变化常能反映出土壤生物活性水平,反映了土壤中物质代谢的旺盛水平。不同产地重楼根际土壤微生物数量测定结果见表2。

表2 不同产地重楼根际土壤微生物数量
不同产地重楼根际土壤微生物数量的大小顺序均依次为细菌>放线菌>真菌,即细菌数量最多,为优势菌群,说明重楼根际有机物的分解和转化主要靠土壤细菌来完成。不同产地重楼根际土壤微生物的组成及其数量存在显著差异(P<0.05),不同类群微生物数量的组成比例因不同品种、生境而异,与周氏等[12]研究结果一致。细菌在 S5样品数量最多,达110.67×106CFU/g,并显著高于其他9个样品(P<0.05),样品S10的细菌量最少,但与S1、S3、S4和S9的差异并不明显。真菌在样品S5数量最多,其次是S2,S4的真菌量为0.633 3×104CFU/g,显著低于其他样品(P<0.05)。放线菌在 S8样品中的数量最多,达360.00×103CFU/g,并显著高于其他9个样品(P<0.05)。
同时,细菌与真菌、细菌与放线菌、真菌与放线菌的数量之比是反映土壤微生物群落结构改变的重要指标[18]。从表2可以看出,不同产地重楼因栽培模式、品种、生态环境等原因,导致根际土壤细菌、真菌和放线菌三者的比例关系改变,差异有统计学意义(P<0.05)。
解有机与无机磷细菌是土壤中具有特定生理功能的微生物类群。从表2可以看出,不同产地重楼根际土壤的解有机和无机磷细菌数量有明显差异,其中S5样品的解有机磷细菌数量达127.67×105CFU/g,与其他9个样品存在显著差异(P<0.05);解无机磷细菌在S7样品数量达58.33×105CFU/g,显著高于其他9个样品(P<0.05),而S5、S9和S10样品中解无机磷细菌数量较低,但相互之间无明显差异。微生物总数量在S5样品最大,达124.36×106CFU/g,与其余9个样品存在显著差异(P<0.05),而样品S4、S9和S10的微生物总数量较低,相互间无明显差异。
2.2不同产地重楼根际土壤微生物多样性分析
Shannon指数是对微生物群落中物种类型数目多寡、组成与分布量的综合度量指标[17]。从图1可见,不同产地重楼Shannon指数存在显著差异(P<0.05),说明不同产地重楼Shannon指数的丰富度不同,且不同微生物类型的个体数量分布不均匀。不同产地、品种重楼Shannon指数与根际土壤微生物总数量的变化趋势不一致,即重楼根际土壤微生物数量总数高的产地,其Shannon指数不一定高,如S5、S6的根际土壤微生物总数量最多,而土壤微生物多样性指数是最低的,这与王氏等[19]的研究结果一致。可能不同产地与品种重楼根际微域环境对各微生物类群的作用结果不同,因而可能使根际土壤中微生物总数量很高,但Shannon指数不一定也高[17]。

图1 不同产地重楼根际土壤Shannon指数比较
2.3不同产地重楼根际土壤酶活性
土壤酶活性反映了土壤中进行的各种生化反应的方向和强度,是土壤生物活性强度的重要标志[20]。由表3可知,不同产地重楼根际土壤蔗糖酶、磷酸酶和蛋白酶活性存在显著差异(P<0.05)。蔗糖酶为转化酶,参与土壤碳素转化的作用,可以反映土壤肥力、土壤呼吸强度及熟化程度。结果显示,除S9、S10外,土壤肥力均较好。磷酸酶为水解酶类,可将有机磷转化为无机磷,可以反映出土壤有效磷的状况。结果显示,S6的根际土壤磷酸酶活性最高,说明其土壤有效磷的含量最高;而S10根际土壤磷酸酶活性最低,说明土壤有效磷的含量明显下降。蛋白酶可将土壤有机氮水解为氨基酸,促进土壤氮循环的重要过程[21]。结果显示,土壤蛋白酶活性在S4样品最高,但与S1、S7、S8和S9之间的差异无统计学意义(P<0.05)。样品S6和S10的蛋白酶活性较低,但两者间无明显差异。

表3 不同产地重楼根际土壤酶活性[mg/(g·d)]
2.4土壤微生物数量与土壤酶活性的相关性分析
土壤酶活性参与土壤中各种生化代谢过程和能量转化,与土壤微生物数量有较好的相关性[17]。对土壤酶活性与土壤微生物数量进行Pearson相关分析表明,两者具有一定的相关性(见表4)。蔗糖酶活性与放线菌呈正相关;磷酸酶与细菌呈显著正相关,与解有机磷细菌呈正相关,与解无机磷细菌呈负相关;蛋白酶与放线菌呈正相关,细菌、解无机磷细菌呈负相关。不同微生物类群与其他酶活性之间相关性不显著。不同土壤酶活性之间也存在一定的相关性。蛋白酶与蔗糖酶呈正相关,与磷酸酶呈负相关。不同微生物类群之间也存在显著相关或极显著相关。细菌与真菌呈显著正相关;细菌、真菌与解有机磷细菌呈显著正相关,相关系数分别为0.908、0.779,说明随着根际土壤细菌或真菌数量的增加,解有机磷细菌的数量也会增加。
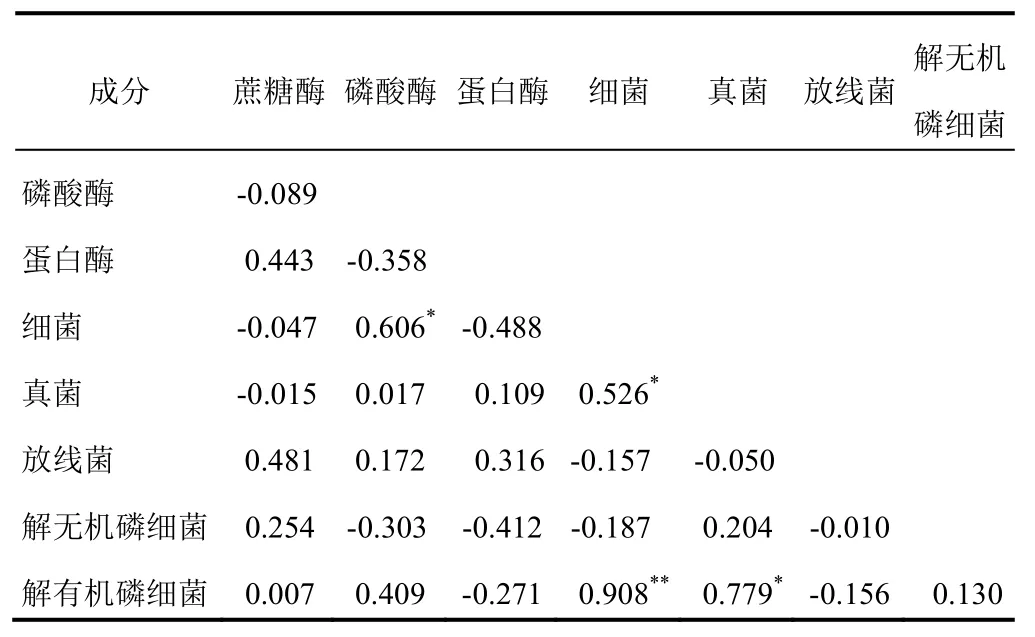
表4 土壤微生物数量与土壤酶活性的相关性分析(r)
3 讨论
药用植物根际土壤微生物的类群组成、数量大小和分布状况对土壤肥力水平及植株对养分的吸收、利用具有重要的影响。周氏等[12]研究发现,不同产地滇重楼根际土壤可培养微生物的数量和种群结构具有显著差异,与本研究结果相一致,表现出根际土壤微生物数量随产地而改变。本研究结果表明,同样为滇重楼(S1、S4、S7、S10)样品,栽培于不同基地的根际土壤可培养微生物数量具有一定差异,微生物总数量表现为S7>S1>S4>S10,因S7样品栽培过程中使用采取了人工施肥措施,从而提高了其根际土壤微生物的数量和土壤肥力,与王氏等[22]对桔梗的研究结果一致。
张氏等[23]研究结果表明,自然条件下,不同品种百合之间“白狐”品种在不同时期的根际土壤微生物数量最多,形成明显的根际效应。本研究中,即使栽培于同一生态条件(石柱县马武镇)的卵叶重楼(S5)、狭叶重楼(S6)、滇重楼(S7)的微生物数量和多样性均具有显著差异,土壤微生物总数量为 S5>S6>S7,而S7的Shannon指数明显好于S5、S6,说明不同品种重楼可形成自身独特的根际微生物区系,从而影响其品质的形成,进一步表明栽培品种和栽培基地的选择对重楼根际土壤微生物群落产生重要影响。
土壤酶活性是土壤生态系统的核心,可反映农业管理措施的改变而引起的土壤性质的变化[24]。本研究发现,不同产地重楼根际土壤蔗糖酶、磷酸酶、蛋白酶活性存在差异,各种酶活性变化也不尽相同,这与陈氏等[17]研究结果基本一致。可能是由于重楼品种、生长环境、栽培模式不同等多种因素共同作用的结果[10,24]。对于导致土壤酶活性的上述变化的主导因素还有待于采集更多重楼样本进一步深入探讨。相关性分析表明,土壤微生物数量与土壤酶活性之间存在不同程度的相关性。细菌数量与磷酸酶活性呈显著正相关,放线菌数量与蔗糖酶、蛋白酶活性呈正相关,解有机磷细菌数量与磷酸酶活性呈正相关。细菌数量与蛋白酶活性呈负相关,解无机磷细菌数量与磷酸酶、蛋白酶活性呈负相关。根际土壤微生物类群与土壤酶活性还存在相关性较小甚至是负相关,其原因可能为土壤酶活性是生物与非生物活性的综合作用,不仅与土壤微生物数量和构成比例密切相关,还与生态环境、植物品种等非生物因素有关[17,25]。
本研究结果表明,滇重楼、毛重楼、狭叶重楼、卵叶重楼、长药隔重楼、五指莲重楼根际土壤可培养微生物的各生理类群数量差异显著,并且均以细菌数量为土壤微生物的主要类群,其次为放线菌数量,真菌数量最少。土壤微生物数量的变化趋势与根际土壤微生物多样性指数的变化趋势不一致。不同产地、不同品种重楼根际土壤蔗糖酶、磷酸酶和蛋白酶活性存在差异。细菌与磷酸酶活性呈显著正相关,放线菌与蔗糖酶、蛋白酶活性呈正相关,解有机磷细菌与磷酸酶活性呈正相关。表明不同药材有效成分累积所需的土壤条件是不同的。因此,在人工驯化栽培中选择合适的重楼品种和栽培基地,有利于土壤微生物数量和酶活性的提高,从而为重楼生长发育创造良好的微生态环境。
[1] 黄璐琦,肖培根,王永炎.中国珍稀濒危药用植物资源调查[M].上海:上海科学技术出版社,2011:148-163.
[2] 杨永红,戴丽君,何昆鸿,等.土壤营养与人工栽培滇重楼品质相关性评价[J].中药材,2012,35(10):1557-1561.
[3] 段英姿,客绍英.不同引种柴胡不同生长期地上部总黄酮含量比较研究[J].中国药学杂志,2015,50(5):394-398.
[4] 张植玮,刘正宇,陈玉菡,等.重庆三峡库区重楼属药用植物资源调查[J].资源开发与市场,2008,24(3):254-256.
[5] 肖艳红,李箐,刘祝祥,等.药用植物根际微生物研究进展[J].中草药,2013,44(4):497-504.
[6] NIHORIMBERE V, ONGENA M, SMARGIASSI M, et al. Beneficial effect of the rhizosphere microbial community for plant growth and health[J]. Biotechnology,Agronomy,Society and Environment,2011,15(2):327-337.
[7] RAJKUMAR M, AE N, PRASAD M N, et al. Potential of siderophoreproducing bacteria for improving heavy metal phytoextraction[J]. Trends in Biotechnology,2010,28(3):142-149.
[8] FLOCH C, CAPOWIEZ Y, CRIQUET S. Enzyme activities in apple orchard agroecosystems:How are they affected by management strategy and soil properties[J]. Soil Biology and Biochemistry,2009,41(1):61-68.
[9] MAZZOLA M. Assessment and management of soil microbial community structure for disease suppression[J]. Annu Rev Phytopathol,2004,42:35-59.
[10] 段艳涛,何忠俊,梁社往,等.滇重楼总皂苷含量和菌根侵染率与土壤因子的关系[J].中国中药杂志,2011,36(22):3091-3095.
[11] 周浓,张德全,孙琴,等.真菌诱导子对滇重楼中次生代谢产物甾体皂苷的影响研究[J].药学学报,2012,47(9):1237-1242.
[12] 周浓,戚文华,肖国生,等.滇重楼根际微生物分布与甾体皂苷含量的相关性[J].中国中药杂志,2015,40(6):1055-1060.
[13] 鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000:14-24.
[14] 林先贵.土壤微生物研究原理与方法[M].北京:高等教育出版社,2010:32-45.
[15] 严君,韩晓增,王树起,等.不同形态氮素对种植大豆土壤中微生物数量及酶活性的影响[J].植物营养与肥料学报,2010,16(2):341-347.
[16] 关松荫.土壤酶及其研究法[M].北京:中国农业出版社,1986:274-339.
[17] 陈汝,王海宁,姜远茂,等.不同苹果砧木的根际土壤微生物数量及酶活性[J].中国农业科学,2012,45(10):2099-2106.
[18] BARDGETT R D, FRANKLAND J C, WHITTAKER J B. The effects of agricultural practices on the soil biota of some upland grasslands[J]. Agriculture, Ecosystems and Environment,1993,45 (1/2):25-45.
[19] 王珊,李廷轩,张锡洲,等.设施土壤中微生物数量及其生物量碳的变化研究[J].中国农学通报,2005,21(4):198-202.
[20] 刘建国,卞新民,张伟,等.长期连作和秸秆还田对棉田土壤生物活性的影响[J].应用生态学报,2008,19(5):1027-1032.
[21] 张威,张明,张旭东,等.土壤蛋白酶和芳香氨基酶的研究进展[J].土壤通报,2008,39(6):1468-1474.
[22] 王渭玲,杜俊波,徐福利,等.不同施肥水平对桔梗土壤微生物和土壤酶活性的影响[J].中国中药杂志,2013,38(22):3851-3856.
[23] 张亮,程智慧,周艳丽,等.百合生育期根际土壤微生物和酶活性的变化[J].园艺学报,2008,35(7):1031-1038.
[24] 曹慧,孙辉,杨浩,等.土壤酶活性及其对土壤质量的指示研究进展[J].应用与环境生物学报,2003,9(1):105-109.
[25] SUSANNE K, VERONICA A M, HUSEIN A. Microbial community composition and enzyme activities in a sandy loam soil after fumigation with methyl bromide or alternative biocides[J]. Soil Biology & Biochemistry,2006,38(6):1243-1254.
Variation of Rhizospheric Microorganisms and Soil Enzyme Activity of Paridis Rhizoma Cultivated in Three Gorges Reservoir Region
ZHANG Jing, XIAO Guo-sheng, ZHOU Nong, DING Bo,ZHAO Xue-qiao, GUO Dong-qin, QI Jun-sheng
(College of Life Science & Engineering, Chongqing Three Gorges University, Chongqing 404000, China)
Objective To study the amount of rhizospheric microorganisms and soil enzyme activity influenced by Paridis Rhizoma in different locations and of different strains. Methods The amount of rhizospheric microorganisms,soil enzyme activity and their correlation were researched through field survey and collection of rhizospheric soil in Paridis Rhizoma cultivated in Three Gorges Reservoir Region and by microbial dilution plate culture method. Results The amount of rhizospheric microorganisms in Paridis Rhizoma from different habitats showed significant differences. The dominant species in soil microflora was bacteria; the second one was actinomycetes; the fewest one was fungus. The variation trend of the amount of rhizospheric microorganisms was not consistent with the variation trend of rhizospheric microorganisms diversity index. The activity of soil phosphatase, invertase and pepsin in Paridis Rhizoma from different habitats varied. The correlation analysis showed that the correlation between the soil enzyme activity and the amount of rhizospheric microorganisms existed. Conclusion Choosing the suitable strains and habitats of Paridis Rhizoma is beneficial to enhancing the amount of rhizospheric microorganisms and soil enzyme activity, which can create good micro-ecological environment for growth and cultivation of Paridis Rhizoma.
Paridis Rhizoma; Three Gorges Reservoir Region; rhizospheric microorganisms; the amount of rhizospheric microorganisms; diversity; enzymatic activity; correlation
R282.2
A
1005-5304(2016)10-0095-05
2015-12-11)
(
2016-02-16;编辑:陈静)
国家自然科学基金(81260622);重庆市教委科学技术研究项目(KJ131109);万州区科技计划项目(201301024)
祁俊生,E-mail:1208986565@qq.com
DOl:10.3969/j.issn.1005-5304.2016.10.022

