消油剂处理120#燃料油对海水青鳉(Oryzias melastigma)胚胎抗氧化酶活性影响的研究
高 翔, 丁光辉, 钱怡婷, 姜玲玲, 熊德琪
消油剂处理120#燃料油对海水青鳉()胚胎抗氧化酶活性影响的研究
高 翔, 丁光辉, 钱怡婷, 姜玲玲, 熊德琪
(大连海事大学环境科学与工程学院, 辽宁大连 116026)
以海水青鳉()胚胎为研究对象, 比较了120#燃料油分散液(water-accommodated fractions, WAFs)与乳化液(biologically enhanced water-accommodated fractions, BE-WAFs)的急性毒性效应, 并研究了不同浓度(40、100、250 mg/L)下WAFs、BE-WAFs对胚胎内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽硫转移酶(GST)活性的影响。结果表明: 在受到石油烃的氧化胁迫后, 海水青鳉胚胎内3种抗氧化酶活性变化明显。随着石油烃浓度的升高和暴露时间的延长, 3种酶表现出程度不同的诱导效应和抑制效应。其中受石油烃污染影响最为明显的为SOD酶; 而GST酶则对消油剂单独暴露表现较为敏感。实验证明, 海水青鳉体内SOD酶活性对石油烃污染反应最为敏感, 适合作为监测石油烃污染程度的生物标志物。
海水青鳉(); 石油烃; 消油剂; 抗氧化酶; 120#燃料油
近年来, 随着海上石油开采和运输业的发展, 各类溢油事故频发, 石油烃的大量输入使海洋生物和海洋生态系统都受到了前所未有的威胁[1-2]。石油烃能够通过食物链在生物体内富集, 进入人体后会对健康造成持续的负面影响, 危害极大[3-4]。为了在短时间内将溢油事故的影响降到最低, 海事部门将喷洒消油剂作为处理海上溢油事故的常用应急措施, 以加速油滴分散[5]。本研究选取的120#船用燃料油为国内常用的船用燃油, 屡次出现在中国近海的溢油事故当中[6-7]。其在波浪作用下形成的分散液以及与消油剂共同作用形成的乳化液也成为了中国海上溢油的污染源之一。
目前大多数国内外研究表明, 溢油经过消油剂处理后, 水中溶解或分散态的油浓度更高, 从而增加了对生物的暴露毒性[8-10]。也有一些学者认为溢油分散剂会使石油的生物毒性降低, 如黄逸君等[11]通过对中国近海常见的10种浮游挠足类生物的72 hLC50的研究, 得到对海洋挠足类的毒性大小顺序为WAF> DWAF>消油剂; Hemmer等[12]研究发现, 路易斯安那原油在加入溢油分散剂Corexit 9500A后, 对糠虾的急性毒性有所降低; Long和Holdway[13]研究得到Bass原油WAF及使用Corexit 9527消油剂后的DWAF对章鱼鱼卵孵化的48h半抑制浓度分别为0.39×10–6和1.83×10–6; Gulec[14]在对Corexit 9527 的研究中发现, 在原油水溶性成分中添加消油剂后, 对生物的半致死浓度大为降低。
抗氧化酶活性的变化可为污染物胁迫下机体的氧化应激反应提供敏感信息。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽硫转移酶(GST)三种酶作为水生生物抗氧化酶系统的重要组成部分, 对污染物胁迫十分敏感。因此, 常被作为分子生物标志物广泛用于环境污染的早期预警[9, 15-16]。而目前国内外学者对海水中石油烃的毒性效应的研究主要集中在浮游植物和成年鱼贝类[17-23], 对生物胚胎涉及较少。而胚胎处于生物生长发育的初期, 对污染物的响应更加敏感。鉴于此研究现状, 本研究以国内常用的船用120#燃料油作为受试油品, 选择海洋模式生物——海水青鳉()胚胎作为受试生物, 从生物抗氧化酶入手研究消油剂处理溢油对海洋生物所造成的毒性效应。旨在探讨其生理指标作为生物标志物的可行性, 为开展海洋环境的生物监测提供基础实验数据, 并为消油剂的优化管理使用以及其海洋生态安全性评估提供依据。
1 实验材料和方法
1.1 受试生物
本实验选择海水青鳉胚胎作为受试生物。实验所用海水青鳉均已于实验室培养数代, 性状稳定。实验中海水青鳉胚胎均在正常受精后2~3 h内收集。为保证其活性正常, 胚胎取得后首先静水培养48 h, 观察并选择活性正常的个体用于实验。
1.2 主要仪器与试剂
主要仪器: 匀浆仪(美国PRO200型)、酶标仪(MDC-SpectraMax M5型)、恒温磁力搅拌器(GL- 3250A型)、光照培养箱(MGC-400B型)、万分之一电子分析天平(FA1004型)、基因研究型纯水仪(FJY2002-UVF-P型)、数控超声清洗器(KQ5200DE型)、高速冷冻离心机(Legend Micro 17R)、水浴槽(DK-8D)。
主要试剂: SOD检测试剂盒(南京建成生物工程研究所); CAT检测试剂盒(南京建成生物工程研究所); GST检测试剂盒(南京建成生物工程研究所); 考马斯亮蓝蛋白测定试剂盒(南京建成生物工程研究所); 红外测油专用四氯化碳(天津光复精细化工研究所)。
1.3 受试溶液的制备
1.3.1 实验所用油品及消油剂
本研究选择120#船用燃料油(RMD15)作为实验油品, 来源于中国船舶燃料有限责任公司。所选消油剂为北京威业源生物科技有限公司生产的微普紧急泄露处理液, 符合国家标准要求[24], 是交通部海事局认可的合格消油剂产品。实验所用消油剂由大连市海事局提供。
1.3.2 实验海水
实验海水取自大连市星海湾, 经沉淀过滤后用于实验。盐度31.35, 电导率47.3 ms/cm, pH 8.13。
1.3.3 120#燃料油分散液(WAFs)及乳化液(BE-WAFs)的制备
120#燃料油分散液(简称WAFs)的制备: 将120#燃料油与过滤海水按质量体积比25 g/L混合, 置于下口瓶中封口避光, 磁力搅拌器低速搅拌18 h, 控制涡度为25%~30%(即漩涡高度为总体系高度的25%~30%)。静置6 h后, 分离下层水相即为WAFs母液。将母液置于4℃环境中避光保存, 实验前稀释至所需浓度。
120#燃料油乳化液(简称为BE-WAFs)的制备: 将120#燃料油与过滤海水按质量体积比25 g/L混合, 并向体系中加入质量为油品质量20%的消油剂, 搅拌静置后, 分离下层水相即为BE-WAFs母液。置于4℃环境中避光保存, 实验前稀释至所需浓度。
1.3.4 WAFs及BE-WAFs中总石油烃(total petroleum hydrocarbon, 简称TPH)的测定
本实验参照HJ 637-2012所介绍的红外分光光度法测定母液中的总石油烃浓度[25]: 1)用CCl4萃取水体中的石油烃; 2)将萃取液通过活化的硅酸镁进行吸附脱除动植物油类; 3)将所得萃取液转移至比色皿, 置于红外测油仪中, 以CCl4作参比溶液, 于2930、2960、3030 cm–1处测量其吸光度2930、2960、3030, 计算石油烃浓度。计算公式为:
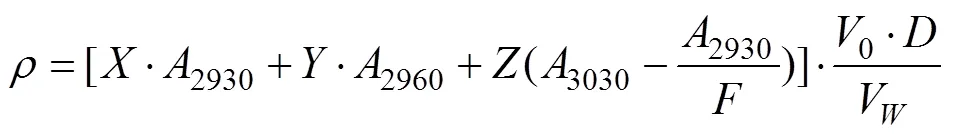
式中,为溶剂中石油烃浓度;、、、为校正系数;0、V分别为萃取溶剂体积和样品体积;萃取液稀释倍数。
1.4 暴露实验
按照预实验结果将120#燃料油WAFs、BE-WAFs设置为3个浓度水平: 每个浓度组共计投放海水青鳉胚胎约2.0 g, 并分为3个平行组进行暴露。胚胎置于6孔板中, 在28℃±1℃, 光暗比为14 h︰10 h条件下,采用半静态法进行培养, 每24 h更换一半受试液。暴露时长为96 h, 之后为恢复期。分别于暴露24、48、96 h和恢复24、96 h后进行取样和测定分析。
1.5 酶含量的测定
将提取的海水青鳉胚胎用预冷的生理盐水清洗, 除去杂质。用滤纸吸干水分并称重约0.1 g, 置于1.5 mL离心管中, 并加入9倍质量的0.86%生理盐水进行稀释。然后用匀浆仪将其冲捣为10%胚胎匀浆, 并在4℃环境下, 以3000 r/min(约为644 g)的速度离心10 min, 取上清液, 置于4℃环境中保存。
SOD、CAT、GST酶活性及蛋白质含量(考马斯亮蓝法)的测定均按照试剂盒方法进行操作。测定组织中酶活性时, 所采用单位为: U·mgprot–1, 表示每毫克蛋白质中的活力单位。
1.6 数据处理
1.6.1 数据统计分析
数据以平均值±标准差(Means±SD)表示, 并采用SPSS 17.0数据分析软件对数据进行单因素方差分析:≤0.05时认为差异显著;≤0.01时认为差异极显著。
1.6.2 诱导率及抑制率计算方法
诱导率=(i–)/×100% 抑制率=(–s)/×100%
式中,i为受诱导后酶的活性;s为受抑制后酶的活性;为对照组酶的活性。
2 实验结果与分析
2.1 WAFs与BE-WAFs各浓度组TPH含量
按照实验设计将WAFs、BE-WAFs设置为3个浓度水平: 40、100、250 mg/L。采用逐级稀释的方式分别将WAFs、BE-WAFs母液(油水质量体积比: 25 g/L)稀释至所设置的浓度水平, 并对各组TPH含量进行测定。各浓度组TPH含量如下表所示。
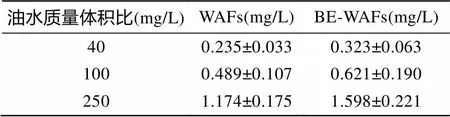
表1 WAFs及BE-WAFs各浓度水平TPH含量
2.2 WAFs与BE-WAFs对海水青鳉胚胎SOD酶活性的影响
不同浓度的WAFs对海水青鳉胚胎的SOD酶活性的影响结果如图1-A所示。由图可知: 整个实验周期中海水对照组的SOD酶活性基本不变。WAFs中的40、100 mg/L浓度组在暴露24 h后SOD活性即开始增大, 并同时在96 h达到最大值, 且100 mg/L浓度组SOD活性在暴露阶段始终较其他两组更高, 其峰值为海水空白组的194.85 %, 停止暴露24 h后, 100、40 mg/L/浓度组的SOD活性均恢复到正常水平; 对250 mg/L浓度组而言, 酶活性变化幅度明显小于其他两组, 在暴露48 h之后, 酶活性达到最大值, 并在96 h时有所下降, 经过恢复期恢复到正常水平。由实验结果可知: 3组浓度组SOD酶活性随时间的变化基本上都遵循先升高后降低的规律, 时间-效应变化比较明显。其中, 250 mg/L浓度组的峰值出现时间较其他浓度组更早。在恢复阶段, 3组SOD活性均恢复到空白组水平。
注: 图中数据为平均值±标准误差(=9), SOD活力单位为U·mgprot-1; “*”表示对该组数据和相应对照组数据进行单因素方差分析结果表明差异显著(≤0.05), “**”表明差异极显著(≤0.01); 图中字母表示各时间点之间的组间差异显著性, 下同。
Note: Error bar: mean ± SD (= 9); unit of SOD: U·mgprot−1; “*”: significant differences between this treatment group and its control group in one-way analysis of variance (≤0.05); “**”: extremely significant differences between this treatment group and its control group in one-way analysisof variance (≤0.01); letters in the figure indicate difference between the treatment groups with different durations of exposure.
BE-WAFs对海水青鳉胚胎SOD酶活性的影响结果如图1-B所示。在整个实验过程中, 海水空白组与消油剂空白组SOD酶活性水平基本一致。在暴露阶段, 40、100 mg/L浓度组SOD酶活性变化趋势基本一致, 在暴露24 h至96 h酶活性呈现线性上升, 并于96 h达到峰值, 分别为海水空白组的189.2 %和201.03%,在结束暴露后迅速回落; BE-WAFs中250 mg/L浓度组SOD酶活性在暴露24 ~96 h阶段酶活性呈现降低趋势, 经过恢复期后逐渐恢复到正常水平。由实验结果可知: 在暴露阶段, 40、100 mg/L浓度组的SOD酶活性受到诱导, 且上升幅度与暴露时间呈线性关系, 组间差异较大, 时间-效应比较明显; 250 mg/L浓度组的SOD酶活性则在暴露阶段一直呈现下降趋势。经过恢复期, 各浓度组SOD酶活性与空白组基本一致。
通过WAFs与BE-WAFs中SOD酶活性的比较, 可以看到: 消油剂空白组中SOD酶活性波动并不明显, 且活性大小与空白组基本一致; WAFs与BE-WAFs的40、100 mg/L浓度组SOD酶活性变化规律相似, 且BE-WAFs中SOD酶活性较WAFs偏高; 而BE-WAFs的250 mg/L浓度组SOD酶活性相对于WAFs却明显偏低。
2.3 WAFs与BE-WAFs对海水青鳉胚胎CAT酶活性的影响
不同浓度的WAFs对海水青鳉胚胎的CAT酶活性的影响结果如图2-A所示。由图可知: 整个实验周期中海水对照组的CAT酶活性基本不变。在暴露24 h后, 各浓度组的CAT酶活性基本呈现线性上升的趋势, 并在96 h时达到峰值, 诱导率分别为33.38%、48.02%、22.44%; 在停止暴露24 h后酶活性下降到空白组水平, 之后略有上升并趋于一致。由实验结果可知: 在WAFs3个浓度组中, 海水青鳉胚胎的CAT酶活性均出现先升高后降低的趋势, 尤其以40、100 mg/L浓度组的时间-效应关系更加明显。当恢复96 h后完成恢复实验时, 3组浓度的CAT酶活性基本趋于一致。
不同浓度的BE-WAFs对海水青鳉胚胎的CAT酶活性的影响结果如图2-B所示。在实验过程中, 消油剂空白组CAT酶活性水平基本与海水空白组保持一致。在暴露阶段, 40、100 mg/L浓度组中CAT的酶活性均随着暴露时间的延长而升高, 上升幅度十分明显且与其余组别差异较大, 其峰值分别达到了海水空白组的158.07%和168.49%, 停止暴露后酶活性水平开始回落并最终恢复到正常水平; 250 mg/L浓度组CAT酶活性暴露后上升幅度较小, 在48 h即达到峰值, 其诱导率为14.46 %, 并在暴露96 h出现酶活抑制现象; 在恢复阶段逐渐回升并与空白组趋于一致。由实验结果可知: 40、100 mg/L浓度组的CAT酶活性随时间的变化基本上遵循先升高后回落的规律, 时间-效应比较明显; 250 mg/L浓度组在暴露初期呈现上升趋势, 峰值出现时间早于其他浓度组, 并在暴露后期出现酶活抑制现象。当完成恢复实验时, 3组的CAT酶活性已趋于一致, 并与海水空白组相持平。
通过对比WAFs与BE-WAFs中CAT酶活性水平, 可以知道: 在暴露初期, BE-WAFs浓度组中, 40、100 mg/L浓度组的海水青鳉胚胎的CAT酶活性均高于WAF中的对应浓度组, 并随着暴露时间的延长, 差异逐渐明显; 暴露阶段消油剂的添加使得250 mg/L浓度组CAT酶活性在暴露后期出现下降趋势, 这可能由于其中的石油烃含量过高且作用时间过长从而导致胚胎产生中毒反应。
2.4 WAFs与BE-WAFs对海水青鳉胚胎GST酶活性的影响
不同浓度的WAFs对海水青鳉胚胎的GST酶活性的影响结果如图3-A所示。由图可知: 实验中海水空白组的GST酶活性基本不变。在暴露24 h后, 各浓度组GST酶活性变化不大, 直到48 h后才出现较为明显的升高, 并同时在暴露96 h时达到峰值。在暴露阶段, 100 mg/L浓度组酶活性始终较40、250 mg/L浓度组更高。停止暴露24 h后, 各浓度组的GST活性明显下降, 且略低于海水空白组水平, 恢复期后各浓度组酶活性恢复正常水平。由实验结果可知: WAFs各浓度组中GST酶活性随着暴露时间的延长, 呈现先增高后降低的趋势, 时间-效应关系较明显, 其中尤以100 mg/L浓度组最为显著; 当恢复96 h完成恢复实验时, 实验组GST酶活性已恢复到空白组水平。
BE-WAFs对海水青鳉胚胎的GST酶活性的影响结果分析如图3-B所示。在实验过程中, 空白组GST酶活性基本保持不变, 而消油剂空白组在暴露期出现升高趋势, 96 h时诱导率达到17.92 %。暴露阶段BE-WAFs的40、100 mg/L浓度组呈现相同的趋势, 其GST活性均较空白组偏高并随着时间的延长愈加显著, 其中以100 mg/L浓度组诱导率更高, 96 h时已达到44.4 %; 而250 mg/L浓度组则出现先诱导后抑制的现象。在结束暴露后, 3个浓度组的酶活性均恢复到正常水平。由实验结果可知; BE-WAFs中40、100 mg/L浓度组海水青鳉胚胎中GST酶活性随着实验时间的延长, 均呈现先增高后降低的趋势, 时间-效应关系明显; 250 mg/L浓度组则出现先升后降的规律, 但是酶活性波动幅度有限。当完成恢复实验时, 各组GST酶活性趋于正常。
将WAFs与BE-WAFs中GST酶活性水平进行对比, 可以发现: 在暴露初期相较于WAFs, BE-WAFs的40、100 mg/L浓度组GST酶活性受诱导更加显著, 并随着时间的延长, 差别愈加明显; BE-WAFs中250 mg/L浓度组GST在暴露前期受到诱导, 活性明显高于WAFs组, 而后于暴露96 h时受到抑制, 低于空白组水平, 这可能与高浓度石油烃长时间暴露, 毒性影响超出生物耐受阈值有关。
2.5 120#燃料油WAFs、CE-WAFs暴露下酶活性变化规律比较
为了直观地对比不同浓度下120#燃料油WAFs、CE-WAFs暴露对SOD、CAT、GST3种酶活性影响, 将暴露期间胚胎内各种酶活性变化情况列于表中, 由表2可见:
(1) 当海水青鳉胚胎暴露于WAFs后, 体内SOD、CAT、GST酶活性发生明显变化: 暴露初期, 3种抗氧化酶活性受到石油烃诱导而明显上升。这主要是由于海水青鳉胚胎在受到较低浓度石油烃产生的氧化胁迫后, 体内活性氧含量增加, 使机体处于氧化应激状态, 从而产生适应性诱导反应[26]。这是生物体应对外源污染物引起氧化压力的一种自我保护调节机制[27]。在对鲈鱼()、鲻鱼()、华贵栉孔扇贝、翡翠贻贝()、菲律宾蛤仔()和毛蚶()的研究中曾经得出相似的结论[28-33]。
(2) 在BE-WAFs的暴露试验中, 水体中石油烃含量上升使得诱导效应更加显著(表现为峰值升高、峰值出现时间提前)。暴露前期3种酶活性呈现上升趋势, 且诱导率随石油烃浓度升高而增大。随着暴露时间延长, 在BE-WAFs中250 mg/L浓度组3种抗氧化酶的活性均出现了不同程度的下降。这是由于当石油烃持续作用产生的氧化胁迫超出了机体适应性反应的抵御能力时, 会使生物体产生中毒反应, 进而抑制抗氧化酶的合成, 导致酶活性降低。吕福荣等[34]研究消油剂处理0#柴油对马粪海胆()的毒性效应, 赵元凤、沈盎绿等[35-36]分别研究石油烃污染对毛蚶()和斑马鱼()抗氧化酶活性的影响, Cheung等[37]研究苯并[a]芘暴露对翡翠贻贝()的抗氧化系统的影响, Richardson等[38]研究多环芳烃暴露下的贻贝()体内抗氧化酶的变化, 都得到了相似的结论。

表2 WAFs、BE-WAFs对酶活性影响的比较
(3)在实验过程中, 3种酶表现出的诱导或抑制程度均不相同。其中以对SOD酶的诱导最为明显, 其次为CAT酶, 而对GST酶的诱导则出现一定的滞后性, 诱导程度也最小; 从抑制率来看, 在加入消油剂后, 250 mg/L浓度组的3种酶均出现酶活抑制现象, 其中以SOD酶活性出现抑制的时间最早, 抑制率最大, GST酶次之, CAT酶受到的抑制最小。由此可见: 3种抗氧化酶中SOD酶对石油烃暴露最为敏感, 也最适合作为监测石油烃污染的指标。王晓艳、蒋凤华等[39-40]的研究结果也分别验证了这一结论。
(4) 在消油剂单独暴露的实验中发现: GST相较于SOD、CAT表现出更大的敏感性, 在暴露阶段持续受到诱导, 活性呈现线性上升趋势; 而在对SOD、CAT的消油剂单独暴露实验中, 没有出现这一现象。这可能是由于消油剂空白组中含有的石油烃降解微生物导致的。研究表明: 谷胱甘肽转移酶(GST)在PAHs降解菌中起着重要的作用, Lloyd等人[41-42]已经将GST酶作为分子探针用于鉴别PAHs降解菌的存在。
3 结论
本文研究了120#号燃料油WAFs、BE-WAFs对海水青鳉胚胎中SOD、CAT、GST3种抗氧化酶活性的影响, 得到如下结论:
(1) 机体中的抗氧化酶既可以在石油烃暴露下产生适应性诱导使活性上升, 也可以受毒性抑制导致活性下降; 石油烃浓度越高, 产生的诱导或抑制效应越强。
(2) BE-WAFs中抗氧化酶活性的诱导或抑制效应均高于对应浓度的WAFs。说明消油剂的添加使得石油烃污染对海水青鳉胚胎的氧化胁迫进一步增强。
(3) 石油烃暴露后, 3种抗氧化酶活性变化的剂量-效应和时间-效应关系显著。尤其以SOD表现最为敏感, 适合作为监测石油烃污染的生物标志物。
(4) GST酶在消油剂单独暴露中出现一定程度的活性变化, 表现较为敏感。表明GST酶对于该生物型消油剂的污染监测具有一定价值。
[1] Ko Jae-Young, Day John W. A review of ecological impacts of oil and gas development on coastal ecosystems in the Mississippi Delta[J]. Ocean & Coastal Management, 2004, 47(11-12): 597-623.
[2] 田立杰, 张瑞安.海洋油污染对海洋生态环境的影响[J]. 海洋湖沼通报, 1999, 23(2): 15-19. Tian Lijie, Zhang Ruian. The effect of offshore oil pollution marine ecological environment[J]. Transactions of Oceanology and Limnology, 1999, 23(2): 15-19.
[3] Lee Jeongae, Kim Min-hwa, Ha Mina, et al. Urinary metabolic profiling of volatile organic compounds in acute exposed volunteers after an oil spill in Republic of Korea[J]. Biomedical Chromatography, 2010, 24(5): 562-568.
[4] Pérez-Cadahía B, Lafuente A, Cabaleiro T, et al. Initial study on the effects of Prestige oil on human health[J]. Environment International, 2007, 33(2): 176-185.
[5] 溥文虹, 周李鑫, 杨帆, 等. 海上溢油防治技术研究进展[J]. 海洋科学, 2005, 29(6): 73-76. Pu Wenhong, Zhou Lixin, Yang Fan, et al. Progress in oil spill recovery technology[J]. Marine Sciences, 2005, 29(6): 73-76.
[6] 尹晓楠.基于三维荧光光谱和小波分析的油品种类识别技术研究[D]. 青岛: 中国海洋大学, 2012. Yin Xiaonan. Studies on the identification of oil types base on 3D fluorescence spectroscopy and wavelet analysis[D]. Qingdao: Ocean University of China, 2012.
[7] 吴运吾.我国船用燃料油市场分析[J]. 当代石油石化, 2011(10): 36-41. Wu Yunwu.The analysis of China’s marine fuel oil market[J]. Petroleum & Petrochemical Today, 2011(10): 36-41.
[8] Adeyemo O K, Kroll K J, Denslow N D. Developmental abnormalities and differential expression of genes induced in oil and dispersant exposedembryos[J]. Aquatic toxicology, 2015, 168: 60-71.
[9] Hannam M L, Bamber S D, Galloway T S, et al. Effects of the model PAH phenanthrene on immune function and oxidative stress in the haemolymph of the temperate[J]. Chemosphere, 2010, 78(7): 779-784.
[10] Nahrgang J, Camus L, Gonzalez P, et al. PAH biomarker responses in polar cod () exposed to benzo(a)pyrene[J]. Aquatic Toxicology, 2009, 94(4): 309-319.
[11] 黄逸君, 陈全震, 曾江宁, 等.原油和消油剂对海洋桡足类的急毒性效应[J]. 应用与环境生物学报, 2010, 16(4): 566-571. Hang Yijun, Chen Quanzhen, Zeng Jingning, et al. Acute toxicity of crude oil and dispersant to marine copepods[J]. Chinese Journal of Applied & Environmental Biology, 2010, 16(4): 566-571.
[12] Hemmer M J, Barron M G, Richard M, et al. Comparative toxicity of eight oil dispersants, Louisiana sweet crude oil (LSC), and chemically dispersed LSC to two aquatic test species[J]. Environmental Toxicology and Chemistry. 2011, 30(10): 2244-2252.
[13] Long S M, Holdway D A. Acute toxicity of crude and dispersed oil to(Hoyle, 1885) hatchlings[J]. Water Research, 2002, 36(11): 2769- 2776.
[14] Gulec I, Leonard B, Holdway D A. Oil and dispersed oil toxicity to amphipods and snails [J]. Spill Science & Technology Bulletin, 1997, 4(1): 1-6.
[15] Luqing P, Jiayun R, Jing L. Effects of benzo (k) fluoranthene exposure on the biomarkers of scallop[J]. Comparative Biochemistry and Physiology, Part C: Toxicology& Pharmacology, 2005, 141(3): 248-256.
[16] Oliveira M, Pacheco M, Santos M A. Organ specific antioxidant responses in golden grey mullet () following a short-term exposure to phenanthrene[J]. Science of the Total Environment, 2008, 396(1): 70-78.
[17] 袁萍, 吕振波, 周革非. 石油烃胁迫下3种微藻的生长动力学研究[J]. 海洋科学, 2014, 38(10): 46-51. Yuan Ping, Lü Zhenbo, Zhou Gefei. Growth kinetics of 3 species of microalgae treated with petroleum hydrocarbon[J]. Marine Sciences, 2014, 38(10): 46-51.
[18] 刘凤娇, 李顺兴, 郑凤, 等. 近海污染物对海洋浮游植物生长及生化组成影响的比较研究[J]. 海洋科学, 2014, 38(5): 66-71. Liu Fengjiao, Li Shunxing, Zheng Feng, et al. Comparison of the effects of coastal pollutants on the growth and biochemical composition of marine phytoplankton[J]. Marine Sciences, 2014, 38(5): 66-71.
[19] Martínez-Gómez C, Fernández B, Valdés J, et al. Evaluation of three-year monitoring with biomarkers in fish following the Prestige oil spill (N Spain)[J]. Chemosphere, 2009, 74(5): 613-620.
[20] Thomas R E, Lindeberg M, Harris P M, et al. Induction of DNA strand breaks in the mussel () and clam () following chronic field exposure to polycyclic aromatic hydrocarbons from the Exxon Valdez spill[J]. Marine Pollution Bulletin, 2007, 54(6): 726-732.
[21] Frantzen M, Regoli F, Ambrose W G, et al. Biological effects of mechanically and chemically dispersed oil on the Icelandic scallop ()[J]. Ecotoxicology and Environmental Safety, 2016, 127: 95-107.
[22] Martinović R, Kolarević S, Kračun-Kolarević M, et al. Genotoxic potential and heart rate disorders in the Mediterranean musselexposed to Superdispersant-25 and dispersed diesel oil[J]. Marine Environmental Research, 2015, 108: 83-90.
[23] Tissier F, Dussauze M, Lefloch N, et al. Effect of dispersed crude oil on cardiac function in seabass[J]. Chemosphere, 2015, 134: 192-198.
[24] 国家质量技术监督局. GB 18188.1-2000—溢油分散剂技术条件[S]. 北京: 中国标准出版社, 2000. The State Bureau of Quality and Technical Supervision. GB 18188.1-2000—Oil Spill Dispersant technical condition[S]. Beijing: Standards Press of China, 2000.
[25] 国家环境保护部. HJ637-2012—水质石油类和动植物油类的测定红外分光光度法[S]. 北京: 中国环境科学出版社, 2012. The Ministry of Environmental Protection. HJ637- 2012—The measure of water quality, petroleum, animal and vegetable oil Infrared spectrophotometry[S]. Beijing: China Environmental Science Press, 2012.
[26] Livingstone D R, Garcia M P, Michel X, et al. Oxyradical production as a pollution-mediated mechanism of toxicity in the common mussel,L., and other molluscs[J]. Functional Ecology, 1990, 4(3): 415-424.
[27] Matthieu D, Morgane D, Stephane L F, et al. Innate immunity and antioxidant systems in different tissues of seabass () exposed to crude oil dispersed mechanically or chemically with Corexit 9500[J]. Ecotoxicology and Environmental Safety, 2015, 120(6): 270-278.
[28] Milinkovitch T, Imbert N, Sanchez W, et al. Toxicological effects of crude oil and oil dispersant: Biomarkers in the heart of the juvenile golden grey mullet ()[J]. Ecotoxicology and Environmental Safety, 2013, 88(2): 1-8.
[29] 许贻斌, 郑惠东, 陈宇, 等. 石油烃分散液对华贵栉孔扇贝()的急性毒性影响[J]. 福建水产, 2014, 36(6): 446-452.Xu Yibin, Zheng Huidong, Chen Yufeng, et al. Acute toxic effects of petroleum hydrocarbon water-accommodated fractions on[J]. Journal of Fujian Fisheries, 2014, 36(6): 446-452.
[30] 杨涛, 陈海刚, 蔡文贵, 等.翡翠贻贝内脏团抗氧化酶活性及脂质过氧化物含量对苯并(b)荧蒽胁迫的生物响应研究[J]. 生态毒理学报, 2011, 6(5): 539-545.Yang Tao, Chen Haigang, Cai Wengui, et al. Response of antioxidant enzymes activities and lipid peroxidation levels invisceral mass of green-lipped mussel () to Benzo[b] fluoranthenestress[J]. Asian Journal of Ecotoxicolog, 2011, 6(5): 539-545.
[32] 陈建华, 阎斌伦, 高焕, 等. Cd2+、Cu2+及石油烃对毛蚶谷胱甘肽S-转移酶活性的影响[J]. 水产科学, 2012, 31(3): 137-142. Chen Jianhua, YanBinlun, Gao Huan, et al. Influences of Cadmium, Copper and Petroleum Hydrocarbons on Activity of Glutathione S-transferase in Marine Clam ()[J].Fisheries Science, 2012, 31(3): 137-142.
[33] 吕福荣, 熊德琪. 消油剂对马粪海胆污染效应的影响[J]. 海洋环境科学, 2010, 29(3): 328-331. Lü Furong, Xiong Deqi.Effect of dispersant and No. 0 diesel oil pollution on sea urchin ()[J]. Marine Environmental Science, 2010, 29(3): 328-331.
[34] 赵元凤, 吕景才, 李丹彤, 等. 海洋污染对毛蚶超氧化物歧化酶影响的研究[J]. 海洋学报, 2003, 25(3): 77-81. Zhao Yuanfeng, Lü Jingcai, Li Dantong, et al. Effects of marine pollution on the activity of superoxide dismutase in[J]. Actaoceanologica Sinica, 2003, 25(3): 77-81.
[35] 沈盎绿, 沈新强. 柴油对斑马鱼超氧化物歧化酶和过氧化氢酶的影响[J]. 海洋渔业, 2005, 27(4): 314-318. Shen Anglü, Shen Xinqiang. Effects of diesel fuel on the superoxide dismutase and catalase of zebra fish[J]. Marine Fisheries, 2005, 27(4): 314-318.
[36] Cheung C C C, Siu W H L, Richardson B J, et al. Antioxidant responses to benzo[a]pyrene and Aroclor 1254 exposure in the green-lipped mussel,[J]. Environmental Pollution, 2004, 128(3): 393-403.
[37] Richardson B J, Mak E, Luca-Abbott S B D, et al. Antioxidant responses to polycyclic aromatic hydrocarbons and organochlorine pesticides in green-lipped mussels (): Do mussels “integrate” biomarker responses?[J]. Marine Pollution Bulletin, 2008, 57 (s 6-12): 503-514.
[38] 王晓艳, 冯丽娟, 蒋凤华, 等. 原油水溶性成分对栉孔扇贝抗氧化酶活性和丙二醛含量的影响[J]. 中国海洋大学学报, 2013, 43(7): 45-50. Wang Xiaoyan, Feng Lijuan, Jiang Fenghua, et al. Effects of Water-Soluble Fraction of Crude Oil on the Activity of Antioxidant Enzyme and Malondialdehyde Content of[J]. Periodical of Ocean University of China, 2013, 43(7): 45-50.
[39] 蒋凤华, 高伟, 赵美丽, 等. 原油污染对栉孔扇贝抗氧化酶活性的影响[J]. 海洋科学, 2012, 36(7): 28-33. Jiang Fenghua, Gao Wei, Zhao Meili, et al. Effect of crude oil on the activity of antioxidant enzyme of scallop[J]. Marine Sciences, 2012, 36(7): 28-33.
[40] Lloyd J G, Pck L. Glutathione S-transferase-encoding gene as a potential probe for environmental bacterial isolates capable of degrading polycyclic aromatic hydrocarbons[J]. Applied & Environmental Microbiology, 1997, 63 (8): 3286-3290.
[41] Lloyd J G, Laurie A D, Hunter D W F, et al. Analysis of catabolic genes for naphthalene and phenanthrene degradation in contaminated New Zealand soils[J]. Fems Microbiology Ecology, 1999, 29(1): 69-79.
Effects of dispersant and #120 fuel oil exposure on antioxidant enzyme activity ofembryos
GAO Xiang, DING Guang-hui, QIAN Yi-ting, JIANG Ling-ling, XIONG De-qi
(Dalian Maritime University, Dalian 116026, China)
In this paper, we consider the acute toxicities of #120 fuel oil water-accommodated fractions (WAFs) and biologically enhanced water-accommodated fractions (BE-WAFs) onembryos. Specifically, in our study, we investigated the effects of WAFs and CE-WAFs with different concentrations on the activities of superoxide dismutase (SOD), catalase (CAT), and glutathione S-transferase (GST). The results show that the activities of SOD, CAT, and GST vary significantly after experiencing oxidative stress from petroleum hydrocarbons. With increasing the TPH concentration and duration of exposure, the activities of SOD, CAT, and GST showed various degrees of inductive and inhibitory effects. Of the three enzymes, the activity of SOD varied most significantly when exposed to petroleum hydrocarbons. GST also showed sensitivity when exposed to a dispersant alone. These study results indicate that the SOD inhas the highest sensitivity to pollution from petroleum hydrocarbons and is suitable for use as a biomarker for monitoring marine oil pollution.
; petroleum hydrocarbons; dispersant; antioxidant enzyme; #120fuel oil
(本文编辑: 康亦兼)
[National Natural Science Foundation of China, No.41276105/ D0608; Application Basic Research Project of Ministry of Transport, No.2013329225250; Fundamental Research Funds for the central Universities, No.3132015081]
Dec. 24, 2015
X55
A
1000-3096(2016)08-0018-09
10.11759/hykx20151224001
2015-12-24;
2016-03-28
国家自然科学基金项目(41276105/D0608); 交通运输部应用基础研究项目(2013329225250); 中央高校基本科研业务费(3132015081)
高翔(1988-), 男, 山东潍坊人, 主要从事环境毒理学方面研究, 电话: 18640968956, E-mail: neo880205@163.com; 熊德琪, 通信作者,博士, 教授, 电话: 0411-84729615, E-mail: xiongdq@dlmu.edu.cn

