一株海绵附生芽孢杆菌的抗硅藻附着活性成分的分离鉴定
吴 珊, 俞思羽, 姜 薇, 2, 张立奎, 2, 靳翠丽, 2, 周晓见, 2
一株海绵附生芽孢杆菌的抗硅藻附着活性成分的分离鉴定
吴 珊1, 俞思羽1, 姜 薇1, 2, 张立奎1, 2, 靳翠丽1, 2, 周晓见1, 2
(1. 扬州大学环境科学与工程学院, 江苏扬州 225127; 2. 扬州大学海洋科学与技术研究所, 江苏扬州 225127)
为寻找天然抗污损活性化合物, 以抗硅藻附着活性为导向, 采用有机溶剂萃取、半制备高压液相色谱对分离自海绵的芽孢杆菌UST050418-715代谢产物进行分离, 纯化抗硅藻附着活性物质, 并利用气相色谱-质谱联用仪、核磁共振波谱分析活性物质结构。从菌株UST050418-715代谢产物中分离得到7种具有抗硅藻附着活性的环二肽类化合物, 分别鉴定为: (1)环(L-亮氨酸-反式-8-羟基-L-脯氨酸-)、(2)环(L-缬氨酸-L-脯氨酸)、(3)环(D-脯氨酸-L-亮氨酸)、(4)环(L-脯氨酸-D-亮氨酸)、(5)环(甘氨酸-L-脯氨酸)、(6)环(L-苯丙氨酸-顺式-8-羟基-D-脯氨酸-)、(7)环(L-苯丙氨酸-反式-8-羟基-L-脯氨酸-)。说明海绵附生芽孢杆菌UST050418-715代谢产物中存在大量环二肽类化合物, 可以帮助宿主海绵实现对硅藻附着的化学防御。
抗硅藻附着; 芽孢杆菌; UST050418-715; 环二肽
海洋生物污损一直是亟待解决的一个问题, 在全球范围内给人类造成巨大的经济损失[1]。海洋污损生物是指栖息、附着及生长在船舶和各类人工设施上给海洋开发活动带来负效益的动物、植物、微生物的总称[2]。其中, 海洋硅藻是海洋生物污损过程的初始附着生物之一, 具有种类多、数量大、繁殖快等特点, 其在水下固相表面的附着可诱导后期藤壶、贝类以及无脊椎动物等大型污损生物的附着生长; 形成复杂的污损生态群落, 加速金属的腐蚀、影响设备的正常使用, 影响水产养殖业的产量和质量[3-5]。所以, 抑制海洋硅藻的附着, 可以推迟或阻止大型污损生物的附着, 对海洋生物污损的防治起着至关重要的作用。
针对海洋生物污损, 人们探索多种防污方法, 如防污涂料涂装法、超声波振动法、氯气注入法、海水电解法、铜-镍合金粘贴法、海水间歇加热法、低表面自由能材料粘贴法等[6]。其中, 防污涂料技术成熟、工艺简单, 通过化学防污剂的受控释放, 阻止海洋生物在物体表面的附着, 是应用最广泛的方法[7]。20世纪70年代起使用的有机锡、氧化亚铜及合成的杀虫剂等防污剂, 是通过毒杀附着生物达到防污目的。由于这些传统防污剂对非目标生物也有严重的毒性, 对海洋生态造成其不可恢复的损伤,因而于20世纪80年代末相继被禁用或限用[8]。近年来, 随着天然产物化学的发展, 海洋天然防污剂以其无毒的防污作用引起了人们注意[9]。海洋天然防污剂是指从一些海洋生物如红藻、珊瑚、海绵等生物体中提取的具有防污活性的天然物质, 目前已报道的物质包括有机酸、内酯、萜类、甾醇类、环二肽类和吲哚类等; 它们降解速度快, 且不危害海洋生物的生命, 有利于保持生态平衡[8, 10-11]。因此, 寻找海洋天然防污损化合物已成为获得高效、无毒、环境友好型防污剂的重要途径之一。
海洋植物(如红藻、褐藻等)、海洋动物(如珊瑚、海绵等)是海洋天然抗污损物质的良好来源, 但由于生长期长、规模化培养条件高等原因, 难以满足商业规模化生产需要[12]。相比较而言, 海洋微生物(细菌、真菌等)容易大规模培养, 生长周期短, 更具有优势和发展潜力[10, 13-14]。海绵以其复杂的孔状结构和滤食系统成为海洋微生物的天然宿主, 其体内微生物的密度高达109个/mL。越来越多的研究证实, 海绵中分离到的活性物质, 其真正来源是共附生的海洋微生物[15-16]。而固着生长的海绵具有化学防御机制, 不会受到污损生物的附着。因此, 海绵共附生微生物在其化学防御中的作用以及从其共附生微生物中寻找天然防污损化合物, 成为目前研究新热点[17-20]。Kon-ya等[21]从海绵中分离出的细菌sp.的培养液中提取出了泛酶-8, 能有效抑制纹藤壶附着。朱建生等[22]从海绵sp.附生菌中提取出了具有抗硅藻附着活性的环(苯丙氨酸-丙氨酸)和环(丙氨酸-色氨酸)等环二肽类化合物。本课题组前期从海绵共附生微生物藻种库中筛选到一株抗硅藻附着的芽孢杆菌UST050418-715, 并发现该菌株对小新月菱形藻、咖啡双眉藻、碎片菱形藻等多种硅藻的附着现象都有较为明显的抑制效果[12, 23]。
本研究以抗硅藻附着活性为导向, 对该菌株代谢产物中的抗硅藻附着活性组分进行分离纯化, 并鉴定其化学结构, 为海绵共附生芽孢杆菌作为天然抗污损活性物质来源做一尝试。
1 材料与方法
1.1 菌株及培养基
试验菌株UST050418-715由香港科技大学海岸海洋实验室钱培元教授课题组提供, 从采集于美国华盛顿州圣璜岛附近海域48.55°N, 123.01°W的海绵样品中分离[12, 23]。该菌株经本实验室鉴定为短小芽孢杆菌()。
培养基配方为: 蛋白胨7.5 g/L, 酵母粉3.0 g/L、NaCl 10.45 g/L、MgCl25.90 g/L、MgSO4·7H2O 3.24 g/L、CaCl21.80 g/L、KCl 0.55 g/L、柠檬酸铁0.10 g/L, pH为9.5。琼脂培养基: 在以上配方中加入琼脂15~20 g/L。
1.2 菌株UST050418-715粗提物的制备
按朱建生等[23](2013)的方法培养和发酵菌株。在发酵产物中加入等体积的乙酸乙酯(含5 %丙酮)进行震荡萃取分离, 收集上层有机相, 萃取三次; 萃取液在37℃水浴下减压浓缩后, 移入小离心管, 用冷冻离心浓缩仪冻干, 4℃避光保存[23-24]。
1.3 抗硅藻附着活性测试
测试硅藻为小新月菱形藻(), 由中国海洋大学水产学院藻种室提供。硅藻采用f/2培养液[25]。
将离心后的硅藻经人工海水洗涤, 调整密度后和待测样品在24孔板上混合, 使样品的最终测试浓度均为100mg/mL。经24 h光照培养后, 注入人工海水洗涤。最后, 于显微镜下观察孔底附着的硅藻数量。具体测试方法按照靳翠丽(2015)方法进行[23]。
抑制率计算公式:

1.4 抗硅藻活性物质的分离纯化
将UST050418-715菌株进行批量发酵, 共120 L, 萃取、蒸馏得到13 g粗提物。将其溶于甲醇进行离心(转速2000 r/min)去除无机盐, 取上清液蒸干得到粗提物10.5 g。在蒸干的粗提物中加入100 mL 的纯水, 用玻璃棒搅拌, 并用超声在30℃下溶解。用等体积的石油醚萃取3次, 收集石油醚相; 再用等体积的二氯甲烷萃取3次, 收集二氯甲烷相; 之后用等体积的乙酸乙酯萃取3次, 收集乙酸乙酯相; 最后用等体积的正丁醇萃取3次, 分别收集正丁醇相和水相, 将以上收集到的五相用旋蒸仪浓缩蒸干, 4℃保存备用。
活性物质的半制备HPLC分离纯化使用LabTech半制备HPLC, 色谱柱: C18(250 mm × 10 mm, 5 μm); 流速: 2 mL/min; UV检测器检测波长: 210 nm。样品用甲醇溶解, 14 000 r/min离心5 min, 取上清液进样。选取一定比例的甲醇水为流动相, 根据出峰的保留时间收集流出液。
1.5 抗硅藻活性物质的结构分析
GC-MS分析采用Thermo ITQ900系统, 配制的GC运行条件: 色谱柱为DB-VRX毛细管柱(60.0 m × 250 μm × 1.40 μm), 载气为高纯He, 进样口温度280℃, 10︰1分流进样模式, 进样量1 µL, 柱流速1 mL/min, 程序升温, 起始温度40℃, 保持3 min, 以10℃/min升到300℃, 保持5 min。MS运行条件: EI离子源, 离子源温度为250℃, 质量扫描范围为50~650 amu。
将5 mg左右真空干燥后的样品, 溶于0.5 mL氘代DMSO中, 装入核磁共振, 利用Bruker AVANCE 600核磁共振波谱仪在600 MHz下共振测量, 得到1H-NMR谱。利用Anton Paar MCP300 旋光仪测得化合物比旋光值。
2 结果与讨论
2.1 有机溶剂萃取结果
按照极性从小到大的顺序用石油醚、二氯甲烷、乙酸乙酯、正丁醇四种有机溶剂对菌株UST050418- 715粗提物进行萃取, 得到石油醚相(Fr-1)、二氯甲烷相(Fr-2)、乙酸乙酯相(Fr-3)、正丁醇相(Fr-4)和水相(Fr-5)。
测定初分离各相的抗硅藻附着活性, 结果见图1。由图1可见, 5个组分对硅藻的附着均有抑制作用, 相对于极性中等和偏大的Fr-3、Fr-4和Fr-5, 极性偏小的Fr-1和Fr-2硅藻抑制活性更好, 说明活性主要集中在中偏小极性区。从质量分布来看, 二氯甲烷相Fr-2(质量占比41.7%)最大, 远远大于其他相, 而其他各相质量占比差异较小。因中等极性的片段分离难度小, 本研究选取抗硅藻附着活性最好和质量占比最大的二氯甲烷相Fr-2和极性中等的乙酸乙酯相Fr-3进行下一步的分离。
2.2 二氯甲烷相(Fr-2)的半制备HPLC分离
对中小极性片段二氯甲烷相Fr-2, 进行半制备HPLC的分离纯化。其分离、纯化流程图如图2所示。
通过半制备HPLC对Fr-2(二氯甲烷相)进行分离(MeOH-H2O=40%), 得到组分Fr-2.1~Fr-2.8, 其半制备高压液相制备分离的保留时间截点图见图3。Fr-2.3、Fr-2.5从液相谱图上看都是单峰且峰面积占比较大, 因此在出峰时将其从半峰高到峰顶的部分单独接出, 就能得到相对较纯的组分, 分别标记为Fr-2.3*、Fr-2.5*。在24孔板下测定Fr-2(二氯甲烷相)经半制备HPLC分离得到的Fr-2.1~Fr-2.8各组分的抗硅藻附着活性, 结果如图4所示。
其中制备得到较纯的组分Fr-2.3*(抑制率12.7%)、Fr-2.5*(抑制率-10%), 都没有表现出显著活性。而Fr-2.4(抑制率57%)、Fr-2.6(抑制率65.5%)、Fr-2.7(抑制率61.5%)、Fr-2.8(抑制率66.5%)都对硅藻表现出一定的抑制作用, 但是从其液相图谱上看都不是单一组分, 因此对Fr-2.4、Fr-2.6、Fr-2.7进行进一步的半制备HPLC分离(MeOH-H2O=30%), Fr-2.8由于极性太小, 分离比较费时, 直接对其尝试结构分析。
对Fr-2.4组分进行半制备HPLC分离, 得到6个组分分别记为Fr-2.4.1~Fr-2.4.6, 测定各组分抗硅藻附着活性, 发现Fr-2.4.1和Fr-2.4.5的活性相对较好, 抑制率分别为67%和39%。从半制备液相谱图上看Fr-2.4.2、Fr-2.4.4、Fr-2.4.6均为单峰, Fr-2.4.3和Fr-2.4.5在半制备液相谱图上看均有两个峰, 成分相对简单。
对Fr-2.6组分进行半制备HPLC分离, 得到6个组分分别记为Fr-2.6.1~Fr-2.6.6, 测定各组分抗硅藻附着活性, 发现Fr-2.6.2对硅藻有显著的抑制活性, 抑制率达98%, Fr-2.6.1也有一定的抑藻活性, 抑制率为58.6%。其余组分没有表现出明显的抑制活性。从半制备液相谱图上看, Fr-2.6.3组分较纯呈单峰, Fr-2.6.4和Fr-2.6.5相对较纯, 都有一个峰面积较大的主峰。活性最好的Fr-2.6.2液相谱图并不是单峰, 有四个较大的峰, 进一步分离纯化(MeOH-H2O=30%)得到4个组分记为Fr-2.6.2.1~Fr-2.6.2.4, 从其液相谱图看来只有Fr-2.6.2.4的组分比较单一。活性其次的Fr-2.6.1, 从液相谱图上看, 有三个较大的峰。
对Fr-2.7组分进行半制备HPLC分离, 得到3个组分分别记为Fr-2.7.1、Fr-2.7.2和Fr-2.7.3, 测定各组分抗硅藻附着活性, 发现Fr-2.7.2的活性相对较好, 抑制率为58%, 另外两个组分没有表现出明显的抑藻活性。从半制备液相谱图上看, Fr-2.7.1和Fr-2.7.3组分较纯, 都呈单峰。而有一定抑藻活性的Fr-2.7.2其液相谱图并不是单峰。
对以上经液相完成初步纯化的组分进行结构分析。
2.3 乙酸乙酯相Fr-3的半制备HPLC分离
对中极性片段乙酸乙酯相Fr-3, 进行半制备HPLC的分离纯化。其分离、纯化流程图见图5。
*. 表示片段中较纯的部分
*. indicates the purer portionof the fragment
通过半制备HPLC对Fr-3(乙酸乙酯相)进行制备分离(MeOH-H2O=40%), 得到组分Fr-3.1~ Fr-3.7, 其半制备高压液相制备分离的保留时间截点图见图6。Fr-3.2、Fr-3.5、Fr-3.7从液相谱图上看都是单峰且峰面积占比较大, 因此在出峰时将其从半峰高到峰顶的部分单独接出, 就能得到相对较纯的组分, 分别标记为Fr-3.2*、Fr-3.5*、Fr-3.7*。
在24孔板下测定Fr-3(乙酸乙酯相)经半制备HPLC分离得到的Fr-3.1 ~ Fr-3.7各组分的抗硅藻附着活性, 结果如图7所示。
其中制备得到较纯的组分Fr-3.2*、Fr-3.5*、Fr-3.6、Fr-3.7*中, Fr-3.7*(抑制率11.0%)活性很差, Fr-3.2*和Fr-3.5*抑制率分别为46.3%和30.7%, 但活性在重复测试中的稳定性不高。Fr-3.3(抑制率44.8%)是10个组分中活性相对最好且活性表现最稳定的组分, 因此对Fr-3.3进行进一步的半制备HPLC分离。
Fr-3.3的极性较大, 用10%的甲醇水对其进行半制备HPLC纯化, 得到组分Fr-3.3.1~Fr-3.3.8, 测定各组分抗硅藻附着活性, 其中Fr-3.3.8的硅藻抑制活性最好, 抑制率高达90%, 液相谱图上看组分单一, 且由于组分质量较少, 没有进行更进一步的分离工作。
对以上经液相完成初步纯化的组分进行结构分析。
2.4 抗硅藻活性化合物结构的分析鉴定
通过GC-MS对前面获得的共计34个样品进行测定, 说明其中共有12个样品纯度较高, 包括: Fr-2.1(101mg)、Fr-2.3*(244mg)、Fr-2.4.2(7.8mg)、Fr-2.4.3(5.7mg)、Fr-3.2*(62mg)、Fr-3.5*(295mg)、Fr-3.6(89mg)、Fr-3.7*(116mg)、Fr-2.6.5(16mg)、Fr-2.7.1(27mg)、Fr-2.7.2(3.7mg)、Fr-2.6.2.4(4mg)。12个组分的GC-MS分析结果见表1, 其中Fr-2.3*未测出结果, Fr-2.4.2、Fr-3.5*、Fr-3.6和Fr-3.7*未定出分子式。Fr-2.4.3、Fr-2.6.2.4、Fr-2.6.5、Fr-2.7.1、Fr-2.7.2的GC-MS测定结果分子质量都为210, Fr-2.4.2、Fr-3.5*的GC-MS测定结果分子量都为226, Fr-3.6和Fr-3.7*的GC-MS测定结果分子质量都为260, 推测它们可能是有不同的同分异构体。其他活性较好组分, 如Fr-2.8、Fr-2.6.2.1、Fr-2.6.2.2、Fr-2.6.2.3、Fr-3.3.5, 由其GC-MS谱图来看成分纯度不高, 难以推测其所含活性物质结构。
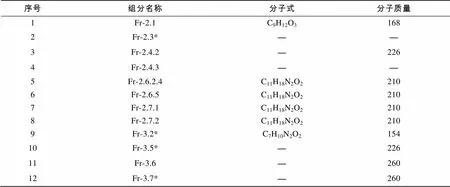
表1 12个组分的GC-MS分析结果
注: “—”代表未测出结果
根据GC-MS的初步分析, 选取上述12个较纯的样品进行1H-NMR波谱分析。样品性状和1H NMR分析结果如下:
Fr-2.3*、Fr-2.4.2、Fr-3.5*为白色粉末;- 102.3 (1.0, MeOH); 分子式: C11H18N2O3;1H NMR (600 MHz, DMSO-6): δH0.87 (3H, d,=6.5 Hz, H-13), 0.85 (3H, d,=6.5 Hz, H-12), 1.35 (1H, m, H-10b), 1.78(1H, m, H-10a), 1.87-1.93 (2H, overlap, H-7b, H-11), 2.03 (1H, m, H-7a), 3.23 (1H, d,=12.3 Hz, H-9a), 3.48 (1H, dd,=4.3, 12.3 Hz, H-9b), 3.49 (1H, m, H-6), 4.04 (1H, t,=6.0 Hz, H-3), 4.38 (1H, m, H-8), 5.08 (1H, brs, OH), 7.98 (1H, brs, 4-NH)。参照Liu H等2010年的文献, 确定结构为环(L-亮氨酸-反式-8-羟基-L-脯氨酸-) [cyclo (L-leu-trans-8-hydroxy-L-pro)] (见图8-化合物1)[15, 26]。
Fr-2.6.5为无色针晶; 分子式: C11H18N2O2;+ 89.2 (1.0, MeOH);1H NMR (600 MHz, DMSO-6): δH0.89 (3H, d,=6.6 Hz, H-12), 0.91 (3H, d,=6.6 Hz, H-13), 1.45 (1H, m, H-10a), 1.56 (1H, m, H-11), 1.77-1.82 (4H, overlap, H-7a, H-8, H-10b), 2.14 (1H, m, H-7b), 3.33 (1H, m, H-9a), 3.34 (1H, m, H-9b), 3.60 (1H, m, H-3), 4.16 (1H, dd,=6.4, 1.5 Hz, H-6), 8.33 (1H, d,=3.2 Hz, 4-NH)。参照Adamczeski M等1999年以及朱建生2013年的文献, 确定结构为环(D-脯氨酸-L-亮氨酸) [cyclo (D-pro-L-leu)](见图8-化合物3)[15, 27, 29]。
Fr-2.7.1为无色针晶; 分子式: C11H18N2O2;– 81.5 (1.0, MeOH);1H NMR (600 MHz, DMSO-6): δH0.87 (6H, overlap, H-12, H-13), 1.35 (1H, m, H-11), 1.76-1.87 (6H, overlap, H-7, H-8, H-10), 3.38 (2H, m, H-9), 4.00 (1H, m, H-3), 4.18 (1H, m, H-6), 7.98 (1H, brs, 4-NH)。将1H NMR数据与朱建生2013年以及刘涛等2009年的文献对照, 确定结构为环(L-脯氨酸-D-亮氨酸)[cyclo (L-pro-D-leu)] (见图8-化合物4)[15, 29-30]。
Fr-3.2*为无色块晶; 分子式: C7H10N2O2;– 98.2 (1.0, MeOH);1H NMR (600 MHz, DMSO-6): δH1.78-1.87 (3H, overlap, H-7a, H-8), 2.13 (1H, m, H-7b), 3.33 (1H, m, H-9b), 3.41 (1H, m, H-9a), 3.51 (1H, dd,=4.5, 16.2 Hz, H-3a), 3.99 (1H, d,=16.2 Hz, H-3b), 4.12 (1H, dd,=6.0, 8.0 Hz, H-6), 8.05 (1H, brs, 4-NH)。将1H NMR数据与Liu H等2010年的文献对照完全一致, 但是旋光值完全相反, 因而结构确定为环(甘氨酸-D-脯氨酸)的对应异构体, 为环(甘氨酸-L-脯氨酸) [cyclo (gly-L-pro)] (见图8-化合物5)[15, 26]。
Fr-3.6呈无色油状; 分子式: C14H16N2O3;+ 31.0 (1.0, MeOH);1H NMR (600 MHz, DMSO-6): δH1.84 (1H, m, H-7a), 2.11 (1H, m, H-7b), 2.92 (1H, dd,=3.5, 15.0 Hz, H-10a), 3.02 (1H, dd,=5.0, 15.0 Hz, H-10b), 3.14 (2H, m, H-9), 3.45 (1H, dd,=3.5, 5.0 Hz, H-3), 3.97 (1H, m, H-6), 4.11 (1H, m, H-8), 5.00 (1H, brs, 5-OH), 7.26-7.30 (5H, overlap, H-11, 12, 13, 14, 15, 16), 8.13 (1H, brs, 4-NH)。参照朱建生2013年以及Shigemori 等1998年的文献, 确定结构为环(L-苯丙氨酸-顺式-8-羟基-D-脯氨酸-)[cyclo (L- phe-cis-8-hydroxy-D-pro)](见图8-化合物6)[15, 29, 31]。
Fr-3.7*呈无色油状; 分子式: C14H16N2O3;–35.9 (1.0, MeOH);1H NMR (600 MHz, DMSO-6): δH1.52 (1H, m, H-7a), 1.94 (1H, m, H-7b), 3.02 (1H, dd,=5.0, 15.0 Hz, H-10a), 3.06 (1H, dd,=5.4, 15.0 Hz, H-10b), 3.07 (1H, dd,=3.8, 12.0 Hz, H-9a), 3.13 (1H, overlap, H-9b), 4.19 (1H, t,=5.2, H-3), 4.31 (1H, dd,=6.2, 11.2 Hz, H-6), 4.39 (1H, m, H-8), 5.10 (1H, brs, OH), 7.19-7.29 (5H, overlap, H-12, 13, 14, 15, 16), 7.95 (1H, brs, 4-NH)。参照Liu 等2010年以及朱建生2013年的文献, 确定结构为环(L-苯丙氨酸-反式- 8-羟基-L-脯氨酸-) [cyclo (L-phe-trans-8-hydroxy-L- pro)](见图8-化合物7)[15, 26, 29]。
Fr-2.1、Fr-2.6.2.4、Fr-2.7.2样品不纯, 无法根据1H-NMR解析出结构。
综上, 通过半制备HPLC对海绵附生芽孢杆菌UST050418-715代谢产物中具有抗硅藻附着活性的组分进行活性导向的分离纯化, 并采用GC-MS和1H-NMR对分离得到的较纯活性组分进行结构分析, 得到7种环二肽类化合物, 分别鉴定为:
(1) Fr-2.3*、Fr-2.4.2和Fr-3.5*的主要成分为同种物质, 均为环(L-亮氨酸-反式-8-羟基-L-脯氨酸-) [cyclo(L-leu-trans-8-hydroxy-L-pro)], 其抑制率最高达30.7%±5.0%;
(2) Fr-2.4.3的平面结构为环(L-缬氨酸-L-脯氨酸)[cyclo (L-val-L-pro)], 其抑制率为28.0%±10.4%;
(3) Fr-2.6.5为环(D-脯氨酸-L-亮氨酸)[cyclo (D-pro-L-leu)], 其抑制率为28.0%±12.6%;
(4) Fr-2.7.1为环(L-脯氨酸-D-亮氨酸)[cyclo (L-pro-D-leu)], 其抑制率为18.0%±2.8%;
(5) Fr-3.2*为环(甘氨酸-L-脯氨酸)[cyclo (gly- L-pro)] , 其抑制率为46.3%±10.8%;
(6) Fr-3.6为环(L-苯丙氨酸-顺式-8-羟基-D-脯氨酸-)[cyclo (L-phe-cis-8-hydroxy-D-pro)], 其抑制率为28.7%±11.3%;
(7) Fr-3.7*为环(L-苯丙氨酸-反式-8-羟基-L-脯氨酸-)[cyclo (L-phe-trans-8-hydroxy-L-pro)], 其抑制率为11%±5.5%。
3 讨论
海洋生物污损一直是困扰人类的棘手难题, 现行的防污措施都只是临时的, 没有从根本上解决问题。开发高效、无毒、环境友好的活性化合物, 是目前国内外都比较看好的解决途径。从海洋微生物中寻找这种环境友好的天然抗污损化合物是切实可行的, 我国在海洋微生物资源的开发方面, 起步较晚, 因此有很大的潜力和发展空间。
海绵其独特的化学防御机制一般认为与其共附生微生物相关, 海绵附生微生物可产生具有显著抗污损活性的次生代谢产物。本研究所采用的试验菌株UST050418-715, 为海绵附生芽孢杆菌, 在前期研究中, 发现其对多种硅藻的附着都有较为明显的抑制作用。本文以抗硅藻附着活性作为追踪指标, 利用溶剂萃取和半制备HPLC相结合的手段, 从该活性菌株发酵产物中分离活性化合物。并通过结构鉴定, 得到7种环二肽类化合物, 对硅藻附着均有一定的抑制作用。这一结果和朱建生等从海绵附着菌中分离到多个具有抗硅藻活性的环二肽的报道相似[22]。说明环二肽在海绵附生微生物帮助宿主进行化学防御的过程中起重要作用。同时, 实验中也发现, 活性随着分离纯化的深入有一定程度的丢失, 说明可能化合物间存在一定的协同效应。
环二肽类化合物广泛存在于自然界中, 报道的活性不仅有抗污损, 还有抗菌、抗肿瘤、调节激素、抑制群体感应等广泛的生物活性[32-33]。另外, 环二肽类化合物多样性极高, 混合样品间的协同效应存在的可能性也较大。因此将其作为海洋天然产物防污剂用于海洋生物防污具有较高的可能性和选择性[32, 34-35]。
[1] Townsin R L. The ship hull fouling penalty [J]. Biofouling, 2003, 19: 9-15.
[2] 方芳, 严涛, 刘庆. 化学生态学在海洋污损生物防除中的应用[J]. 应用生态学报, 2005, 16(10): 1997- 2002. Fang Fang, Yan Tao, Liu Qing. Application of chemical ecology in controlling marine fouling organisms[J]. Chinese Journal of Applied Ecology, 2005, 16(10): 1997-2002.
[3] Hoagland K D, Rosowski J R, Gretz M R, et al. Diatom extracellular polymeric substances: function, fine structure, chemistry and physiology[J]. Journal of Phycology, 1993, 29(5): 537-566.
[4] 李燕, 高亚辉, 李雪松, 等. 海洋硅藻附着研究进展[J]. 生命科学, 2008, 20(5): 768-772.Li Yan, Gao Yahui, Li Xuesong, et al. Research progress on marine diatom adhesion[J]. Chinese Bulletin of Life Sciences, 2008, 20(5): 768-772.
[5] 黄运涛, 彭乔. 海洋生物污损的防治方法及研究进展[J]. 全面腐蚀控制, 2004, 18(1): 3-5. Huang Yuntao, Peng Qiao. The Prevention Method and Research Development of Marine Fouling[J]. Total Corrosion Control, 2004, 18(1): 3-5.
[6] 张立侠. 防海生物污损技术初探[J]. 橡塑资源利用, 2006, 2(2): 7-12. Zhang Lixia. Preliminary study on marine antifouling techniques[J]. Rubber & Plastics Resources Utilization, 2006, 2(2): 7-12.
[7] 许凤岭, 刘升发, 侯保荣. 海洋生物污损研究进展[J]. 海洋湖沼通报, 2008, 1: 146-152. Xu Fengling, Liu Shengfa, Hou Baorong. Marine fouling and the protection[J]. Transactions of Oceanology and Limnology, 2008, 1: 146-152.
[8] 安军, 叶嘉, 陈雷, 等. 海洋生物防污损活性的研究进展[J]. 邯郸学院学报, 2007, 17(3): 70-73. An Jun, Ye Jia, Chen Lei, et al. Progress in studies on antifouling activity of marine organism[J]. Journal of Handan College, 2007, 17(3): 70-73.
[9] 王毅, 张盾. 天然产物防污剂研究进展[J]. 中国腐蚀与防护学报, 2015, 35(1): 1-11. Wang Yi, Zhang Dun. Recent research progress of nature product as antifouling agents[J]. Journal of Chinese Society for Corrosion and Protection, 2015, 35(1): 1-11.
[10] 周世伟, 杨翠云, 夏传海. 天然产物防除海洋污损生物的研究进展[J]. 天然产物研究与开发, 2011(1): 186-192. Zhou Shiwei, Yang Cuiyun, Xia Chuanhai. The prevention of marine fouling organisms by natural antifoulants a Review[J]. Natural Product Research and Development, 2011(1): 186-192.
[11] 刘超, 付玉彬, 郑纪勇. 环境友好型防污剂及海洋防污涂料的研究进展[J]. 材料开发与应用, 2009(4): 69-74.Liu Chao, Fu Yubin, Zheng Jiyong. Review on environmental friendly biocides and marine antifouling coatings[J]. Development and Application of Materials, 2009(4): 69-74.
[12] 忻夏莹, 靳翠丽, 周晓见. 抗硅藻附着活性细菌的筛选、鉴定与发酵条件优化[J]. 海洋科学, 2013, 37: 90-96. Xin Xiaying, Jin Cuili, Zhou Xiaojian. Screening, identification and fermentation conditions optimization of bacteria against diatom adhesion[J]. Marine Sciences, 2013, 37: 90-96.
[13] Armstrong E, Boyd K G, Burgess J G. Prevention of marine biofouling using natural compounds from marine organisms[J]. Biotechnology Annual Reviews, 2000, 6: 221-241.
[14] Dobretsov S, Dahms H U, Qian P Y. Inhibition of biofouling by marine microorganisms and their metabolites[J]. Biofouling, 2006, 22: 43-54.
[15] Fabbri D, Adamiano A, Falini G, et al. Analytical pyrolysis of dipeptides containing proline and amino acids with polar side chains. Novel 2, 5-diketopiperazine markers in the pyrolysates of proteins[J]. Journal of Analytical and Applied Pyrolysis, 2012, 95: 145-155.
[16] Luis S M, Ballesteros J, Gutierrez M. Antibacterial constituents from the octocoral-associated bacteriumsp.[J]. Revista Latinoamericana de Quimica, 2011, 39(1-2): 75-83.
[17] Dash S, Jin C L, Lee O O, et al. Antibacterial and antilarval-settlement potential and metabolite profiles of novel sponge-associated marine bacteria[J]. Journal of Industrial Microbiology & Biotechnology, 2009, 36: 1047-1056.
[18] Lee O O, Lau S C K, Tsoi M M Y, et al.sp. nov., a novel member of the family Flavobacteriaceae, isolated from the marine sponge[J]. International Journal of Systematic and Evolutionary Microbiology, 2006, 56: 1795-1799.
[19] Lee O O, Tsoi M M Y, Li X C, et al.gen. nov., sp. nov., a novel halotolerant member of theisolated from the marine spongeat Friday Harbor, USA[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57: 1919-1924.
[20] Qian P Y, Xu Y, Fusetani N. Natural products as antifouling compounds: recent progress and future perspectives[J]. Biofouling, 2010, 26: 223-234.
[21] Kon-ya K, Shimidzu N, Miki W, et al. Indole derivatives as potent inhibitors of larval settlement by the barnacle,.[J]. Bioscience, Biotechnology and Biochemistry, 1994, 58: 2178-2181.
[22] 朱建生, 姜薇, 缪莉, 等. 海洋细菌中具有抗硅藻附着的活性成分[J]. 微生物学报, 2013, 53: 825-831.Zhu Jiansheng, Jiang Wei, Miao Li, et al. Anti-diatom compounds from marine bacterium.[J]. Acta Microbiologica Sinica, 2013, 53: 825- 831.
[23] 靳翠丽. 海绵附生微生物对底栖硅藻附着性能的影响[D]. 扬州: 扬州大学, 2015. Jin Cuili. The effects of marine sponge-associated microorganisms on the adhesion performance of benthic diatoms[D]. Yangzhou: Yangzhou University, 2015.
[24] Yang L H. Antifouling compounds from the marine spongeand its associated microbes[D]. Hong Kong: Hong Kong University of Science and Technology, 2006.
[25] Wen Z Y, Chen F. Continuous cultivation of the diatom Nitzschia laevis for eicosapentaenoic acid production: physiological study and process optimization[J]. Biotechnology, 2002, 18(1): 21-28.
[26] Liu H, Chen J, Deng Z W, et al. Secondary metabolites from marine derived fungus[J].Journal of Chinese Pharmaceutical Sciences, 2010, 19: 482-486.
[27] Adamczeski M, Reed A R, Crews P. New and known diketopiperazines from the Caribbean sponge,cf.[J].Journal of Natural Products, 1995 58(2): 201-208.
[28] 李益, 唐金山, 高昊, 等. 海洋放线菌sp.(No.69)抗MRSA活性成分研究[J]. 中国海洋药物杂志, 2010, 29(5): 16-21. Li Yi, Tang Jinshan, Gao Hao, et al. Study of anti- MRSA bioactive constituents from a marine actinomycetessp.(No.69)[J]. Chinese Journal of Marine Drugs, 2010, 29(5): 16-21.
[29] 朱建生. 海洋细菌中环二肽及其生物活性研究[D]. 扬州: 扬州大学, 2013. Zhu Jiansheng. The study of diketopiperazines from marine bacteriumand its biological activity[D]. Yangzhou: Yangzhou University, 2013.
[30] 刘涛, 李占林, 王宇, 等. 海洋细菌次级代谢产物的研究[J]. 中国海洋药物杂志, 2009, 28(5): 1-6. Liu Tao, Li Zhanlin, Wang Yu, et al. Studies on the secondary metabolites from the marine bacteria[J]. Chinese Journal of Marine Drugs, 2009, 28(5): 1-6.
[31] Shigemori H, Tenma M, Shimazaki K, et al. Three new metabolites from the marine yeast[J]. Journal of natural products, 1998, 61(5): 696-698.
[32] 周世宁, 林永成, 吴雄宇, 等. 海洋真菌与细菌发酵物中的环二肽[J]. 微生物学通报, 2002, 29(3): 59-62. Zhou Shining, Lin Yongcheng, Wu Xiongyu, et al. Cyclic dipertides from marine fungi and bacteria cultures[J]. Microbiology, 2002, 29(3): 59-62.
[33] Holden M T G, Chhabra S R, de Nys R, et al. Quorum-sensing cross talk: isolation and chemical characterization of cyclic dipeptides fromand other gram-negative bacteria[J]. Molecular Microbiology, 1999, 33: 1254-1266.
[34] 杨子娟, 向兰, 邢杰, 等. 环二肽的研究进展[J]. 现代药物与临床, 2009, 24(2): 73-81. Yang Zijuan, Xiang Lan, Xing Jie, et al. Research advances in cyclic dipeptides[J]. Modern Pharmacy and Clinic, 2009, 24(2): 73-81.
[35] 刘华珍, 王嶽. 微生物产生的酶抑制剂[J]. 抗生素, 1983(01): 49-63. Liu Huazhen, Wang Yue. Enzyme inhibitors from microorganisms[J]. Antibiotics, 1983(01): 49-63.
Isolation and identification of active compounds inhibiting diatom settlements using sponge-associatedsp.
WU Shan1, YU Si-yu1, JIANG Wei1, 2, ZHANG Li-kui1, 2, JIN Cui-li1, 2, ZHOU Xiao-jian1, 2
(1. College of Environmental Science & Engineering, Yangzhou University, Yangzhou 225127, China; 2. Marine Science & Technology Institute, Yangzhou University, Yangzhou 225127, China)Received:Oct. 10, 2015
antidiatom settlement;sp. ; UST050418-715; cyclic dipeptides
In order to search for natural antifouling compounds, the compounds inhibiting diatom settlements were purified from the metabolites of a sponge-associatedsp. UST050418-715 via purification of organic solvent extraction and semipreparative high-performance liquid chromatography (HPLC) using antidiatom- settlement assays. The structures of active compounds were analyzed via gas chromatography–mass spectroscopy (GC–MS) and1H nuclear magnetic resonance (NMR). Consequently, seven active cyclic dipeptides in addition to dozens of fractions were isolated and purified. The seven cyclic dipeptides were identified as (1) cyclo (L-leu-trans-8- hydroxy-L-pro), (2) cyclo (L-val-L-pro), (3) cyclo (D-pro-L-leu), (4) cyclo (L-pro-D-leu), (5) cyclo (gly-L-pro), (6)cyclo (L-phe-cis-8-hydroxy-D-pro), and (7) cyclo (L-phe-trans-8-hydroxy-L-pro). The results of this study indicate that multiple cyclic dipeptides exist in the metabolites of sponge-associatedsp. UST050418-715 and contribute to the host’s chemical defense.
P735
A
1000-3096(2016)07-0023-10
10.11759/hykx20151010003
2015-10-10;
2015-11-16;
国家自然科学基金资助项目(41306131, 41106113, 41271521); 教育部科学技术研究重点项目资助项目(211065); 江苏省自然科学基金项目(BK2012267, BK20130440); 江苏省教育厅高校自然科学基金资助项目(13KJB180029, 15KJB170020)
[Foundation: National Natural Science Foundation of China, No. 41306131, No. 41106113 and No. 41271521; Key Project of Chinese Ministry of Education, No. 211065; Natural Science Foundation Grant of Jiangsu Province, China, No. BK2012267 and No. BK20130440; Natural Science Foundation for College and University of Jiangsu Province, No. 13KJB180029 and No.15KJB170020]
吴珊, 山西晋中人, 硕士研究生, 研究方向: 环境科学, E-mail: 15298466716@163.com;周晓见,通信作者, 博士, 教授, E-mail: zhouxiaojian@yzu.edu.cn
(本文编辑: 康亦兼)

