改性干菌吸附去除染化废水中共存污染物活性蓝13及五氯酚的研究
钱勇兴, 李中坚, 杨 彬, 张兴旺, 雷乐成
改性干菌吸附去除染化废水中共存污染物活性蓝13及五氯酚的研究
钱勇兴, 李中坚, 杨 彬, 张兴旺, 雷乐成
(浙江大学工业生态与环境研究所, 浙江杭州 310027)
为了提高干菌吸附污染物的性能,分别用酸质子化处理的干菌(B.1)以及先去羧基后酸质子化处理的干菌(B.2)对共存污染物活性蓝13(RB13)和五氯酚(PCP)进行吸附去除。实验结果表明,pH值是影响吸附性能的主要因素,干菌在酸性条件下(pH=3)的污染物吸附能力要高于中性条件(pH=7)。中性条件下,干菌吸附污染物符合拟二级动力学模型及Langmuir吸附等温模型,B.2和B.1的最大单层饱和吸附量分别为38.02(RB13)、48.78 mg×g-1(PCP)和26.35(RB13)、33.90 mg×g-1(PCP);酸性条件下,干菌吸附RB13符合Langmuir吸附等温模型,而吸附PCP则是线性吸附模型。改性后的干菌强化了RB13及PCP的吸附去除,同时B.2较B.1和未改性干菌有更好的污染物去除效果。
生物吸附;改性干菌;持久性有机污染物(POPs);吸附机理
1 前 言
染化废水成分复杂,含有多种对环境有害的污染物。不仅可以阻止光在水中的透过性,从而抑制有害物质的光解及水生生物的光合作用,而且还能消耗水中的氧气或直接产生化学毒性,导致水生生物死亡[1,2]。活性蓝13作为一种典型的类POPs阴离子活性染料,具有生物难降解性及较强的生化毒性,在课题组的前期实验研究中被广泛的关注。五氯苯酚(PCP)则是一种公认的难降解有机物,其进入水体会被吸附于底泥或被生物富集,产生“三致效应”[3]。在以往的研究中,已经在水体及污泥沉积物中都检测到了PCP,且污泥中的量更大[4,5]。同时,在本课题组的前期实验中,也在某染化废水中检测到了PCP。共存污染物会进一步对菌产生毒害作用,从而更不利于生物降解污染物[6]。
与其它方法相比,吸附法由于吸附材料成本低、材料易得而且不受污染物的毒害,因此被广泛地用于工业难降解废水的处理中[7~9]。在吸附材料选择上,活性炭的优点是吸附效果好,但缺点是成本相对较高,且活性炭再生较困难[10,11]。其它吸附材料,如农业废弃物[12],稻壳[13]、海草纤维[14]、以及香蕉皮和桔子皮[15],虽然价格相对较低,但吸附效果却较差。相反,用微生物吸附污染物,如厌氧、好氧及活性污泥;菌类物质,如细菌、真菌以及酵母菌等不仅成本低,而且吸附效果好[16,17]。因此,在吸附重金属、染料以及难降解有机物方面都有较为广泛的应用。
在用微生物吸附污染物的过程中,研究者发现经过适当的方法对微生物进行改性,会很大程度提高吸附剂的吸附性能。化学改性方法包括酸、碱、乙醇以及丙酮处理等[18,19],处理方法与吸附剂吸附污染物的机理相关。酸处理法在很多以静电吸附作用占主导的吸附研究中效果较好。但许多研究者都关注于增加活性吸附点位来提高吸附量,而用减少抑制点位来提高吸附量的研究较少。如Rao等[18]在用不同的处理方法处理生物质时发现,经过硫酸处理的生物质在吸附去除酚类时,效果最好。其规律如下:硫酸处理 > 实验室清洁剂处理 > NaOH处理。Vijayaraghavan等[20]也发现用0.1 mol×L-1的HNO3处理生物后,其对活性黑5的吸附量比没改性前提高了1.3倍。经0.1 mol×L-1HCl处理后的海草生物质吸附活性黑5(53.8 mg×g-1)比未处理时(39.4 mg×g-1)要高[17]。同时,他们还发现当去除生物质中的抑制位后,生物质吸附活性黑5的吸附量从111.8 mg×g-1增加到了257.3 mg×g-1,提高了近2倍[19]。但对于两种方法的结合,几乎没人关注。因此,本文采用既减少抑制点位又增加活性点位的方法来进行干菌改性,预期达到更好的吸附去除效果。同时,生物吸附过程较为简单,而且大多数研究都是选择一种吸附剂,进行单组份污染物的吸附研究。包括动力学、等温模型以及吸附机理等的探讨,但对生物吸附共存污染物的关注较少。
基于此,本文采用从杭州市四堡污水处理厂的厌氧段中提取,并通过分离纯化和染料RB13长期驯化得到的假单胞菌属。将上述菌种制备成干菌及改性干菌,用于吸附废水中的污染物活性蓝13(RB13)和五氯苯酚(PCP),研究了不同影响因素及吸附特性,并分析了干菌吸附污染物的可能去除机制。
2 实验(材料和方法)
2.1 干菌及改性干菌的制备
干菌的制备:首先假单胞菌在2 L密封血清瓶中厌氧培养,接种量为体积比1/100。营养液组成如下:葡萄糖(500 mg×L-1)、NH4Cl(191 mg×L-1)、KH2PO4(15 mg×L-1)、 K2HPO4(10 mg×L-1)、 MgSO4(12.5 mg×L-1)、 FeSO4(12.5 mg×L-1)和磷酸缓冲液(6.8 g×L-1KH2PO4,1.135 g×L-1NaOH)以保证溶液的pH维持在7左右。血清瓶用铝盖密封并在菌体加入前通入N2。将血清瓶放入温度为33℃的恒温培养箱中培养24 h,以8000 r×min-1离心10 min,去上清液,将下层物质用去离子水洗涤数次,冷冻干燥24 h。再放入100℃烘箱中干燥2 h(使细菌失活),碾磨干菌,放入样品瓶中备用,定义为B;
改性干菌的制备(a):取1 g上述得到的干菌加入100 mL 0.1 mol×L-1H2SO4的溶液中质子化24 h,后用去离子水洗掉多余的酸(至溶液中的pH为中性为止),冷冻干燥24 h,碾磨干菌,放入样品瓶中备用,称其为B.1;
改性干菌的制备(b):取2 g干菌先加入130 mL无水甲醇,后加入1.2 mL浓盐酸,在转速为125 r×min-1的条件下反应6 h,去除干菌中所含有的羧基基团,然后将离心后得到的沉淀物用方法a进行质子化,再冷冻干燥24 h。碾磨干菌,放入样品瓶中备用,称其为B.2。
实验所用的干菌都进行碾磨,并过50目筛子。
2.2 PCP和RB13溶液的配制
称取1 g分析纯PCP固体溶解于1 L 0.1 mol×L-1NaOH溶液中,制得1 g×L-1的PCP标准储备液;5 g RB13溶解在1 L去离子水中制成5 g×L-1的RB13储备液。操作液用储备液进行适当稀释,同时用1 mol×L-1NaOH和1 mol×L-1HCl调节溶液pH值。
2.3 干菌的吸附实验
吸附实验在150 mL的具塞锥形瓶中进行。具体方法如下:称取一定量的干菌或改性干菌加到含有100 mL含有不同浓度污染物的锥形瓶中,并将锥形瓶放入温度控制在25℃,转速为200 r×min-1的振荡摇床,避光振荡。前期实验表明,吸附能在24 h内达到平衡,因此,后续实验确定吸附时间为24 h。用不投加干菌作为实验空白,以扣除实验过程中因挥发和玻璃器皿吸附对污染物所造成的损失。
2.4 干菌的脱附实验
为了揭示干菌吸附污染物的机理以及重生干菌,对吸附污染物的干菌进行了脱附实验。将吸附了污染物的干菌离心,去掉上清液,后用不同的洗脱剂洗脱,0.01 mol×L-1的NaOH溶液[17]、乙醇还有丙酮[21]。取一定量吸附了污染物的干菌加入到100 mL上述不同洗脱溶液中,避光在200 r×min-1和25 ℃的振荡摇床中再次振荡24 h。取样品在8000 r×min-1离心10 min,测定上清液中污染物的含量。
2.5 分析方法
将样品间歇从锥形瓶中取出,8000 r×min-1离心10 min后测定上清液中污染物的含量。对于RB13,采用紫外-可见分光光度计,而对于PCP,则采用高效液相色谱测定。用公式(1)计算被干菌吸附的污染物的量。

式中e是吸附平衡时吸附剂的污染物吸附量(mg×g-1),0和e分别是溶液中污染物的起始浓度和吸附平衡时的浓度(mg×L-1),是溶液体积(L),是吸附剂质量(g)。
吸附剂表面的官能团用红外光谱仪(FT-IR Nicolet 6700,America)表征。

图1 干菌处理前后的红外图谱
3 结果与讨论
3.1 干菌和改性干菌的红外表征
将得到的干菌进行红外光谱分析,考察其改性前后干菌表面基团的变化,结果如图1所示。干菌与改性干菌在4000~500 cm-1存在着明显的基团特征峰,如在3388~3420 cm-1处的较强吸收峰代表着干菌表面的羟基与氨基基团的拉伸振动,2928和2878 cm-1的峰则主要是由-CH2的对称振动引起,1392 cm-1处形成的峰则主要是由于C=O的拉伸振动[22],而在1658和 1545 cm-1产生的峰则是由于酰胺基-I和酰胺基-II基团拉伸振动的结果[16]。
通过比较B和B.1的红外谱图发现,除了1392.18和 2878.52 cm-1的峰基本没有改变外,其它的峰都出现了变化。而对比B.1和B.2则发现在3400.01 和 1392.20 cm-1处的峰发生了较小的偏移,分别移到了3428.04 和 1381.92 cm-1。这些变化都表明干菌表面的N-H和C=O基团发生了改变,N-H改变主要是由于B.1和B.2都发生了质子化反应,而C=O改变主要是由于B.2发生了去羧基的反应。于此同时,B.2在2878.52 cm-1处属于脂类物质产生的峰偏移到了2859.32 cm-1处,而B.1未发现改变,这说明脂类物质在去羧基过程中受到了无水甲醇的影响。
3.2 改性干菌在pH为中性条件下的吸附
溶液pH值会影响污染物在溶液中的存在形式,对于RB13,其在溶液中都以阴离子形式存在。而对于PCP,由于其值为4.75,当pH值为3时,98 %都以PCP分子形态存在,而当pH为8时则99.9 %的PCP都是以阴离子形态存在的[23]。在pH为中性的条件下,所选择的两种污染物RB13和PCP都以阴离子的形态存在[24]。
在前期实验中,发现未经改性的干菌在中性条件下(pH=7)对RB13及PCP的吸附去除率都很低,两者都低于5 %,因此在中性条件下主要考虑改性后的干菌对RB13及PCP的去除。

图2 干菌的投加量对污染物去除的影响
3.2.1 干菌的投加量对污染物吸附的影响
干菌投加量对污染物RB13及PCP吸附去除率的影响如图2所示,为确保吸附平衡,干菌吸附污染物时间定为24 h。随着投加量的增加,污染物去除率也随着增加,且用第二种方法(即两种方法结合)改性的干菌B.2的吸附去除污染物的效果较B.1要好。当干菌的投加量为1 g×L-1时,干菌B.2可完全去除污染物。因此后续实验干菌的投加量定为1 g×L-1。

图3 接触时间对干菌吸附去除RB13 与PCP 的影响
3.2.2 吸附动力学
吸附时间在吸附实验中是较为重要的参数,其直接反映了吸附剂的好坏。因为吸附时间短可以大大减少运行成本,从而可以在一定时间内增加其循环使用次数。改性干菌在吸附去除污染物时,干菌的投加量为1 g×L-1,RB13和PCP的初始浓度分别为100和10 m g×L-1。结果表明干菌吸附污染物过程相当迅速,10 min内就能较好的去除污染物,经过180 min吸附基本达到平衡(图3)。这说明改性干菌吸附污染物是快速吸附过程,这与Mathialagan等[23]在用菌吸附PCP和Yang等[16]在用菌吸附染料的研究中所得到的结果相吻合。Vijayaraghvan[25]将这种快速吸附归因于吸附剂表面存在着的空吸附位。他们认为,在起始阶段由于表面空吸附位丰富,活性黑5的去除率高,但随着空吸附位不断被占据,吸附能力不断下降,最终达到吸附平衡。同时,吸附在吸附位上的分子还会通过静电排斥力,使溶液中的分子更难吸附在吸附剂上。
为了分析改性干菌对污染物的吸附速率情况,分别用两种较为传统的简化动力学方程对实验数据进行拟合[26]。
拟一级动力学方程:
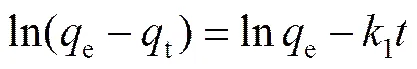
拟二级动力学方程:

式中,1(min-1)、2(g×mg×mol)-1分别为拟一级和拟二级反应速率常数,e和t分别代表平衡吸附量和时间时的瞬时吸附量(mg×g-1)。
将实验所得数据根据以上的方程的线性关系进行拟合,结果见表1。从表中的相关系数R2值以及计算值与实验值的关系对比发现,两种改性干菌都符合拟二级动力学,而不太符合拟一级动力学。拟二级动力学的相关系数R2> 0.99。通过拟二级动力学模型计算得到两种改性干菌吸附RB13的e值分别为15.24与18.73 mg×g-1,这与实验值的15.92和19.20 mg×g-1非常接近。对于干菌吸附PCP,两种改性干菌的q值都为9.8 mg×g-1,而实验值为10 mg×g-1,两者也相当接近。许多生物质吸附污染物的动力学研究都得到了相同的结论[13,17,27]。Aksu等人认为生物吸附染料主要是在生物表面完成,而生物表面上的吸附位则是生物吸附染料的限制性因素[28]。

表1 干菌吸附去除RB13与PCP的拟一级、拟二级吸附动力学参数
3.2.3 吸附等温线
在干菌吸附染料、重金属以及氯酚类污染物的研究中,Langmuir和Freundlich等温模型是最为常见的。Langmuir方程如(4)所示:
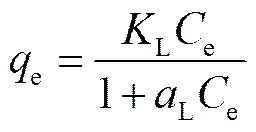
其线性方程为
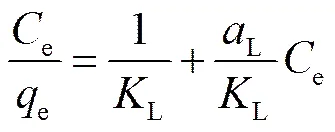
其吸附特征用分离因子L表示
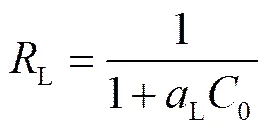
式中,L(L×g-1)为Langmuir等温吸附常数,L(L×mg-1)是与吸附力相关的Langmuir常数,L/L为饱和吸附容量,用0(mg×g-1)表示。L是分离因子,也叫平衡常数。
不同于Langmuir等温吸附模型,Freundlich等温吸附模型如方程(7)所示

其线性方程表述如下:

式中,e(mg×g-1) 是吸附达到平衡时吸附剂的吸附量,而e(mg×L-1)则是吸附达到平衡时吸附质的浓度。F(mg1-1/n·L1/n×g-1) 是 Freundlich等温模型常数,而(g×L-1) 则是吸附指数。

表2 干菌吸附RB13与PCP的Langmuir和Freundlich等温吸附常数
改性干菌吸附RB13和PCP的吸附等温线趋势分别如图4(a)和4(b)所示,先上升后趋于平缓,表现为非线性关系。因此将实验所得数据根据上述两种模型的线性关系进行拟合,结果见表2。从表中可以看出,Langmuir等温吸附模型在干菌吸附污染物实验中,线性相关系数RL2值都较高,都大于0.99,干菌B.2的0值在吸附RB13和PCP的过程中分别为38.91和48.78 mg×g-1,比B.1的0值(25.97和33.90 mg×g-1)要高。这表明干菌B.2吸附污染物的能力比B.1要强,说明去羧基后质子化比直接质子化能更好地吸附污染物。对于Freundlich等温模型,其RF2值在用两种干菌吸附RB13时都大于0.99,而在干菌吸附PCP时却都低于0.95。

图4 干菌吸附去除RB13(a)与PCP(b)的吸附等温线
在描述改性干菌吸附污染物RB13和PCP的过程中,单层吸附模型Langmuir更加接近实际吸附结果(根据线性相关系数R2),对于改性干菌B.2而言,理论单层饱和吸附量0值在吸附RB13和PCP的过程中分别为38.91和48.78 mg×g-1,这种较高的吸附能力主要与B.2中吸附抑制点位的去除与活性点位的增加有直接的关系,即羧基基团的减少与质子化氨基基团的增加[29]。
3.2.4 污染物之间的竞争吸附
在污染物共存的体系中,保持污染物PCP的浓度不变(初始浓度为10 mg×L-1),逐渐提高溶液中RB13的浓度,同时加入一定量的改性干菌进行实验。如图5所示,随着RB13的浓度由10 mg×L-1逐渐增加到140 mg×L-1,同时保持PCP的浓度都在10 mg×L-1,在RB13浓度较低时,PCP能达到100 %的去除,但随着RB13浓度的增加,PCP去除率减小,在RB13浓度增加到140 mg×L-1时,PCP的去除率降到了8 6 %以下。这表明污染物之间存在着竞争吸附,但这并不像Savvaidis等人在用菌在吸附金属离子时发现Cu离子比其它金属离子更易吸附在该菌上[30],Zhang等人[31]发现胞外聚合物吸附重金属的顺序是Pb > Ni > Cd。Otero等人[32]在共存污染物靛蓝胭脂红和苯酚共存的体系中,发现两种污染物之间存在着优先吸附现象。文章指出,尽管吸附量不大,但污泥吸附去除靛蓝胭脂红要优先于苯酚。在本实验中,并没有发现较为明显的干菌优先吸附现象,事实上,两种污染物在吸附过程中是被同时吸附去除的。

图5 中性pH=7 条件下污染物间的竞争吸附
3.3 改性干菌在pH为酸性条件下的吸附
前期的实验表明干菌在酸性条件下(pH=3)对RB13与PCP都有较为明显的吸附去除,且都符合拟二级动力学模型(不再赘述)。但干菌与改性干菌吸附RB13与PCP的吸附等温线与中性条件下有较大区别。如图6(a)和6(b)所示,对干菌吸附RB13的数据用Langmuir和Freundlich吸附等温模型表述(表3),根据两种模型的R2值可知,Langmuir的等温吸附模型都大于0.98,而Freundlich等温吸附模型仅大于0.83,说明与中性条件下相同,吸附更符合Langmuir等温吸附模型。酸性条件下B、B.1和B.2的理论单层饱和吸附量分别为74.63、93.46和112.36 mg×g-1。改性干菌在吸附RB13时都比未改性时有较为明显地提高,同时,值在酸性条件下比中性条件下要高,这可能与溶液中H+浓度的增加有关。
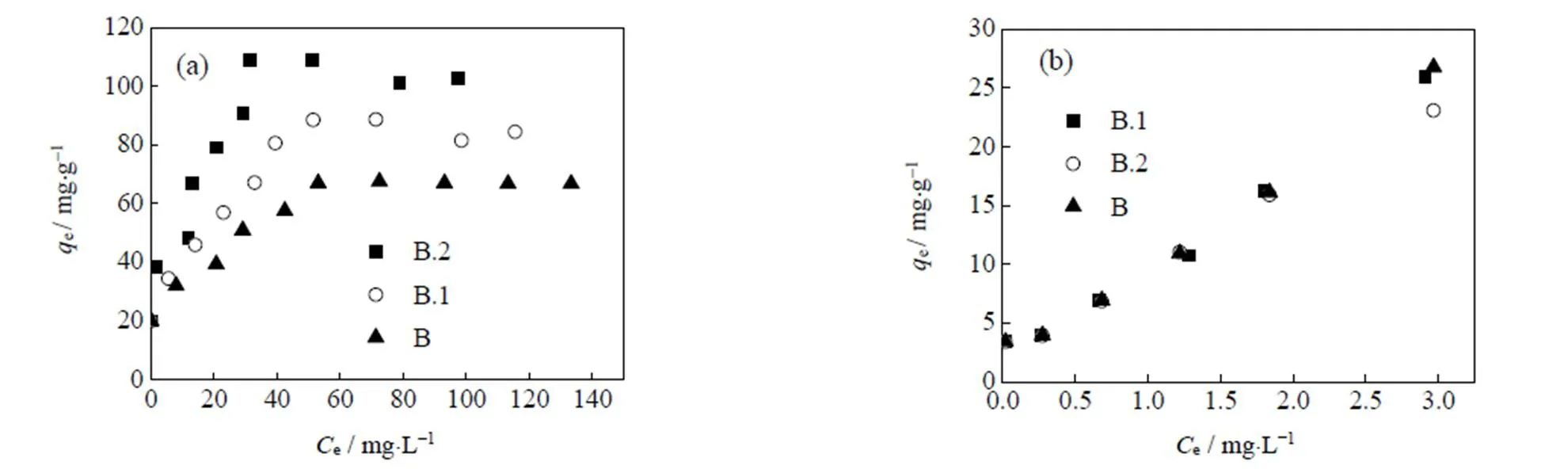
图6 pH=3条件下的干菌吸附去除RB13 (a)与PCP (b)的吸附等温线
干菌与改性干菌吸附五氯苯酚的等温吸附如图6(b)所示,平衡吸附量随着溶液平衡浓度呈线性增加,等温线可以用线性吸附模型[33]来表示:

式中e值为平衡吸附量(mg×g-1),e值为平衡浓度(mg×L-1),d值为吸附系数,可用来衡量吸附作用的大小,为常数。

表3 pH=3条件下干菌吸附RB13的Langmuir和Freundlich等温吸附常数
表4为实验数据经线性回归分析得到的参数,三种干菌的相关系数(R2)均大于0.99,表明三种干菌对PCP的等温吸附曲线符合线性等温吸附方程,吸附量与平衡浓度间呈线性正相关。d值越高表明越容易吸附,通过比较d值发现未改性干菌B与改性干菌B.1的d值较为接近,分别为8.08和7.98,而改性干菌B.2的d值就出现了降低,这可能与脂类物质在干菌去羧基的过程中被无水甲醇部分破坏有关。Chen等人[34]指出,脂类物质在PCP的吸附过程中有较为重要的作用,其能将PCP不可逆的吸附在含脂类物质的污泥中。
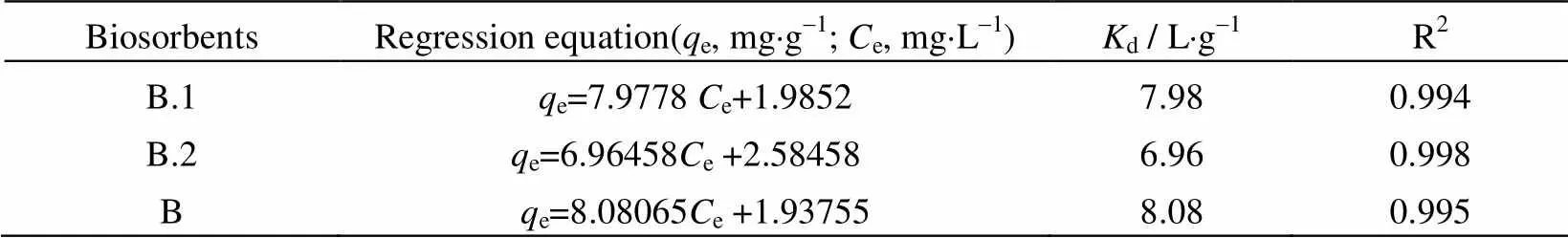
表4 pH=3条件下干菌吸附PCP的线性拟合参数
在酸性条件下,实验过程与中性条件下相同,PCP的去除率并没有随着RB13的增加而有所降低(图7)。事实上,RB13的增加对PCP的去除基本没有影响,两种改性干菌对PCP的去除率都达到了100 %(甚至将RB13初始浓度提高到400 mg×L-1)。这表明,在酸性条件下,RB13与PCP之间不存在竞争吸附。

图7 pH=3条件下污染物间的相互影响
3.4 吸附机理探讨
静电吸附作用普遍存在于生物吸附离子态污染物中,许多研究者都指出这种吸附机理在生物吸附染料[35]和金属离子[36]时占主导作用。
静电吸附方程可表述如下,首先是生物质的质子化过程表述:

在pH为7的中性条件下,活性蓝13和五氯酚在溶液中都是以离子态的形式存在,因此可以将其形式简化如下:

其与改性干菌上的基团的反应如下:

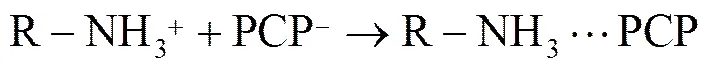
中性条件下改性干菌对污染物的吸附结果表明,静电吸附作用能很好地解释两种污染物共存时的竞争吸附现象。为了进一步揭示这一现象,实验使用相同摩尔浓度的RB13与PCP溶液,即混合溶液中RB13和PCP的摩尔浓度都为0.04 mol×L-1。实验结果如图8(a)所示,比较只有RB13的溶液和两者共存的溶液发现,两种干菌在单体系溶液中的对RB13的吸附量都比共存体系中干菌对RB13的吸附量要高,而且单体系下比共存体系下所多吸附的RB13量,两种改性干菌都是相同的。这就说明在共存体系中RB13吸附量的减少与PCP吸附量的增加有关。为了得到静电吸附的等式,做了以下假设:
1) 在干菌吸附污染物的过程中,静电吸附为主要的吸附力,其它的作用力忽略;
2) 同一种干菌在不同的体系中,单一污染物体系与共存污染物体系,其表面所带的质子摩尔数相同;
3) 尽管吸附过程是一个动态吸附过程,但在假设中不考虑污染物的吸附与脱附这一动态过程。
基于上述假设,得到的干菌在不同体系中吸附污染物的静电吸附等式如(14)所示。
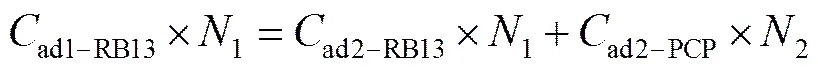
式中ad1-RB13表示在单RB13溶液体系中每克干菌吸附RB13的摩尔浓度(mmol×g-1),1为活性蓝13溶于水所电离出的阴离子数,而Cd2-RB13和ad2-PCP则分别表示在共存体系中干菌吸附的RB13的摩尔浓度与干菌吸附PCP的摩尔浓度(mmol×g-1),2为PCP溶于水所电离处的阴离子数。通过实验数据可得到以下的等式(RB13和PCP的相对分子质量分别为1003.7和266.5 g×mol-1)。式中被干菌吸附的污染物的摩尔浓度可以通过实验求得,PCP中2的值已知为1,从而可以通过等式求取1的值。
通过计算,干菌B.1和B.2所求得的1值分别为3.6和3.7,两者都接近4。这表明1 mol的RB13溶于水能产生将近4 mol的负电荷。从RB13的分子式中可以看到,其溶于水会游离出4 mol的Na离子,从而在染料分子上形成4 mol的负电荷。计算值与理论值较为接近,表明假设等式成立,这就表明,在干菌吸附污染物的实验中,静电吸附作用占主导作用。

图8 pH=7条件下的干菌对共存污染物的吸附去除(a);不同萃取剂条件下污染物脱附(b)
用洗脱剂对吸附剂进行洗脱,不仅可以使吸附剂能实现循环利用这一目的,同时也能在一定程度上揭示吸附剂吸附污染物的机理[27]。实验选择了3种不同的洗脱溶剂对在pH为3和7条件下吸附了污染物的干菌进行洗脱。结果如图8(b)所示,pH=7条件下吸附污染物的干菌,用0.01 mol×L-1NaOH能很好的洗脱吸附的污染物,无论是RB13还是PCP,其洗脱率都可以达到将近100%,而另外两种洗脱剂则洗脱效果很差。但对于pH=3条件下吸附污染物的干菌来说,却发生了一些变化。对于RB13而言,其洗脱效果和洗脱剂的关系与中性条件下相同,都是0.01 mol×L-1NaOH有效。但对于PCP而言,则是乙醇和丙酮洗脱效果要好于0.01 mol×L-1NaOH。
综上所述,不同pH值条件下,干菌吸附污染物的机理不同。干菌在pH=7条件下,干菌吸附活性蓝13和五氯酚主要是由于静电作用吸附,细菌表面的吸附位一定,因此,两种污染物之间存在竞争作用。当pH=3时,干菌吸附RB13仍然是静电作用为主,而对PCP则主要是由于分配作用,与干菌中所含的有机质脂类物质有关,因此,两种污染物之间不存在竞争作用。
4 结 论
(1) 通过改性后的生物干菌在中性和酸性条件下都能较未改性干菌能更好地去除共存体系中的RB13与PCP,而且先去羧基后质子化改性的干菌具有更好的吸附污染物效果;
(2) 吸附动力学及等温线表明改性干菌在pH=7的条件下,其吸附符合二级动力学模型以及Langmuir吸附等温模型。在中性条件下,两种干菌对RB13和PCP的最大单层饱和吸附量分别为38.91、48.78 mg×g-1(B.2)和25.97、33.90 mg×g-1(B.1);在酸性条件下,两种干菌对RB13的最大单层饱和吸附量分别为112.36 mg×g-1(B.2)和93.46 mg×g-1(B.1),比未改性干菌(74.63 mg×g-1)要高;
(3) 对吸附机理进行了探讨,在中性条件下由于RB13与PCP的吸附作用都是静电吸附,因此两者之间存在着竞争作用,其吸附量与所带的干菌所带的质子数有关,吸附1 mol RB13需要4 mol质子而吸附1 mol的PCP则只需1 mol质子。在酸性条件下,两种污染物之间不存在竞争作用,对于RB13仍是静电吸附为主,而对于PCP则是分配作用为主。
参考文献:
[1] Sadettin S, Donmez G. Bioaccumulation of reactive dyes by thermophilic cyanobacteria [J]. Process Biochemistry, 2006, 41(4): 836-841.
[2] Donmez G. Bioaccumulation of the reactive textile dyes by Candida tropicalis growing in molasses medium [J]. Enzyme and Microbial Technology, 2002, 30(3): 363-366.
[3] Wang J L, Qian Y, Nigel H,. Bioadsorption of pentachlorophenol (PCP) from aqueous solution by actived sludge biomass [J]. Bioresource Technology, 2000, 75(2): 157-161.
[4] Czaplicka M. Sources and transformations of chlorphenols in the natural environment [J]. Science of the Total Environment, 2004, 322(1-3): 21-39.
[5] Aksu Z. Application of biosorption for the removal of organic pollutants: a review [J]. Process Biochemistry, 2005, 40(20): 997-1026.
[6] Alvarez L H, Perez-Cruz M A, Rangel-Mendez J R,. Immobilized redox mediator on metal-oxides nanoparticles and its catalytic effect in a reductive decolorization [J]. Journal of Hazardous Materials, 2010, 184(1-3): 268-272.
[7] Escalona I, Fortuny A, Bengoa C,. Fenton couopled with nanofiltration for elimination of Bisphenol A [J]. Desalination, 2014, 345: 77-84.
[8] Kertesz S, Cakl J, Jirankova H. Submerged hollow fiber microfiltration as a part of hybrid photocatalytic process for dye wastewater treatment [J]. Desalination, 2014, 343: 106-112.
[9] Sharma P, Kaur H, Sharma M,. A review on applicability of naturally available adsorbents for the removal of hazardous dyes from aqueous waste [J]. Environmental Monitoring and Assessment, 2011, 183(1): 151-195.
[10] Belala Z, Jeguirim M, Belhachemi M,. Biosorption of basic dye from aqueous solutions by date stones and palm-trees waste: kinetic, equilibrium and thermodynamic studies [J]. Desalination, 2011, 271(1-3): 80-87.
[11] WANG Guang-jian (王广建), ZHANG Jian-kang (张健康), YANG Zhi-jian (杨志坚),. Preparation of activated carbon loaded copper adsorbent for removal of thiophene (活性炭负载铜吸附剂的制备与脱除噻吩的研究) [J]. Journal of Chemical Engineering of Chinese Universities (高校化学工程学报), 2014,28(1): 165-170.
[12] MA Chun-fang (马春芳), SHI Yang (时洋), LIU Jian-ping (刘建平),. Adsorption of Pb2+Ion with sulfuric acid modified Glycyrrhiza residue (硫酸改性甘草废渣生物吸附剂对Pb2+离子的吸附) [J]. Journal of Chemical Engineering of Chinese Universities (高校化学工程学报), 2015, 29(3): 716-723.
[13] Vadibelan V, Kumar K V. Equilibrium, kinetics, mechanism, and process design for the sorption of methylene blue onto rice husk [J]. Journal of Colloid and Interface Science, 2005, 286(1): 90-100.
[14] Ncibi M C, Mahioub B, Seffen M. Kinetic and equilibrium studies of methylene blue biosorption by(L.) fibres [J]. Journal of Hazardous Materials, 2007, 139(2): 280-285.
[15] Annadurai G, Juang R S, Lee D J. Use of cellulose-based wastes for adsorption of dyes from aqueous solutions [J]. Journal of Hazardous Materials, 2002, 92(3): 263-274.
[16] Yang Y Y, Jin D F, Wang G,. Biosorption of acid blue 25 by unmodified and CPC-modified biomass of Penicillium YW01: kinetic study,equilibrium isotherm and FT-IR analysis [J]. Colloids and Surfaces B: Biointerfaces, 2011, 88(1): 521-526.
[17] Vijayaraghavan K, Yun Y S. Biosorption of C.I. Reactive Black 5 from aqueous solution using acid-treated biomass of brown seaweed[J]. Dyes and Pigments, 2008, 76(3): 726-732.
[18] Rao J R, Viraraghavan T. Biosorption of phenol from an aqueous solution by Aspergillus niger biomass [J]. Bioresource Technology, 2002, 85(2): 165-171.
[19] Vijayaraghavan K, Yun Y S. Chemical modification and immobilization of corynebacterium glutamicum for biosorption of reactive black 5 from aqueous solution [J]. Industrial and Engineering Chemistry Research, 2007, 46(2): 608-617.
[20] Vijayaraghavan K, Yun Y S. Utilization of fermentation waste () for biosorption of reactive black 5 from aqueous solution [J]. Journal of Hazardous Materials, 2007, 141(1): 45-52.
[21] Binupriya A R, Sathishkumar M, Ku C S,. Sequestration of Reactive Blue 4 by free and immobilizedcells and its extrcellular polysaccharides [J]. Colloids and Surfaces B: Biointerfaces, 2010, 76(1): 179-185.
[22] Gao J F, Zhang Q, Wang J H,. Contributions of functional groups and extracellular polymeric substances on the biosorption of dyes by aerobic granules [J]. Bioresource Technology, 2011, 102(2): 805-813.
[23] Mathialagan T, Viraraghavan T. Biosorption of pentachlorophenol from aqueous solutions by a fungal biomass [J]. Bioresource Technology, 2009, 100(2): 549-558.
[24] Aksu Z, Yener J. A comparative adsorption/biosorption study of mono-chlorinated phenols onto various sorbents [J]. Waste Management, 2001, 21(8): 695-702.
[25] Vijayaraghavan K, Han M H, Choi S B,. Bisorption of Reactive Black 5 by Corynebacterium glutamicum biomass immobilized in alginate and polysulfone matrices [J]. Chemosphere, 2007, 68(10): 1838-1845.
[26] Ho Y S, Ng J C Y, Mckay G. Kinetics of pollutants sorption by biosorbents: review [J]. Separation and Purification Methods, 2000, 29(2):189-232.
[27] Binupriya A R, Sathishkumar M, Kavitha D,. Experimental and isothermal studies on sorption of congo red by modified mycelial biomass of wood-rotting fungus [J]. Clean, 2007, 35(2): 143-150.
[28] Aksu Z, Donmez G. A comparative study on the biosorption characteristics of some yeasts for Remazol Blue reactive dye [J]. Chemosphere, 2003, 50(8): 1075-1083.
[29] Farah J Y, EI-Gendy N S, Farahat L A. Biosorption of astrazone blue basic dye from an aqueous solution using dried biomass of baker’s yeast [J]. Journal of Hazardous Materials, 2007, 148(1-2): 402-408.
[30] Savvaidis I, Hughes M N, Poole R K. Differential pulse polarography: a method for the direct study of biosorption of metal ions by live bacteria from mixed metal solution [J]. Antonie van Leeuwenhoek Journal of Microbiology, 2003, 84(2): 99-107.
[31] Zhang D Y, Wang J L, Pan X L. Cadmium sorption by EPSs produced by anaerobic sludge under sulfate-reducing conditions [J]. Journal of Hazardous Materials, 2006, 138(3): 589-593.
[32] Otero M, Rozada F, Calvo L F, Garcia A I,. Elimination of organic water pollutants using adsorbents obtained from sewage sludge [J]. Dyes and pigments, 2003, 57(1): 55-65.
[33] Changchaivong S, Khaodhiar S. Adsorption of naphtahlene and phenanthrene on dodecylpyrinium-modified bentonite [J]. Applied Clay Science, 2009, 43(3-4): 317-321.
[34] Chen Y X, Chen H L, Xu Y T,. Irreversible sorption of pentachlorophenol to sediments: experimental observations [J]. Environment International, 2004, 30(1): 31-37.
[35] Maurya N S, Mittal A K, Cornel P,. Biosorption of dyes using dead macro fungi: effect of dye structure, ionic strength and pH [J]. Bioresource Technology, 2006, 97(3): 512-521.
[36] Goksungur Y, Uren S, Guvenc U. Biosorption of cadmium and lead ions by ethanol treated waste baker’s yeast biomass [J]. Bioresource Technology, 2005, 96(1): 103-109.
Biosorption of Reactive Blue 13 and Pentachlorophenol from Dye Wastewater Using Treatedsp. Bacteria
QIAN Yong-xing, LI Zhong-jian, YANG Bin, ZHANG Xing-wang, LEI Le-cheng
(Industrial Ecology and Environment Research Institute, Zhejiang University, Hangzhou 310027, China)
In order to enhance adsorption performance of dried bacteria biosorbents, an acid treated dried bacteria (B.1) and a dried bacteria treated with carboxyl-removal followed by protonation (B.2) were used to treat Reactive Blue 13 (RB13) and Pentachlorophenol (PCP) co-existed wastewater. The results indicate that pH is the main factor, and biosorption capacities under acidic condition (pH=3) are higher than that under neutral conditions (pH=7). Both biosorbents follow the pseudo-second order and the Langmuir isotherm models during adsorption. The maximum monolayer biosorption capacity of RB13 (PCP) is 38.02 (48.78) mg×g-1for B.2 and 26.35 (33.90) mg×g-1for B.1 under neutral conditions. However, the adsorption processes follow the Langmuir isotherm model for RB13, but a linear model for PCP under acidic conditions. Both biosorbents show improved biosorption of RB13 and PCP from aqueous solutions, and B.2shows better performance than B.1.
biosorption; treatment bacteria; persistent organic pollutants (POPs); adsorption mechanism
1003-9015(2016)05-1203-10
http://www.cnki.net/kcms/detail/33.1141.TQ.20160617.1543.002.html
X789
A
10.3969/j.issn.1003-9015.2016.00.021
2015-10-20;
2015-12-28。网络出版时间:2016-06-17 15:43:29
国家自然科学基金(21276231,21376216)。
钱勇兴(1985-),男,浙江淳安人,浙江大学博士生。通讯联系人:张兴旺,E-mail:xwzhang@zju.edu.cn

