土壤微生物对紫茎泽兰生长与竞争的反馈:不同灭菌方法的比较*
梁作盼 李立青,2 万方浩 刘万学**
土壤微生物对紫茎泽兰生长与竞争的反馈:不同灭菌方法的比较*
梁作盼1李立青1,2万方浩1刘万学1**
(1. 中国农业科学院植物保护研究所/植物病虫害生物学国家重点实验室 北京 100193; 2. 贵州大学生命科学学院 贵阳 550025)
土壤微生物去除是验证土壤微生物反馈调节入侵植物竞争排斥本地植物群落的重要手段。为了确定土壤微生物反馈效应的最佳土壤微生物去除方法, 以及土壤微生物对紫茎泽兰与本地植物竞争中的反馈作用, 本试验比较了添加蛭石和未添加蛭石下, 3种常见土壤微生物灭菌方式(干热灭菌、湿热灭菌、辐照灭菌)处理的紫茎泽兰单优群落根际土壤对紫茎泽兰与本地植物香茶菜生长的影响。结果表明: 与未灭菌处理土壤相比, 3种灭菌处理土壤均显著抑制了紫茎泽兰和香茶菜的生长; 添加蛭石灭菌的土壤相对于未添加蛭石的灭菌土壤显著促进了2种植物的生长; 灭菌土壤添加蛭石的情况下辐照灭菌土壤的两种植物的生物量显著地高于干热灭菌和湿热灭菌土壤两种植物的生物量, 其中辐照灭菌下紫茎泽兰的生物量分别比干热灭菌和湿热灭菌条件下增加30.8%和66.5%, 香茶菜生物量分别显著增加109.5%和63.4%。辐照灭菌土壤添加蛭石的处理方式最接近真实地反映土壤微生物对植物生长的反馈效应。进一步进行辐照灭菌土壤添加蛭石处理与未灭菌土壤添加蛭石处理的紫茎泽兰与香茶菜混种的盆栽试验, 结果显示, 土壤微生物显著增强了紫茎泽兰对香茶菜的竞争优势, 相对竞争优势度增加16.0%, 说明土壤微生物在紫茎泽兰竞争排斥本地植物的入侵过程中具有正反馈偏利调节作用
入侵植物 紫茎泽兰 土壤微生物 灭菌方法 反馈作用
土壤微生物群落作为植物地下生态系统的重要生物因子, 在生态系统中组成了一个强大的动力资源库。大量研究已表明, 生态系统的地上和地下部分紧密联系、互为依存; 植物与土壤微生物群落的互作可以决定植物群落的竞争演替方向和进程[1-4]。外来入侵植物一旦在入侵地成功定殖, 就可通过种群竞争性扩张而迅速形成单优群落, 不仅造成入侵地生境地上植物群落结构改变和生物多样性丧失, 而且对地下土壤微生物群落和功能产生深远的影响[5-6],这一生态过程和生态系统深层次的变化也必然会反过来直接或间接地影响外来入侵植物与本地植物的竞争[4]。因此, 外来植物与入侵地土壤微生物互作及其在促进入侵植物竞争替代本地植物的作用, 成为近年来国际上备受关注的焦点和研究热点[7-14]。
为了验证土壤微生物对植物群落竞争演替的影响, 设置土壤微生物对植物生长与竞争的反馈效应试验时(如温室盆栽试验), 其中常见的重要手段是通过特定的方法去除土壤微生物以进行比较研究, 即带菌土壤与无菌土壤种植的植物生长情况相比较,才能真正反映土壤微生物对植物的反馈作用。在对土壤进行灭菌的过程中, 最理想的方法是灭杀了所有微生物且不改变土壤理化性质[15]。迄今为止, 去除土壤微生物的主要方法有高温干热灭菌法[16-17]、高压蒸气湿热灭菌法[10,18]、γ射线的辐照灭菌法[18-20]和化学熏蒸法[16,18]等。显然, 不同土壤微生物去除方法会影响土壤微生物反馈的实际强度[19], 从而形成研究结果或结论的差异, 但鲜有研究比较土壤微生物的不同去除方法的优劣。
我国是外来生物入侵最为严重的国家之一, 其中入侵植物种类占51%[21]。紫茎泽兰[(Sprengel) R. King & H. Robinson] (Synonym:Sprengel)是我国危害最严重的外来入侵植物之一, 也是世界性入侵杂草[21-23]; 现已在我国云南、贵州、四川、重庆、广西等地区广泛分布, 并正向东和向北继续迅速扩散[24-25]。紫茎泽兰可迅速竞争排挤当地植物形成单种优势群落, 不仅严重降低了入侵地的生物多样性, 导致生态系统功能退化, 而且对入侵地的农、林、畜牧业生产造成了严重经济损失[22-23,26]。前期的研究已经发现, 土壤微生物在紫茎泽兰的竞争扩张中具有重要作用[27-37]。本研究目的是以紫茎泽兰入侵土壤作为案例, 一是比较研究3种常见土壤微生物去除方法(干热灭菌法、湿热灭菌法、辐照灭菌法)对植物生长的影响, 为相关研究的微生物去除方法的采用提供借鉴; 同时, 进一步解析土壤微生物在紫茎泽兰竞争排斥本地植物的入侵扩张中的作用。为进一步了解紫茎泽兰在入侵地的种群建立和扩张的微生物学机制提供理论依据, 为研究紫茎泽兰的控制策略和紫茎泽兰入侵生境的生态修复奠定基础, 同时对其他外来入侵植物的研究也具有重要的参考价值。
1 材料与方法
1.1 紫茎泽兰土壤的采集
紫茎泽兰单优群落土壤采集样地位于云南省玉溪市澄江县麒麟桥附近的山谷带(24°42′N, 102°52′E),海拔1 840~1 873 m, 年平均降水量869 mm。该地区为中亚热带、北亚热带、南温带和中温带4个气候类型的气候, 土壤类型属于南方红壤, 是滇中地区主要的土壤类型, 是紫茎泽兰最适生长区和严重发生的区域。
于2013年9月上旬, 参照Niu等[28]和肖博等[35]的土壤采集方法, 在上述区域的紫茎泽兰单优群落中进行20点取样。于采样区选定20个条件较为均一的样点, 每样点面积约3 m×3 m, 样点间相隔约10 m。去除采样点地表杂草和枯枝落叶后, 取0~10 cm的表土; 每个样点取土约4 L。将所有土壤过20目筛, 充分混合后作为植物盆栽的基质土壤备用。
1.2 温室盆栽反馈试验
1.2.1 供试植物
紫茎泽兰种子和本地植物香茶菜[(Benth.) Hara]种子均取自云南省澄江县, 香茶菜为紫茎泽兰发生区常见伴生植物。
1.2.2 盆栽土壤的处理设置
设置为8种紫茎泽兰土壤的处理方式, 分别为: 不灭菌处理、干热灭菌处理、湿热灭菌处理、辐照灭菌处理; 不灭菌添加蛭石处理、干热灭菌添加蛭石处理、湿热灭菌添加蛭石处理、辐照灭菌添加蛭石处理。后4种处理即添加灭菌蛭石的目的是考虑到土壤灭菌可能会对土壤理化特性(尤其是土壤通透性)产生影响, 从而影响土壤微生物反馈效应的实际强度。不灭菌处理即土壤不作任何处理, 视为含有土壤微生物的对照处理; 干热灭菌处理参考Trevors[16]方法, 将土壤分装于托盘后置于烘箱中, 于180 ℃下加热4 h, 其间2 h后用洁净的铁铲翻土一次; 湿热灭菌处理参考Callaway等[10]的方法, 将土壤装入布袋后置于高压蒸汽灭菌锅, 在121 ℃、0.105 MPa条件下湿热灭菌3次, 每次30 min, 间隔时间为24 h; 辐照灭菌处理参考Berns等[20]的方法, 将土壤装袋置于BFT-Ⅱ型60Co-γ辐照装置中, 辐照源为60 Co-γ射线, 辐照剂量为36 kGy (4 kGy∙h-1, 持续9 h)。添加蛭石的4种处理为前4种处理的土壤分别与辐照灭菌蛭石充分混合; 蛭石添加量为土壤︰蛭石(质量比)=9︰1。
1.2.3 盆栽试验设计
为了验证土壤微生物及灭菌方式对植物生长的反馈效应以及对紫茎泽兰与本地植物竞争效应的影响, 温室盆栽分别设置紫茎泽兰与香茶菜分别单种和二者混种2类盆栽类型。每处理均重复10个。
植物单种设置, 即将上述8种处理土壤分别盆栽种植紫茎泽兰和香茶菜。紫茎泽兰单种, 于盆栽试验开始前1个月进行紫茎泽兰种子播种育苗, 播种前以3% H2O2溶液浸泡紫茎泽兰种子3 min, 用无菌水冲洗3次后播种于经湿热灭菌的河沙中, 适时浇水, 保证光照适度, 待苗高3 cm左右时按每盆1株移栽入盆钵(直径12 cm, 高10 cm, 下同)中央区域。香茶菜单种, 将消毒后的香茶菜种子按每盆5粒均匀撒播于盆钵中央区域, 然后覆盖对应处理的薄土一层, 出苗后不连续间苗至每盆1株。
基于前期的预备试验, 采用不灭菌土壤添加蛭石和辐照土壤灭菌添加蛭石的2种土壤处理方式分别混合种植紫茎泽兰与香茶菜。即在盆钵直径并离钵边1/3的位置栽植1株紫茎泽兰幼苗, 再在紫茎泽兰相对离钵边1/3的位置均匀撒播5粒香茶菜种子(出苗后不连续间苗至每盆1株香茶菜)。紫茎泽兰单种、香茶菜单种以及紫茎泽兰与香茶菜混种一共18个种植处理。
上述各盆栽处理在温室内随机摆放。植物生长期内温室温度在25 ℃左右, 光周期14 L︰10 D, 根据植物生长情况浇水, 植物生长3个月后收获。
1.2.4 测定指标及测定方法
土壤理化性质: 为了明确土壤灭菌方式对土壤理化特性的影响, 分别测定了用于盆栽试验的4种处理(不灭菌、干热灭菌、湿热灭菌与辐照灭菌)的土壤理化指标。土壤pH用电极法(WTWpH340)测定, 土壤悬浊液为水土比1︰2.5(质量比); 土壤有机碳用重铬酸钾法测定; 土壤全氮采用凯氏定氮法测定; 土壤硝态氮含量采用硫酸铜澄清-紫外分光光度法; 铵态氮含量采用氯化钾浸提-靛蓝吸光光度法, 用流动分析仪(Zellwegger Analytical Milwaukee WI)测定; 全磷采用氢氧化钠熔融-钼锑抗比色法; 土壤速效磷含量采用碳酸氢钠浸提-钼锑抗比色法; 全钾采用氢氧化钠熔融-火焰光度法; 土壤速效钾含量采用醋酸铵浸提-火焰光度法。每个处理随机选取3个重复。
植株生物量: 植株生长3个月后, 分别完整取出盆钵中植物, 洗净泥土, 置于烘箱70 ℃烘干72 h直至恒重后称重。混合种植处理的紫茎泽兰和香茶菜的生物量分开测定。为了获得紫茎泽兰对本地植物香茶菜的竞争强度, 用紫茎泽兰的相对竞争优势度(%)来表示紫茎泽兰的竞争力, 计算公式[38]:
紫茎泽兰竞争相对优势度=紫茎泽兰生物量/两种植物总生物量×100%(1)
1.3 数据统计分析方法
紫茎泽兰相对竞争优势度采用单因子方差分析(one-way ANOVA), 微生物不同去除方法的土壤养分含量比较采用单因子多重比较方差分析(one-way ANOVA: Fisher LSD test), 微生物不同去除方式以及有无蛭石的各个处理紫茎泽兰、香茶菜的生物量比较采用双因子多重比较方差分析(two-way ANOVA: Fisher LSD test)。统计分析软件为SAS10.0(Inc. Chicago USA)。
2 结果与分析
2.1 土壤不同灭菌方法下土壤理化性质的比较
不同灭菌方式对土壤理化特性有一定影响, 湿热灭菌的影响最大, 干热灭菌次之, 而辐照灭菌的影响最小(表1)。与未灭菌土壤相比, 干热灭菌的土壤pH和速效钾含量显著性降低, 分别降低4.5%和11.5%; 湿热灭菌的土壤总氮、总钾、硝态氮、铵态氮、速效钾的含量显著降低, 分别降低9.7%、2.6%、7.1%、18.7%和20.1%; 辐照灭菌的土壤仅是总氮含量显著降低, 降低9.7%。4种土壤处理中, 干热灭菌的土壤pH最低, 显著低于其他3个处理; 干热处理的土壤速效钾含量相对于土壤未灭菌处理、辐照灭菌的土壤显著降低, 相对于湿热灭菌的土壤显著增加; 湿热灭菌的土壤总钾、硝态氮和铵态氮在4个处理间含量最低, 相对于未灭菌、干热灭菌的土壤显著降低, 但与辐照灭菌的土壤无显著差异, 湿热灭菌的土壤速效钾显著低于其他3个处理; 有机碳、总磷、速效磷在4种土壤处理间无显著差异。
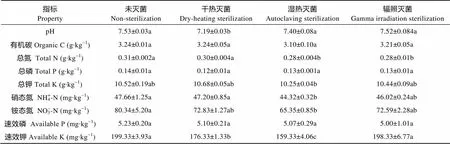
表1 不同土壤灭菌方法对土壤理化性质的影响
同行数据中不同字母表示不同灭菌方式之间在5%水平上差异显著, 下同。Different letters in the same line indicate significant differences among different sterilization methods at 0.05 level (Fisher’s LSD test). The same below.
2.2 土壤不同灭菌方法、蛭石添加对紫茎泽兰和香茶菜生物量的影响
紫茎泽兰单优群落土壤无论是不添加蛭石还是添加蛭石, 3种灭菌方式(干热灭菌、湿热灭菌、辐照灭菌)均显著降低入侵植物紫茎泽兰和本地植物香茶菜的生物量, 但3种灭菌方式之间对紫茎泽兰和香茶菜生物量的影响存在种间差异和是否添加蛭石的影响(图1)。
SNS: 未灭菌; SDS: 干热灭菌; SAS: 湿热灭菌; SIS:辐照灭菌。不同大写字母表示相同的蛭石因子下灭菌方式之间在5%水平上差异显著; 不同小写字母表示相同的土壤灭菌处理下添加蛭石与未添加蛭石之间在5%水平上差异显著(Two-way ANOVA, Fisher’s LSD test)。SNS: non-sterilized soil; SDS: soil subjected to dry-heating sterilization; SAS: soil subjected to autoclaving sterilization; SIS: soil subjected to gamma irradiation sterilization; SAV: soil plus vermiculite; SNV: soil without vermiculite. Different capital letters indicate significant differences among soil sterilization methods with the same vermiculite addition treatment at 0.05 level (Fisher’s LSD test). Different lowercase letters indicate significant differences between adding vermiculite and none-adding vermiculite for the same soil sterilization method at 0.05 level (Fisher’s LSD test).
紫茎泽兰单种时(图1a), 未添加蛭石的紫茎泽兰土壤经干热灭菌、湿热灭菌、辐照灭菌后紫茎泽兰生物量比未灭菌土壤分别显著降低98.9%、99.1%和97.8%; 添加蛭石的土壤经干热灭菌、湿热灭菌、辐照灭菌后紫茎泽兰的生物量相对于未灭菌添加蛭石的土壤处理分别显著降低84.8%、80.7%和74.7%。在未添加蛭石的紫茎泽兰土壤中, 3种灭菌方式之间的紫茎泽兰生物量没有显著差异; 而在添加蛭石的土壤中, 3种灭菌方式之间的紫茎泽兰生物量有显著差异, 辐照灭菌处理土壤的紫茎泽兰生长最好, 分别比干热灭菌、湿热灭菌显著增加30.8%和66.5%, 湿热灭菌次之, 比干热灭菌增加27.3%。
香茶菜单种时(图1b), 未添加蛭石的紫茎泽兰土壤经3种方法灭菌后, 香茶菜在种植后1个月相继死亡; 添加蛭石的土壤经干热灭菌、湿热灭菌、辐照灭菌后, 香茶菜生物量相比于添加蛭石的未灭菌土壤处理分别显著降低81.2%、75.9%和60.7%。在添加蛭石的土壤中, 3种灭菌方式对香茶菜生物量有显著影响, 辐照灭菌处理的香茶菜生长最好, 分别比干热灭菌、湿热灭菌显著增加109.5%和63.4%, 香茶菜生物量在湿热灭菌土壤虽然比干热灭菌土壤增加28.2%, 但没有显著差异。
从4种灭菌方法处理的土壤是否添加蛭石的结果比较来看(图1), 在未灭菌土壤中, 是否添加蛭石对紫茎泽兰和香茶菜生物量均无显著影响; 而在3种灭菌处理土壤中, 添加蛭石分别显著提高了紫茎泽兰和香茶菜的生物量, 经干热灭菌、湿热灭菌和辐照灭菌后添加蛭石土壤的紫茎泽兰生物量比未添加蛭石的土壤分别显著增加12.9倍、20.1倍和10.5倍, 香茶菜在未添加蛭石的3种灭菌土壤中相继死亡, 但在添加蛭石的3种灭菌土壤中则缓慢生长。
土壤不同灭菌方式和是否添加蛭石间存在显著的交互作用(紫茎泽兰:=3.59,=3,=0.001 5; 香茶菜:=4.59,=3,=0.005 6), 交互作用对紫茎泽兰和香茶菜的生物量产生显著影响(表2)。
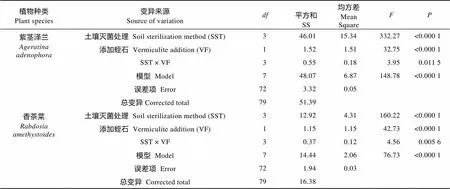
表2 土壤不同灭菌方式和是否添加蛭石以及两者交互作用对紫茎泽兰、香茶菜生物量影响的方差分析
2.3 土壤微生物对紫茎泽兰与香茶菜竞争的影响
未灭菌添加蛭石的土壤处理和辐照灭菌添加蛭石的土壤处理之间紫茎泽兰相对竞争优势度具有显著性差异(=7.31,=1,=0.014 5), 辐照灭菌添加蛭石的土壤处理的紫茎泽兰相对竞争优势度为52.54%, 未灭菌添加蛭石的土壤处理(对照组)紫茎泽兰相对竞争优势度为60.94%, 未灭菌添加蛭石的土壤处理比辐照灭菌添加蛭石的土壤处理紫茎泽兰相对竞争优势度增加了16.0%(图2), 表明土壤灭菌后降低了紫茎泽兰的竞争优势度。
SNSAV: 未灭菌土壤添加蛭石; SISAV: 辐照灭菌添加蛭石。不同字母表示5%水平差异显著(Fisher’s LSD test). SNSAV: non-sterilized soil plus vermiculite; SISAV: soil subjected to gamma irradiation sterilization plus vermiculite. Different letters indicate significant difference at the 0.05 level (Fisher’s LSD test).
3 讨论
大量的研究业已证实, 土壤微生物在调节和促进外来入侵植物对本地植物的群落竞争演替中具有重要的作用[10,39-43], 土壤微生物的去除以及去除后添加特定微生物是验证土壤微生物反馈作用的重要研究手段[44-46]。本文的结果显示, 土壤微生物对紫茎泽兰与本地植物香菜的生长均具有显著的正反馈效应, 且土壤微生物有助于增强紫茎泽兰对本地植物的竞争优势, 这也与前人的结果一致[27-28,35], 从而进一步说明了土壤微生物在促进紫茎泽兰的竞争性入侵扩张中具有重要作用。
国际上, 验证土壤微生物总体反馈效应的土壤微生物去除方式有干热灭菌、湿热灭菌、辐照灭菌和化学熏蒸等, 其中湿热灭菌由于操作简单、成本较低而被广泛应用, 其次为辐照灭菌。本文的结果显示, 不同的灭菌方式对植物的生长产生显著影响, 以辐照灭菌的方式为最佳, 干热灭菌不可取。一方面, 可能由于灭菌降低土壤营养有关, 如干热处理降低速效钾含量, 湿热处理降低可利用氮含量和速效钾, 但辐照灭菌对可利用肥力无显著性影响。前人发现, 湿热高压灭菌可改变土壤理化性质[47], 包括降低土壤pH和土壤团聚体、增加可溶性离子锰含量、降低铁含量、产生有毒的有机物等[16]; 也有报道, γ射线灭菌法也会改变土壤的理化性质, 例如硝态氮与铵态氮的比例[48]; McNamara等[19]通过对ISI (Institute for Scientific Information)数据库涉及辐照灭菌和高压灭菌的试验结果比较后认为, 高压灭菌方法对理化性质和生物活性影响较大, γ射线灭菌法对土壤和土壤有机质影响较小; Berns等[20]研究发现γ射线灭菌法对土壤的理化性质和生物活性影响相对于高温灭菌方式具有较小的影响。另一方面, 可能主要与不同灭菌方式改变土壤的物理特性有关, 干热易造成土壤颗粒干化[16], 湿热灭菌增加了土壤的紧密度[20,48-49], 而辐照灭菌则影响小[19,47,50]。如Smith等[51]通过将高温灭菌和没有处理过的土壤混合之后与没有处理的土壤进行比较, 发现高温灭菌土壤对植物生长以及菌根真菌侵染有显著性影响。本文结果显示, 土壤灭菌后添加蛭石的土壤植物生物量显著大于灭菌土壤未添加蛭石的处理, 这可能主要是因为添加蛭石提高土壤的疏松程度和通透性, 从而有利于植物的生长。
由于灭菌方式影响植物的生长或生物量, 因此不合适的土壤微生物去除方式(如干热灭菌、湿热灭菌相对于辐照灭菌)可能会造成土壤微生物对植物生长和竞争的反馈作用被高估。本试验结果显示, 辐照灭菌为土壤灭菌处理的最佳方式, 同时, 由于未灭菌土壤是否添加蛭石对植物的生长无影响, 因此, 为了验证或更真实反映土壤微生物在外来植物竞争替代本地植物中的作用和作用强度, 应该优先采用辐照灭菌添加蛭石的方式。未灭菌土壤是否添加蛭石对植物的生长无影响, 则可能是由于土壤微生物的活动具有改善土壤物理特性(通透性)的作用, 从而抵消了蛭石对土壤通透性的提升作用。
References
[1] Mills K E, Bever J D. Maintenance of diversity within plant communities: soil pathogens as agents of negative feedback[J]. Ecology, 1998, 79(5): 1595–1601
[2] Buyer J S, Roberts D P, Russek-Cohen E. Soil and plant effects on microbial community structure[J]. Canadian Journal of Microbiology, 2002, 48(11): 955–964
[3] Porazinska D L, Bardgett R D, Blaauw M B, et al. Relationships at the aboveground-belowground interface: Plants, soil biota, and soil processes[J]. Ecological Monographs, 2003, 73(3): 377–395
[4] Wardle D A, Bardgett R D, Klironomos J N, et al. Ecological linkages between aboveground and belowground biota[J]. Science, 2004, 304(5677): 1629–1633
[5] Belnap J, Phillips S L. Soil biota in an ungrazed grassland: Response to annual grass () invasion[J]. Ecological Applications, 2001, 11(5): 1261–1275
[6] Ravit B, Ehrenfeld J G, Haggblom M M. A comparison of sediment microbial communities associated withandin two brackish wetlands of New Jersey[J]. Estuaries, 2003, 26(2): 465–474
[7] van der Putten W H, van Dijk C, Peters B A M. Plant-specific soil-borne diseases contribute to succession in foredune vegetation[J]. Nature, 1993, 362(6415): 53–56
[8] Bever J D. Feedback between plants and their soil communities in an old field community[J]. Ecology, 1994, 75(7): 1965–1977
[9] Klironomos J N. Feedback with soil biota contributes to plant rarity and invasiveness in communities[J]. Nature, 2002, 417(6884): 67–70
[10] Callaway R M, Thelen G C, Rodriguez A, et al. Soil biota and exotic plant invasion[J]. Nature, 2004, 427(6976): 731–733
[11] Reinhart K O, Callaway R M. Soil biota and invasive plants[J]. New Phytologist, 2006, 170(3): 445–457
[12] Kardol P, Cornips N J, van Kempen M M L, et al. Microbe- mediated plant-soil feedback causes historical contingency effects in plant community assembly[J]. Ecological Monographs, 2007, 77(2): 147–162
[13] van der Putten W H, Klironomos J N, Wardle D A. Microbial ecology of biological invasions[J]. ISME Journal, 2007, 1(1): 28–37
[14] Busby R R, Stromberger M E, Rodriguez G, et al. Arbuscular mycorrhizal fungal community differs between a coexisting native shrub and introduced annual grass[J]. Mycorrhiza, 2013, 23(2): 129–141
[15] Bank T L, Kukkadapu R K, Madden A S, et al. Effects of gamma-sterilization on the physico-chemical properties of natural sediments[J]. Chemical Geology, 2008, 251(1/4): 1–7
[16] Trevors J T. Sterilization and inhibition of microbial activity in soil[J]. Journal of Microbiological Methods, 1996, 26(1/2): 53–59
[17] Hartmann A, Simmeth I. The influence of soil water potential on the locality of microbial activity in aggregates of an arid sandy loess soil[J]. Mitteilungen der Deutschen Bodenkundlichen Gesellschaft, 1990, 62: 9–42
[18] Razavi darbar S, Lakzian A. Evaluation of chemical and biological consequences of soil sterilization methods[J]. Caspian Journal of Environmental Sciences, 2007, 5(2): 87–91
[19] McNamara N P, Black H I J, Beresford N A, et al. Effects of acute gamma irradiation on chemical, physical and biological properties of soils[J]. Applied Soil Ecology, 2003, 24(2): 117–132
[20] Berns A E, Philipp H, Narres H D, et al. Effect of gamma-sterilization and autoclaving on soil organic matter structure as studied by solid state NMR, UV and fluorescence spectroscopy[J]. European Journal of Soil Science, 2008, 59(3): 540–550
[21] 万方浩, 郭建英, 张峰, 等. 中国生物入侵研究[M]. 北京: 科学出版社, 2009: 302 Wan F H, Guo J Y, Zhang F, et al. Research on Biological Invasions in China[M]. Beijing: Beijing Science Press, 2009: 302
[22] Wan F H, Liu W X, Guo J Y, et al. Invasive mechanism and control strategy of(Sprengel)[J]. Science China Life Sciences, 2010, 53(11): 1291–1298
[23] 万方浩, 刘万学, 郭建英, 等. 外来植物紫茎泽兰的入侵机理与控制策略研究进展[J]. 中国科学: 生命科学, 2011, 41(1): 13–21 Wan F H, Liu W X, Guo J Y, et al. Invasive mechanism and control strategy of(Sprengel)[J]. Science China Life Sciences, 2011, 41(1): 13–21
[24] Wang B, Qui Y L. Phylogenetic distribution and evolution of mycorrhizas in land plants[J]. Mycorrhiza, 2006, 16(5): 299–363
[25] Lu Z J, Ma K P. Spread of the exotic crofton weed () across southwest China along roads and streams[J]. Weed Science, 2006, 54(6): 1068–1072
[26] Xu H G, Ding H, Li M Y, et al. The distribution and economic losses of alien species invasion to China[J]. Biological Invasions, 2006, 8(7): 1495–1500
[27] Yu X J, Yu D, Lu Z J, et al. A new mechanism of invader success: Exotic plant inhibits natural vegetation restoration by changing soil microbe community[J]. Chinese Science Bulletin, 2005, 50(11): 1105–1112
[28] Niu H B, Liu W X, Wan F H, et al. An invasive aster () invades and dominates forest understories in China: Altered soil microbial communities facilitate the invader and inhibit natives[J]. Plant and Soil, 2007, 294(1/2): 73–85
[29] 牛红榜, 刘万学, 万方浩. 紫茎泽兰()入侵对土壤微生物群落和理化性质的影响[J]. 生态学报, 2007, 27(7): 3051–3060 Niu H B, Liu W X, Wan F H. Invasive effects ofSprengel(Asteraceae) on soil microbial community and physical and chemical properties[J]. Acta Ecologica Sinica, 2007, 27(7): 3051–3060
[30] 牛红榜, 刘万学, 万方浩, 等. 紫茎泽兰根际土壤中优势细菌的筛选鉴定及拮抗性能评价[J]. 应用生态学报, 2007, 18(12): 2795–2800 Niu H B, Liu W X, Wan F H, et al. Screening, identification, and antagonism assessment of dominant bacteria inSprengel rhizosphere soil[J]. Chinese Journal of Applied Ecology, 2007, 18(12): 2795–2800
[31] 李会娜, 刘万学, 戴莲, 等. 紫茎泽兰入侵对土壤微生物、酶活性及肥力的影响[J]. 中国农业科学, 2009, 42(11): 3964–3971 Li H N, Liu W X, Dai L, et al. Invasive impacts of(Asteraceae) on the changes of microbial community structure, enzyme activity and fertility in soil ecosystem[J]. Scientia Agricultura Sinica, 2009, 42(11): 3964–3971
[32] 于文清, 刘万学, 万方浩. 外来植物紫茎泽兰入侵对菌根菌群落的影响[J]. 中国生态农业学报, 2011, 19(4): 883–889 Yu W Q, Liu W X, Wan F H. Effects of exotic plantinvasion on mycorrhizal fungal community[J]. Chinese Journal of Eco-Agriculture, 2011, 19(4): 883–889
[33] 于文清, 周文, 万方浩, 等. 丛枝菌根真菌(AMF)对外来植物入侵反馈机制的研究进展[J]. 生物安全学报, 2012, 21(1): 1–8 Yu W Q, Zhou W, Wan F H, et al. Current understanding of the role of arbuscular mycorrhizal fungi in exotic plant invasions[J]. Journal of Biosafety, 2012, 21(1): 1–8
[34] 李会娜, 刘万学, 万方浩. 杀真菌剂对入侵植物紫茎泽兰与伴生植物生长的反馈作用[J]. 中国农业科学, 2011, 44(11): 2269–2275 Li H N, Liu W X, Wan F H. Feedback of fungicide on invasive plantand companion plants[J]. Scientia Agricultura Sinica, 2011, 44(11): 2269–2275
[35] 肖博, 周文, 刘万学, 等. 紫茎泽兰入侵地土壤微生物对紫茎泽兰和本地植物的反馈[J]. 中国农业科技导报, 2014, 16(4): 151–158 Xiao B, Zhou W, Liu W X, et al. Feedback ofsoil microbe onand native plants[J]. Journal of Agricultural Science and Technology, 2014, 16(4): 151–158
[36] Yu W Q, Liu W X, Liu W Z, et al. Positive feedback of soil fungi, including arbuscular mycorrhizal fungi, to the invasive weed: Evidence from field studies[J]. Journal of Biosafety, 2014, 23(1): 4–12
[37] Yu W Q, Wan F H, He X H, et al. Soil microbes enhance competition ability of the exoticSprengel against native plant species[J]. Journal of Biosafety, 2014, 23(3): 156–164
[38] Myers J H, Bazely D. Appendix-Some Tools for Studying Plant Populations[M]//Myers J H, Bazely D. Ecology and Control of Introduced Plants. Cambridge: Cambridge University Press, 2003: 255
[39] van der Heijden M G A. Arbuscular mycorrhizal fungi as support systems for seedling establishment in grassland[J]. Ecology Letters, 2004, 7(4): 293–303
[40] Batten K M, Scow K M, Davies K F, et al. Two invasive plants alter soil microbial community composition in Serpentine grasslands[J]. Biological Invasions, 2006, 8(2): 217–230
[41] van der Heijden M G A, Horton T R. Socialism in soil? The importance of mycorrhizal fungal networks for facilitation in natural ecosystems[J]. Journal of Ecology, 2009, 97(6): 1139–1150
[42] 尧水红, 刘艳青, 王庆海, 等. 河滨缓冲带植物根系和根际微生物特征及其对农业面源污染物去除效果[J]. 中国生态农业学报, 2010, 18(2): 365–370 Yao S H, Liu Y Q, Wang Q H, et al. Characteristics of aquatic plant roots, soil microbes and agricultural non-point source pollutant mitigation in riparian buffer zones[J]. Chinese Journal of Eco-Agriculture, 2010, 18(2): 365–370
[43] 毕捷, 张乃莉, 梁宇, 等. 施氮和增雨对内蒙古半干旱地区草原土壤微生物群落碳源利用潜力的影响[J]. 中国生态农业学报, 2012, 20(12): 1586–1593 Bi J, Zhang N L, Liang Y, et al. Impacts of increased N use and precipitation on microbial C utilization potential in the semiarid grassland of Inner Mongolia[J]. Chinese Journal of Eco-Agriculture, 2012, 20(12): 1586–1593
[44] 陈慧丽, 李玉娟, 李博, 等. 外来植物入侵对土壤生物多样性和生态系统过程的影响[J]. 生物多样性, 2005, 13(6): 555–565 Chen H L, Li Y J, Li B, et al. Impacts of exotic plant invasions on soil biodiversity and ecosystem processes[J]. Biodiversity Science, 2005, 13(6): 555–565
[45] Suding K N, LeJeune K D, Seastedt T R. Competitive impacts and responses of an invasive weed: Dependencies on nitrogen and phosphorus availability[J]. Oecologia, 2004, 141(3): 526–535
[46] Boon N, Marlé C, Top E M, et al. Comparison of the spatial homogeneity of physico-chemical parameters and bacterial 16S rRNA genes in sediment samples from a dumping site for dredging sludge[J]. Applied Microbiology and Biotechnology, 2000, 53(6): 742–747
[47] 路鹏, 苏以荣, 牛铮, 等. 土壤质量评价指标及其时空变异[J]. 中国生态农业学报, 2007, 15(4): 190–194 Lu P, Su Y R, Niu Z, et al. Soil quality assessment indicators and their spatial-temporal variability[J]. Chinese Journal of Eco-Agriculture, 2007, 15(4): 190–194
[48] Eno C F, Popenoe H. Gamma radiation compared with steam and methyl bromide as a soil sterilizing agent[J]. Soil Science Society of America Journal, 1964, 28(4): 533–535
[49] Shih K L, Souza K A. Degradation of biochemical activity in soil sterilized by dry heat and gamma radiation[J]. Origins of Life, 1978, 9(1): 51–63
[50] Stotzky G, Mortensen J L. Effect of gamma radiation on growth and metabolism of microorganisms in an organic soil[J]. Soil Science Society of America Journal, 1959, 23(2): 125–127
[51] Smith F A, Smith S E. Mycorrhizal infection and growth of: Use of sterilized soil as a control treatment. New Phytologist, 1981, 88(2): 299–309
Feedback of soil biota ongrowth and competitiveness with native plant: A comparison of different sterilization methods*
LIANG Zuopan1, LI Liqing1,2, WAN Fanghao1, LIU Wanxue1**
(1. State Key Laboratory for Biology of Plant Diseases and Insect Pests / Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China; 2. School of Life Sciences, Guizhou University, Guiyang 550025, China)
Soil sterilization is often used to explore feedback effects of soil microbes in community successions of competitive exclusion of native plants by invasive plants. In order to choose the most suitable soil sterilization method and to further analyze feedback effects of soil microbes on invasive plantcompetition with native plants, we compared the differences in biomass betweenand native plantcultured in sterilized soils. The tested soil sterilization methods in the study included dry-heating sterilization, autoclaving sterilization and irradiation sterilization. Non-sterilized soil was the control. In order to mitigate effects of sterilization on soil physico- chemical properties, vermiculite was added to soils sterilized with different methods. The results showed that sterilization by the three methods significantly decreasedandbiomass, regardless of vermiculite addition. For the three different sterilization methods, adding vermiculite to soil promoted the growth ofandwhereas plant biomass in non-sterilized soils was not affected by vermiculite addition.andbiomass under irradiation sterilization soils plus vermiculite was 30.8% and 66.5% higher than that under dry-heating and autoclaving sterilization soils with vermiculite, respectively. Thenbiomass under irradiation sterilization soils plus vermiculite increased by 109.5%and 63.4% compared with that in dry-heating sterilization or autoclaving sterilization soils plus vermiculite, respectively. Plants in gamma irradiated soils had the highest plant biomass among the soils subjected to the three sterilization treatments. Through mixed pot experiment ofandunder irradiation sterilization soils plus vermiculite and non-sterilized soils plus vermiculite, we found that soil microbes enhanced the competitive ability ofover the native plantand relative competitive advantage increased by 16%. These results indicated that irradiation sterilization soil plus vermiculite treatment was efficient in pot experiment studies on feedback effects of soil microbes on plants. Soil microbes exerted positive feedback during invading process of invasive plant.
Invasive plant;;Soil biota; Sterilization method; Feedback
10.13930/j.cnki.cjea.160040
S451.1
A
1671-3990(2016)09-1223-08
2016-01-11 接受日期: 2016-03-29
* 国家自然科学基金项目(31171907, 30871654)资助
**通讯作者:刘万学, E-mail: liuwanxue@caas.cn
梁作盼, 研究方向为入侵生物学和生态学。E-mail: liang1989qnd@163.com
* Funded by the National Natural Sciences Foundation of China (31171907, 30871654)
** Corresponding author, E-mail:liuwanxue@caas.cn
Received Jan. 11, 2016; accepted Mar. 29, 2016

