microRNA-132在人脐静脉内皮细胞中调控作用的研究
张枥心,陶利娟
·实验论著·
microRNA-132在人脐静脉内皮细胞中调控作用的研究
张枥心,陶利娟
Department of Ophthalmology,Hunan Children’s Hospital,Changsha 410007,Hunan Province,China
Abstract
•AIM: To evaluate the regulatory effect of microRNA-132 (miR-132) in human umbilical vein endothelial cell (HUVEC).
•METHODS: In vitro cultured human umbilical vein endothelia cells in hypoxic environment for 6h,then maintained under normal oxygen condition for 3h,6h,12h,24h.miR-132 and peroxisome-proliferator-activated receptor-γ coactivator-1α (PGC-1α) expression was detected by quantitative Real-time polymerase chain reaction and Western blot analysis.Human umbilical vein endothelial cells transfected miR-132 mimic and miR-132 inhibitor(anti-miR-132) were measured by quantitative Real-time polymerase chain reaction and Western blot.
•RESULTS: miR-132 and PGC-1α expression was significantly (P<0.01) upregulated in the hypoxic environment of cells at 3h compared with the normal oxygen condition.After cells transfection,the hypoxic environment the miR-132 and PGC-1α expression were markedly increased compared with the normal oxygen condition.The cells transfected miR-132-mimic,the expression of the miR-132 and PGC-1α were higher than that of transfected anti-miR-132 and contrast group (P<0.01).
•CONCLUSION: miR-132 level is highly expressed in the HUVEC under hypoxia and may be an effect of regulation for PGC-1α.
目的:探讨miR-132在人脐静脉内皮细胞(human umbilical vein endothelia cells,HUVEC)中的调控作用。
方法:体外低氧培养人脐静脉内皮细胞6h后继续常氧培养3、6、12、24h,利用Real-time PCR检测miR-132和PGC-1α mRNA表达变化,Western-blot检测PGC-1α 蛋白表达变化,及观察各组与正常培养的细胞之间的表达差异。通过对人脐静脉内皮细胞转染miR-132模拟物与拮抗剂后,再分别置于常氧和低氧环境中培养,利用Real-time PCR检测不同氧条件下miR-132和PGC-1α mRNA的表达变化,Western-blot检测PGC-1α蛋白表达变化。
结果:miR-132和PGC-1α在细胞低氧培养后继续常氧培养3h时蛋白与mRNA表达量最高,与正常培养的细胞表达差异最为明显(P<0.01)。细胞转染后可观察到miR-132和PGC-1α在低氧组表达量要高于常氧组,而两组中转染miR-132模拟物后的表达量要高于转染拮抗剂组(P<0.01)。
结论:miR-132在低氧时的人脐静脉内皮细胞中表达明显上调,对PGC-1α存在调控作用。
microRNA-132;过氧化物酶增殖激活受体-γ共激活子-1α;人脐静脉内皮细胞;缺氧
引用:张枥心,陶利娟.microRNA-132在人脐静脉内皮细胞中调控作用的研究.国际眼科杂志2016;16(10):1820-1823
0 引言
微小RNA(microRNA,miRNA)是一类生物内源的非编码小RNA,由20~24个核苷酸组成,通过与mRNA转录物的3’非翻译区结合而调控基因转录后表达[1]。miR-132是发现较早的miRNA之一,2002年马克斯普朗克学会的Lagos-Quintana等首次在小鼠神经组织中发现miR-132[2],成熟的miR-132长度为22bp,由长度为66bp的前体序列进行加工而成[3],miR-132具有进化保守性,在人、大鼠、小鼠、猿等物种中具有相同的序列与结构。作为内皮细胞特异性miRNA之一,miR-132在内皮靶向p120RasGAP诱导新血管形成被称为血管生成开关。调查结果显示,在人类血管生成的胚胎干细胞模型中,miR-132高度上调,这在正常内皮中是检测不到的[4]。前期研究中,我们已经发现过氧化物酶增殖激活受体-γ共激活子-1α(peroxisome proliferator activated receptor-γ coactivator-1α,PGC-1α)参与了调控小鼠视网膜新生血管形成[5]。本研究中,我们将体外培养人脐静脉内皮细胞,并进行缺氧培养,观察缺氧状态下miR-132和PGC-1α的表达变化,同时对细胞进行转染miR-132模拟物(miR-132 mimic)和miR-132拮抗剂(anti-miR-132),观察在缺氧与常氧环境中两者的表达变化情况,从而为缺氧诱导的新生血管性疾病的发病机制和诊治研究提供新的思路基础。
1 材料和方法
1.1材料人脐静脉内皮细胞(human umbilical vein endothelia cells,HUVEC)由湖南湘雅医院皮肤科惠赠,脂质体Lipofectamine TM 2000(LF2000)和Trizol均购自美国Invitrogen公司,EGM培养基、Opti-MEM培养基及新生胎牛血清购自Gibco公司,实时定量PCR试剂盒购自美国MBI公司,RT-PCR引物由上海捷瑞生物技术服务有限公司合成,miR-132-mimic和 anti-miR-132由广州锐博生物科技有限公司合成。兔抗鼠PGC-1α抗体购自美国Abcam公司,兔抗鼠β-actin抗体购自美国Santa Cruz公司。
1.2方法
1.2.1细胞培养分组体外培养HUVEC,细胞进入对数期生长后,更换培养液,再将细胞分别置于常氧(20% O2)和低氧(1% O2、5% CO2和94% N2混合气体)环境中培养,低氧培养6h后,再恢复常氧培养3、6、12、24h。对各时间点的细胞检测miR-132和PGC-1α的表达变化。
1.2.2脂质体介导细胞转染HUVEC转染mir-132-mimic和anti-miR-132及阴性对照物,细胞在转染的前1d,将5×104细胞接种在6孔板上,按Lipofectamine 2000转染试剂盒说明书进行转染。设置空白组、阴性对照组(NC、将miR-132序列随机打乱)、miR-132模拟物组(mir-132-mimic)、miR-132拮抗剂组(anti-miR-132)。mir-132-mimic合成序列:5’-ACCGUGGCUUUCGAUUGUUACU-3’;anti-mir-132合成序列: 5’-AGUAACAAUCGAAAGCCACGGU-3’。细胞转染后分别置于常氧(20% O2)和低氧(1% O2)环境中继续培养16h后,对不同氧环境的各组细胞检测miR-132和PGC-1α的表达变化。
1.2.3qPCR检测miR-132与PGC-1α mRNA表达的变化提取各组的总RNA,miR-132引物序列:上游: 5’-GGCAACCGTGGCTTTCGA-3’;下游:5’-TTTGGCACTAGCACATT-3’。U6内参基因引物:上游:5’-CTCGCTTCGGCAGCACA-3’;下游:5’-AACGCTTCACGAATTTGCGT-3’。 PCR反应条件为:95℃预变性5min,95℃ 20s,60℃ 20s,72℃ 10s,共40个循环。PGC-1α引物序列:上游:5’-CCTGCATGAGTGTGTGCTCT-3’;下游:5’-GCAAAGAGGCTGGTCTTCAC-3’。β-actin内参引物序列:上游:5’- CATTAAGGAGAAGCTGTGCT-3’;下游:5’-GTTGAAGGTAGTTTCGTGGA-3’。PCR反应条件为95℃预变性5min,94℃ 20s,58.5℃ 20s,72℃ 20s,共40个循环。
1.2.4Western-blot印迹检测PGC-1α蛋白表达的变化提取各组总蛋白后,进行聚丙烯酰胺凝胶电泳。电泳结束后,转PVDF膜。取出PVDF膜,对比蛋白质标准质量位置,将所需测定片段和内参片段膜剪下。加入封闭液(5%脱脂牛奶),置水平摇床于室温下封闭1h。加入一抗,PGC-1α一抗稀释比为1∶1000,β-actin稀释比例为1∶200,置水平摇床于4℃振摇过夜。加入二抗,洗膜。在暗室内用ECL发光法检测目的条带,X射线曝光。以β-actin作为内对照。用BandScan5.0软件进行条带灰度分析。

2 结果
2.1miR-132细胞转染效率检测在转染率最高的时间点24h时,用荧光显微镜下观察细胞转染数量,采集该时间点荧光镜下视野与光镜下视野对比片(图1),细胞的转染效率达到80%以上,可以进行后续实验。采用Realtime PCR法进行分析,以确定最佳干预片段(图2)。
2.2不同时间点各组HUVEC细胞miR-132和PGC-1α表达变化
2.2.1不同时间点各组HUVEC细胞miR-132和PGC-1α mRNA表达HUVEC在低氧培养6h,再恢复常氧继续培养3、6、12、24h后,Realtime PCR检测正常组细胞与各时间点细胞miR-132和PGC-1α mRNA的表达变化(图3、4):正常组与缺氧培养后复氧3、6、12、24h时miR-132 mRNA相对含量分别为1.0083±0.1324、2.5735±0.3049、1.9073±0.3172、1.5634±0.3419、1.0430±0.1634。复氧3h时miR-132 mRNA表达量最高,随着复氧时间延长,其表达含量逐步降低。正常组与缺氧培养后复氧3、6、12、24h时PGC-1α mRNA相对含量分别为1.07293±0.1752、13.3957±0.1569、2.8705±0.3616、1.7924±0.2515、1.3616±0.1577,与miR-132 mRNA表达趋势相似,在复氧3h表达最高,与正常组含量相比,差异有统计学意义(P<0.01)。
2.2.2不同时间点各组HUVEC细胞PGC-1α蛋白表达HUVEC中PGC-1α的蛋白表达水平见图5:92kD检测到PGC-1α蛋白表达,43kD处检测到内参β-actin蛋白表达。缺氧干预后复氧3h时,PGC-1α在蛋白表达水平明显增高,与正常组蛋白表达水平相比,差异有统计学意义(P<0.01)。随着复氧时间延长,蛋白表达水平逐渐下调。2.3不同氧条件下各组HUVEC miR-132和PGC-1α表达变化
2.3.1不同氧条件下各组HUVEC细胞miR-132和PGC-1α mRNA表达HUVEC转染后,在不同氧条件下各组细胞中miR-132和PGC-1α mRNA的表达变化见图6、7:在常氧下,正常组、阴性对照组、转染模拟物组、转染拮抗剂组的miR-132 mRNA的含量为0.9683±0.1154、1.0135±0.1075、3.9581±0.3453、0.2616±0.3244;PGC-1α mRNA的含量为1.0926±0.1591、1.0493±0.1331、3.3232±0.1457、0.5391±0.1612。而在缺氧条件下各组中miR-132 mRNA的含量为2.7660±0.4568、2.6658±0.3494、7.1525±0.4137、0.3187±0.1109;PGC-1α mRNA的含量为:3.4582±0.3456、3.4751±0.2420、5.4544±0.1560、1.8523±0.2826。两种氧条件下,细胞转染mir-132-mimic后miR-132 mRNA表达量较其他各组表达量明显增高。与正常组相比,差异有统计意义(P<0.01)。而在低氧条件下的各组细胞miR-132 mRNA表达量又较其在常氧条件下的表达量有不同程度的上调。
2.3.2不同氧条件各组HUVEC细胞PGC-1α蛋白表达HUVEC转染mir-132-mimic、anti-mir-132、阴性对照物后分别在常氧和低氧环境中培育后PGC-1α蛋白表达水平见图8:与PGC-1α mRNA表达趋势一致,低氧中的表达量明显高于常氧条件。而转染mir-132-mimic后PGC-1α蛋白与正常组相比,差异有统计学意义(P<0.01)。
3 讨论
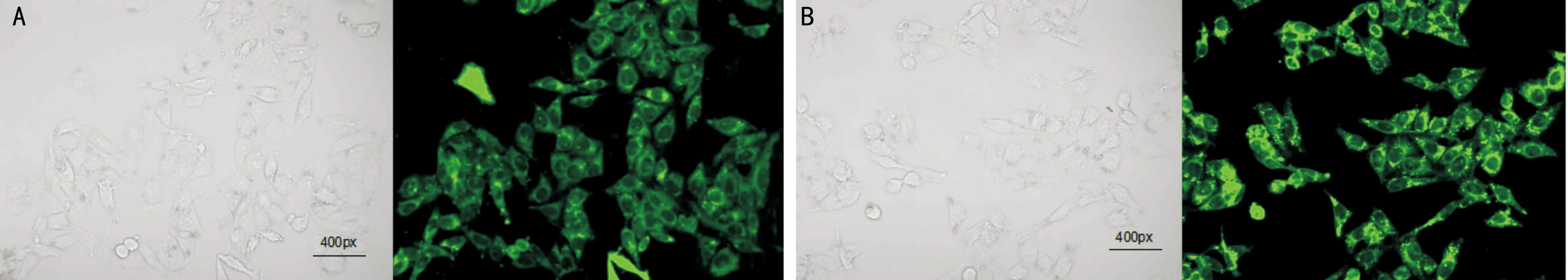
图1细胞转染效率检测白光和荧光照片A:人miR-132模拟物转染;B:人miR-132拮抗剂转染。
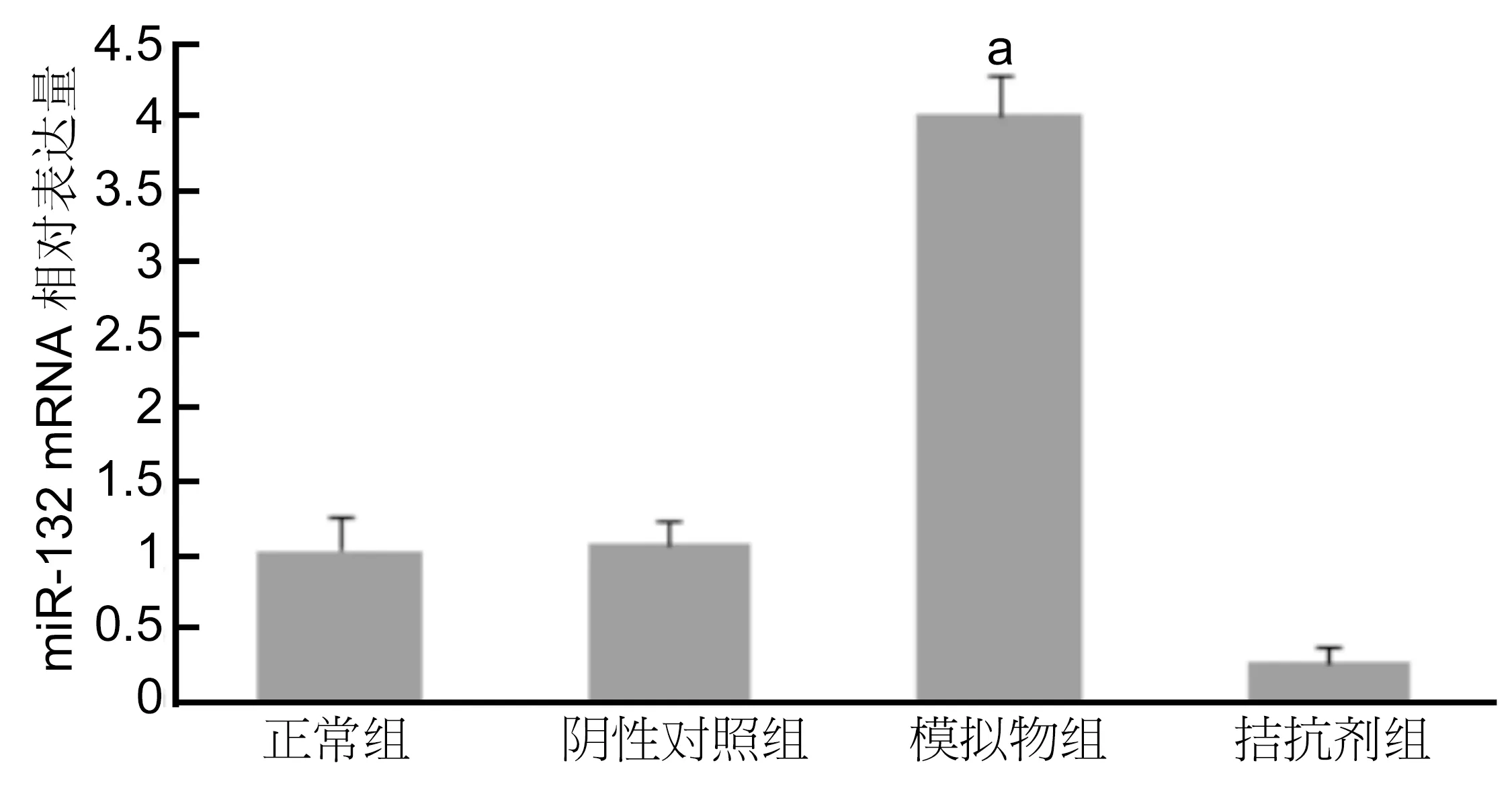
图2各组HUVEC转染后miR-132 mRNA表达变化aP<0.01 vs 拮抗剂组。
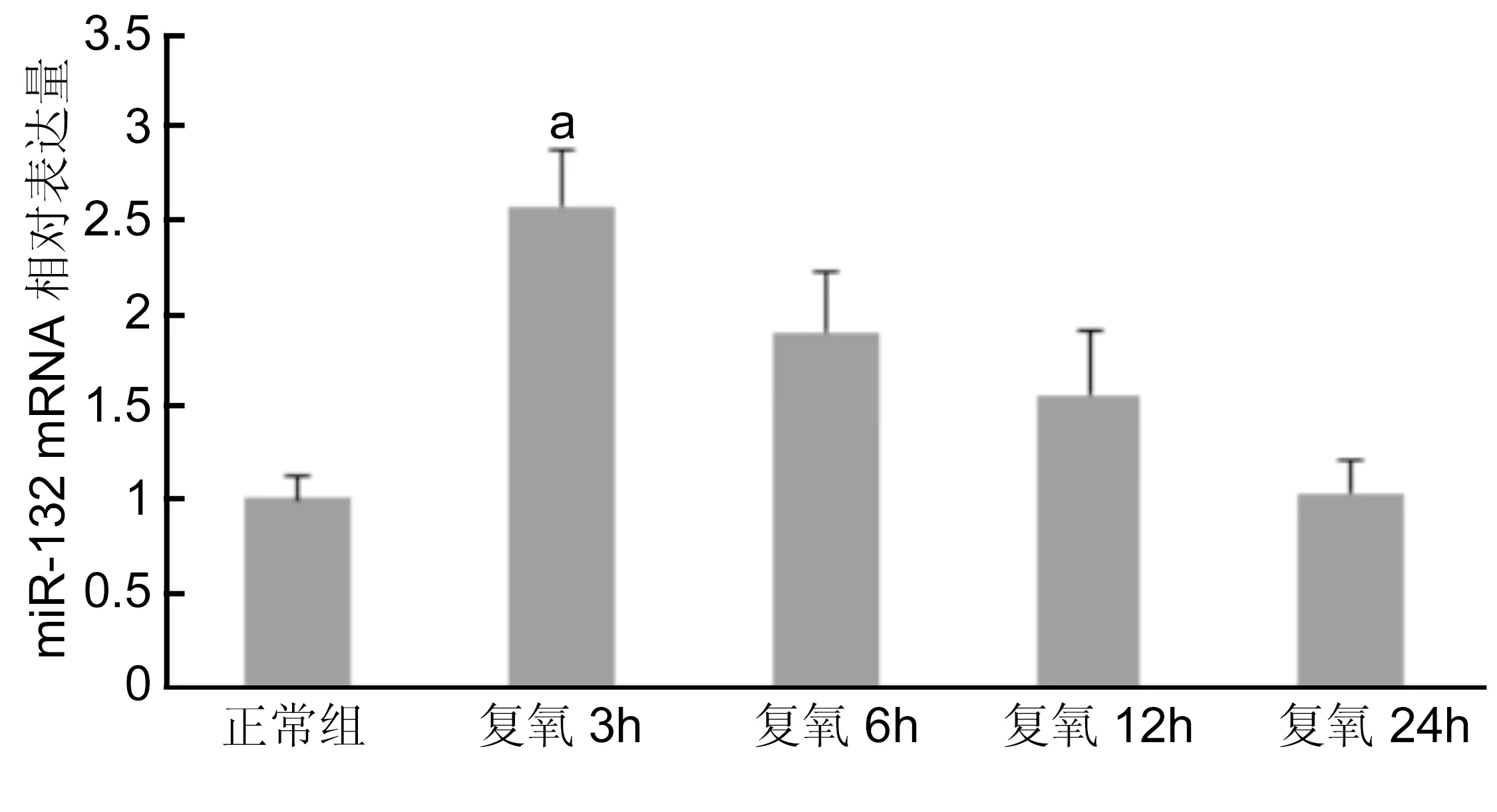
图3不同时间点各组HUVEC中miR-132 mRNA表达aP<0.05 vs 正常组。
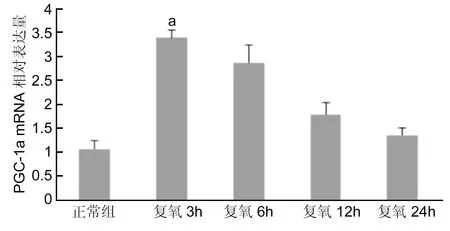
图4各时间点组HUVEC中PGC-1α mRNA表达aP<0.05 vs 正常组。
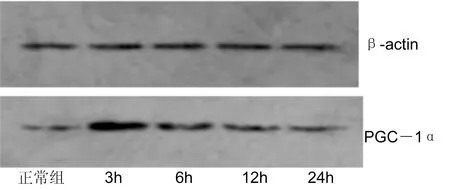
图5不同时间点各组HUVEC中PGC-1α蛋白表达的Western-blot印迹结果。
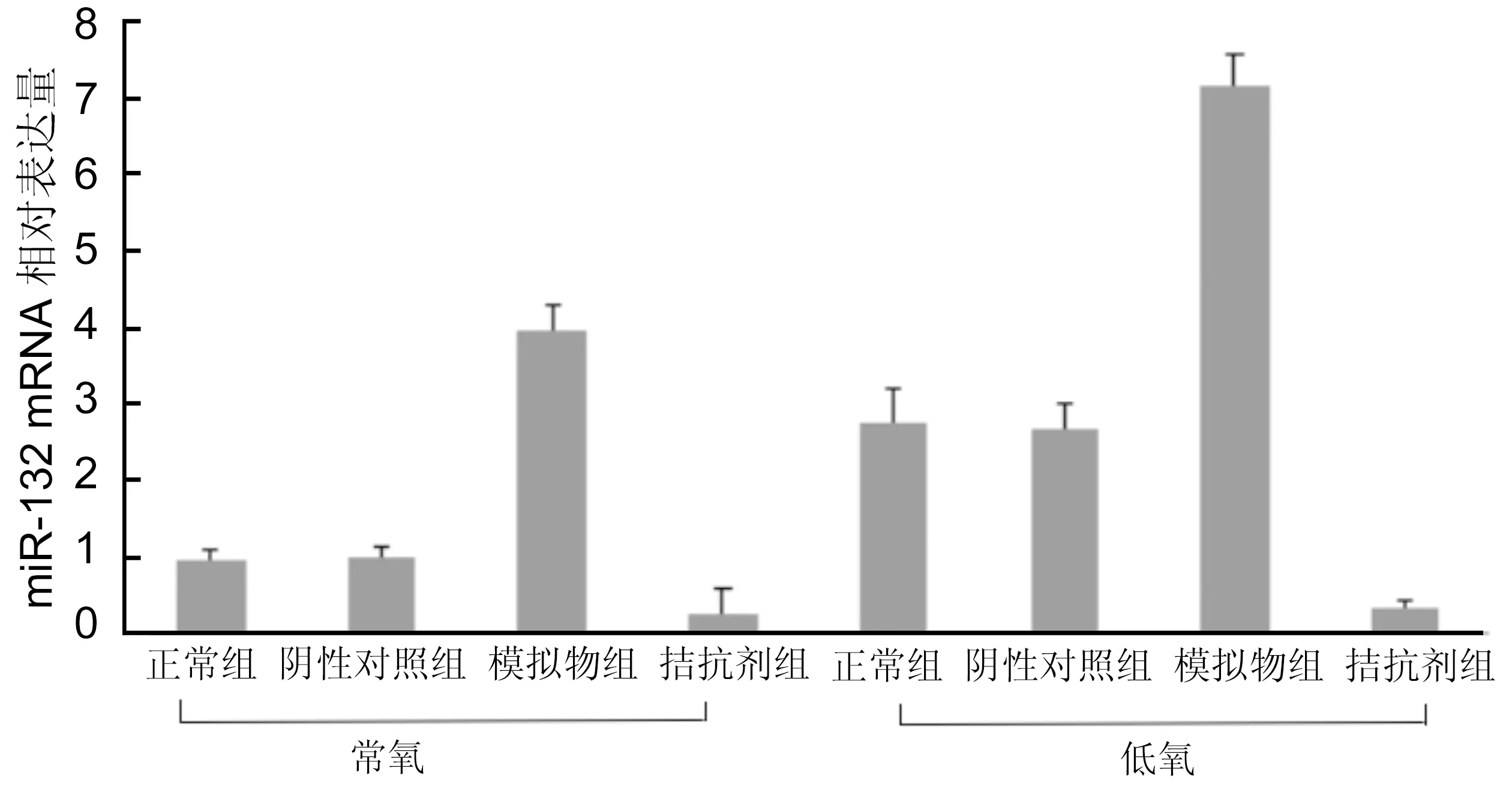
图6不同氧条件下各组HUVEC中miR-132 mRNA表达。
microRNA是近年来发现的存在于各种生物体内具有重要调控作用的一种小分子RNA,与其它调控基因表达的方式如转录水平调控或者表观遗传修饰相比,miRNAs具有很多优势。首先,miRNAs相比反式作用因子的调节,能在细胞质中发挥作用。其次,miRNAs的表达水平可在细胞中被迅速上调至几千个拷贝,相比其它调节方式具有更大的调节潜能。再者,在为细胞隔离外界干扰上,miRNAs介导的反馈调节机制比转录抑制因子应对外界刺激更加有效。最后,miRNAs能同时调节多个靶基因,而且通常这些靶基因位于同一信号转导通路中,使得miRNAs对于调节细胞针对特定刺激的基因表达改变更为有效[6]。
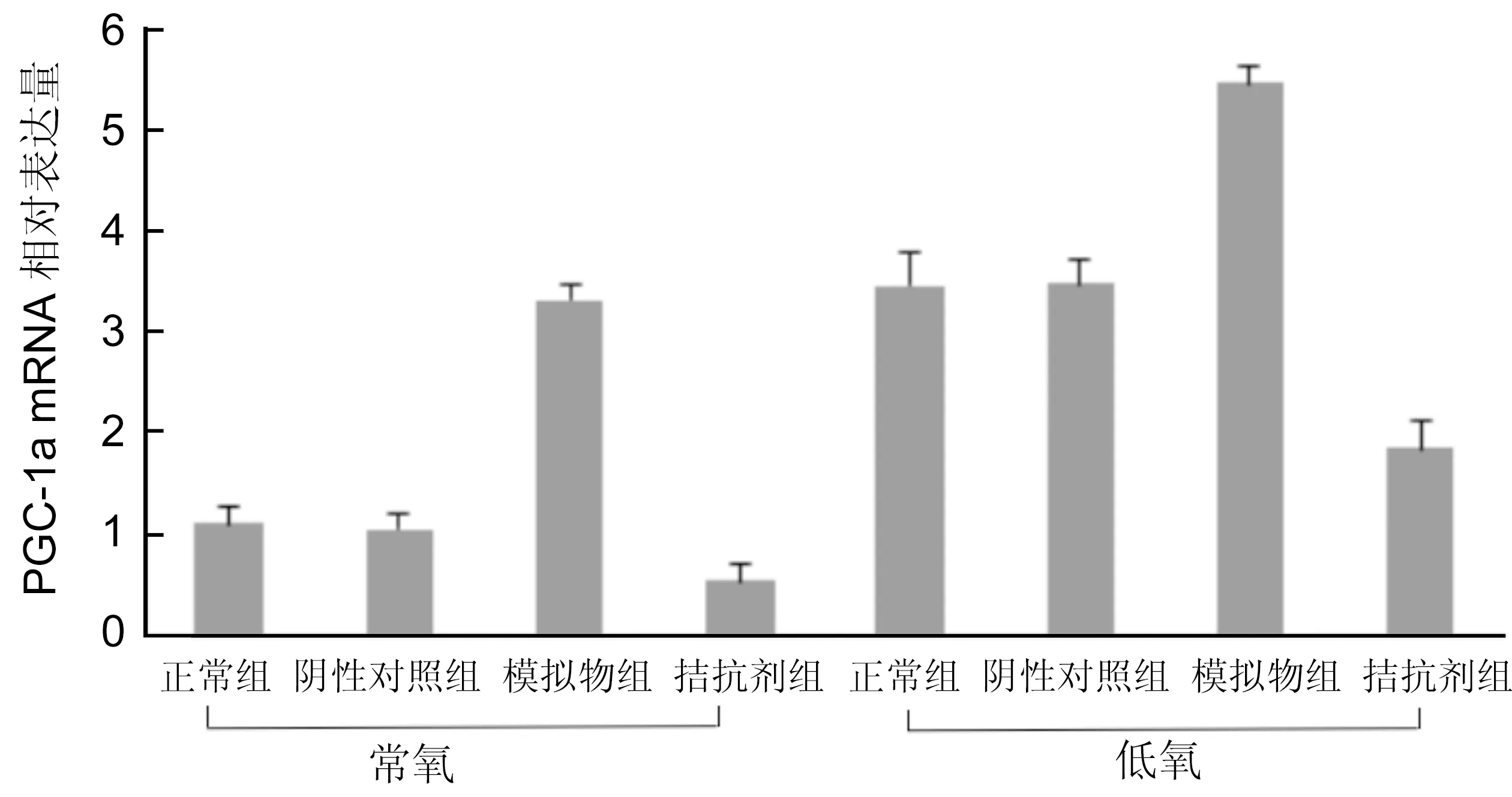
图7不同氧条件下各组HUVEC 中PGC-1α mRNA表达。
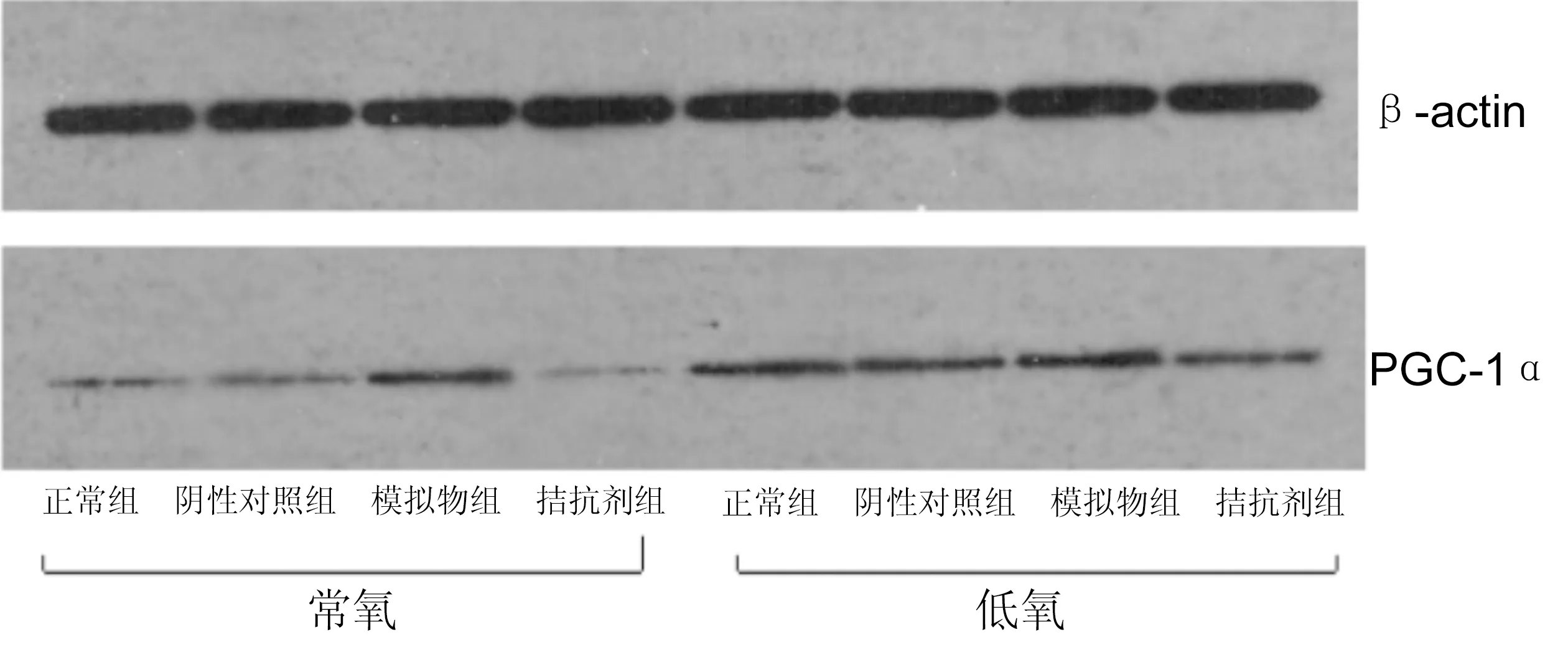
图8不同氧条件各组HUVEC 中PGC-1α蛋白表达的Western-blot印迹结果。
miR-132可通过作用于新生血管刺激因子,在血管过度增生、血管瘤及肿瘤血管发生中发挥重要作用,对血管新生过程中起调节作用[7]。当血管生长因子信号上调miR-132的表达时,p120RasGAP的表达水平降低,可使Ras持续激活,放大血管生成信号[8]。本研究中,利用人脐静脉内皮细胞在低氧中培育,之后恢复常氧继续培育,对细胞模拟一个“缺氧-高氧”状态,观察miR-132在新生血管生成过程中表达情况以及对PGC-1α可能存在的调控作用。实验结果表明:细胞缺氧诱导后,细胞中miR-132mRNA表达水平明显升高,复氧3h表达量最高,随着复氧时间延长,其表达量逐渐下调,至24h左右表达量接近正常组状态。说明缺氧刺激后血管内皮细胞中的miR-132会迅速生成,在新生血管形成过程中起着促进作用,代偿组织的缺氧状态;而当缺氧刺激消除后,miR-132则会降至一个平衡状态。在我们的前期研究中,发现在缺氧诱导的视网膜新生血管模型小鼠中,小鼠视网膜血管PGC-1α的表达也明显上调,说明缺氧也可以调控视网膜中PGC-1α的表达。为了检测miR-132对新生血管及PGC-1α的调控作用,本研究采用脂质体介导细胞转染mir-132-mimic与anti-mir-132,转染后将细胞分别置于常氧与低氧中培育,观察HUVEC中miR-132和PGC-1α的变化及相应的分子机制。常氧组中,未转染与转染阴性对照物组细胞中miR-132处于较低表达水平,转染mir-132-mimic 表现出明显升高趋势,而转染anti-mir-132后出现显著表达下调。而在低氧组中,转染mir-132-mimic与anti-mir-132两者同样表现出与常氧组中类似的升高与下降的表达趋势。但在转染mir-132-mimic、未转染与转染阴性对照物组细胞中,miR-132的表达水平要较其在常氧中表达量高。表明在低氧状态下,转染mir-132-mimic细胞中miR-132表达量明显增加,可促进新生血管形成。PGC-1α的表达水平也表现出类似的趋势,进一步证实了缺氧可诱导血管内皮细胞中PGC-1α的表达增加,PGC-1α对新生血管也存在调控作用,但细胞转染mir-132-mimic后PGC-1α的表达水平明显增强,说明在缺氧环境中miR-132对PGC-1α具有更强的调控能力。
总之,本研究揭示了缺氧时HUVEC中miR-132和PGC-1α的表达增强,对细胞转染mir-132-mimic 后,可以增强细胞中miR-132的表达量,进而进一步刺激PGC-1α的表达上调,进而可促进新生血管形成。本研究为探讨miR-132与新生血管及对PGC-1α的可能存在的调节信号通路提供新的思路,为进一步的研究提供实验基础。
1Jimenez-Mateos EM,Henshall DC.Epilepsy and microRNA.Neuroscience 2013;238:218-229
2王攀,戚丽华,刘雪林,等.MiR-132的生物学功能.生物技术通讯杂志2013;24(4):562-564
3管娣,刘春颖,陈晨,等.MiR-132抑制肿瘤转移.生物化学与生物物理进展2013;40(2): 159-164
4Anand S,Majeti BK,Acevedo LM,et al.MicroRNA-132-mediated loss of p120RasGAP activates the endothelium to facilitate pathological angiogenesis.Nature Medicine 2010;16(8):909-914
5Zhang L,Jiang J,Xia X.Suppression of retinal neovascularization by siRNA targeting PGC-1α.Int J Mol Med 2014;33(6):1523-1530
6Anand S.A brief primer on microRNAs and their roles in angiogenesis.Vasc Cell 2013;5(1):2
7杨子岩,晏贤春,赵星成,等.微小RNAs与新生血管形成.心脏杂志 2015;27(1):102-109
8Anand S,Cheresh DA.Emerging role of Micro-RNAs in the regulation of angiogenesis.Genes Cancer 2011;2(12):1134-1138
Effect of regulation in human umbilical vein endothelia cells treated by microRNA-132
Li-Xin Zhang,Li-Juan Tao
Li-Juan Tao.Department of Ophthalmology,Hunan Children’s Hospital,Changsha 410007,Hunan Province,China.wupoxin@suhu.com
2016-04-28Accepted:2016-09-07
microRNA-132; peroxisome-proliferator-activated receptor-γ coactivator-1α; human umbilical vein endothelial cells; hypoxia
(410007)中国湖南省长沙市,湖南省儿童医院眼科
张枥心,女,毕业于中南大学湘雅医院眼科,博士,主治医师,研究方向:小儿眼病、眼底病。
陶利娟,女,毕业于南华大学,硕士,主任医师,主任,研究方向:斜弱视、屈光、眼保健.wupoxin@suhu.com
2016-04-28
2016-09-07
Zhang LX,Tao LJ.Effect of regulation in HUVEC treated by microRNA-132.Guoji Yanke Zazhi(Int Eye Sci) 2016;16(10):1820-1823
10.3980/j.issn.1672-5123.2016.10.08

