细胞毒素相关蛋白A和白细胞介素-9与消化性溃疡的关系研究
刘宝珍, 屈冬冬, 金世禄, 刘京运
(1. 山东省滨州市人民医院 消化科; 山东 滨州, 256610;2. 滨州医学院临床学院, 山东 滨州, 256603)
细胞毒素相关蛋白A和白细胞介素-9与消化性溃疡的关系研究
刘宝珍1, 屈冬冬2, 金世禄1, 刘京运2
(1. 山东省滨州市人民医院 消化科; 山东 滨州, 256610;2. 滨州医学院临床学院, 山东 滨州, 256603)
目的探讨细胞毒素相关蛋白A(CagA)、白细胞介素-9(IL-9)与消化性溃疡发病的关系。方法选取消化性溃疡患者40例为研究组,慢性胃炎患者40例为对照组,检测2组血清CagA、IL-9水平及幽门螺杆菌(Hp)感染情况等,并对消化性溃疡进行单因素、多因素Logistic回归分析。结果研究组血清CagA水平明显高于对照组, IL-9水平明显低于对照组(P<0.001); 研究组Hp感染率及CagA+Hp感染率均明显高于对照组(P<0.01); CagA+患者血清IL-9水平明显低于CagA-患者(P<0.01)。Logistic回归分析显示, CagA+Hp感染、吸烟、生活不规律、Ⅰ级亲属共患病、精神因素、饮酒与消化性溃疡的发生密切相关(P<0.01), CagA+Hp感染与所选分层因素之间在消化性溃疡的发生中具有协同作用。结论CagA+幽门螺杆菌感染可能与消化性溃疡的发生有关, IL-9可能对Hp感染所致的消化性溃疡具有抑制作用。消化性溃疡的发生是众多因素共同作用的结果。
消化性溃疡; 细胞毒素相关蛋白A; 白细胞介素-9; 幽门螺杆菌
自1983年首次从人胃黏膜活检标本中分离培养出幽门螺杆菌(Hp)后,诸多研究[1-2]表明Hp感染是消化性溃疡的重要病因之一,与消化性溃疡的发生密切相关,但感染Hp后是否致病取决于不同的毒力株。现已证实,一半以上的Hp菌株均表达细胞毒素相关蛋白A(CagA), CagA是Hp的重要毒力因子之一,会引起更为严重的炎症反应、消化道黏膜损伤等[3-4]。白细胞介素-9(IL-9)能通过抑制细胞免疫活性,发挥抗炎效应,具有多效性免疫功能[5]。本研究探讨CagA、IL-9与消化性溃疡发病的关系。
1 资料与方法
1.1一般资料
选择2013年9月—2014年9月就诊的消化性溃疡患者40例为研究组,慢性胃炎患者40例为对照组,均经胃镜结合组织病理学检查确诊,排除患有其他消化道疾病、其他急慢性疾病、恶性肿瘤的患者。其中研究组男30例,女10例;年龄38~66岁,平均(46.5±5.6)岁。对照组男28例,女12例;年龄37~68岁,平均(47.2±5.3)岁。2组一般资料比较差异无统计学意义,具有可比性(P>0.05)。研究方案经本院伦理委员会研究并批准进行,入组患者及家属均知情同意并书面签署同意书。
1.2方法
采集所有患者空腹末梢血3 mL, 离心后分离血清,采用ELISA法检测各组血清CagA、IL-9水平。根据14C-UBT、RUT和病理性特殊染色确定Hp阳性(至少有2项测定结果阳性则判定为Hp阳性);对Hp感染者采用斑点金免疫渗滤法检测血清抗Hp-CagA IgG。根据设计假设,选择可能与消化性溃疡发生有关的危险因素并制定统一调查表[4], 内容主要包括个人资料、生活习惯、健康状况、家族史、社会经济、卫生状况、精神因素等,对消化性溃疡进行单因素、多因素Logistic回归分析。
1.3统计学分析
2 结 果
2.12组血清CagA、IL-9水平及Hp感染情况
研究组血清CagA水平明显高于对照组, IL-9水平明显低于对照组(P<0.01)。研究组Hp感染率为92.5%(37/40), 明显高于对照组的47.5%(19/40)(P<0.01)。见表1。
与对照组比较, **P<0.01。
2.2血清CagA+HP感染率及IL-9水平比较比较
研究组CagA+HP感染率为90.0%(36/40), 明显高于对照组的22.5%(9/40);研究组、对照组CagA+Hp血清IL-9水平均明显低于CagA-Hp患者(P<0.01)。见表2。

表2 2组CagA+比例及其血清IL-9水平比较[n(%)]
与CagA-比较, **P<0.01。
2.3消化性溃疡单因素条件Logistic回归分析
Logistic回归分析显示, CagA+Hp感染、吸烟、生活不规律、Ⅰ级亲属共患病、精神因素、饮酒与消化性溃疡的发生密切相关(P<0.01), 其中CagA+Hp感染与消化性溃疡的关系最为密切, OR值最大,生活不规律次之。见表3。
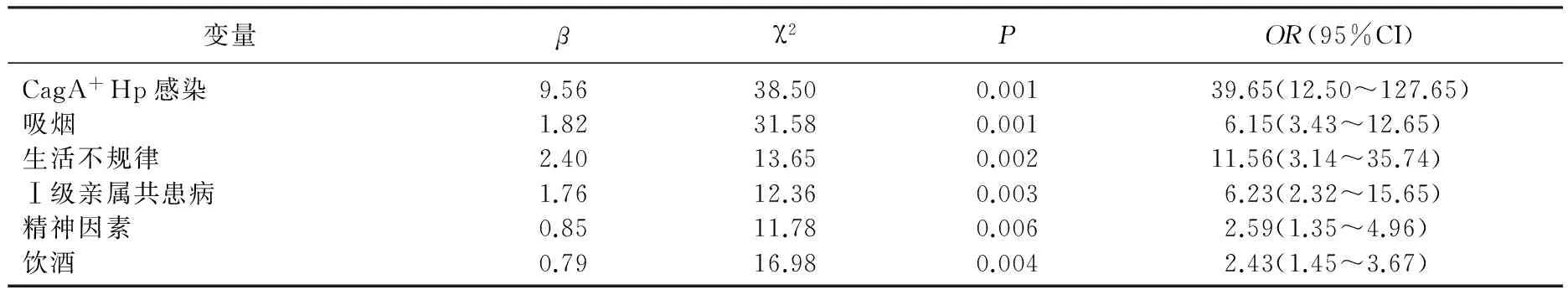
表3 消化性溃疡单因素条件Logistic回归分析
2.4消化性溃疡多因素条件Logistic回归分析
对单因素分析有意义的因素进行多元Logistic回归分析,结果显示CagA+Hp感染与所选分层因素之间在消化性溃疡的发生中具有协同作用。见表4。

表4 消化性溃疡多因素条件Logistic回归分析
3 讨 论
Hp广泛存在于人体,与消化性溃疡、胃炎、胃癌等多种消化系统疾病密切相关[6]。研究[7]认为Hp产生的毒素CagA虽然含量甚微,但能通过白细胞趋化及激活,引起强烈的免疫反应和组织损伤。本研究通过ELISA法检测患者血清CagA, 结果显示研究组血清CagA水平明显高于对照组,提示CagA与消化性溃疡的关系较慢性胃炎更为密切。CagA基因表达分子量为120~145 KDa的CagA蛋白,能够通过PAI构成的分泌系统进入消化道上皮细胞,破坏细胞顶端连接复合体的结构及功能,干扰上皮细胞分化,降解基膜。研究[8]认为, CagA阳性与胃十二指肠疾病有关。Caliskan等[9]将492例患者分为无症状对照组、慢性萎缩性胃炎组、胃腺癌组、十二指肠球部溃疡组及胃溃疡组5组,计算各组Hp及CagA+Hp的感染率,结果显示, Hp相关性疾病如慢性萎缩性胃炎、胃腺癌及消化性溃疡时,以CagA+Hp感染为主, CagA+Hp感染率较无症状对照组更高。近年来,Hp感染与消化性溃疡的关系受到学者们的普遍关注,诸多研究结果均证实Hp感染是消化性溃疡发病诸因素中的危险因素之一。国外学者Saber等[10]采用ELSIA法检测患者对CagA抗体的免疫反应,发现超过70%的胃溃疡患者和100%的十二指肠溃疡患者呈阳性。Cheng等[11]也报道,十二指肠溃疡患者血清中的CagA抗体检出率为84%, 显著高于非溃疡性消化道疾病患者。本研究结果显示研究组与对照组Hp感染率分别为92.5%、47.5%, CagA阳性HP感染率分别为90.0%、22.5%, 研究组Hp感染率及CagA+HP感染率均明显高于对照组。提示CagA阳性Hp感染与消化道溃疡的发生密切相关,抗CagA抗体阳性的检测结果能够作为消化性溃疡的临床诊断参考指标。
IL-9是分子量为14 KDa的糖蛋白,具有双重调节功能,既可负向调节炎症反应、增加T细胞免疫抑制活性,又可以通过激活肥大细胞、巨噬细胞等促过敏反应及炎症反应[12]。Defendenti等[13]在实验研究中构建了Hp感染的小鼠模型,结果显示Hp感染组血清IL-9水平明显低于Hp未感染组;进一步在临床上检测消化系统疾病患者血清标本,结果发现Hp阴性的受试者血清IL-9水平明显高于Hp阳性的患者。上述结果提示, IL-9表达减少与Hp感染相关,两者具有互相抑制的作用。本研究通过检测对2组血清IL-9水平,结果提示IL-9可能对消化性溃疡及慢性胃炎均具有抑制作用。根据是否存在CagA+Hp感染,进一步比较2组间血清IL-9水平,结果显示CagA+患者血清IL-9水平均明显低于CagA-患者,提示CagA可能在Hp抑制IL-9的表达中发挥重要作用。
研究[14]认为,消化性溃疡可能是多种因素共同作用的结果,本研究通过Logistic回归分析显示, CagA+Hp感染、吸烟、生活不规律、Ⅰ级亲属共患病、精神因素、吸烟与消化性溃疡的发生密切相关,且CagA+Hp感染与所选分层因素之间在消化性溃疡的发生中具有协同作用。
[1]Saha R, Roy P, Das S, et al. Application of a stool antigen test to evaluate the burden of Helicobacter pylori infection in dyspepsia patients[J]. Indian J Pathol Microbiol, 2016, 59(1): 66-8.
[2]Waldum H L, Hauso, Fossmark R. The regulation of gastric acid secretion-clinical perspectives[J]. Acta Physiol (Oxf), 2014, 210(2): 239-56.
[3]胡团敏, 倪秀琴, 游海梅, 等. 中国闽南地区幽门螺杆菌感染及其基因型调查分析[J]. 中华消化杂志, 2015, 35(4): 262-264.
[4]Ghasemi Kebria F, Bagheri H, Semnani S, et al. Seroprevalence of anti-Hp and anti-cagA antibodies among healthy persons in Golestan province, northeast of Iran (2010)[J]. Caspian J Intern Med, 2011, 2(3): 256-60.
[5]Barrett N A, Austen K F. Licensed to Ill: IL-9 Generation in Immature Mast Cells Permits Food-Elicited Anaphylaxis[J]. Immunity, 2015, 43(4): 626-628.
[6]Tsimmerman IaS, Zakharova IuA, Vedernikova V E. Comparative estimation of diagnostic tests for helicobacter pylori and the spectrum of gastric mucosal microflora in gastritis and ulcer disease[J]. Klin Med (Mosk), 2013, 91(4): 42-48.
[7]Talebkhan Y, Mohammadi M, Mohagheghi M A, et al. CagA gene and protein status among Iranian Helicobacter pylori strains[J]. Dig Dis Sci, 2008, 53(4): 925-932.
[8]Hussein N R, Tunjel I, Majed H S, et al. Duodenal ulcer promoting gene 1 (dupA1) is associated with A2147G clarithromycin-resistance mutation but not interleukin-8 secretion from gastric mucosa in Iraqi patients[J]. New Microbes New Infect, 2015, 4(6): 5-10.
[9]Caliskan R, Sayi Yazgan A, Tokman H B, et al. The cytokine response in THP-1 (monocyte) and HL-60 (neutrophil-differentiated) cells infected with different genotypes of Helicobacter pylori strains[J]. Turk J Gastroenterol, 2015, 26(4): 297-303.
[10]Saber T, Ghonaim M M, Yousef A R, et al. Association of Helicobacter pylori cagA Gene with Gastric Cancer and Peptic Ulcer in Saudi Patients[J]. J Microbiol Biotechnol, 2015, 25(7): 1146-1153.
[11]Cheng S F, Li L, Wang L M. miR-155 and miR-146b negatively regulates IL-6 in Helicobacter pylori (CagA+) infected gastroduodenal ulcer[J]. Eur Rev Med Pharmacol Sci, 2015, 19(4): 607-613.
[12]Chen C Y, Lee J B, Liu B, et al. Induction of Interleukin-9-Producing Mucosal Mast Cells Promotes Susceptibility to IgE-Mediated Experimental Food Allergy[J]. Immunity, 2015, 43(4): 788-802.
[13]Defendenti C, Sarzi-Puttini P, Saibeni S, et al. Significance of serum Il-9 levels in inflammatory bowel disease[J]. Int J Immunopathol Pharmacol, 2015, 28(4): 569-575.
[14]McCracken K W, Catá E M, Crawford C M, et al. Modelling human development and disease in pluripotent stem-cell-derived gastric organoids[J]. Nature, 2014, 516(7531): 400-404.
Study on relationship of cytotoxin associated gene A and interleukin-9 with peptic ulcer
LIU Baozhen1, QU Dongdong2, JIN Shilu1, LIU Jingyun2
(1.DepartmentofGastroenterology,BinzhouPeople′sHospital,Binzhou,Shandong, 256610;2.ClinicalSchool,BinzhouMedicalUniversity,Binzhou,Shandong, 256603)
ObjectiveTo explore the relationship of cytotoxin associated gene A (CagA) and interleukin-9 (IL-9) with peptic ulcer. MethodsA total of 40 patients with peptic ulcer were selected as research group while another 40 patients with chronic gastritis as control group. Serum CagA and IL-9 levels as well as helicobacter pylori (Hp) infection condition were detected in both groups, and univariate and multivariate Logistic regression analysis were conducted to patients with peptic ulcer. ResultsResearch group was markedly higher in serum CagA level but evidently lower in IL-9 level than control group (P<0.001). Research group was notably higher in Hp infection rate and CagA-positive Hp infection rate than control group (P<0.01). Patients with positive CagA+were prominently lower in serum IL-9 level than those with negative CagA-(P<0.01). Logistic regression analysis indicated that CagA+Hp infection, smoking, irregular lifestyle, co-illness with relatives in degree Ⅰ, mental factors and alcoholic consumption were closely associated with the occurrence of peptic ulcer (P<0.01), and CagA+Hp infection had synergistic effect with selected stratification factors in the development of peptic ulcer. ConclusionCagA+Hp infection may be associated with the development of peptic ulcer, and IL-9 has potential inhibitory effect in peptic ulcer induced by Hp infection. And the occurrence of peptic ulcer is in close association with multiple factors.
peptic ulcer; cytotoxin associated gene A; interleukin-9; helicobacter pylori
2016-04-13
中国高校医学期刊临床专项资金(11527692)
屈冬冬, E-mail: Qddcool@163.com
R 573.1
A
1672-2353(2016)17-057-03
10.7619/jcmp.201617018

