慢性萎缩性胃炎镜下萎缩程度与病理相关性
陈珍林

[摘 要] 目的:分析慢性萎缩性胃炎(Chronic atrophic gastritis,CAG)镜下萎缩程度与病理相关性,为CAG提高镜下诊断水平提供参考。方法:以我院2014年6月—2015年6月胃镜初诊CAG倾向的284例患者为研究对象,比较其镜下判断与病理诊断结果,计算镜下各类表现诊断CAG的灵敏度与特异性。结果:284例疑似CAG患者中,病理检查确诊185例,胃镜诊断符合率为65.14%。胃镜下各种表现诊断CAG的特异性均在65%以上,其中黏膜粗糙不平诊断CAG的灵敏度为61.59%,显著高于其他表现,两种表现并存时,其诊断CAG的特异性显著高于单一表现,差异有统计学意义(P<0.05)。胃镜下黏膜粗糙及两种表现并存时,患者中重度黏膜萎缩率、中重度肠上皮化生率显著高于其他表现,差异有统计学意义(P<0.05)。结论:单纯应用胃镜诊断CAG仍存在一定的误诊风险,但随着CAG患者腺体萎缩程度的加剧,其镜下特征逐渐增多,与黏膜萎缩程度、肠上皮化生程度的相关性亦逐渐提高。
[关键词] 慢性萎缩性胃炎;胃镜;萎缩程度;病理;相关性
中图分类号:R573.3 文献标识码:B 文章编号:2095-5200(2016)04-036-03
DOI:10.11876/mimt201604014
慢性萎缩性胃炎(Chronic atrophic gastritis,CAG)是临床公认的胃癌常见癌前病变之一[1]。病理是CAG临床诊断的“金标准”,临床在高度怀疑癌变或难以确诊时方采取病理检查以明确诊断[2]。由于内镜设备及医师诊断水平间存在的差异,胃镜诊断CAG的临床价值仍存在一定争议[3]。笔者就镜下萎缩程度与病理组织学变化的相关性进行了前瞻性分析,现将研究过程与结论报道如下。
1 资料与方法
1.1 一般资料
以我院2014年6月—2015年6月胃镜初诊为CAG倾向,均接受病理组织学检查的284例患者为对象。排除既往有胃大部切除手术史、消化性溃疡史、胃十二指肠疾病史及长期服用非甾体类抗炎药物者。患者年龄33~82岁,临床症状以上腹部不适为主,部分患者存在食欲不振、恶心、呕吐、反酸、嗳气等消化不良症状。
1.2 检查方法及诊断标准
Olympus-GIF260型胃镜(日本奥林巴斯公司),由经验丰富的消化科医师实施内镜检查与记录操作。胃镜检查诊断标准参考相关文献,CAG常见胃镜下表现主要包括[5]:1)黏膜变薄:黏膜红白相间,以白相为主,皱襞变平甚至消失;2)血管显露:部分黏膜下血管网显露;3)黏膜粗糙不平:黏膜及黏膜壁不光滑,表面参差不平,可见黏膜颗粒或结节状表现。
胃镜下取受试者黏膜异常处标本2~3块,使用10%甲醛固定,而后以石蜡包埋切片,行H.E染色[4],由我院两名病理科医师双盲判断,意见不一致时由第三名医师参与讨论决定。
病理组织学检查诊断标准参照《中国慢性胃炎共识意见》(2012年版,上海),病理活检可见腺体萎缩即判定为CAG,萎缩程度分度[6]:轻度:固有腺体减少<1/3;中度:固有腺体减少1/3~2/3;重度:固有腺体减少>2/3;肠上皮化生分度:轻度:肠上皮化生细胞取代<1/3胃粘膜固有细胞;中度:肠上皮化生细胞取代1/3~2/3胃粘膜固有细胞;重度:肠上皮化生细胞取代>2/3胃粘膜固有细胞。
1.3 分析方法
分析胃镜下各临床表现的病理特征、CAG患者病灶分布,计算胃镜、镜下各临床表现诊断CAG的灵敏度、特异性[7]。采用SPSS18.0进行分析,临床表现以(n/%)表示,χ2检验,以P<0.05为有统计学意义。
2 结果
2.1 病理诊断结果与胃镜特征表现
284例疑似CAG患者病理检查确诊185例,胃镜诊断符合率为65.14%。
胃镜下各种表现诊断CAG的特异性均在65%以上,其中黏膜粗糙不平诊断CAG的灵敏度为61.59%,显著高于其他表现,两种表现并存时,其诊断CAG的特异性显著高于单一表现,差异有统计学意义(P<0.05)。见表1。
2.2 胃镜下各种表现与黏膜萎缩程度、肠上皮化生程
度的相关性
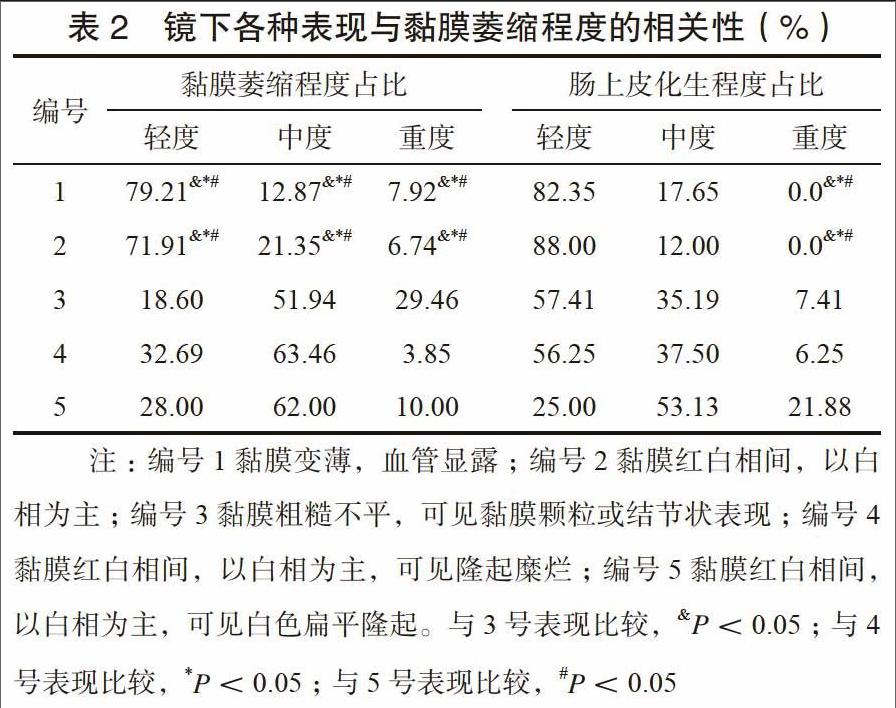
胃镜下黏膜粗糙及两种表现并存时,患者中重度黏膜萎缩率、中重度肠上皮化生率显著高于其他表现,差异有统计学意义(P<0.05),见表2。
3 讨论
近年来,随着内镜器械的不断成熟,内镜下消化道疾病的诊断准确率有所提高[8],但单纯依靠胃镜诊断CAG仍存在一定局限性,主要与胃镜的视觉限制、检查过程中胃腔充气导致的胃腔过度扩张有关[9]。
过往研究表明,CAG胃镜与病理相关性仅为20%~60%,本研究结果示,胃镜与病理检查诊断CAG的符合率为65.14%,笔者进一步分析胃镜下各种常见表现时发现,胃镜下两种表现并存时,其诊断符合率显著高于单一表现,考虑与CAG常与糜烂、溃疡等病变共存有关,上述病变可掩盖胃镜下黏膜萎缩特征,导致诊断准确率受到影响[10]。因此,胃镜检查时见糜烂、溃疡等镜下表现,应仔细观察其边缘及周围状态,多处取检,保证诊断效果。
Yasir等[11]发现,萎缩与肠化改变均具有多灶性、局灶性特点,而胃镜活检仅可取得病灶局部组织,取材范围往往造成病理活检结果受到影响,这表明,仅仅依靠活检亦无法有效保证CAG的早期检出,应在保证活检部位和组织数量的前提下,全面结合镜下特征,高度重视存在镜下黏膜变薄、血管显露、黏膜粗糙不平等表现患者[12]。同时,Young-Eun等[13]将胃小凹黏膜隆起凹陷性病灶作为肠上皮化生的观察指标,其诊断符合率可达85.40%,为今后临床CAG的早期镜下诊断提供了新的方向。
国内报道表明,CAG最常见的发病位置为胃窦[14-15]。本研究病理检查结果显示,185例确诊CAG患者中,胃窦CAG 116例,占62.70%,在印证上述结论的同时,亦提示胃镜检查退镜时需实施反转操作,避免漏诊贲门下区病灶,将检查盲区缩减至最低率[16]。
在腺体萎缩程度及肠上皮化生程度观察中可以发现,胃镜下黏膜粗糙及两种表现并存时,患者中重度黏膜萎缩率、中重度肠上皮化生率显著高于其他表现,说明随着腺体上皮萎缩、修复增生与肠化、异型增生加剧,黏膜增厚逐渐明显,据此可提高CAG检出率,主观预测患者病情进展状态,为临床治疗策略的制定提供参考[17]。此外,Dinis-Ribeiro等[18]指出,若镜下检查考虑为肠化者,可借助美兰染色等方法明确肠化生部位与范围,保证诊断准确率。
综上所述,CAG镜下诊断与病理诊断符合率有限,但随着CAG患者腺体萎缩程度的加剧,其镜下特征逐渐增多,与黏膜萎缩程度、肠上皮化生程度的相关性亦逐渐提高,故应加强CAG镜下特征的认识并重视典型部位活检,以提高CAG的早期诊治率,降低CAG进展至胃癌风险。
参 考 文 献
[1] Mcnicholl A G, Gisbert J P. Response to: Misleading results in the diagnosis of atrophic gastritis.[J]. J Gastroenterol, 2015, 27(1): 104-105.
[2] Mcnicholl A G, Forné M, Barrio J, et al. Accuracy of GastroPanel for the diagnosis of atrophic gastritis.[J]. J Gastroenterol, 2014, 26(9): 941-948.
[3] 魏丽娟. 慢性萎缩性胃炎内镜诊断与病理及Hp相关性研究[D].长春:吉林大学, 2008.
[4] Di M F, Goni E. Misleading results in the diagnosis of atrophic gastritis.[J]. J Gastroenterol, 2014, 26(12): 1439-1440.
[5] 薄元恺, 张金宝, 李冬梅,等. 内镜下胃窦黏膜红白相间表现对慢性萎缩性胃炎的诊断价值[J]. 中华消化内镜杂志, 2010, 27(10):535-537.
[6] 戴威娜. 影响慢性萎缩性胃炎内镜诊断与病理诊断不一致的相关因素分析[D]. 石家庄:河北医科大学, 2010.
[7] Masci E, Pellicano R, Mangiavillano B, et al. GastroPanel? test for non-invasive diagnosis of atrophic gastritis in patients with dyspepsia.[J]. Minerva Gastroenterol Dietol, 2014, 60(1): 79-83.
[8] Miceli E, Padula D, Lenti M V, et al. A laboratory score in the diagnosis of autoimmune atrophic gastritis: a prospective study.[J]. J Clin Gastroenterol, 2015, 49(1): 1-5.
[9] Vanoli A, La Rosa S, Luinetti O, et al. Histologic changes in type A chronic atrophic gastritis indicating increased risk of neuroendocrine tumor development: the predictive role of dysplastic and severely hyperplastic enterochromaffin-like cell lesions[J]. Hum Pathol, 2013, 44(9): 1827-1837.
[10] 余晓云, 陈婕, 郑丽端,等. 激光共聚焦内镜对慢性萎缩性胃炎和肠上皮化生的诊断价值[J]. 临床消化病杂志, 2013, 25(5): 280-282.
[11] Yasir S, Owais K, Moin F, et al. Pernicious Anemia: Non – Gastroscopic Diagnosis of Autoimmune Atrophic Gastritis with Positive Serological Marker[J]. J Med Case Rep, 2014, 2(2): 32-34.
[12] 蒋予, 付娅, 吴建维,等. 醋酸增强内镜技术在慢性萎缩性胃炎及肠上皮化生诊断中的价值[J]. 现代消化及介入诊疗, 2012, 17(6): 313-316.
[13] Young-Eun J, Hyun-Kyung P, Dae-Seong M, et al. Prevalence and Risk Factors of Atrophic Gastritis and Intestinal Metaplasia: A Nationwide Multicenter Prospective Study in Korea.[J]. Gut & Liver, 2013, 7(3): 303-310.
[14] Pogoriler J, Kamin D, Goldsmith J D. Pediatric non-helicobacter pylori atrophic gastritis: a case series.[J]. Am J Surg Pathol, 2015, 39(6): 786-792.
[15] 汤瑜, 向培, 张鑫,等. 窄带成像结合放大内镜在慢性萎缩性胃炎诊断中的应用[J]. 江苏医药, 2013, 39(18): 2189-2190.
[16] Zhang X X, Chen W W, She B, et al. The efficacy and safety of Jian-Wei-Qu-Tong Pills for the treatment of chronic non-atrophic gastritis (spleen and stomach qi deficiency with damp-heat stasis syndrome): study protocol for a phase II, randomized controlled trial[J]. Trials, 2014, 15(1): 1-11.
[17] 李绍琼. 慢性萎缩性胃炎的内镜下形态与组织学改变比较[C]// 中华医学会第七次全国消化病学术会议论文汇编(上册). 2007:340-340.
[18] Dinis-Ribeiro M, Areia M, de Vries A C, et al. Management of precancerous conditions and lesions in the stomach (MAPS): guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP), and the Sociedade Portuguesa de Endoscopia Digestiva (SPED)[J]. Virchows Arch, 2012, 460(1): 19-46.

