西妥昔单抗及氟尿嘧啶对大肠癌细胞放疗敏感性影响
任宏涛 王中卫 王宝锋 王亚利 黄珊 王西京

[摘 要] 目的:分析西妥昔单抗及氟尿嘧啶对大肠癌细胞放疗敏感性影响。方法:选取我院2011年3月—2013年3月收治的100例大肠癌患者,随机数字表法分为单纯放疗组(A组)、西妥昔单抗联合放疗组(B组)、氟尿嘧啶联合放疗组(C组)、西妥昔单抗及氟尿嘧啶联合放疗组(D组),各25例,按照患者组别给予相应治疗,行大肠癌根治术。比较各组患者病理完全缓解(Pathological complete response,pCR)率及2年生存率、复发率,总结西妥昔单抗及氟尿嘧啶对大肠癌细胞放疗敏感性的影响。结果:D组pCR率最高,为24.0%(6/25),但与C组的20.0%(5/25)比较,差异无统计学意义(P>0.05),D组、C组均高于A组的8.0%(2/25)和B组的12.0%(3/25),差异有统计学意义(P<0.05)。各组患者治疗期间毒性反应比较,差异无统计学意义(P>0.05)。D组、B组、C组复发率均为0,其2年DFS、OS均显著高于A组,差异有统计学意义(P<0.05)。结论:西妥昔单抗、氟尿嘧啶均可在一定程度上增强大肠癌细胞放疗敏感性,氟尿嘧啶增敏效果更为显著,两药联合应用并不比氟尿嘧啶单药增敏效果显著。
[关键词] 西妥昔单抗;氟尿嘧啶;大肠癌;放疗;敏感性
中图分类号:R735.3 文献标识码:B 文章编号:2095-5200(2016)04-033-04
DOI:10.11876/mimt201604013
Impact of cetuximab combined with fluorouracil on radiation sensitivity of colorectal carcinoma REN Hongtao,WANG Zhongwei,WANG Baofeng,WANG Yali,HUANG Shan,WANG Xijing. (Department of Oncology,The Second Affiliated Hospital of Xian Jiaotong University,Xian 710004,China)
[Abstract] Objective: To analyze the influence of cetuximab with fluorouracil on radiation sensitivity of colorectal carcinoma. Methods: 100 cases of colorectal cancer patients admitted in our hospital from March 2011 to March 2013 were enrolled for the study. According to random number table, they were randomly divided into radiotherapy (group A), cetuximab plus radiotherapy group (group B), fluorouracil radiotherapy group (group C), fluorouracil combined with cetuximab radiotherapy group (group D), each 25 cases; the patients were treated in accordance with the different groups, conducted with colorectal cancer surgery. Rate of pathological complete response (pCR), 2-year survival rate, recurrence rate were compared among all the groups of patients, the influence of cetuximab with fluorouracil on radiation sensitivity of colorectal carcinoma was analyzed. Results: The pCR rate of group D was 24.0% (6/25) which was highest, but the difference was not statistically significant compared with 20.0% (5/25) of group C (P>0.05); pCR rate of group C and group D were both higher than group A 8.0% (2/25) and group B 12.0% (3/25), the differences were statistically significant (P<0.05). Toxic reaction during the treatment of patients in each group were compared, the differences were not statistically significant (P>0.05). Recurrence rates of group D, group B, and group C were all 0, of which the 2-year DFS and OS were all significantly higher than those of group A, the difference were statistically significant (P<0.05). Conclusions: Both of cetuximab and fluorouracil can be found to increase radiation sensitivity of colorectal cancer cell, sensitizing effect of fluorouracil is more significant, but the sensitizing effect of combination of the two kinds of drugs is not significant than that of fluorouracil.
[Key words] cetuximab;fluorouracil;colorectal cancer;radiotherapy;sensitivity
大肠癌包括结肠癌和直肠癌,其发病率仅次于胃癌、食管癌[1]。目前大肠癌的临床治疗以外科手术为主,多学科综合治疗在提高总体治疗效果中的作用已经得到公认[2]。实体肿瘤中普遍存在乏氧细胞,故放疗增敏尤其重要[3]。增加乏氧细胞对放射的敏感性不只是加大放疗剂量,放疗和化疗药物联合应用亦可有效提高大肠癌细胞放疗敏感性,提高患者病理完全缓解率(pCR率)。我院对应用西妥昔单抗、氟尿嘧啶单药及两药联合应用对大肠癌患者的放疗增敏作用进行对比研究,报道如下。
1 资料与方法
1.1 病例资料
选取我院2011年3月—2013年3月收治的100例大肠癌患者,按照随机数字表法分为单纯放疗组(A组)、西妥昔单抗联合放疗组(B组)、氟尿嘧啶联合放疗组(C组)、西妥昔单抗及氟尿嘧啶联合放疗组(D组),各25例。各组患者年龄、病程、性别、原发部位、病理分期及病理类型比较,差异无统计学意义(P>0.05),具有可比性。本临床研究经我院医学伦理学批准,患者均知情同意并签署知情同意书。
1.2 选取标准及排除标准
选取标准:1)经病理组织学检查,参照卫生部《新编常见恶性肿瘤诊治规范》确诊直肠癌或结肠癌[4];2)肿瘤可测量病灶≥1个,且直径≥1 cm。
排除标准:1)多重大肠癌或合并其他恶性肿瘤;2)合并放化疗禁忌证;3)癌细胞已出现肺部、纵膈、肝脏、腹主动脉旁淋巴结远处转移;4)有直肠手术史或盆腔放化疗治疗史。
1.3 治疗方案
各组患者均接受手术治疗,术后行辅助化疗,持续6~8个月[5]。
放射治疗:放疗设备采用6MV-X线,常规分割,每次剂量2 Gy,每天1次,每周治疗5次,照射剂量60~70 Gy[6]。疗程5~6周。
各组患者在放疗方案基础上,按照组别给予相应用药方案治疗:1)A组:仅接受同步放化疗。2)B组:加用西妥昔单抗注射液(德国霍克大药厂,批准文号S20050095,规格50 mL:100 mg)静脉滴注,首次剂量400 mg/m2,维持量每周250 mg/m2,持续2周。3)C组:加用氟尿嘧啶注射液(江苏吴中医药集团有限公司苏州制药厂,国药准字H32022814,规格10 mL:250 mg)静脉滴注,每日375 mg/m2,持续5 d。4)D组:在放化疗方案基础上加用西妥昔单抗、氟尿嘧啶静脉滴注,用法用量同上。
1.4 观察指标
pCR评判标准[7]:经非手术抗肿瘤治疗后,手术完整切除的组织标本经病理组织学检查未见存活的癌细胞残留。
参照世界卫生组织(WHO)制定的毒性反应标准[8],对各组患者治疗期间脱发、神经毒性、恶心呕吐等毒性反应发生情况进行评价,共分0~IV度,其中Ⅲ度及以上为严重不良反应。
采用门诊随诊、电话随访等形式,对患者进行为期2年的随访,记录其2年无病生存率(DFS)、总生存率(OS)及复发率。
1.5 统计学分析
SPSS20.0软件进行分析,数据以(n/%)表示,并采用χ2检验,检验水准设定为α=0.05,以P<0.05为有统计学意义,以P<0.01为有显著统计学意义。
2 结果
2.1 各组患者pCR比较
D组pCR率最高,为24.0%(6/25),与C组的20.0%(5/25)比较,差异无统计学意义(P>0.05),此两组均高于A组的8.0%(2/25)和B组的12.0%(3/25),差异有统计学意义(P<0.05)。
2.2 各组患者毒性反应比较
各组患者治疗期间毒性反应比较,差异无统计学意义(P>0.05)。见表1。
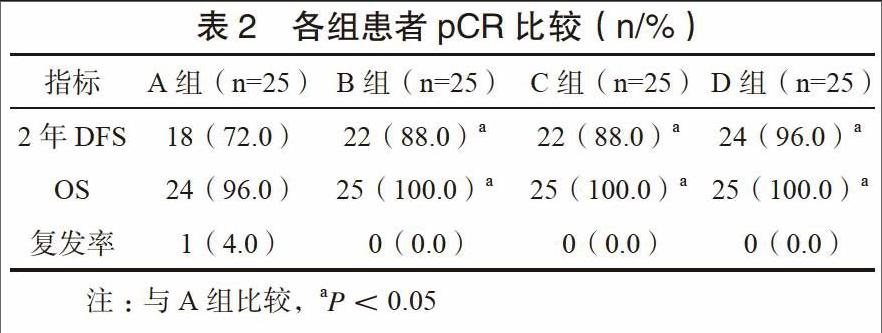
2.3 各组患者随访结果比较
各组患者均获得有效随访,平均随访时间(24.97±1.86)个月。D组、B组、C组复发率均为0,其2年DFS、OS均显著高于A组,差异有统计学意义(P<0.05)。见表2。
3 讨论
放疗是大肠癌局部治疗的主要方法,亦在其综合治疗中扮演了重要角色,但临床大肠癌患者对放疗的敏感性表现存在较大差别,可能与肿瘤自身的异质性及肿瘤细胞乏氧程度的差异有关[9]。而且,在治疗过程中,若放疗剂量超过正常组织耐受范围,极有可能引起消化道出血、疼痛、穿孔等并发症的发生与加重,影响患者耐受性。因此,寻求一种高效、低毒且能够提高大肠癌细胞放疗敏感性的药物,一直是临床研究的重点[10]。
西妥昔单抗是一种人鼠嵌合型IgG 1型抗表皮生长因子受体(EGFR)单抗,可结合受体胞外区,促进受体内化、降解并抑制EGFR信号传导,从而通过细胞毒效应促进肿瘤细胞的杀伤,在近年来各类恶性肿瘤的综合治疗中受到了广泛关注[11]。本研究结果显示,在同步放化疗基础上应用西妥昔单抗,患者pCR率得到了显著提高,说明西妥昔单抗在增强大肠癌细胞放疗敏感性方面具有一定作用,其机制可能为:EGFR通路在肿瘤内分子生物学的动态变化过程中发挥了重要作用,并可参与放疗抵抗,应用EGFR拮抗剂西妥昔单抗后,EGFR通路被阻断,不仅能够抑制肿瘤细胞增殖活化、抑制新生血管生成、抑制癌细胞侵袭和转移,亦可增加大肠癌细胞系放疗敏感性,促进患者预后的改善[12]。
氟尿嘧啶为嘧啶类氟化物,具有抑制胸腺嘧啶核苷酸合成酶、阻断脱氧嘧啶核苷酸转换成胸腺嘧啶核苷酸、干扰RNA及DNA合成的作用,是一种抗代谢肿瘤药,也是临床治疗大肠癌、乳腺癌等恶性肿瘤的首选药物之一[13]。在本次研究中,与B组比较,C组患者获得了更高的pCR率,与Bhardwaj等[14]动物实验结果一致,这主要得益于氟尿嘧啶对DNA合成的抑制,DNA是电离辐射的主要靶点,由于放疗多采用分次照射方法,在两次照射之间肿瘤细胞DNA双键断裂(DSB)的自我修复是导致放疗敏感性下降的主要原因[15-16];氟尿嘧啶对肿瘤细胞修复基因表达的抑制作用可使得DSB修复过程受阻,在控制肿瘤进展的同时,进一步上调大肠癌细胞放疗敏感性,保证治疗效果[17-18]。
本研究结果各组pCR率表明由于西妥昔单抗与氟尿嘧啶作用机制不同,故其联合应用对提高患者放疗敏感性的提高有着一定的作用,但对pCR的改善作用并不显著。与此同时,联合应用西妥昔单抗及氟尿嘧啶并未导致患者毒性反应增加,说明该方案的安全性亦值得肯定,且较单纯放疗而言,该方案能够进一步提高患者2年DFS及OS,对其预后及生存质量的改善具有明显积极意义。
本研究的局限性在于样本量较小,且随访时间有限,未能明确该方案对患者远期预后的影响。总体而言,西妥昔单抗及氟尿嘧啶能够显著提高大肠癌细胞放疗敏感性,在保证治疗安全性的前提下有效改善患者预后、保证生存质量,具有良好的临床前景,值得进一步研究与推广。
参 考 文 献
[1] 杜灵彬, 余传定, 汪祥辉,等. 浙江省四个肿瘤登记地区2006年恶性肿瘤发病率与死亡率分析[J]. 中华肿瘤防治杂志, 2010, 17(16):1244-1248.
[2] SALENDO J, SPITZNER M, KRAMER F, et al. Identification of a microRNA expression signature for chemoradiosensitivity of colorectal cancer cells, involving miRNAs-320a, -224, -132 and let7g[J]. Radiother Oncol, 2013, 108(3): 451-457.
[3] 徐小雯, 袁捷, 左志贵, 等. 与放疗抵抗相关的长链非编码 RNA 在不同放疗敏感性结直肠癌细胞株中的表达[J]. 中华胃肠外科杂志, 2014, 17(11): 1096-1100.
[4] LYNAM-LENNON N, REYNOLDS JV, MARIGNOL L, et al. MicroRNA-31 modulates tumour sensitivity to radiation in oesophageal adenocarcinoma[J]. J Mol Med, 2012, 90(12): 1449-1458.
[5] STEGEMAN H, KAANDERS JH, VAN DER KOGEL AJ, et al. Predictive value of hypoxia, proliferation and tyrosine kinase receptors for EGFR-inhibition and radiotherapy sensitivity in head and neck cancer models[J]. Radiother Oncol, 2013, 106(3): 383-389.
[6] GREEN BL, MARSHALL HC, COLLINSON F, et al. Long-term follow-up of the Medical Research Council CLASICC trial of conventional versus laparoscopically assisted resection in colorectal cancer[J]. Br J Surg, 2013, 100(1): 75-82.
[7] ZHAO Y, DENG X, WANG Z, et al. Genetic polymorphisms of DNA repair genes XRCC1 and XRCC3 and risk of colorectal cancer in Chinese population[J]. Asian Pac J Cancer Prev, 2012, 13(2): 665-669.
[8] 苏玉飞. 自噬诱导对大肠癌细胞放射敏感性的影响[D]. 苏州: 苏州大学, 2015.
[9] SMITH JD, RUBY JA, GOODMAN KA, et al. Nonoperative management of rectal cancer with complete clinical response after neoadjuvant therapy[J]. Ann Surg, 2012, 256(6): 965-972.
[10] 左志贵, 于志奇, 高显华, 等. 表皮生长因子受体表达及其下游基因突变与结直肠癌细胞放射敏感性的关系[J]. 中华胃肠外科杂志, 2013, 16(8): 753-758.
[11] Schoen R E, Pinsky P F, Weissfeld J L, et al. Colorectal-cancer incidence and mortality with screening flexible sigmoidoscopy[J]. New Engl J Med, 2012, 366(25): 2345-2357.
[12] KIMPLE RJ, SMITH MA, BLITZER GC, et al. Enhanced radiation sensitivity in HPV-positive head and neck cancer[J]. Cancer Res, 2013, 73(15): 4791-4800.
[13] Gao C, Kozlowska A, Nechaev S, et al. TLR9 signaling in the tumor microenvironment initiates cancer recurrence after radiotherapy[J]. Cancer Res, 2013, 73(24): 7211-7221.
[14] Bhardwaj V, Cascone T, Cortez M A, et al. Modulation of c‐Met signaling and cellular sensitivity to radiation[J]. Cancer, 2013, 119(10): 1768-1775.
[15] SMIT JK, FABER H, NIEMANTSVERDRIET M, et al. Prediction of response to radiotherapy in the treatment of esophageal cancer using stem cell markers[J]. Radiother Oncol, 2013, 107(3): 434-441.
[16] 朱梁军, 李晟, 冯继锋, 等. 西妥昔单抗联合 FOLFIRI 双周方案在野生型 K-Ras 基因晚期结直肠癌患者中的Ⅱ期临床观察[J]. 临床肿瘤学杂志, 2013, 18(1): 39-44.
[17] BISKER G, YEHESKELY-HAYON D, MINAI L, et al. Controlled release of Rituximab from gold nanoparticles for phototherapy of malignant cells[J]. J Control Release, 2012, 162(2): 303-309.
[18] ETIENNE-GRIMALDI MC, BENNOUNA J, FORMENTO JL, et al. Multifactorial pharmacogenetic analysis in colorectal cancer patients receiving 5-fluorouracil-based therapy together with cetuximab-irinotecan[J]. Br J Clin Pharmacol, 2012, 73(5): 776-785.

