共聚焦显微镜在感染性角膜炎诊断及疗效判定中应用价值
杨华 唐德荣
[摘 要] 目的:分析共聚焦显微镜(In vivo confocal microscopy,IVCM)在感染性角膜炎诊断及病情评估中应用价值。方法:选取2011年3月—2015年3月收治的98例感染性角膜炎住院患者,于治疗前行IVCM、角膜刮片镜检及溃疡标本细菌、真菌培养,而后行保守治疗,治疗失败者行角膜移植或眼内容物剜除。分别于治疗2周、治疗1个月后再次行IVCM检查,评价治疗效果。结果:IVCM共检出真菌感染70例,检出率89.7%,检出细菌感染28例,检出率90.3%,总检出率为89.9%;角膜刮片镜检共检出感染性角膜炎64例,总检出率58.7%,其总检出率显著低于IVCM检查,差异有统计学意义(P<0.05)。98例患者中,行保守治疗的患者,病原菌平均浸润深度为(64.37±8.85)μm,行手术治疗的患者,病原菌平均浸润深度为(69.52±9.71)μm。患者治疗2周后治愈率为0,治疗1个月后治愈率为67.3%。结论:作为一种无创诊断方式,IVCM在感染性角膜炎的早期诊断中具有较高价值,同时可准确评估患者病情改变,指导治疗方案的实施与预后评价,在感染性角膜炎临床诊治中均发挥了重要作用。
[关键词] 共聚焦显微镜;感染性角膜炎;诊断
中图分类号:R772.2 文献标识码:B 文章编号:2095-5200(2016)04-023-04
DOI:10.11876/mimt201604009
Discussion on the application value ofIn vivo confocal microscopy (IVCM) in diagnosing and treatinginfectious keratitis YANG Hua1,TANG Derong2. (1.Health Management Center,Xijing Hospital,Xian 710032,China;2. Department of Ophthalmology,Ankang city central Hospital,Ankang 725000,China)
[Abstract] Objective: Analyze the application value of IVCM in diagnosing and assessing infectious keratitis.Methods: 98 patients with infectious keratitis hospitalized from March, 2011 to March 2015 were selected and checked with IVCM, microscopic examination of cornea smear, germ and fungi cultivation in ulcer, then they were treated with conservative methods. For patients who failed to recover, cornea was transplanted and eye imputieswas removed. Results: Through IVCM, 70 cases of fungi were detected (89.7%) and 28 cases of germs were discovered (90.3%). The overall detection rate was 89.9%. Through microscopic examination of cornea smear, 64 cases of infectious keratitis were detected, the overall detection rate standing as 58.7%, which is remarkably lower than that of IVCM. The difference is statistically significant(P<0.05). Of the 98 patients, the patients who underwent conservative treatment had an average infiltration depth of (64.37±8.85)μm while the patients who underwent surgery had an average infiltration depth of (69.52±9.71)μm. After two months the healing rate was zero and after a month the healing rate was 67.3%.Conclusions: As a noninvasive diagnosis, IVCM has a relatively high value in the early diagnosis of infectious keratitis, can accurately assess change of conditions and provide guidance for implementing treatment plan and assessment of prognosis, thus playing an important role in the clinical diagnosis and treatment of infectious keratitis.
[Key words] IVCM, infectious keratitis;diagnosis
感染性角膜炎是最常见的致盲性角膜疾病之一,好发于户外工作者,其致病因素以细菌、真菌及病毒为主,并与植物性外伤有关[1]。若感染性角膜炎早期病变局限时可得到控制,患者预后一般较为理想;若已出现角膜穿孔或发生眼内炎,预后往往较差,甚至需行眼球摘除。因此,感染性角膜炎治疗的关键在于早期明确诊断[2]。
临床诊断该病主要依据接触史、临床表现、角膜刮片镜检及培养,但培养假阴性率高、耗时长,检出率不足65%[3]。共聚焦显微镜(In vivo confocal microscopy,IVCM)是一种新型活体生物检查技术,可通过动态观察角膜组织细胞形态,快速、无创地完成诊断,在各类眼表疾病诊断中受到了广泛关注。为明确IVCM在感染性角膜炎诊断及治疗中的应用价值,选取2011年3月—2015年3月收治的98例感染性角膜炎住院患者进行前瞻性研究,现就研究方法与结果报道如下。
1 一般资料
选取我院2011年3月—2015年3月收治的98例感染性角膜炎患者,其中男61例,女37例,左眼52例,右眼46例,年龄23~69岁,病程5 ~37 d,平均(21.60±8.85)d,职业:农民65例,工人29例,无业4例;病因:角膜植物性外伤64例,异物剔除10例,其他24例。患者均存在不同程度的眼部不适或疼痛、畏光、视力下降等症状,并伴有角膜水肿、角膜溃疡、房水浑浊、纤维素样渗出或前房积脓等临床体征。以角膜溃疡标本实验室培养结果为金标准,确诊感染性角膜炎[4]。
2 研究方法
2.1 标本采集及检查
严格无菌操作,于手术或治疗时,行表面麻醉角膜溃疡物刮取,伴有前房积脓患者,行玻璃体腔或前房穿刺,取玻璃体或防水送检。使用Bact/ALERT? 3D 全自动血培养仪(法国生物梅里埃公司)行标本培养,将培养结果阳性标本转种于血琼脂培养基、麦康凯琼脂及萨布罗琼脂行分离培养,使用VITEK 2 Compact 全自动鉴定系统(法国生物梅里埃公司)行菌种鉴定。质控菌株为大肠埃希菌(ATCC25922)、铜绿假单胞菌(ATCC27853)、金黄色葡萄球菌(ATCC25923),均购自卫生部临床检验中心。
2.2 检查方法
IVCM检查:0.4%盐酸奥布卡因滴眼液滴眼3次,于激光共聚焦显微镜(德国海德堡公司)的圆锥物镜涂抹眼用凝胶,将无菌角膜接触帽盖住物镜。使用开睑器将患者眼睑打开,将其下颌部置于检查架上,保持前额紧贴检查架。嘱患者注视前方凝视光点,逐渐前移物镜,使物镜通过凝胶接触角膜,保持患者静止。缓慢调节手柄,于角膜表面移动物镜,获取角膜各层扫描图像。对角膜溃疡病灶区及其周围区域行全面扫描,选取清晰、有价值图像进行保存,通过计算机分析软件进行测量分析[5]。每名患者检查前均更换无菌帽,全部操作均由同一名经验丰富的医师在同一台机器上完成。
角膜刮片镜检:0.4%盐酸奥布卡因滴眼液滴眼3次,于溃疡浸润处刮取坏死角膜组织,将刮取物置于载玻片上,行Gram染色,30 min后于光镜下观察查找菌丝或孢子。
2.3 治疗与疗效评价
患者入院后均立即接受经验性抗菌药物全身及局部应用治疗,待培养结果明确感染类型及菌种后,按照其耐药性选用敏感性较高的药物。治疗期间间断应用碘酊烧灼清创[6]。
分别于治疗2周后、治疗1个月后行IVCM检查,参照文献标准对其临床疗效进行评价[7]:治愈:角膜炎完全消失,角膜荧光素染色阴性,前房反应及积脓消失,角膜水肿减退,角膜遗留瘢翳,视力完全恢复或部分恢复;好转:角膜炎显著减轻,角膜荧光素染色阳性,前房反应及积脓消失,角膜水肿显著改善,视力有所恢复;无效:不符合上述标准。
2.4 统计学分析
以SPSS18.0进行分析,计数资料以(n/%)表示,χ2检验,计量资料以(x±s)表示,t检验,以P<0.05为有统计学意义。
3 结果
3.1 病原菌分布
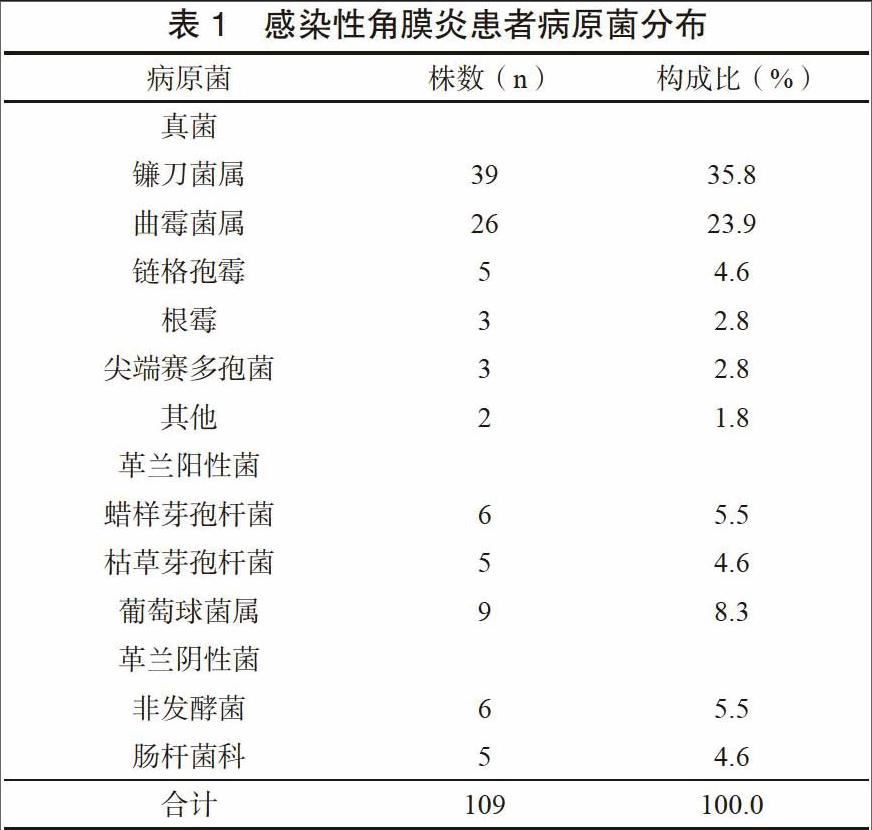
98例患者共检出病原菌109株,其病原菌以真菌为主,占71.6%,其次为革兰阳性菌,占18.3%,格兰阴性菌占10.1%。见表1。
3.2 IVCM及角膜刮片检查结果
IVCM共检出真菌感染70例,检出率89.7%,检出细菌感染28例,检出率90.3%,总检出率为89.9%。IVCM显示的真菌图像为相对较暗的背景中,可见明亮细长、扭曲、分叉、无规则走形的高反光物质,菌丝形态各异,部分菌丝可聚集成团块状;IVCM显示的细菌图像为角膜上皮可见大量圆形、高反光炎症细胞浸润。患者病原菌浸润深度范围在7 ~217μm不等,平均深度为(67.92±8.41)μm。
角膜刮片镜检共检出感染性角膜炎64例,总检出率58.7%,其总检出率显著低于IVCM检查,差异有统计学意义(P<0.05)。
3.3 疗效
98例患者中,52例经保守治疗后感染得到明显控制,其余46例因保守治疗效果不佳接受手术治疗。行保守治疗的患者,病原菌平均浸润深度为(64.37±8.85)μm,行手术治疗的患者,病原菌平均浸润深度为(69.52±9.71)μm,其病原菌浸润深度比较,差异无统计学意义(P>0.05)。
患者治疗2周后治愈率为0,治疗1个月后治愈率达67.3%。治疗后1个月治愈患者IVCM检查可见溃疡灶消失,病灶局部出现胶原纤维增生,呈瘢痕化改变,基质间存在皱褶样暗纹。
4 讨论
感染性角膜炎是病原菌侵袭角膜引发的角膜炎症性疾病,在世界范围内发病率约为6.3~710/千万,随着工业的发展及居民生活习惯的变化,近年来感染性角膜炎的发病率呈显著上升趋势[8]。快速、准确的病原学诊断是保证及时、合理、有效治疗的基础,也是改善患者预后、阻断病情进展的重要前提。目前感染性角膜炎的临床诊断主要依赖病史调查、裂隙灯检查、病灶刮片镜检及病原微生物培养等,但均存在不同程度的局限性,如病史调查易受主观因素影响,裂隙灯放大倍数仅为40倍,角膜刮片镜检阳性率较低,病原微生物培养耗时较长等[9]。在本次研究中,角膜刮片镜检总检出率仅为58.7%。
作为一种非侵入性图像采集设备,IVCM放大倍数可达400倍,能够在无创前提下获得角膜、角膜缘及结膜高清晰图像,从而在细胞水平分析眼表结构,具有较好的直观性,且重复性佳。本研究结果示,IVCM对感染性角膜炎的总检出率达到89.9%,与梁庆丰等[10]研究结果一致,体现出该方法在感染性角膜炎早期诊断中的良好作用。
孙中华[11]指出,真菌性角膜炎是感染性角膜炎首位致盲原因,且其早期临床表现特异性有限,多数患者在确诊时病情已发生快速进展,有较高的角膜穿孔及眼内炎风险,需接受手术治疗,导致预后不够理想。在本次研究中,我们发现,感染性角膜炎患者感染病原菌以真菌为主,占71.6%,且其治疗2周后治愈率为0,治疗1个月后治愈率也仅为67.3%,表明真菌性角膜炎的早期诊断十分重要。通过IVCM检查,真菌性角膜炎早期丝状高反光带可早期发现,即使无法明确真菌均属,已可在该病的早期治疗中发挥指导作用。
细菌性角膜炎的病原菌以革兰阳性菌为主,由于细菌体积较小,即便IVCM亦无法直接发现细菌的存在,因此,在细菌性角膜炎的诊断中,应仔细观察病变组织周围的细胞形态学特征,对炎症细胞的类型做出鉴别。Kobayashi等[12]认为,角膜组织中细菌病原体周围可见大量活化的树突状细胞及相关炎症细胞,可为该病的诊断提供参考。
与此同时,IVCM的无创性及可重复性在感染性角膜炎的治疗及随诊中亦发挥了较佳作用。Kurbanyan等[13]运用IVCM观察真菌性角膜炎患者治疗期间角膜组织变化情况,发现通过真菌菌丝长度及折光度能够明确患者病情转归,且与金标准有着良好的一致性;Hong等[14]使用白光IVCM监测细菌性角膜炎患者角膜愈合及炎症过程,为疾病的治疗及预后评估提供了重要参考。本研究使用IVCM检查结果评价患者病原菌平均浸润深度及临床疗效,均取得了可靠的结论,说明IVCM在评估患者病情变化、指导临床治疗方案方面均具有重要价值。需要注意的是,目前IVCM技术、操作体系尚未完善,仅处于初级起步阶段,因此,关于如何在检查中进一步减轻患者不适感、提高对菌属的分辨能力,仍是今后研究的主要方向[15]。
参 考 文 献
[1] 熊健,周文天. 活体共聚焦显微镜在感染性角膜炎诊断应用进展[J]. 中国实用眼科杂志,2014,32(8):934-938.
[2] HAMRAH P,SAHIN A,DASTJERDI MH,et al. Cellular changes of the corneal epithelium and stroma in herpes simplex keratitis: an in vivo confocal microscopy study[J]. Ophthalmol,2012,119(9):1791-1797.
[3] VADDAVALLI PK,GARG P,SHARMA S,et al. Role of confocal microscopy in the diagnosis of fungal and acanthamoeba keratitis[J]. Ophthalmol,2011,118(1):29-35.
[4] 王学勇,王绪梅. 共聚焦显微镜在真菌性角膜炎中的应用[J]. 国际眼科杂志,2011,11(2):311-312.
[5] M?LLER RT,ABEDI F,CRUZAT A,et al. Degeneration and Regeneration of Subbasal Corneal Nerves after Infectious Keratitis: A Longitudinal In Vivo Confocal Microscopy Study[J]. Ophthalmol,2015,122(11):2200-2209.
[6] M?LLER RT,POURMIRZAIE R,PAVAN-LANGSTON D,et al. In Vivo Confocal Microscopy Demonstrates Bilateral Loss of Endothelial Cells in Unilateral Herpes Simplex Keratitis[J]. Invest Ophthalmol Vis Sci,2015,56(8):4899-4906.
[7] 王效武,郑晓汾,赵炬伟. 共焦激光角膜显微镜在真菌性角膜炎诊断中的应用[C]// 国际角膜病学术研讨会.2006:839-840.
[8] HILLENAAR T,VAN CLEYNENBREUGEL H,VERJANS GM,et al. Monitoring the inflammatory process in herpetic stromal keratitis: the role of in vivo confocal microscopy[J]. Ophthalmol,2012,119(6):1102-1110.
[9] Muller R T,Pourmirzaie R,Aggarwal S,et al. In Vivo Confocal Microscopy Reveals Differential Corneal Immune Response in Patients with Central vs. Peripheral HSV Keratitis[J]. Invest Ophthalmol Vis Sci,2014,55(13):2846-2846.
[10] 梁庆丰,孙旭光,LABBE Antoine. 活体共聚焦显微镜在感染性角膜炎诊治中的应用[J]. 中华眼科杂志,2013,49(10):951-955.
[11] 孙中华. 激光共聚焦显微镜在棘阿米巴角膜炎诊疗中的应用(附病例报告)[D].济南:山东大学,2012.
[12] KOBAYASHI A,YOKOGAWA H,YAMAZAKI N,et al. In vivo laser confocal microscopy findings of radial keratoneuritis in patients with early stage Acanthamoeba keratitis[J]. Ophthalmol,2013,120(7):1348-1353.
[13] KURBANYAN K,HOESL L M,SCHREMS W A,et al. Corneal nerve alterations in acute Acanthamoeba and fungal keratitis: an in vivo confocal microscopy study[J]. Eye,2012(1):126-132.
[14] HONG J,LE Q,DENG SX,et al. Pseudomonas aeruginosa keratitis misdiagnosed as fungal keratitis by in vivo confocal microscopy: a case report[J]. BMC Res Notes,2014,7:907.
[15] YAMAGUCHI T,CALVACANTI BM,CRUZAT A,et al. Correlation between human tear cytokine levels and cellular corneal changes in patients with bacterial keratitis by in vivo confocal microscopy[J]. Invest Ophthalmol Vis Sci,2014,55(11):7457-7466.

