冷鲜鸡产气荚膜梭菌及其毒素的潜在危害分析
马 壮,彭新宇,叶得河,高 彪,袁明贵,尹烨华,徐志宏(.甘肃农业大学动物医学院,甘肃 兰州 730070;.广东省农科院动物卫生研究所,广东 广州 50640)
冷鲜鸡产气荚膜梭菌及其毒素的潜在危害分析
马 壮1,2,彭新宇2,叶得河1,高 彪2,袁明贵2,尹烨华2,徐志宏2
(1.甘肃农业大学动物医学院,甘肃 兰州 730070;2.广东省农科院动物卫生研究所,广东 广州 510640)
为调查广州市冷鲜鸡产气荚膜梭菌及其毒素危害,从广州市各大型超市随机采集鸡肉样品进行产气荚膜梭菌分离、鉴定和毒素分型,同时检测分离菌株对常用抗生素的抗药性,并采用Eric-PCR对分离出梭菌进行亚型分析。结果表明,从78个样本中分离出57株产气荚膜梭菌,所有菌株均为A型,其中,cpb2(Atypical)型40株,cpb2(consensus)型1株;含netB基因菌株1株;药敏结果显示,分离出的产气荚膜梭菌大部分对氟苯尼考、氨苄西林、青霉素敏感;值得注意的是产气荚膜梭菌分离株对仅可用于人的抗生素克林霉素、头孢氨卞的耐药率分别达73.68%和31.58%。Eric-PCR结果显示,相似性为80%时,57株梭菌可分为13个亚型,提示污染来源的多样性。
冷鲜鸡;产气荚膜梭菌;毒素;耐药性;Eric-PCR
马壮,彭新宇,叶得河,等. 冷鲜鸡产气荚膜梭菌及其毒素的潜在危害分析[J].广东农业科学,2016,43(8):113-118.
产气荚膜梭菌(Clostridium perfringens)是一种在自然界和动物肠道中广泛存在的革兰氏阳性芽孢杆菌[1],在一定条件下可引起人和动物发病[2],如可致鸡坏死性肠炎和人的食物中毒、创伤性气性坏疽等,是一种条件性致病菌。该种梭菌能产生多种致病性外毒素,其中α、β、ε、ι是主要致死毒素,据此,将产气荚膜梭菌分为A、B、 C、D、E5种类型[3],其中A型是对人和禽类产生主要致病性的菌株。产气荚膜梭菌中的β2毒素的编码基因分为cpb2 (Consensus)和cpb2(Atypical)两种,β2毒素与其对人的致病性有关[4];netB毒素[5]是一种新发现的毒素,据国外研究报道,这种新毒素与鸡坏死性肠炎密切相关。
产气荚膜梭菌对养鸡业具有重大经济影响,据估计,全世界每年因坏死性肠炎所致养鸡业经济损失高达20亿美元以上。目前控制鸡产气荚膜梭菌的通用方法是在饲料中添加饲用抗生素。但出于对细菌耐药性及其传播的担忧,世界上越来越多的国家开始限制乃至禁止在饲料中添加抗生素和化学药,而这使得鸡产气荚膜梭菌引起的坏死性肠炎发病率显著升高,进而造成在肉鸡制品中该菌污染机会增加。国外已有较多鸡肉中产气荚膜梭菌及毒素情况的报道,而国内还未见冷鲜鸡中产气荚膜梭菌及毒素的系统研究报道。
本文通过对广州市超市中冷鲜鸡肉样品中产气荚膜梭菌进行分离鉴定、毒素分型及抗药性分析、基因分型等,对广州市冷鲜鸡中产气荚膜梭菌及其毒素的危害进行分析,为防范鸡产气荚膜梭菌及其毒素可能引起的食品安全风险提供参考。
1 材料及方法
1.1试验材料
产气荚膜梭菌标准菌株:A型产气荚膜梭菌(ATCC13124)购于广东省微生物菌种保藏中心;B型(CVCC54)和C型(CVCC58)产气荚膜梭菌购于中国兽医微生物菌种保藏中心。netB质粒:由澳大利亚国立动物健康研究所Anthony Keyburn博士等提供;cpb2 (Consensus)和cpb2(Atypical)两种基因型菌株由本实验室分离保存。
冷鲜鸡翅购自广州各大型超市,4℃冷藏保存运至实验室。
主要试剂:液体硫乙醇酸盐培养基(FT)、胰月示-亚硫酸盐-环丝氨酸琼脂培养基(TSC)、胰月示-亚硫酸盐-环丝氨酸琼脂培养基配套试剂、血平板、牛乳培养基、微量生化发酵管:均购自于青岛海博生物技术有限公司;2.5 L厌氧产气袋:日本株式会社生产;药敏片:杭州微生物;PCR反应液(2×Taq MasterMix)。
主要实验仪器:PCR仪:MJMini BIORAD;生物安全柜:J11101110(苏州安泰空气技术有限公司);低温离心机:centrifuge 5804R eppendorf;凝胶成像仪:ZF-258(上海嘉鹏科技有限公司)、电泳仪:DYY-8C型(北京市六一仪器厂);微需氧培养系统:MPI(广州市尤德生物科技有限公司)。
PCR引物:(1)多重PCR引物[6],预期片段大小分别为α402 bp、β236 bp、ε 541 bp、ι317 bp(表1)。(2)产气荚膜梭菌3个毒素基因,netB 383 bp、cpb2(Consensus )304 bp和cpb2(Atypical) 741 bp[7]引物(表2)。(3)Eric-PCR 引物[8],ERIC 1:5- ATGTAA GCTCCTGGGGATTCAC-3 ;ERIC2:5-AAGTAA GTGACTGGGGTGAGCG-3。以上引物均由上海生工生物工程股份有限公司合成。
1.2试验方法
1.2.1产气荚膜梭菌的分离鉴定 (1)细菌分离。无菌称取20 g鸡肉样品,剪碎,置于50 mL小烧杯中,并加入适量FT(液体硫乙醇酸盐培养基)浸没鸡肉,并用力摇晃使鸡肉和FT培养基充分混合,45℃厌氧培养20 h;用接种环蘸取以上培养过后的液体接种于TSC平板(胰䏡-亚硫酸盐-环丝氨酸琼脂培养基),45℃厌氧培养1~2 d;在TSC平板上长出黑色菌落的,从每个中挑选黑色的菌落接种于血平板上,45℃厌氧培养24 h;再在血平板上挑选具有双层溶血环的单个菌落接种于10 mL的液体硫乙醇酸盐培养基中,45℃厌氧过夜培养。

表1 多重PCR引物序

表2 毒素引物序列
(2)生化鉴定。将阳性对照菌株和疑似菌株的单菌落分别接种于各种生化发酵管中,37℃厌养培养24 h,观察结果。
(3)牛乳发酵试验:将阳性菌株和疑似菌株接种于含有牛乳培养基中,37℃厌氧培养24h,观察是否有爆乳发酵现象。
1.2.2菌株的毒素基因分型 (1) DNA的提取。采用煮沸法提取DNA,从各过夜培养过的培养物中用移液枪各吸取1 mL菌液于2 mL无菌离心管中,10 000 r/min常温下离心3 min,弃去上清液,加入300 μL PBS缓冲液,涡旋振荡混匀、洗涤菌体再离心,反复两次;向菌体沉淀中加入100 μL无核酸酶水,涡旋振荡混匀,100℃煮沸10 min;4℃10 000 r/min离心15 min,取上清液作为DNA模板。
(2)PCR鉴定。PCR反应体系中,所有引物浓度均为10 pmol/μL,上下游引物各为0.5 μL,每个PCR反应体系的最终体积为25 μL,2×MixMaster 12.5 μL,无核酸酶水9.5 μL,DNA模板2 μL。
多重PCR反应程序:94℃预热2 min;94℃变性45 s,50℃退火30 s,72℃延伸45 s,30个循环;之后72℃延伸10 min,然后保持在4℃。netB、cpb2(Consensus)和cpb2(Atypical)3对引物的反应程序如下:94℃预变性2 min,-94℃45 s,退火温度50~55℃ 30 s,72℃ 45 s,共30个循环;循环最后72℃ 5 min,4℃保存。其中netB的退火温度为55℃,cpb2(Consensus)和cpb2(Atypical)的退火温度为50℃。
取扩增产物8 μL,1%的琼脂糖凝胶,90v电泳45 min,在紫外下拍照分析。
1.2.3药敏实验 按照CLSI标准推荐的方法选取11种常用的抗生素进行药敏实验。将分离鉴定过的产气荚膜梭菌在FT培养基上培养8~10 h,取300 μL培养过的菌液加入另一个试管中,用灭菌生理盐水稀释,使其与0.5麦氏标准浓度一致(细菌浓度大致为1.5×108CFU/mL),在FT平板上均匀涂布接种,3~5 min后,用灭菌镊子放置药片,各纸片中心相距大于24 cm,纸片聚平皿内缘大于15 cm; 38℃厌氧培养24 h (3个重复)。用游标卡尺测量抑菌圈直径 。
结果判定标准:抑菌圈直径大于15 mm为敏感,10~15 mm为中敏,小于10 mm为耐药。1.2.4 Eric-PCR PCR反应体系:25μL反应体系,DNA模板2 μL、上下游引物(10 pmol/ μL)各1 μL、2×MixMaster 12.5 μL、无核酸酶水8.5 μL。
PCR反应程序:94℃5 min;94℃1 min,32℃ 1 min,72℃2 min,前5个循环;后40个循环94℃ 30 s,48℃ 30 s,72℃ 1 min。最后72℃,10 min,8℃ 保存。
电泳:PCR反应结束后用1%的琼脂糖电泳检测,每个样品加8 μL,80V电泳45 min,照相结果通过NTSYS软件聚类分析。
2 结果与分析
2.1鸡肉中梭菌的分离鉴定结果
通过选择性培养基的筛选分离发现,78个鸡肉样本中有57个样品中分离出疑似菌株;生化实验结果表明,疑似菌株能发酵葡萄糖、乳糖、蔗糖、麦芽糖、棉子糖、液化明胶、产生硫化氢、硝酸盐还原反应,不发酵甘露醇、山梨醇、水杨苷阴性、动力性试验阴性、不产生吲哚,这些生理生化特性与产气荚膜梭菌一致,因此可认为这些细菌为产气荚膜梭菌阳性菌株(图1~图3)。
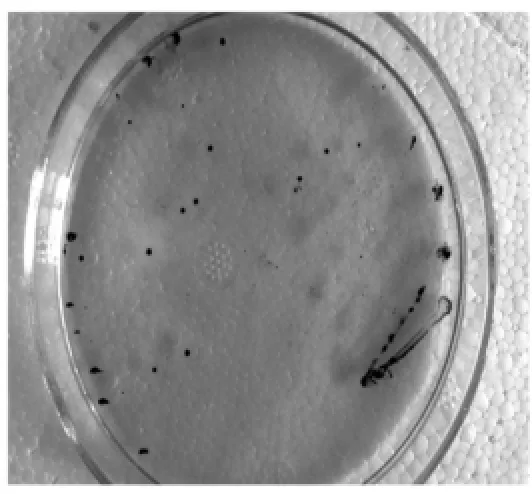
图1 产气荚膜梭菌在TSC平板上生长形成典型黑色菌落
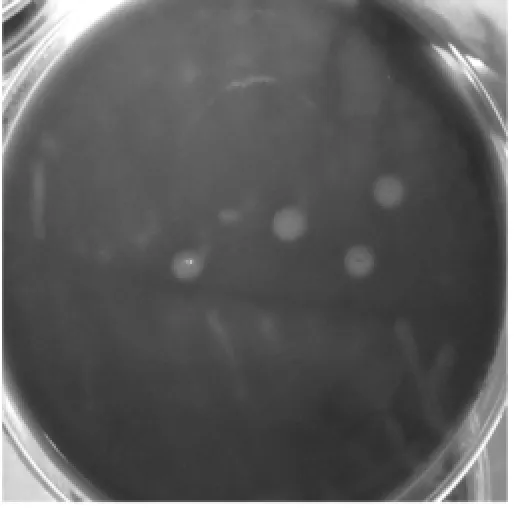
图2 产气荚膜梭菌在血平板上生长形成溶血环

图3 牛乳爆裂发酵现象
毒素基因PCR结果表明,所有菌株均为产气荚膜梭菌A型菌株,其中含netB基因1株,cpb2(Atypical)型40株,cpb2(Consensus)型1株(图4~图7)。
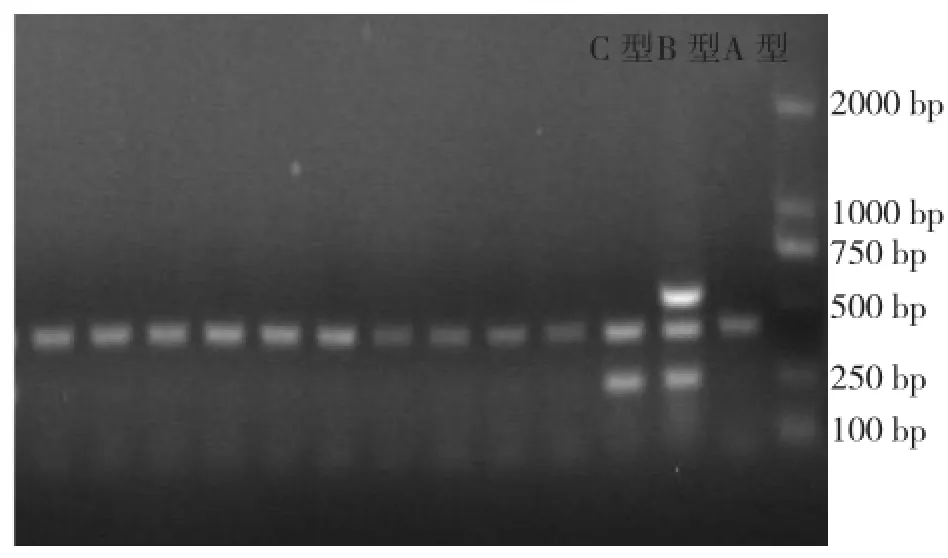
图4 多重PCR结果
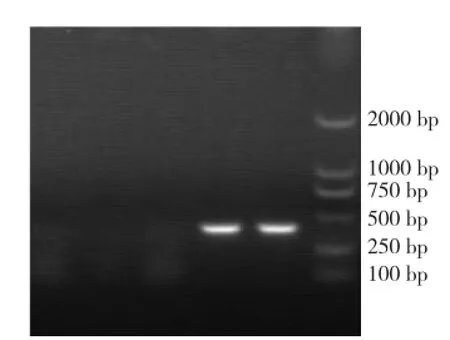
图5 netB基因PCR结果
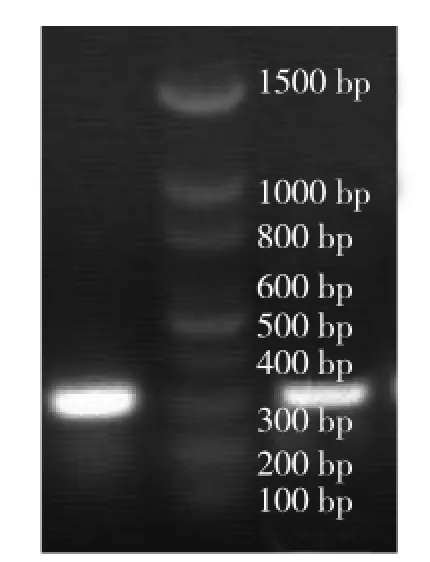
图6 cpb2(Consensue)基因PCR结果
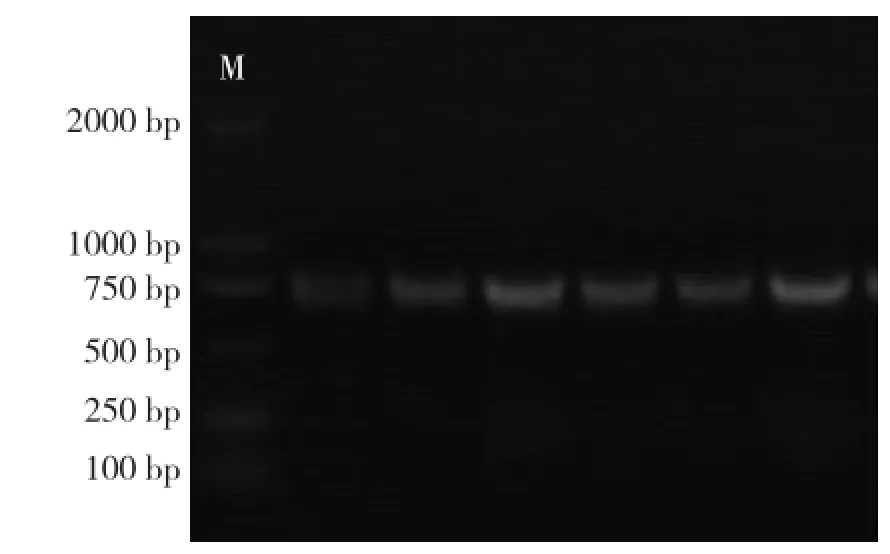
图7 cpb2(Atypical)基因PCR结果
2.2药敏实验结果
药敏结果(表3)显示,57株鸡源性产气荚膜梭菌对多西环素、红霉素、诺氟沙星、林可霉素和土霉素耐药性严重;对头孢氨苄有部分耐药;对氨苄西林、青霉素较敏感,对氟苯尼考无耐药性。
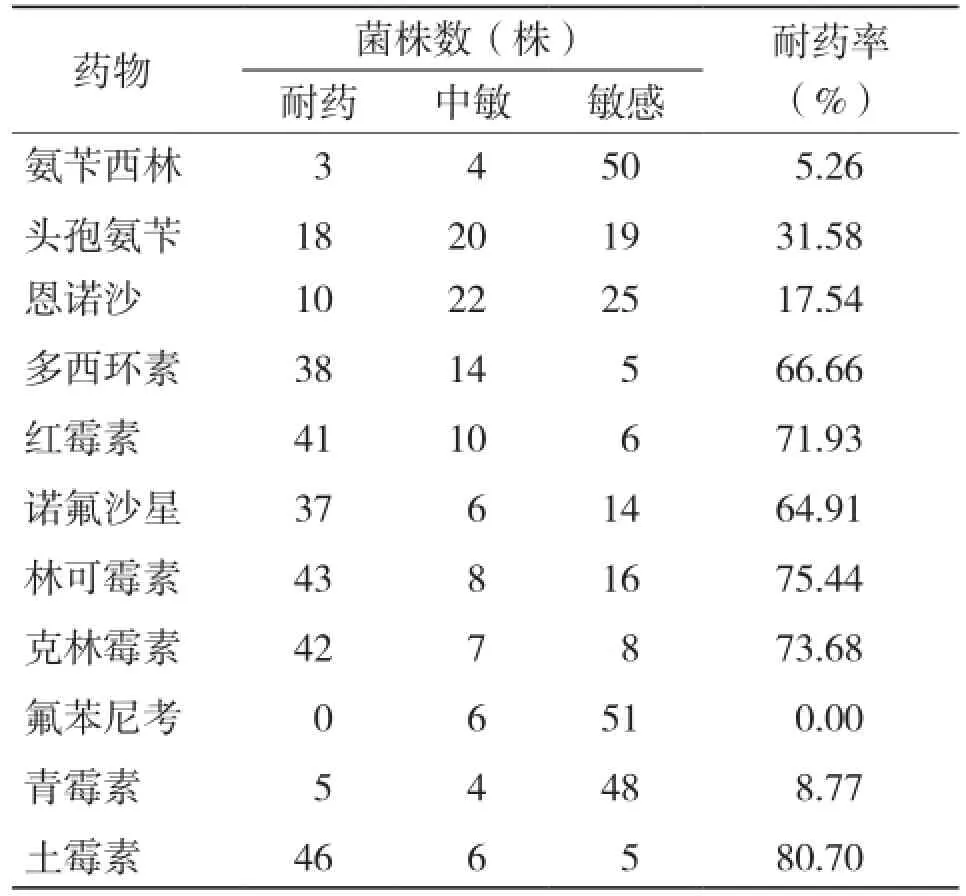
表3 57株鸡源性产气荚膜梭菌药敏实验结果
2.3梭菌的ERIC-PCR亚型分析结果
57株梭菌扩增出条带范围在100~2 000 bp之间,运用NTSYS 2.10e软件进行聚类分析,根据相似性≧80%的菌株归为一类,根据树状图分析,将57个菌株分为13个不同亚型(图8)。
3 结论与讨论
通过对广州市零售冷鲜鸡肉中产气荚膜梭菌污染的调查发现,广州市冷鲜鸡肉中产气荚膜梭菌的分离率为73.08%,这与土耳其鸡肉产气荚膜梭菌分离率77%[9]、澳大利亚零售鸡肉中产气荚膜梭菌分离率66%[10]相接近,说明国内的零售鸡肉中都存在产气荚膜梭菌的污染,且污染率与国外相近,意味着国内冷鲜鸡肉中产气荚膜梭菌对公众的健康威胁也与国外类似。
在分离出的产气荚膜梭菌中,含cpb2基因比例为71.9%,其中的大部分为cpb2 (Atypical)型,cpb2(Consensus)只有1株,且cpb2(Atypical)和cpb2(Consensus)都是独立存在的,这与国外cpb2基因的分离率51%相比,明显要高,提示广州市的零售冷鲜鸡肉中的产气荚膜梭菌的基因型可能与国外有较大差别。最近研究显示,cpb2基因与产气荚膜梭菌引起的人的相关性的疾病有关联,而产气荚膜梭菌冷鲜鸡分离株的cpb2基因是否可以向感染人类的细菌传播并导致相关疾病?值得密切关注。
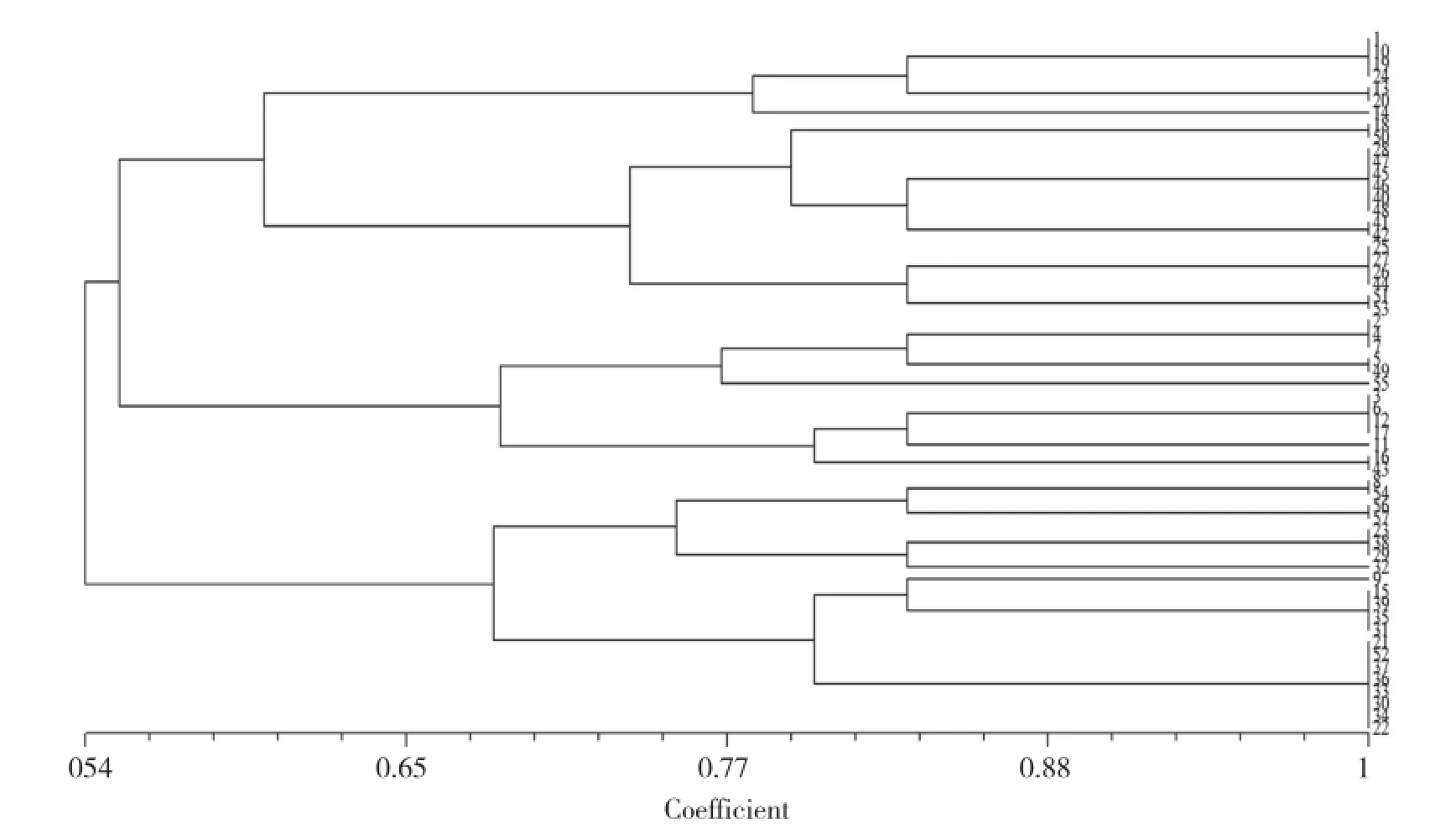
图8 A型梭菌的ERIC-PCR亚型分类树状
本次分离的产气荚膜梭菌中含有一株netB基因型的菌株,据国外研究显示netB基因和鸡坏死性肠炎的发生直接相关,但国内还没有类似报道,同时国内产气荚膜梭菌中netB基因的分离率很低,关于netB基因和鸡坏死性肠炎发生的关系还需进一步验证。
肠杆菌基因间重复序列(Enterobacterial Repetitive Intergenic Consensus Senquence,ERIC)是存在于肠道致病菌和多种细菌基因组中,具有极强的保守性。 Eric-PCR指纹图谱已被广泛用于细菌种、株的分型鉴定等[11]。ERIC-PCR结果显示,57个产气荚膜梭菌分离株按相似性系数大于80%可分为13个亚型,若按相似性系数大于77%则可分为8个亚型,这提示冷鲜鸡所受到外源性梭菌污染的种类较多,来源可能是养殖过程中鸡肠道产气荚膜梭菌过度繁殖,也可能是在冷鲜鸡的屠宰、加工、运输、包装过程中的发生的各种污染。本次试验只是调查了鲜鸡肉中梭菌的污染情况,没有对养殖场等流程进行采样分析,无法判断产气荚膜梭菌的来源,因此有必要进行进一步研究。
细菌的耐药性问题一直是人们关注的焦点,特别是发现细菌的有些耐药性质粒是可以通过某种方式向人类传播之后。本试验所用药物中,只有氟苯尼考和恩诺沙星为畜禽专用药物,而头孢氨卞、克林霉素、诺氟沙星仅可用于人,其中诺氟沙星是最近禁止在畜禽使用的。从结果来看,氟苯尼考对产气荚膜梭菌效果最好,其次是氨苄西林、青霉素、恩诺沙星和头孢氨苄,产气荚膜梭菌对其他几种药物的耐药性已经非常严重,包括仅用于人的克林霉素和诺氟沙星。值得关注的是,头孢类药物作为人专用药物是禁止在畜禽养殖中使用的,而本试验中,产气荚膜梭菌对头孢的耐药率达到31.58%,同样仅可用于人的抗生素克林霉素的耐药率更高达73.7%,这提示在选用治疗人产气荚膜梭菌相关感染的抗生素要特别注意,同时值得思考和进一步研究的是产气荚膜梭菌获得对这些药物耐药的途径和机理,这对防控畜禽和人的梭菌性疾病具有重要指导意义。
[1] Hatheway C L.Toxigenic clostridia[J]. Clin Microbiol Rev,1990,3(1):66-98.
[2] Songer J G.Clostridial enteric diseases of domestic animals[J]. Clin Microbiol Rev,1996,9(2):216-234.
[3] Petit L M,Gibert M R. Popoff,Clostridium perfringens:toxinotype and genotype[J]. Trends Microbiol,1999,7(3):104-110.
[4] Ba-Thein W,Inui S,Shimizu T,et al. Genomic diversity in the pfoA region of the theta-toxindeficient strains of Clostridium perfringens[J]. Microbiol Immunol,1997,41(8):629-631.
[5] Keyburn A L,Boyce J D,Vaz P,et al. NetB,a new toxin that is associated with avian necrotic enteritis caused by Clostridium perfringens[J]. PLoS Pathog,2008,4(2):26.
[6] YOO H S,Lee S U,PARK K Y,et al. Molecular typing and epidemiological survey of prevalence of Clostridium perfringens types by multiplex PCR [J]. J Clin Microbiol,1997,35(1):228-232.
[7] Jost B H,Billington S J,Trinh H T,et al. Atypical cpb2 genes,encoding beta2-toxin in Clostridium perfringens isolates of nonporcine origin[J]. Infect Immun,2005,73(1):652-656.
[8] Hulton C S,Higgins C F,Sharp P M. ERIC sequences:a novel family of repetitive elements in the genomes of Escherichia coli,Salmonella typhimurium and other enterobacteria[J]. Mol Microbiol,1991,5(4):825-34.
[9] Guran H S,Oksuztepe G. Detection and typing of Clostridium perfringens from retail chicken meat parts[J]. Lett Appl Microbiol,2013,57(1):77-82.
[10] Nowella V J,Poppe C,Parreira V R,et al. Clostridium perfringens in retail chicken[J]. Anaerobe,2010,16(3):314-315.
[11] Versalovic J T,Koeuth J R. Lupski,Distribution of repetitive DNA sequences in eubacteria and application to fingerprinting of bacterial genomes [J]. Nucleic Acids Res,1991,19(24):6823-6831.
(责任编辑 白雪娜)
Potential hazards analysis of Clostridium perfringens and its toxins from cold fresh chicken
MA Zhuang1,2,PENG Xin-yu2,YE De-he1,GAO Biao2,YUAN Ming-gui2,YIN Ye-hua2,XU Zhi-hong2
(1.College of Veterinary Medicine,Gansu Agricultural University,Lanzhou 730070,China;2. Institute of Animal Health,Guangdong Academy of Agricultural Sciences,Guangzhou 510640,China)
Retail cold fresh chicken samples were collected randomly from several Guangzhou supermarkets to investigate the hazards of Clostridium perfringens and its toxins from the chicken. Results showed that 57 isolates were isolated from 78 chicken samples,all isolates were C. perfringens type A. One of the isolates carried netB gene,40 isolates carried cpb2 Atypical gene,one isolate carried cpb2 consensus gene. Results of drug resistance test showed that most of the isolates were sensitive to florfenicol,ampicillin and penicillin. It was noteworthy that some isolates were resistant to clindamycin(73.68%) and cefalexin(31.58%),which could only be used in human being. Results of Eric-PCR showed that when similarity was 80%,these isolates could be classified into 13 subtypes,that implied the diversity of pollution sources cold fresh.
Chicken;Clostridium perfringens;toxin;drug sensitivity test;Eric-PCR
855.1
A
1004-874X(2016)08-0113-06
2016-04-10
国家公益性行业(农业)科研专项(201303040-16);广东省科学技术厅省级科研计划(2013B 060400037,2014A020208133);广东省科学技术厅国际合作基地项目(2015B050501007)
马壮(1989-),男,在读硕士生,E-mail:1091650562@qq.com
叶得河(1962-),男,副教授,E-mail:gndydh@126.com

