马铃薯中α-茄碱提取工艺优化
李志文王 娜刘 翔李 航
(1. 天津农学院食品科学与生物工程学院,天津 300384;2. 天津市农副产品深加工技术工程中心,天津 300384;3. 天津大学环境科学与工程学院,天津 300072)
马铃薯中α-茄碱提取工艺优化
李志文1,2王娜1刘翔3李航1
(1. 天津农学院食品科学与生物工程学院,天津300384;2. 天津市农副产品深加工技术工程中心,天津300384;3. 天津大学环境科学与工程学院,天津300072)
为了获得马铃薯中α-茄碱的最佳提取工艺参数,对其提取温度、提取时间、超声波功率及料液比等参数进行研究,运用响应面Box Behnken中心组合试验设计对α-茄碱的提取工艺进行优化。结果表明:马铃薯中α-茄碱的最佳提取工艺参数为以体积比8︰2 的乙醇—乙酸混合溶液作提取溶剂,提取温度49 ℃,提取时间61 min,超声波功率152 W,料液比1︰14(g/mL),该条件下α-茄碱提取量为7.715 mg/g,RSD为1.74%(n=5),与理论预测值基本吻合,平均回收率为98.21%,RSD为1.33%(n=3),说明该方法的提取率和精密度高、稳定性好,合理可行。
马铃薯;α-茄碱;提取
马铃薯(Solanumtuberosum)是茄科多年生草本植物,在世界范围内广泛种植。它是一种常见的重要蔬菜作物,同时也是一种粮食作物,还可以为许多工业生产提供原料[1]。糖苷生物碱是马铃薯的次生代谢产物之一,主要存在于马铃薯的芽、未成熟块茎、成熟薯皮及靠近薯皮的薯肉组织中[2],其中主要的成分为α-茄碱(α-solanine)[3],又称龙葵素。α-茄碱是一种毒性物质,可麻痹人体的呼吸系统和神经系统,引发一系列的中毒症状;同时还具有抗疟疾[4-5]、抗炎[6]4、抗肿瘤[6]4[7]、降低血脂和胆固醇[8-9]等功效,是马铃薯中的活性成分之一[10],但含量低且成分复杂。
目前关于马铃薯中α-茄碱提取、分离纯化方法的研究有少量报道,张玮琴等[11]采用超声波技术提取马铃薯中的糖苷生物碱,通过单因素及正交试验优化马铃薯中糖苷生物碱提取工艺参数,发现在提取时间 30 min,提取温度 40 ℃,超声功率 150 W 和乙酸体积分数 35%的条件下,马铃薯中糖苷生物碱提取率最高;张薇等[12]用微波辐射技术辅助提取马铃薯薯皮中的龙葵素,采用正交试验设计优化提取工艺,结果表明微波辐射提高了提取效率并缩短了提取时间。但目前此类研究仍不够系统和全面,对马铃薯中α-茄碱提取、分离纯化条件的筛选及优化仍不够细致和深入,得到的提取率普遍较低,因此对于如何完善马铃薯中α-茄碱的提取条件、提高回收率已成为该研究领域急待解决的问题。本研究拟利用响应面法优化超声波提取马铃薯中α-茄碱的提取工艺流程,由于马铃薯中α-茄碱主要存在于薯皮、靠近薯皮的果肉和薯芽中,因此本研究将马铃薯薯皮为代表性试验材料,通过分析回归方程得到最佳提取工艺参数,以期为马铃薯α-茄碱资源的有效开发利用提供参考,同时,为完善马铃薯食品安全相关检测技术标准提供依据。
1 材料与方法
1.1材料和试剂
马铃薯:采购于天津红旗农贸批发市场,洗净去皮、将薯皮晒干、粉碎,装袋备用;
α-茄碱标准品:纯度≥95%,美国Sigma公司;
甲醇、乙醇、冰乙酸、氯仿、乙腈、四氢呋喃等:分析纯,天津市江天化工技术有限公司;
Welchrom C18柱、Welchrom Alumina-N中性氧化铝柱:500 mg/6 mL,月旭科技上海股份有限公司;
Waters Oasis HLB固相萃取小柱:北京纽朴生物技术有限公司。
1.2试验仪器
高效液相色谱仪:Waters 2487型,Waters 600E 泵,Waters-2487 紫外检测器,美国Waters公司;
紫外可见分光光度计:UV2700型,日本岛津公司;
超声波发生器:KQ-250B型,昆山市超声仪器有限公司;
旋转蒸发器:RE-52D型,上海荆和分析仪器有限公司;
pH计:Orion Star A基础型,美国赛默飞世尔科技(中国)有限公司;
真空离心浓缩仪:ZLS-2型,湖南赫西离心机仪器有限公司。
1.3试验方法
1.3.1α-茄碱的提取及纯化方法精确称取7等份马铃薯薯皮干粉,每份5.00 g,分别加入冰乙酸、甲醇、乙醇、甲醇—氯仿(体积比2︰1)、甲醇—乙酸(体积比95︰5)、乙醇—乙酸(体积比95︰5)和四氢呋喃—水—乙腈—乙酸(体积比50︰30︰20︰1)各20 mL,超声波处理60 min,布氏漏斗抽滤,40 ℃旋转蒸发收集提取液,15 mL 2% HCl溶解沉淀,浓HCl调pH至2.5,布氏漏斗抽滤,收集滤液,加入浓氨水调pH至10~10.5,放入4 ℃冰箱静置过夜,20 ℃ 10 000 r/min离心30 min,弃去上清液,沉淀用氨水洗涤,再离心,风干沉淀,用色谱甲醇充分溶解,用0.45 μm微孔滤膜过滤后浓缩成10 mL溶液备用,设3次重复。
将Waters Oasis HLB固相萃取小柱用50%甲醇活化,湿法装柱,20%甲醇溶液平衡,将马铃薯α-茄碱提取液上柱吸附2 h,用氯仿—无水甲醇(体积比2︰8)洗脱,将洗脱液减压浓缩备用。
1.3.2α-茄碱的测定采用紫外可见分光光度计对样品在一段波长内进行扫描,找到最大吸收峰波长,利用高效液相色谱仪测定,采用外标法定量。
(1) 液相色谱条件:色谱柱为Waters Nova-pak C18(150 mm×3.9 mm,4 μm);流动相为乙腈;KH2PO4(0.05 mol/L)(体积比70︰30);流速为0.7 mL/min;检测波长为205 nm;柱温25 ℃;进样量10 μL。
(2) 标准曲线的制作:首先将20 mgα-茄碱标准品用3~5 mL色谱甲醇溶解,之后将溶液定容至10 mL容量瓶中,得到2 mg/mL浓度的α-茄碱标准溶液。从其中分别吸取50,100,200,300,400,500 μL,以色谱甲醇定容至1 mL,得到浓度分别为0.10,0.20,0.40,0.60,0.80,1.00 mg/mL的α-茄碱—甲醇溶液,用上述色谱条件进行测定,进样量为10 μL,以α-茄碱的浓度为横坐标,峰高为纵坐标,绘制标准曲线。得到回归方程为y=1 180.3x+132.19,相关系数R2=0.995 4,说明α-茄碱在0.10~1.00 mg/mL的范围内呈良好的线性关系。
1.3.3单因素试验
(1) 提取溶剂:在提取温度为40 ℃、提取时间为40 min、超声波功率为200 W、料液比为1︰10(g/mL)的条件下,考察乙酸、甲醇、乙醇、甲醇—氯仿(体积比2︰1)、乙醇—乙酸(体积比95︰5)、甲醇—乙酸(体积比95︰5)、四氢呋喃—水—乙腈—乙酸(体积比50︰30︰20︰1)对马铃薯α-茄碱提取量的影响。
(2) 提取溶剂配比:根据1.3.3(1)筛选得到试验结果,在提取温度为40 ℃、提取时间为40 min、超声波功率为200 W、料液比为1︰10(g/mL)的条件下,在不同乙醇—乙酸提取溶剂比例(体积比9︰1,8︰2,7︰3,6︰4,5︰5)条件下考察溶剂配比对马铃薯α-茄碱提取量的影响。
(3) 提取温度:根据1.3.3(1)得出的最优提取溶剂,在超声波功率为200 W,料液比为1︰10(g/mL),提取时间为40 min的条件下,考察提取温度(20,30,40,50,60,70 ℃)对马铃薯α-茄碱提取量的影响。
(4) 提取时间:根据1.3.3(1)得出的最优提取溶剂,在超声波功率为200 W,料液比为1︰10(g/mL),提取温度为50 ℃,考察提取时间(20,30,40,50,60,70,80,90 min)对马铃薯α-茄碱提取效果的影响。
(5) 超声波功率:根据1.3.3(1)得出的最优提取溶剂,在提取温度为50 ℃,提取时间为60 min,料液比为1︰10(g/mL),考察超声波功率(50,100,150,200,250,300 W)对马铃薯α-茄碱提取效果的影响。
(6) 料液比:根据1.3.3(1)得出的最优提取溶剂,在提取温度为50 ℃,提取时间为60 min,超声波功率为150 W,考察料液比[1︰6,1︰8,1︰10,1︰12,1︰14,1︰16(g/mL)]对马铃薯α-茄碱提取效果的影响。
1.3.4响应面分析以马铃薯α-茄碱提取量为响应值,将单因素试验结果作为响应因素,利用Design Expert 8.5b 软件进行Box-Benhnken试验设计,对马铃薯α-茄碱提取参数进行分析,研究不同因素之间的交互作用。
1.3.5加标回收试验精确称取已知α-茄碱含量的马铃薯果皮粉末3份,每份5.00 g,分别加入2 mg/mL的α-茄碱标准品溶液1.0,1.5,2.0 mL,即加标浓度为0.04,0.06,0.08 mg/mL,按照最佳提取条件进行提取、定容,再使用高效液相色谱仪测定α-茄碱含量。
2 结果与分析
2.1马铃薯α-茄碱提取工艺条件单因素试验
2.1.1提取溶剂对马铃薯α-茄碱提取效果的影响由图1可知,不同提取溶剂对α-茄碱提取效果有明显差异,7种提取溶剂中甲醇—乙酸混合溶剂提取效果最好,α-茄碱提取量达7.01 mg/g,乙醇—乙酸混合溶液次之,但由于甲醇溶液有毒,在实际应用中存在较大危险性,因此本试验选用乙醇—乙酸混合溶液作为响应面试验中马铃薯α-茄碱的提取溶剂。
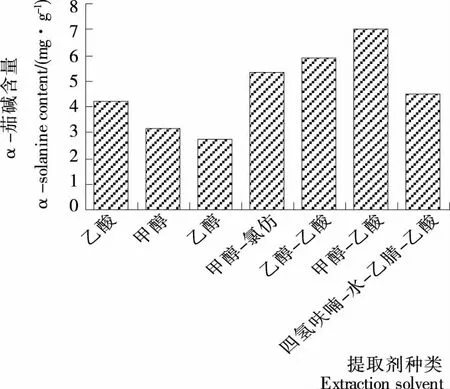
图1 提取溶剂对马铃薯α-茄碱提取效果的影响
2.1.2乙醇—乙酸体积比对马铃薯α-茄碱提取效果的影响
对于混合溶剂提取液来说,溶剂的配比对提取效果的好坏也十分重要。由图2可知,α-茄碱含量随着乙醇—乙酸体积比的下降而呈现先升高后降低的趋势,不同乙醇—乙酸体积比对马铃薯α-茄碱的提取量差异较小,其中乙醇—乙酸体积比为8︰2时α-茄碱含量最高,为3.38 mg/g,之后随乙醇—乙酸体积比的下降,α-茄碱的提取量有小幅下降,变化不明显,因此选择乙醇—乙酸体积比为8︰2作为响应面试验中马铃薯α-茄碱提取溶剂的体积配比。
2.1.3提取温度对马铃薯α-茄碱提取效果的影响由图3可知,提取温度为20 ℃时马铃薯α-茄碱提取量最低,随着提取温度的升高,提取量不断增加,温度升至50 ℃时提取量最高,为5.13 mg/g,之后随着温度继续升高,提取量明显下降,可能是温度过高,破坏了α-茄碱的成分,提取温度为60 ℃和70 ℃时α-茄碱提取量差异较小,因此将响应面试验中α-茄碱提取温度定为40~60 ℃。
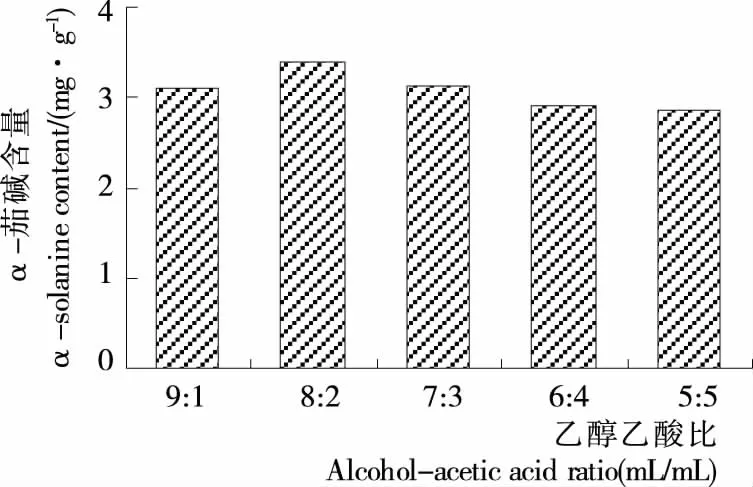
图2 乙醇—乙酸体积比对马铃薯α-茄碱提取效果的影响

图3 提取温度对马铃薯α-茄碱提取效果的影响
2.1.4提取时间对马铃薯α-茄碱提取效果的影响由图4可知,提取时间为20 min时马铃薯α-茄碱提取量最低,为3.56 mg/g,提取时间为30 min时提取量上升幅度较小,之后随着提取时间的增加,提取量上升速度逐渐加快,当时间为60 min时提取量最高,为5.84 mg/g,当提取时间延长至70 min时,提取量明显下降,当提取时间超过70 min后,提取量下降幅度较小,因此将响应面试验中马铃薯α-茄碱的提取时间范围定在50~70 min。

图4 提取时间对马铃薯α-茄碱提取效果的影响
2.1.5超声波功率对马铃薯α-茄碱提取效果的影响由图5可知,随着超声波功率的增加,马铃薯α-茄碱提取量呈现先上升后下降的趋势,超声波功率升至150 W时提取量最高,为6.47 mg/g,之后随超声波功率的增加提取量明显下降,可能是超声波功率过高时会影响α-茄碱的溶出,因此将响应面试验中马铃薯α-茄碱超声波提取功率定为100~200 W。2.1.6料液比对马铃薯α-茄碱提取效果的影响由图6可知,料液比为1︰6(g/mL)时马铃薯α-茄碱提取量最低,为4.43 mg/g,随着料液比降低,提取量持续上升,可能是溶剂与浸提物接触充分,使溶出率增加的缘故;当料液比为1︰12(g/mL)时提取量最大,为6.18 mg/g,之后随料液比降低提取量有小幅下降,料液比为1︰16(g/mL)时提取量下降幅度较大,因此将响应面试验中α-茄碱提取时的料液比定在1︰10~1︰14(g/mL)。

图5 超声波功率对马铃薯α-茄碱提取效果的影响

图6 料液比对马铃薯α-茄碱提取效果的影响
2.2响应面试验结果与分析
2.2.1响应面试验设计与结果在单因素试验的基础上,采用Box-Behnken试验设计,以马铃薯α-茄碱提取量为响应值,分别以提取温度、提取时间、超声波功率和料液比作为自变量(见表1)进行四因素三水平分析,试验结果见表2。
2.2.2回归模型方程的建立及显著性分析利用Design Expert 8.05b 软件对马铃薯α-茄碱的提取量进行方差分析,得到马铃薯α-茄碱的提取量(Y)对提取温度、提取时间、超声波功率和料液比的回归方程:
Y=-45.676+0.910X1+0.848X2+0.140X3-115.456X4-3.850×10-3X1X2-3.000×10-5X1X3+0.250X1X4+3.400×10-4X2X3-0.917X2X4+3.333×10-3X3X4-7.080×10-3X12-5.305×10-3X22-5.242×10-4X32+886.667X42。
(1)

表1 Box-Behnken 试验设计因素与水平

表2 响应面试验结果
2.2.3响应曲面分析利用Design Expert 软件根据得出的回归模型绘制响应曲线图及等高线图,见图8~10。响应曲面图和等高线图可以直观的表现出不同因素间交互作用的强弱[13],椭圆形的等高线说明交互作用显著,圆形则表示交互作用不显著[14-15]。由图8可知,响应曲面图坡度十分陡峭,等高线呈现明显椭圆形,提取温度和提取时间互作效应对α-茄碱提取量的影响十分显著,在一定范围内提取温度和提取时间同时增加可明显提高α-茄碱提取量。由图9可知,响应曲面图坡度同样十分陡峭,提取时间和超声波功率等高线图呈明显椭圆形,α-茄碱提取量受二者互作效应影响十分

表3 方差分析结果†
†*表示差异显著;**表示差异极显著。
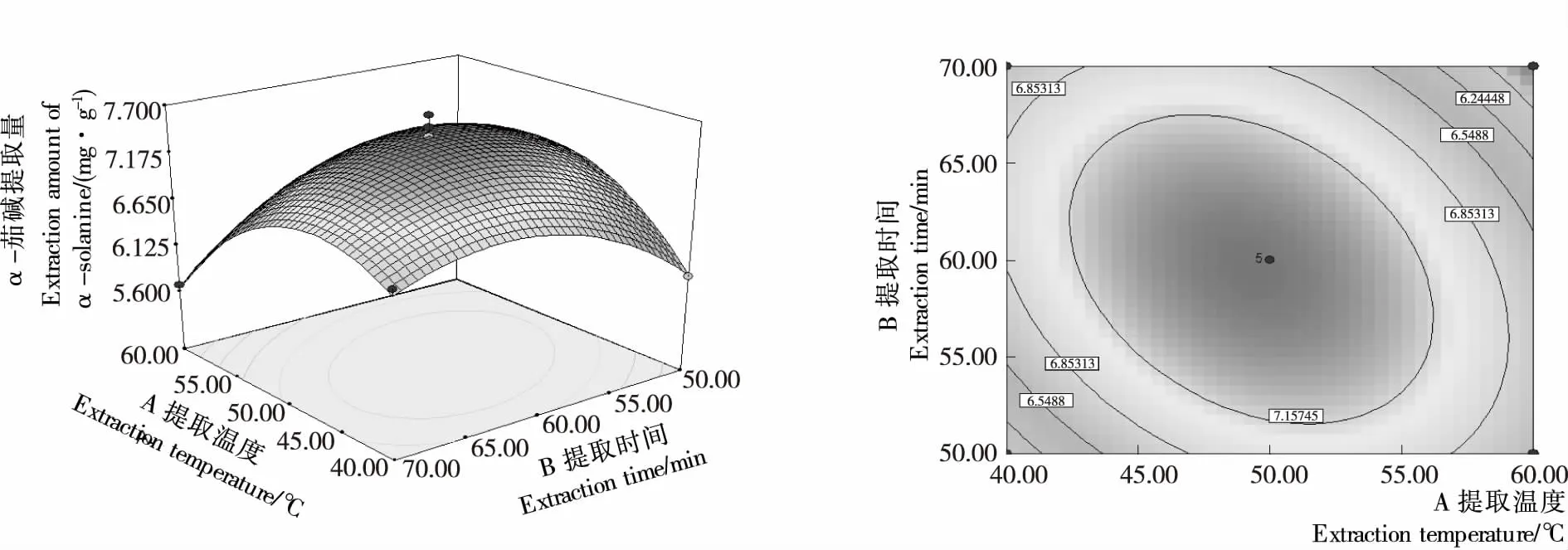
图7 提取温度和提取时间的交互作用

图8 提取时间和超声波功率的交互作用

图9 提取时间和料液比的交互作用
显著。由图10可知,提取时间和料液比间互作效应对响应值也有显著的影响,在一定范围内同时增加提取时间和料液比,α-茄碱提取量明显上升,并且有明显的极值,但超过一定值之后继续增加提取时间和料液比,α-茄碱提取量明显下降。由各响应面图可看出,响应值存在最大值。通过软件分析计算得出理论最佳提取工艺:提取温度49 ℃,提取时间61 min,超声波功率152 W,料液比1︰14(g/mL),理论上在此条件下可提取到的α-茄碱量为7.773 mg/g。
2.3最佳提取条件验证及加标回收率的测定
称取马铃薯果皮粉末5份,每份5 g,按照上述得到的最佳提取条件进行提取测定并计算RSD值。结果测得马铃薯α-茄碱提取量为7.715 mg/g,与预测值相差0.058 mg/g,RSD为1.74%(n=5),说明该方程与实际情况的拟合性良好。加标回收试验结果表明,α-茄碱的平均回收率为98.21%,RSD为1.33%(n=3)。说明该提取方法精密度和提取率均较高,适用于马铃薯中α-茄碱的提取。
3 结论
应用单因素试验和响应面法试验设计优化不同提取工艺参数,在此基础上采用Design-Expert 软件对试验结果进行处理,研究不同提取参数间的关系及对α-茄碱提取量的影响,建立了不同提取参数对马铃薯中α-茄碱提取量影响的回归模型,并且得到了最优提取条件,提取条件为:以体积比8︰2的乙醇—乙酸混合溶液为提取溶剂,大孔树脂柱纯化,提取温度49 ℃,提取时间61 min,超声波功率152 W,料液比1︰14(g/mL),此条件下α-茄碱提取量与预测值基本吻合,加标回收试验结果表明,α-茄碱的平均回收率为98.21%,RSD为1.33%(n=3)。说明该提取方法精密度和提取率均较高,适用于马铃薯中α-茄碱的提取。可为马铃薯α-茄碱的工业化应用提供参考。
由于取样手段的不足,本研究只选取了薯皮作为马铃薯中α-茄碱的提取对象,而对薯肉中的α-茄碱含量研究尚且不足。由于部分成熟马铃薯靠近果皮的薯肉部分α-茄碱含量同样较高,而这部分果肉的大小在不同马铃薯个体间存在很大差异,造成这种差异的原因尚不明确,因此要进行代表性取样难度较大。此部分果肉中α-茄碱的含量对于马铃薯中α-茄碱的系统研究应用及食品安全检测具有非常重要的意义。
[1] 张志军, 李会珍, 姚宏亮, 等. 多效唑对马铃薯试管苗生长和块茎形成的影响[J]. 浙江大学学报: 农业与生命科学版, 2004, 30(3): 318-322.
[2] 赵雪淞, 朱光明, 郭永键, 等. 糖苷生物碱化学生态学研究进展[J]. 生物学杂志, 2007, 26(6): 948-953.
[3] 张玮琴, 童军茂. 马铃薯中糖苷生物碱的提取及其工艺条件的优化[J]. 农产品加工: 学刊, 2014(10): 43-45.
[4] 李会珍, 张志军. 马铃薯糖苷生物碱及其影响因素研究进展[J]. 食品研究与开发, 2012, 33(11): 227-230.
[5] 赵雪淞, 李盛钰, 何大俊, 等. 马铃薯糖苷生物碱抗真菌活性构效关系研究[J]. 食品工业科技, 2013, 34(6): 159-163.
[6] 余静. 马铃薯糖昔生物碱的提取与纯化[D]. 武汉: 华中农业大学, 2010.
[7] ALVAREZ-PARRILLA E, LA DELA R, RODRIGO-GARCIA J, et al. Dual effect ofβ-cyclodextrin(β-CD) on the inhibition of apple polyphenol oxidsae by 4-hexylresorcinol(HR) and Methyl Jasmonate (MJ)[J]. Food Chemistry, 2007, 101(4): 1 346-1 356.[8] AWAD M A, DE JAGER A. Flavonoid and chlorogenic acid concentrations in skin of Jonagold and Elstarapples during and after regular and ultra low oxygen storage[J]. Postharvest Biology and Technology, 2000, 20(1):15-24.
[9] MURATA M, KUROKAMI C, HOMMA S. Purification and some properties of chlorogenic acid oxidase from apple(Malus pumila)[J]. Bioscience Biotechnology and Biochemistry, 1992, 56(11):1 705-1 710.
[10] 商婷婷, 邝梦婷, 胡新喜, 等. HPLC—ELSD法同时测定马铃薯中α-茄碱和α-卡茄碱含量[J]. 食品与机械, 2015, 31(4): 55-58, 125.
[11] 张玮琴, 童军茂. 马铃薯中糖苷生物碱的提取及其工艺条件的优化[J]. 农产品加工: 学刊, 2014(10): 43-45.
[12] 张薇, 文雄, 潘双银, 等. 微波辅助提取马铃薯龙葵素[J]. 园艺学报, 2008, 35(9): 1 393-1 396.
[13] 宋丽军, 侯旭杰, 李雅雯. 核桃青皮中多酚的超高压提取工艺优化[J]. 食品与机械, 2015, 31(4): 178-182.
[14] 魏安池, 代红丽, 谷文英. 响应面分析法优化红花黄色素提取工艺条件[J] . 食品与机械, 2006, 22(2): 11-13.
[15] 董秀芳, 李楠, 韩冬, 等. 裙带菜孢子叶多糖的超声辅助提取工艺优化及其抗氧化活性研究[J]. 食品与机械, 2015, 31(4): 162-166, 177.
Optimizing extraction process of α-solanine from potato using response surface method
LI Zhi-wen1,2WANGNa1LIUXiang3LIHang1
(1.SchoolofFoodScienceandBiotechnology,TianjinAgriculturalUniversity,Tianjin300384,China;2.TianjinEngineeringandTechnologyCenterofAgriculturalProductsProcessing,Tianjin300384,China;3.SchoolofEnvironmentalScienceandEngineering,TianjinUniversity,Tianjin300092,China)
This study was carried out to establish optimum conditions for the extraction of total alkaloids from potato (Solanumtuberosum). The extraction temperature, extraction time, ultrasonic power and solid-liquid ratio, as major factors influencing the extraction amount according to the single factor tests, were selected as the independent variables. And the extraction amount ofα-solanine was selected as response factor. The optimal extraction conditions were studied using the response surface analysis and the Box Behnken central combination design. The results showed that the optimum extraction conditions were the alcohol-acetic acid ratio as the extraction solvent, 8︰2 extraction temperature 49 ℃, extraction time 61 min, ultrasonic power 152 W and solid-liquid ratio 1︰14. Under these conditions, the extraction amount ofα-solanine from potato was 7.715 mg/g with RSD (relative standard deviation) = 1.74% (n=5), which was consistent with the simulated predictive value. And the average recovery rate was 98.21% with a RSD of 1.33% (n=3). Result analysis indicated that the extraction method established in our study was applicable in the extraction ofα-solanine from potato.
potato;α-solanine; extraction technique
天津农学院实验教学示范中心教学改革项目(编号:2015SY012)
李志文(1981-),女,天津农学院讲师,博士。
E-mail:lizhiwen315@163.com
2016-03-09
10.13652/j.issn.1003-5788.2016.08.041

