臭氧降解黄曲霉毒素B1污染玉米的体内毒性评价
罗小虎齐丽君王 韧王 莉李永富杨 丹余晓斌陈正行
(1. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2. 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;3. 江南大学食品学院,江苏 无锡 214122;4. 江南大学生物工程学院,江苏 无锡 214122)
臭氧降解黄曲霉毒素B1污染玉米的体内毒性评价
罗小虎1,2,3齐丽君1,2,3王韧1,2,3王莉1,2,3李永富1,2,3杨丹1,2,3余晓斌4陈正行1,2,3
(1. 江南大学食品科学与技术国家重点实验室,江苏 无锡214122;2. 粮食发酵工艺与技术国家工程实验室,江苏 无锡214122;3. 江南大学食品学院,江苏 无锡214122;4. 江南大学生物工程学院,江苏 无锡214122)
以黄曲霉毒素B1污染玉米(Aflatoxin B1-contaminated corn, ACC)为原料,评估经90 mg/L臭氧处理40 min的ACC (83.0 μg/kg)在小鼠体内的毒性。结果表明,与基础饲料相比,ACC饲喂小鼠的平均体重显著降低(P<0.05),肝脏与肾脏体重比显著增加(P<0.05),血清中谷丙转氨酶、谷草转氨酶和碱性磷酸酶活性显著升高(P<0.05),总蛋白、白蛋白和球蛋白含量显著降低(P<0.05)。而ACC经臭氧处理后饲喂小鼠,小鼠体重、饲料消耗量、肝脏与肾脏体重比均无显著差异,血清中谷丙转氨酶活性、总蛋白、白蛋白和球蛋白含量也无显著差异(P>0.05);而谷草转氨酶和碱性磷酸酶活性显著升高(P<0.05)。ACC可导致小鼠多项生理、生化指标发生显著变化,而ACC经臭氧处理后能显著改善其变化。关键词:黄曲霉毒素B1;玉米;臭氧;降解;毒性
黄曲霉毒素(aflatoxins,AFs)是20世纪60年代初发现的一类主要由黄曲霉(Aspergillusflavus)和寄生曲霉(Aspergillusparasiticus)产生的化学结构类似的有毒次级代谢产物的总称。在已发现的20余种AFs中,以黄曲霉毒素B1、B2、G1和G2(AFB1、AFB2、AFG1、AFG2)最为常见。而天然污染的食品中又以AFB1最常见,毒性也最强,故以AFB1为对象的研究最多。大量毒理试验[1-2]证明,AFB1毒性是氰化钾的10倍,砒霜的68倍,AFB1除具有强烈的“三致能力”,还对动物肝脏有严重破坏作用,可致急性肝炎、肝癌甚至死亡。因此,国际癌症研究机构(IARC)在1993年就将AFB1定为1级致癌物。
AFB1广泛存在于粮油原料及其制品中,而且在热带和亚热带地区,由于温度和湿度较高,不少农作物甚至在收获前就被黄曲霉菌感染,使得粮油原料及其制品中AFB1的检出率很高,特别是玉米、花生、小麦和稻米等农作物更易受AFB1污染[3-4]。玉米是中国重要的食品和饲料原料,由于收获、加工和储藏等因素影响,黄曲霉毒素B1污染玉米(Aflatoxin B1-contaminated corn,ACC)的现象非常突出。高秀芬等[5]于2011年对中国部分地区玉米中AFs的污染状况展开了调查,从调查的279份玉米样品中,211份样品检出AFs,59份样品超过中国国家限定标准,这其中又以AFB1阳性率和浓度最高。
AFB1污染范围广且理化性质稳定,目前仍很难避免AFB1对食品或饲料污染。因此,良好的消减AFB1方法就变得至关重要,在目前已研究的众多物理、化学和生物消减AFB1方法中,多数存在消减后原料营养损失严重、感官品质变差,方法操作不便或费用过高等不足[6-8]。因此,寻求一种成本低廉、操作方便、安全有效和环境友好的消减方法仍将是今后努力的方向。
前人研究[9-10]表明,臭氧在降解不同粮食中AFB1具有独特的优势,本课题组前期的研究结果也表明,臭氧对玉米中AFB1具有良好的降解效果[11-12],且AFB1降解后的玉米细胞毒性显著降低[13]。但考虑到AFB1毒性极大,对人和动物的危害严重,虽然AFB1降解产物的细胞毒性显著降低,但并不代表AFB1降解产物体内毒性也显著降低。因此,为了评估AFB1污染玉米经脱毒后体内毒性是否显著降低或消失,以便进一步提高臭氧技术实际应用的可行性,其降解产物的体内安全性仍有待进一步评估。本研究采用ACC和臭氧处理ACC分别饲喂小鼠,通过观察小鼠的生理指标、血清指标、组织变化,来分析臭氧处理ACC后是否仍具有较强的体内毒性,这也可为今后进一步研究臭氧降解ACC技术的安全性提供科学依据。
1 材料与方法
1.1主要仪器与设备
臭氧发生器:QJ-8003K-A型,青岛国林实业股份有限公司;
臭氧气体浓度在线检测仪:IDEAL-2000型,山东淄博爱迪尔测控技术有限公司;
高效液相色谱仪带荧光检测器:1260型,美国安捷伦科技有限公司;
全自动生化仪测定:Cobas C 501型,瑞士罗氏公司。
1.2臭氧处理ACC
臭氧发生器的氧气源由外接纯氧气提供,臭氧浓度通过调节电压和氧气流量调整。3 kg ACC放入圆柱形玻璃反应器(直径×高:35 cm×50 cm),臭氧气体经反应器底部进入,多余臭氧从顶部排出。为了让ACC和臭氧充分接触,在反应器中放入3个不锈钢筛,每个筛上放置1 kg玉米,并不断将臭氧通入反应器中。反应器中臭氧浓度90 mg/L,环境温度为 25 ℃,相对湿度为 75%。臭氧处理40 min后,静置 120 min再将ACC裹入干净的聚乙烯袋中,密封,4 ℃保存,待用。
1.3试验动物
35只昆明鼠:清洁级、雄性、4周龄,体重(22±2) g,动物许可证号,SCXK(沪)2012-0002,上海斯莱克实验动物有限公司。
1.4饲料的准备
基础饲料、定制饲料均由上海斯莱克实验动物有限公司提供,试验中采用饲料均达到试验动物饲料相关卫生标准。定制饲料中玉米籽粒经粉碎后与基础饲料混合加工,玉米与基础饲料质量比1︰1。臭氧处理的玉米饲料组中,臭氧处理玉米的条件均为:臭氧浓度90 mg/L,处理时间40 min。AFB1污染玉米经臭氧处理后,AFB1含量由83.0 μg/kg降低到11.6 μg/kg。ACC饲料和臭氧处理ACC饲料中AFB1含量分别为41.7,6.5 μg/kg。玉米中AFB1含量测定方法采用GB/T 5009.23—2006检测。
1.5动物分组及饲喂
小鼠预饲2周后,根据体重随机均分为5组,每组7只。试验用小鼠同室分笼饲养,室内温度(22±2) ℃,相对湿度50%~60%,室内环境清洁,安静,12/12 h白天—黑夜循环光照。小鼠自由采食和饮水,每10 d称量小鼠体重1次,每5 d更换1次垫料,保持笼内清洁。

表1 昆明鼠分组
1.6血液及组织样品采集
小鼠在试验前禁食8~10 h,将采集的血液迅速放入离心管中,4 ℃,3 000 r/min离心15 min,上清液-18 ℃保存,待测。称取小鼠肝脏、肾脏总重后,迅速放入预冷的生理盐水中漂洗,取部分肝脏和肾脏放于10%甲醛溶液中固定,用于组织病理学检查。
1.7血清及肝功能相关生化指标
谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、总蛋白(TP)、白蛋白(ALB)和球蛋白(GLB)等生化指标均采用全自动生化仪测定。
1.8小鼠肝脏和肾脏组织学观察
小鼠肝脏和肾脏组织切片方法参考Diao等[14]的方法。
1.9数据统计分析
2 结果与讨论
2.1饲料对小鼠体重及饲料消耗的影响
表2为小鼠饲喂不同饲料后10,20,30和40 d的体重变化结果,从表2中可看出,CC组第30天后的小鼠体重显著低于Control组与OCC组(P<0.05);ONC组、OCC组与Control组的小鼠体重无显著差异(P>0.05),而NC组小鼠体重第30 天后就显著高于其他组小鼠体重(P<0.05)。OCC组小鼠体重显著高于CC组,最主要的原因是ACC经过臭氧处理后,AFB1含量显著降低,对小鼠的毒性显著降
低。Diao等[14]研究了臭氧处理AFB1污染的花生喂养小鼠,与AFB1污染花生喂养小鼠相比,小鼠体重显著增长,且与未污染AFB1的花生饲料相比无显著差异,这与本研究结果是一致的。NC组小鼠体重和饲料消耗量均显著高于ONC组,这可能是未污染玉米臭氧处理后,对玉米的品质造成了不良影响,从而影响了小鼠的体重增长。Diao等[14]研究表明,未污染AFB1花生经臭氧处理后饲喂小鼠,小鼠体重没有发生显著变化,而本试验中未污染玉米经臭氧处理后饲喂小鼠,相比NC组小鼠体重显著下降(表2)。这可能是本研究中臭氧浓度较高,且玉米中营养物质更容易被臭氧破坏,从而造成玉米饲料的营养品质下降。
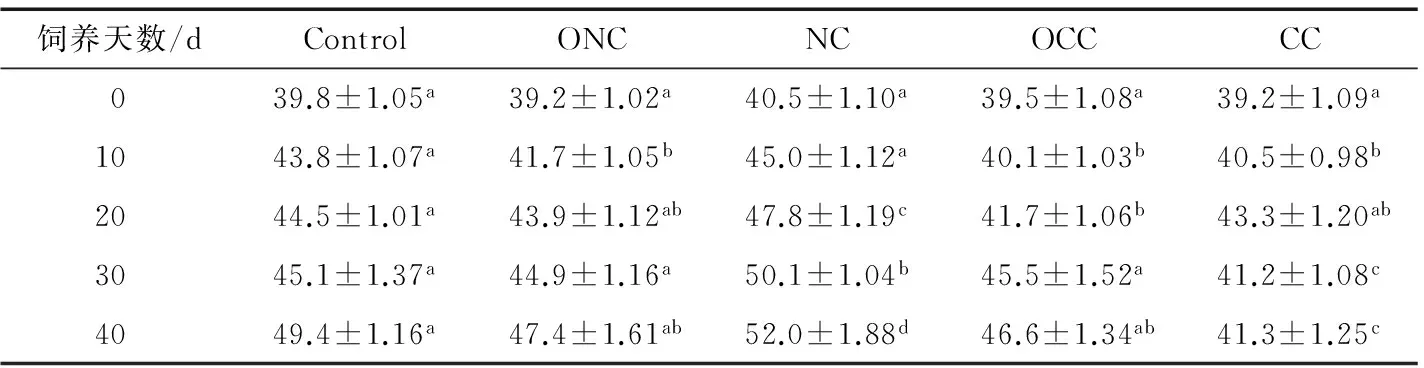
表2 各饲料组小鼠体重变化†
†同行上标字母不同表示组间差异显著,P<0.05。
2.2饲料对小鼠肝脏与肾脏的影响
图1分别为不同饲料饲喂小鼠40 d后的肝脏、肾脏与体重的比值。结果表明,CC组的小鼠肝脏、肾脏与体重的比值显著高于其他饲料组(P<0.05)。这是因为AFB1毒性极强,而采用ACC饲喂小鼠后,AFB1对小鼠的敏感器官肝脏和肾脏造成毒害,从而导致小鼠肝脏和肾脏肿大。Skalicka等[15]的研究也表明,AFB1主要损伤动物的肝脏和肾脏,可造成肝脏和肾脏的肿大、坏死等。另外,由图1可知,OCC组小鼠肾脏与体重比和Control组没有显著差异(P>0.05),表明其肾毒性显著降低,该结果与Naguib等[16]的研究结果一致。但OCC组小鼠肝脏与体重比显著高于Control组(P<0.05),本研究在饲喂小鼠前,已经测定过OCC组中AFB1含量,确定该浓度不会对小鼠造成危害,因此造成这种结果的主要原因不是AFB1的毒性作用。可能是ACC品质较未污染玉米差,经臭氧处理后,虽然AFB1含量显著降低,但是其营养品质进一步劣变,从而对小鼠造成了不良影响。而且从图1结果看,NC组小鼠的肝脏、肾脏与体重比显著低于Control组(P<0.05),ONC组的肝脏、肾脏与体重比显著高于NC组的(P<0.05),因此,未污染玉米经过臭氧处理后,对小鼠肝脏和肾脏也有不利影响。

不同字母表示组间差异显著
2.3小鼠血清中ALT、AST和ALP活力变化
由图2可知,CC组中ALT活力显著高于其他组(P<0.05),而其它4个饲料组中ALT活力无显著差别(P>0.05)。图2的CC组血清中AST活力最高,显著高于其他饲料组(P<0.05),ONC组与OCC组无显著差异(P>0.05),但均显著高于NC组和Control组(P<0.05),NC组和Control组无显著差异(P>0.05)。小鼠血清中ALP活力结果表明,CC组血清中ALP活力显著高于其他4组,OCC组的ALP活力虽显著低于CC组,但仍显著高于其他3组(P<0.05),其他组间无显著差别(P>0.05)。
AFB1很容易造成动物的肝脏和肾脏损伤,改变动物血清中各种酶类的活性,因此,肝脏和血清中各种酶的活性变化是评估动物伤害程度的可靠依据[17]。而在这些酶中,ALT、AST和ALP因其主要存在于肝脏和肾脏中,又是动物机体代谢过程中必不可少的“催化剂”,因此,是反映肝脏和肾脏等重要脏器功能损伤最直接和最重要的指标[18]。通常情况下,动物摄食AFB1污染的饲料后,肝细胞或某些组织会损伤或坏死,使ALT、AST和ALP等胞内酶释放到血液里,造成血液中这些酶的活性升高[19]。Harvey等[20]发现仔猪AFB1中毒时,肝脏受到严重损伤,ALP经淋巴道和肝窦进入血液,且由于肝内胆道胆汁排泄障碍,此时,大量胞内酶释放到血液中,而引起血清中ALT、AST和ALP的活性显著升高。Netke等[21]采用抗坏血酸饲喂豚鼠,观察抗坏血酸对饲喂AFB1污染饲料对豚鼠肝脏和血清中AST、ALT和ALP的影响,研究结果表明,饲喂抗坏血酸的豚鼠的各项指标均得到显著改善,AST、ALT和ALP能显著反应AFB1对豚鼠肝脏损伤情况。Diao等[14]发现采用臭氧处理AFB1污染花生,能显著缓解AFB1引起的对Wistar大鼠血清中ALT、AST和ALP的不利影响,同时,与基础饲料组比,大鼠血清中的各项生化指标无显著差异。本试验结果表明,ACC能导致小鼠血清中ALT、AST和ALP活性显著升高(P<0.05),而ACC经臭氧处理后,各项酶活指标均显著改善,且部分指标与Control组无显著差异(P>0.05),可说明臭氧能显著降低ACC对小鼠的毒害。
2.4小鼠血清中TP、ALB和GLB含量变化
由图3可知,小鼠摄入ACC饲料40 d后,血清总蛋白(TP)、白蛋白(ALB)和球蛋白(GLB)含量均显著低于其他饲料组(P<0.05),而其他饲料组间无显著差异(P>0.05)。Obuseh等[22]认为动物体内TP、ALB和GLB含量的改变是反映AFB1对肝脏合成各种蛋白能力的一项重要指标,当动物肝脏功能受到严重损害时,其蛋白合成能力将受到显著影响,蛋白含量将显著降低。因此,本研究分析可能是小鼠摄入ACC后,引起小鼠的肝功能障碍,造成肝脏中蛋白合成受到抑制。另外,也有研究[23-24]表明,ACC组中白蛋白和球蛋白含量显著下降,可能是小鼠其他方面的肝脏功能受到损害。本试验结果表明,CC组的小鼠血清中TP、ALB和GLB的含量降低,说明AFB1污染的玉米对小鼠的肝脏有显著损害;而OCC组的小鼠各项生化指标均得到显著改善,表明AFB1污染玉米经臭氧处理后,肝脏毒性显著降低,这也与Diao等[14]和Naguib等[16]的研究结果一致。
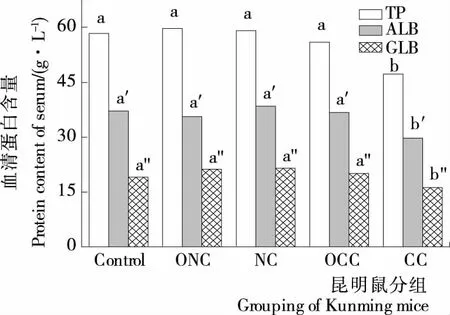
不同字母表示组间差异显著
3 结论
研究表明,ACC饲喂小鼠表现出典型AFB1中毒症状,包括小鼠体重增长减慢、血清酶学指标异常等;而ACC经臭氧处理后,能显著降低AFB1导致的小鼠生理、主要血清指标ALT、TP、ALB和GLB水平,极大降低了AFB1对小鼠的毒性,减轻了AFB1对小鼠生长性能、血清及肝肾器官的不良影响。此外,ONC组小鼠肾脏体重比、AST活力显著高于Control组(P<0.05),其他生化、血清指标无显著差异;而NC组小鼠各项生理、生化指标结果均优于ONC组,表明正常玉米经臭氧处理后饲喂小鼠,对小鼠也有一定不利影响。
[1] YEH Fu-sun, YU Mimi C, MO Chi-chun, et al. Hepatitis-B virus, aflatoxins, and hepatocellular-carcinoma in southern Guangxi, China[J]. Cancer Research, 1989, 49(9): 2 506-2 509.
[2] CHEN Jian-guo, EGNER Patricia A, NG Derek, et al. Reduced aflatoxin exposure presages decline in liver cancer mortality in an endemic region of china[J]. Cancer Prevention Research, 2013, 6(10): 1 038-1 045.
[3] LEWIS L, ONSONGO M, NJAPAU H, et al. Aflatoxin contamination of commercial maize products during an outbreak of acute aflatoxicosis in eastern and central Kenya[J]. Environmental Health Perspectives, 2005, 113(12): 1 763-1 767.
[4] 康绍英, 周兴旺, 张继红, 等. 液相色谱—串联质谱法同时检测食品中的4种黄曲霉毒素[J]. 食品与机械, 2013, 29(2): 77-81, 120.[5] GAO Xiu-fen, YIN Shi-an, ZHANG Hong-yuan, et al. Aflatoxin contamination of corn samples collected from six regions of China[J]. Journal of hygiene research, 2011, 40(1): 46-49.[6] FARZANEH M, Shi Zhi-qi, GHASSEMPOUR A, et al. Aflatoxin B1degradation by Bacillus subtilis UTBSP1 isolated from pistachio nuts of Iran[J]. Food Control, 2012, 23(1): 100-106.
[7] 曹铭, 樊明涛. 黄曲霉毒素脱除技术研究进展[J]. 食品与机械, 2015, 31(1): 260-264.
[8] 罗小虎, 齐丽君, 房文苗. 等. 比重筛分黄曲霉毒素B1污染玉米[J]. 食品与机械, 2016, 32(6): 13-18.
[9] DE ALENCAR E R, FARONI L R D, SOARES N D F, et al. Efficacy of ozone as a fungicidal and detoxifying agent of aflatoxins in peanuts[J]. Journal of the Science of Food and Agriculture, 2012, 92(4): 899-905.
[10] 罗建伟, 李荣涛, 陈兰, 等. 臭氧去除粮食中黄曲霉毒素B1的方法研究[J]. 粮食储藏, 2003, 32(4): 29-32.
[11] LUO Xiao-hu, WANG Ren, WANG Li, et al. Detoxification of aflatoxin in corn flour by ozone[J]. Journal of the Science of Food and Agriculture, 2014, 94(11): 2 253-2 258.
[12] 罗小虎, 王韧, 王莉, 等. 臭氧降解玉米中黄曲霉毒素B1效果及降解动力学研究[J]. 食品科学, 2014, 36(15): 45-49.
[13] LUO Xiao-hu, WANg Ren, WANG Li, et al. Effect of ozone treatment on aflatoxin B1and safety evaluation of ozonized corn[J]. Food Control, 2014, 37(3): 171-176.
[14] DIAO En-jie, HOU Han-xue, CHEN Bin, et al. Ozonolysis efficiency and safety evaluation of aflatoxin B1in peanuts[J]. Food and Chemical Toxicology, 2013, 55: 519-525.
[15] SKALICKA M, MAKOOVA Z, KORENEKOVA B. The influence of aflatoxin B1on activity of alkaline phosphatase and body weight of broiler chicks[J]. Trace Elements and Electrolytes, 2000, 17(3): 142-146.
[16] NAGUIB K M, HASSAN N S, EL-NEKEETY A A, et al. Safety use of ozone gas in the degradation of aflatoxin in tobacco and prevention its toxicity in rats[J]. Toxicology Letters, 2011, 205S: S144.
[17] OZER J, RATNER M, SHAW M, et al. The current state of serum biomarkers of hepatotoxicity[J]. Toxicology, 2008, 245(3): 194-205.
[18] ADEDARA I A, OWUMI S E, UWAIFO A O, et al. Aflatoxin B1and ethanol co-exposure induces hepatic oxidative damage in mice[J]. Toxicology and Industrial Health, 2010, 26(10): 717-724.[19] DEVENDRAN G, BALASUBRAMANIAN U. Biochemical and histopathological analysis of aflatoxin induced toxicity in liver and kidney of rat[J]. Asian Journal of Plant Science and Research, 2011, 1(4): 61-69.
[20] HARVEY R, KUBENA L, HUFF W, et al. Effects of treatment of growing swine with aflatoxin and T-2 toxin[J]. American Journal of Veterinary Research, 1990, 51(10): 1 688-1 693.[21] NETKE S P, ROOMI M W, TSAO C, et al. Ascorbic acid protects guinea pigs from acute aflatoxin toxicity[J]. Toxicology and Applied Pharmacology, 1997, 143(2): 429-435.[22] OBUSEH FA, JOLLY PE, YI Jiang, et al. Aflatoxin B1albumin adducts in plasma and aflatoxin M1in urine are associated with plasma concentrations of vitamins A and E[J]. International Journal for Vitamin and Nutrition Research, 2010, 80(6): 355-368.[23] TURNER P C, LOFFREDO C, KAFRAWY S E, et al. Pilot survey of aflatoxin-albumin adducts in sera from Egypt[J]. Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure & Risk Assessment, 2008, 25(5): 583-587.
[24] SAAD MMM, ABDEL-FATTAH SM. A food additive formula to minimize the negative effects due to ingesting aflatoxins(s) contaminated food[J]. Saudi Society for Food & Nutrition, 2008, 3(1): 31-40.
In vivo toxicity assessment of aflatoxin B1-contaminated corn after ozone degradation
LUO Xiao-hu1,2,3QILi-jun1,2,3WANGRen1,2,3WANGLi1,2,3LIYong-fu1,2,3YANGDan1,2,3YUXiao-bin4CHENZheng-xing1,2,3
(1.StateKeyLaboratoryofFoodScienceandTechnology,JiangnanUniversity,Wuxi,Jiangsu214122,China;2.NationalEngineeringLaboratoryforCerealFermentationTechnology,Wuxi,Jiangsu214122,China;3.SchoolofFoodScienceandTechnology,JiangnanUniversity,Wuxi,Jiangsu214122,China;4.SchoolofBiotechnology,JiangnanUniversity,Wuxi,Jiangsu214122,China)
Aflatoxin B1-contaminated corn (ACC) (83.0 μg/kg) was treated for 40 min at 90 mg/L ozone. And mice were used to assess the vivo toxicity of ozone treated ACC. Results indicated that compared with basal feedstuff, the mean weight of mice fed with ACC significantly decreased (P<0.05). Whereas, the liver and kidney/body weight ratio increased significantly (P<0.05). Alanine transaminase (ALT), aspartate aminotransferase (AST), and alkaline phosphatase (ALP) in serum increased significantly (P<0.05). The total protein (TP), albumin (ALB), and globulin (GLB) content significantly decreased (P<0.05). When mice were fed with the ozone-treated ACC, no significant differences were observed in the mice mean weight, as well as the liver and kidney/body weight ratio. Additionally, no significant differences occurred in the major serum indexes ALT, TP, ALB, and GLB (P>0.05). Meanwhile, AST and ALP increased significantly (P<0.05). The study indicated that ACC can lead to significant changes in various physiological characteristics and biochemical indexes in liver and kidney tissues, while the ozone-treated ACC could significantly improve these changes.
aflatoxin B1; corn; ozone; degradation; toxicity
公益性行业(农业)科研专项项目(编号:201203037);公益性行业(粮食)科研专项项目(编号:201313005,201513006);国家自然科学基金(编号:31371874,31501579);国家国际科技合作专项(编号:2015DFA30540);江苏省博士后基金(编号:1501078B)
罗小虎,男,江南大学副教授,博士。
陈正行(1960-),男,江南大学教授,博士,博士生导师。
E-mail: zxchen_2008@126.com
2016-06-03
10.13652/j.issn.1003-5788.2016.08.014

