空洞型肺癌误诊为肺曲霉菌病的原因分析
朱强 陈良安 杨震
(中国人民解放军总医院呼吸科,北京 100039)
·真菌病治疗·
空洞型肺癌误诊为肺曲霉菌病的原因分析
朱强陈良安杨震
(中国人民解放军总医院呼吸科,北京 100039)
目的通过分析1例以肺内单发空洞为表现的周围型肺癌误诊原因,总结经验教训以降低误诊率。方法回顾分析 1例空洞型肺癌误诊为肺曲霉菌病的临床资料,并复习相关文献。结果本例患者为44岁男性,以咳嗽、咯血症状起病,CT发现右下肺单发空洞,被误诊为肺曲霉菌病7个月,经抗真菌治疗后临床症状好转,多次复查胸部CT提示肺内空洞大小未见明显变化,洞壁变厚,原发空洞内结节消失并新发微小附壁结节,空洞边缘出现锯齿状突起,周围出现多发卫星结节,胸膜牵拉、相连渐进明显。后经CT引导下肺穿刺活检确诊为右肺下叶中-低分化腺癌。结论肺内单发空洞的鉴别诊断有一定难度,需要通过影像学结合临床特征和实验室检查来仔细鉴别,PET/CT可以很好的对其良恶性进行鉴别,组织病理是确诊的金标准,为避免误诊误治,在没有明确禁忌和高危因素的情况下,及早活检是十分必要的。
肺部单发空洞;鉴别诊断;肺癌;肺曲霉菌病
[Chin J Mycol,2016,11(4):235-239]
肺癌是全球及中国发病率和死亡率最高的恶性肿瘤,严重威胁我国居民的身体健康[1-2]。影像学检查是早期发现和诊断肺癌的重要手段,胸部CT已成为最常用的影像学方法。肺部空洞是肺癌常见的CT表现之一,但缺乏特异性,需要与多种疾病进行鉴别。本文回顾性分析我院收治的1例表现为右下肺单发空洞、误诊为肺曲霉菌病的肺癌患者临床资料,复习文献并总结经验,以期减少相关病例的误诊。
1 病例资料
男,44岁,主因发现右下肺空洞5个月余入院。患者于2014年10月28日无明显诱因出现咳嗽、咯血,伴右胸不适,无发热,于当地医院查肺CT提示右肺下叶后基底段4.0 cm×3.7 cm大小的类圆形空洞,壁薄,边缘光滑,腔内有一乳头状密度增高影,呈“空气新月征”表现,空洞边缘可见片状低密度磨玻璃影,呈“晕征”表现(见图1)。实验室检查肿瘤标记物正常,结核三项、结核感染T细胞检测(T-spot)、痰涂片找抗酸杆菌均为阴性,风湿疾病相关抗体均阴性,痰培养发现曲霉菌。11月2日于当地医院住院治疗,给予伏立康唑注射液(首剂400 mg,第2天起200 mg/d)抗感染、祛痰、止血等治疗。11月12日复查肺CT示右下肺空洞病灶形态较前相仿,空洞内容物消失,边缘毛糙,可见密集的细短毛刺,空洞后缘与背侧胸膜牵拉(见图2)。患者咳嗽、咯血症状好转,出院继续口服伊曲康唑胶囊(0.2 g/次,2次/d)。2014年12月中旬患者自行停服伊曲康唑胶囊。2015年1月咳痰、咯血症状复发,自行恢复口服伊曲康唑胶囊(0.2 g/次,2次/d)。3月7日复查肺CT示右肺下叶后基底段类圆形薄壁空洞转变为壁厚空洞,洞壁厚薄不均,内壁可见结节,空洞边缘可见小棘状突起,空洞后缘与胸膜相连(见图3)。3月11日患者就诊于我院,入院时咳嗽伴少量咯血,无发热。查体:肺部查体未及异常。胸部正中线可见长度约20 cm的手术瘢痕,右侧胸部腋中线附近可见两个直径约2.0 cm的类圆形手术疤痕,下腹正中可见长度约10 cm的手术疤痕。既往II型糖尿病史10 a,高血压病史10 a,2005年因冠状动脉粥样硬化性心脏病行冠脉搭桥术,上述慢性病长期规律用药,病情控制可。2010年因结肠癌行部分结肠切除术,术后规范复查,未见肿瘤复发。入院后查血常规、C-反应蛋白(CRP)、降钙素原正常,尿常规镜下未见红细胞,肿瘤标记物正常,痰涂片及培养均阴性,结核三项阴性,T-spot阳性,1,3-β-D葡聚糖检测(G试验)阴性,半乳糖甘露醇聚糖抗原检测(GM试验)阳性(≥0.5),风湿免疫相关抗体均正常。3月14日复查肺CT示空洞下缘周围出现多个膜玻璃密度小结节,空洞后缘与胸膜接触面增宽(见图4)。给予口服伏立康唑(0.2 g/次,2次/d),咳嗽、咯血症状好转,4月22日复查肺CT(见图5)示右下肺空洞较前相仿,停用伏立康唑,行CT引导下肺穿刺活检,病理示右肺中分化腺癌,转胸外科行胸腔镜下右肺下叶切除术,术后病理分期为(pT2aN0M0 IB期),术后给予培美曲塞/顺铂辅助化疗4周期。目前患者病情稳定。
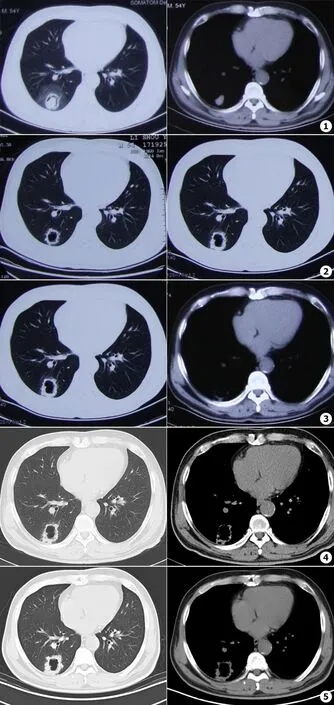
图12014年10月28日胸部CT平扫,临床考虑肺曲霉菌病图2 伏立康唑注射液(首剂400 mg,第2天起200 mg/d)抗感染治疗10 d(11月12日复查胸部CT平扫)图3间断口服伊曲康唑胶囊(0.2 g,2次/d)4个月余(2015年3月7日复查肺CT平扫)图4初诊(2015年3月14日复查肺CT平扫)图5口服伏立康唑(200 mg,2次/d)1个月余(2015年4月22日复查肺CT平扫)
Fig.1The chest CT scan on October 28,2014,the pulmonary aspergillosis was considered clinicallyFig.2Reexamined the chest CT on November 12,2014 after the patient took anti-infection treatment with voriconazole(The first dose of 400 mg,the second day of 200 mg/d) for 10 daysFig.3Reexamined the chest CT on March 7,2015 after the patient intermittent took oral itraconazole capsulesat(0.2 g,2/d) for four monthsFig.4Reexamined the chest CT on March 7,2015 when the patient was admitted to our hospital for the first time and reexamined the chest CT on March 14,2015Fig.5Reexamined the chest CT on March 7,2015 after the patient took oral voriconazole tables(200 mg,2/d) for four months
2 讨 论
近年来,全球肺癌患者日趋增多,年平均增长率达1.63%[3],存在吸烟、高危职业及肺部基础疾病等高危因素时发病率普遍更高,如韩国、日本和中国科学家统计了全球吸烟的肺癌发生率达到75%左右,亚洲人群甚至更高,但大部分高危人群并未引起重视,诊断明确时已处于肺癌晚期。肺癌最常见影像学表现是肺部孤立性圆或椭圆形块影,孤立性肺空洞作为少见的肺癌特殊表现类型也在不断增多,薄壁或厚壁空洞均可出现。一般认为壁厚度>4 mm或者周围有浸润或肿物的含气腔称为空洞,而壁厚度<4 mm的含气腔病变为肺囊性病变,普遍认为肺孤立性囊性病变是良性病变[4-5]。1954年,英国的Anderson和Pierce首先报道了表现为囊性病变的肺癌[6],此后也有该类肺癌的相关文献报道,但大多数为个案报道,且多数为亚洲国家,而我国郭俊唐等[7]首次将此类肺癌定义为薄壁空洞性肺癌。厚壁空洞性肺癌相对常见,约占空洞性肺癌70%,且预后较差,主要原因是两种类型的肺癌形成机制不同,厚壁空洞性肺癌血管浸润更常见[8],而大多数薄壁空洞性肺癌由阀门效应引起。由于其影像学表现复杂多样,且发病隐匿,病死率较高,早期诊断是临床中一大挑战。本例报道根据影像学表现经验性诊断为肺曲霉菌病,忽略了恶性病变在孤立性肺空洞的发生率。
孤立性肺空洞中恶性病变较良性病变比较有较高的厚壁空洞发生率,Woodring等[9]报道空洞壁最厚部分可以用来鉴别良恶性空洞。空洞性肺癌在肺孤立性空洞病变中比例约为6%,属于少见疾病。其他常见的疾病包括肺大疱、先天性囊性病变、结核和肺曲霉菌病。本例报道主要为空洞性肺癌与肺曲霉菌病相鉴别,有研究表明肺癌在肺曲霉菌病上有较高的发生率[10],而肺曲霉菌病也容易发生在有肺部原发性疾病的基础上[11],其中肺结核、肺癌和支气管扩张是最常见并发肺曲霉菌病的基础疾病。Hanagiri T和Roig J曾报道肺曲霉菌病继发于空洞性肺癌[12-13],发生率约2%~7%,可见二者在临床上可相互影响或共存,致使其鉴别十分困难。一般认为“空气新月征”“晕征”为肺曲霉菌的常见影像学表现,此类患者多合并免疫功能缺陷,而其他肺曲霉菌病患者影像学表现形式常无上述征象[14-15],最近的一项研究也显示重症监护室中只有2.5%的肺曲霉菌患者在CT上可表现为“晕征”[16]。此外,少数肺曲霉菌病患者空洞周围还可出现“串珠征”“滚珠征”“球内含气征”等[17]。上述部分影像学特征性表现有助于临床诊断肺曲霉菌病。如“晕征”多见于曲霉菌感染后1周左右,对肺曲霉菌病早期诊断有一定帮助[18]。Caillot等[19]的研究发现“空气新月征”多见于曲霉菌感染后2~3周,是诊肺曲霉菌病处于中晚期或感染吸收期非常有用的依据且不受外界因素影响,但对于早期诊断帮助不大[20-21]。国外也有文献报道空洞性肺癌影像学也可表现为“空气新月征”“晕征”[22-23],值得注意的是,在具有免疫活力的人群中支气管肺泡腺癌表现为“晕征”最常见,其他各种系统性疾病如韦格纳肉芽肿病、结节病、淀粉样变等疾病影像学均可表现为“晕征”[24-35],在临床中遇到此类影像学表现时容易主观经验性诊断为肺曲霉菌病,导致误诊误治。结合该病例,患者初始空洞特征有“空气新月征”“晕征”,有肺曲霉菌病发生的危险因素之一糖尿病史,查GM试验阳性,痰培养找到曲霉菌,外院先发抗曲霉菌治疗后咳嗽、咯血症状改善,空洞内容物消失,临床高度怀疑肺曲霉菌病,经伏立康唑注射液序贯伊曲康唑胶囊口服抗真菌治疗,症状反复、病灶未在继续吸收,不排除早期合并曲霉菌感染,经抗真菌治疗后肺曲霉菌病已好转,以至于患者最终组织活检病理提示肺腺癌而未能发现肺曲霉菌,仅能最终诊断为空洞性肺癌。但结合文献复习该病例完全存在肺癌早期合并肺曲霉菌病可能,甚至后期诊断的空洞性肺癌可能继发与肺曲霉菌病,遗憾的是未能及早获得组织培养和组织病理,缺少肺曲霉菌病的确诊条件,导致在该病例中未能明确二者的始发因素,这表明空洞性肺癌在影像学上属于不典型肺癌而诊断困难。因此,临床工作中因注意此类肺癌,仔细鉴别影像学表现中的孤立性肺空洞。
本文中患者单发空洞鉴别诊断的疾病主要为肺癌和肺曲霉菌病,高分辨CT仍是主要鉴别手段,二者影像学鉴别的要点有:①大小:肺癌空洞直径常大于4 cm,霉菌空洞大小不一。②洞壁的厚度:肺癌空洞多为厚壁(≥3 mm)或洞壁厚薄不均,少数患者因肿瘤发生于肺泡壁表现为薄壁空洞。霉菌空洞壁厚薄不一,受感染的曲霉菌菌属影响。③空洞内壁及内容物:癌性空洞内壁凹凸不平,可见壁结节,空洞内多为肿瘤结节、坏死物和凝血块等,内容物形态易受洞内气体或体位影响。霉菌空洞内壁凹凸不平,空洞内多为曲霉球,空洞内气体在其衬托下呈现出“空气新月征”。④空洞外壁及周围异常形态:癌性空洞外壁毛糙,可见毛刺、放射冠、分叶、胸膜牵拉等恶性病变征象,空洞周围多无异常形态。霉菌空洞外壁较模糊,与邻近肺组织界限不清,难以辨别,空洞周围可见磨玻璃样“晕征”环绕。“空气新月征”“晕征”可作为肺曲霉菌病影像学的特征性表现,但仅可作为空洞鉴别的重要参考条件,并非诊断的决定性因素。如“空气新月征”,最常见于肺曲霉菌病[36],还可见于肺结核、肺栓塞、错构瘤等疾病。鉴别“空气新月征”时主要观察其位置、大小、形状、边缘特点及患者临床症状,如肺曲霉菌病影像学表现中的“空气新月征”多发生于肺上中叶,形状较小,密度非均匀,腔内容物为纤维钙化样组织,即曲霉球,且易动态变化,病变周围常出现低密度磨玻璃样的浸润影,直径常超过3 cm[37],咯血病史可作为其重要诊断依据之一[38]。肺癌影像学表现中的“空气新月征”极少见,无特异性好发部位,形状较大,腔内容物为低密度软组织影,多为肿瘤结节或凝血块,部分可见钙化点,病变周围多合并毛刺征、分叶征、胸膜凹陷征及血管集束征等。
肺内单发空洞可发生于多种疾病,甚至一种疾病的不同分型或是在其发病的不同时期会出现其他疾病的空洞特征,导致在分析空洞的过程中造成“误判”。因此影像学鉴别有其局限性,需仔细分析空洞特点,并综合临床症状、实验室检查结果,缩小鉴别疾病范围,大多数情况下组织病理才是确诊的金标准。“空气新月征”“晕征”等在肺曲霉菌病具有一定特征性的影像表现,结合危险因素、临床表现和实验室检查虽然可作出肺曲霉菌病的临床诊断并采用先发治疗,但仍有误诊的可能,确诊仍然依靠组织病理。
PET/CT是肺部良恶性疾病鉴别诊断的重要工具,对于单发空洞、以及伴随的“空气新月征”“晕征”,PET/CT也可以很好的通过18F-FDG吸收模式和SUVpeak等参数对其良恶性进行初步判断[39],为组织活检提供更多的信息。
此外,该患者不能完全排除肺癌合并曲霉菌感染的可能,这提示临床在没有明确禁忌和高危因素的情况下,尽早活检是十分必要的。本例患者的误诊原因在临床具有一定的代表性,其经验教训对今后的临床工作有较好的警示意义。
[1]杨玲,李连弟,陈育德.中国肺癌死亡趋势分析及发病、死亡的估计与预测[J].中国肺癌杂志,2005,8(4):274-278.
[2]屈若炜,周宝森.2004-2010年中国肺癌死亡分布及趋势分析[J].中国卫生统计,2014,6(31):934-935.
[3]王永川,魏丽娟,刘俊田,等.发达与发展中国家癌症发病率与死亡率的比较分析[J].中国肿瘤临床,2012,39(10):679-682.
[4]Ryu JH,Swensen SJ.Cystic and cavitary lung diseases:focal and diffuse[J].Mayo Clin Proc,2003,78(6):744-752.
[5]Vourtsi A,Gouliamos A,Moulopoulos L,et al.CT appearance of solitary and multiple cystic and cavitary lung lesions[J].Eur Radio,2001,11(4):612-622.
[6]Anderson HJ,Pierce JW.Carcinoma of the bronchus presenting as thin-walled cysts[J].Thorax,1954,9(2):100-105.
[7]郭俊唐,梁朝阳,初向阳,等.薄壁空洞性肺癌:24例病例分析及文献回顾[J].Chin J Lung Cancer,2014,17(7):553-556.
[8]Chaudhuri MR.Pimary pulmonary cavitating carcinomas[J].Thorax,1973,28(3):354-366.
[9]Woodring JH,Fried AM,Chuang VP.Solitary cavities of the lung:diagnostic implications of cavity wall thickness[J].AJR Am J Roentgenol,1980,135(6):1269-1271.
[10]Ueda H,Motohiro A,Iwanaga T.Bronchogenic carcinoma following pulmonary aspergilloma[J].Thorac cardiovasc surg,1997,45:261-262.
[11]Park CK,Jheon S.Results of surgical treatment for pulmonary aspergilloma[J].Eur J Cardiothorac Surg,2002,21(5):918-923.
[12]Hanagiri T,Okabayashi K,Mitsudomi T,et al.Aspergilloma within cavitating pulmonary carcinoma[J].scand J Thorac cardiovasc surg,1993,27(1):57-60.
[13]Roig J,Ruiz J,Puig X,et al.Bronchial stump asperigillosis four years after Lobectomy[J].Chest,1993,104(1):295-296.
[14]Franquet T,Muller NL,Gimenez A,et al.Specturm pulmonary aspergillosis:histologic,clinical,and radiologic findings[J].Radiographics,2001,21(4):825-837.
[15]Thompson BH,Stanford W,Galvin JR,et al.Varied radiologic appearances of pulmonary aspergillosis[J].Radiographics,1995,15(6):1273-1284.
[16]Vandewoude KH,Blot SI,Depuydt P,et al.Clinical relevance of Aspergillus isolation from respiratory tract samples in critically ill patients[J].Crit Care,2006,10(1):31.
[17]王大伟,甘新莲.肺真菌感染的CT征象分析[J].临床肺科杂志,2011,16(3):350-351.
[18]王树军,刘金山,刘刚,等.肺曲霉菌病二例误诊为肺结核讨论[J].临床误诊误治,2009,22(10):46-47.
[19]Caillot D,Couaillier JF,Bernard A,et al.Increasing volume and changing characteristics of invasive pulmonary aspergillosis on sequential thoracic computed tomography scans in patients with neutropenia[J].J Clin Oncol,2001,19(1):253-259.
[20]Stefan S,Carlos H,Buitrago T,et al.Direct detection of angioinvasive pulmonary aspergillosis in immunosuppressed patients:preliminary result with high-resolution 16-MDCT angiography[J].AJR,2005,185(3):746-751.
[21]Angus RM,Davies ML,Cowan MD,et al.Computed tomographic scanning of the in patients with allergic bronchopulmonary aspergillosis and in asthmatic patients with a positive skin test to Aspergillus fumigatus[J].Thorax,2004,49(6):586-589.
[22]Tseng YY,Chen CH.Air crescent sign:not always due to fungal infection[J].QJM,2015,108(3):255-256.
[23]Godoy MC,Viswanathan C,Marchiori E,et al.The reversed halo sign:update and differential diagnosis[J].Br J Radiol,2012,85(1017):1226-1235.
[24]Primack SL,Hartman TE,et al.Pulmonary nodules and the CT halo sign[J].Radiology,1994,190(2):513-515.
[25]Gaeta M,Blandino A,Scribano E,et al.Computed tomography halo sign in pulmonary nodules:frequency and diagnostic value[J].J Thorac Imaging,1999,14(2):109-113.
[26]Gaeta M,Volta S,Scribano E,et al.Air-space pattern in lung metastasis from adenocarcinoma of the GI tract[J].J Comput Assist Tomogr,1996,20(2):300-304.
[27]Godoy MC,Rouse H,Brown JA,et al.Imaging features of pulmonary Kaposi sarcoma-associated immune reconstitution syndrome[J].Am J Roentgenol,2007,189(4):956-965.
[28]King LJ,Padley SP,Wotherspoon AC,et al.Pulmonary MALT lymphoma:imaging findings in 24 cases[J].Eur Radiol,2000,10(12):1932-1938.
[29]Nara M,Sasaki T,Shimura S,et al.Diffuse alveolar hemorrhage caused by lung metastasis of ovarian angiosarcoma[J].Intern Med,1996,35(8):653-656.
[30]Pandit SA,Fiedler PN,Westcott JL.Primary angiosarcoma of the lung[J].Ann Diagn Pathol,2005,9(5):302-304.
[31]Ueda T,Hosoki N,Isobe K,et al.Diffuse pulmonary involvement by mycosis fungoides:high-resolution computed tomography and pathologic findings[J].J Thorac Imaging,2002,17(2):157-159.
[32]Woodring JH,Bognar B.CT halo sign in pulmonary metastases from mucinous adenocarcinoma of the pancreas[J].South Med J,2001,94(4):448-449.
[33]Tomiyama N,Ikezoe J,Miyamoto M,et al.CT halo sign in metastasis of osteosarcoma[J].Am J Roentgenol,1994,162:468.
[34]Horger M,Lengerke C,Pfannenberg C,et al.Significance of the "halo" sign for progression and regression of nodular pulmonary amyloidosis:radiographic-pathological correlation[J].Eur Radiol,2005,15(9):2037-2040.
[35]Marten K,Rummeny EJ,Engelke C.The CT halo:a new sign in active pulmonary sarcoidosis[J].Br J Radiol,2004,77(924):1042-1045.
[36]Felson,B.The mural nodule in cavity opportunistic pulmonary aspergillosis[J].Radiology,1982,143(3):619-622.
[37]Rrcan Tuncel.Pulmonary Air Meniscus Sign[J].Respiration,1984,46(1):139-144.
[38]Levin EJ.Pulmonary intracavitary fungus ball[J].Radiology,1956,66(1):9-16.
[39]Ji Young Kim,Jung-Wan Yoo,Minyoung Oh,et al.18F-Fluoro-2-Deoxy-D-Glucose Positron Emission Tomography/Computed Tomography findings are different between invasive and noninvasive pulmonary aspergillosis[J].J Comput Assist Tomogr,2013,37(4):596-600.
[本文编辑]施慧
The reason for cavitating lung adenocarcinoma misdiagnosed as pulmonary aspergillus disease
ZHU Qiang,CHEN Liang-an,YANG Zhen
(The General Hospital of the People's Liberation Army)
ObjectiveTo conclude the experience and reduce misdiagnosis rate in future by analyzing a case of single lung cancer cavity misdiagnosed as pulmonary aspergillosis cavity on CT.MethodsA patient with lung cancer cavity misdiagnosed as pulmonary aspergillosis was retrospectively analyzed and relevant literatures were reviewed.ResultsOnset with cough and hemoptysis,a 44-year-old male patient was found with a solitary cavity in the lower lobe of right lung,was misdiagnosed as pulmonary aspergillosis for seven months.The clinical symptoms were improved after antifungal treatment,but there was no obvious change on pulmonary cavity by many times chest CT reexamine.The cavity wall became thicker,the nodules within primary cavity disappeared,and many new tiny wall nodules were found.Serrated protrusions and multiple satellite nodules appeared on the cavity margin and around the cavity respectively.The stretch and connection between cavity and pleura became obvious gradually.Then a definite diagnosis of moderately and poor differentiated lung adenocarcinoma in the lower lobe of right was produced through lung puncture biopsy guided by CT.ConclusionThere had certain diffculty to make differential diagnosis of solitary lung cavity by radiographic methods.Clinical characteristics and laboratory tests should be combined to help identification.Tissue pathology was the gold standard for diagnosis.So early biopsy might benecessary to avoid the misdiagnosis and mistreatment,provided that there was no obvious tabooes and risk factors.
single lung Cavity;differential diagnosis;lung cancer;Pulmonary asperillosis
朱强,男(汉族),学士,住院医师.E-mail:zhuqiang168168@163.com
杨震,E-mail:yztoogetyou@163.com
R 734.2R 519.8
A
1673-3827(2016)11-0235-05
2016-01-07

