红花籽水解蛋白的精制
赵丽,王佳,李君,朱丹实,王胜男,王勃,何余堂,马涛,刘贺
(渤海大学 食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州,121013)
红花籽水解蛋白的精制
赵丽,王佳,李君,朱丹实,王胜男,王勃,何余堂,马涛,刘贺*
(渤海大学 食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州,121013)
以水酶法制油工艺得到的红花籽水解蛋白为原料,对比了DA201-C、XAD1180N、D3520三种大孔吸附树脂对红花籽水解蛋白的静态吸附性能,并对其组成成分进行分析。结果表明:DA201-C树脂对水解蛋白吸附率与解吸率最高,能有效去除糖类等杂质;DA201-C树脂对水解蛋白的吸附平衡时间为2 h,吸附率为48.39%,体积分数70%乙醇解吸效果最好,解吸率为90.44%。经DA201-C树脂纯化后的水解蛋白,蛋白质含量提高了30.10%,脂肪含量降低了91.53%,糖含量降低了95.52%,色差L*值提高了11.63%,b*值降低了20.91%。
红花籽水解蛋白;大孔吸附树脂;纯化
红花(CarthamustinctoriusG.Safflower),又称红兰花或草红花,属于菊科、红花属,是一年生双子叶植物[1],其花冠、籽实、茎叶、秸秆都可利用。红花籽,是红花的种子,俗称为“白平子”,红花籽蛋白含有许多氨基酸,且绝大多数为必需氨基酸[2],可作为一种蛋白质营养强化剂和食品添加剂,从而缓解植物蛋白质资源的缺乏,具有较高的开发利用价值。
水酶法是以机械和生物酶解为手段来破坏植物种子细胞结构,增加油料组织中油的流动性,继而分离出油脂同时制得蛋白质[3]。水酶法反应条件温和,周期短,工艺简单,制成的水解蛋白营养价值高,且主要以低分子质量的短肽和游离氨基酸为主,易于人体吸收。但水酶法制得的红花籽水解蛋白中含有较多的脂肪、糖类、灰分等杂质,严重影响其色泽、货架期等,极大地限制了在食品行业中的应用。
蛋白质的分离纯化有溶剂法、沉淀法、超滤法、层析法等[4]。层析法中,柱填料有大孔吸附树脂、离子交换树脂、凝胶、硅胶、聚丙烯酰胺等[5]。大孔吸附树脂主要通过分子间作用力如范德华引力或氢键等对被吸附的分子进行吸附,吸附剂表面的亲水性或疏水性决定了具有不同的吸附特性;同时其本身的多孔性结构亦决定其具有一定的分子筛作用[6]。大孔吸附树脂由于具有比表面积大、理化性质稳定、吸附量大、选择性好、吸附速度快、解吸条件温和、易再生、可重复利用等优点[7],现已广泛应用于环保、化工、医药和食品行业。
本试验以水酶法制油工艺得到的红花籽水解蛋白为原料,对比了DA201-C、XAD1180N、D3520三种大孔吸附树脂对红花籽水解蛋白的静态吸附性能,筛选出最佳大孔吸附树脂以除去其中糖类、脂肪及色素等杂质,以提高红花籽水解蛋白的纯度。
1 材料与方法
1.1材料与仪器
红花籽,新疆红花缘科技有限公司;胰蛋白酶,酶活4 000 u/g,南宁庞博生物工程有限公司;牛血清白蛋白标准品,上海如吉生物科技发展有限公司;NaOH、酒石酸钾钠、无水Na2CO3,分析纯,天津市风船化学试剂科技有限公司;福林酚试剂,分析纯,上海荔达生物科技有限公司;CuSO4、正丁醇、葡聚糖,分析纯,天津市化学试剂三厂;石油醚,分析纯,天津市致远化学试剂有限公司;蒽酮,分析纯,天津市科密欧化学试剂有限公司;三氯甲烷、浓H2SO4、浓HCl,分析纯,锦州古城化学试剂厂;无水乙醇,分析纯,天津市光复科技发展有限公司;DA201-C、D3520、XAD1180N大孔吸附树脂,郑州勤实科技有限公司,具体物理参数见表1。

表1 不同大孔吸附树脂的物理参数
SL-205A高速多功能粉碎机,浙江省永康市松青五金厂; DZF-6050真空干燥箱,上海博迅实业有限公司医疗设备厂;PHS-3C精密pH计,上海雷磁仪器厂;DK-8D电热恒温水浴槽,上海一恒科技有限公司;RE-3000旋转蒸发仪,上海亚荣生化仪器厂;L-535R离心机,长沙湘仪仪器有限公司;JA21002精密电子天平,上海舜宇恒平科技仪器有限公司;SP-1500喷雾干燥机,上海顺仪试验设备有限公司;DHG-9055A电热鼓风干燥箱,上海一恒科学仪器有限公司;UV-2550紫外分光光度计,日本岛津公司;CR-400型色彩色差计,Konica Minolta。
1.2实验方法
1.2.1红花籽水解蛋白的制备工艺
将红花籽干燥粉碎后,与去离子水以1∶5(g∶mL)比例混匀,置于80 ℃水浴中灭酶10 min,调pH 9~12,加入156 u/g胰酶,50~55 ℃酶解3 h;80 ℃水浴灭酶10 min后,4 000 r/min离心20 min;移取上层清油和少许乳化层,得到水解蛋白液[8];再进行真空浓缩(比例0.6);然后喷雾干燥,雾化频率60 Hz,撞针间隔时间5 s,进气压力0.3 MPa,进料速度276.5 mL/h、进口温度175 ℃,最终制得红花籽水解蛋白粉[9]。
1.2.2大孔吸附树脂的预处理
将不同型号的大孔吸附树脂先用无水乙醇浸泡24 h,使树脂充分溶胀,然后用无水乙醇洗至220 nm处无吸收峰,再用去离子水洗净至无乙醇味备用。接着浸泡于5倍体积的质量分数5%NaOH溶液中2 h,用蒸馏水洗至pH值为7;最后浸泡于5倍体积的体积分数5%HCl溶液中浸泡2 h后,用蒸馏水洗至pH值为7,备用[10]。
1.2.3大孔吸附树脂的筛选
(1)静态吸附:称取处理好的DA201-C、D3520、XAD1180N树脂各10 g,分别加入质量浓度8 mg/mL的红花籽水解蛋白溶液50 mL,在25 ℃恒温摇床振荡12 h,速度为150 r/min。测定溶液中蛋白质含量,计算各型号树脂的吸附率及吸附量,公式如下[11]:


(2)静态解吸:取上述已经吸附平衡的各型号树脂10 g过滤,加入75%乙醇40 mL作为洗脱剂,在25 ℃恒温摇床振荡12 h,速度为150 r/min,测定溶液中蛋白质含量,计算解吸率,公式如下[11]:

1.2.4DA201-C大孔吸附树脂静态吸附能力
称取DA201-C大孔吸附树脂10 g,加入质量浓度8 mg/mL红花籽水解蛋白溶液50 mL,在25 ℃恒温摇床振荡12 h,速度为150 r/min,间隔1 h取样[12],测定溶液中蛋白质含量,计算树脂的吸附率。
1.2.5DA201-C大孔吸附树脂解吸剂的确定
称取10 g DA201-C大孔吸附树脂,加入质量浓度8 mg/mL红花籽水解蛋白溶液50 mL,在25 ℃恒温摇床振荡2 h,速度为150 r/min。将吸附后的10 g DA201-C树脂过滤,分别加入体积分数(下同)65%、70%、75%、80%、85%、90%乙醇40 mL作为洗脱剂,在25 ℃恒温摇床振荡12 h,速度为150 r/min,测定解附液中蛋白质含量,计算解吸率[13]。
1.2.6样品成分分析
蛋白质含量的测定:Folin-酚测定法[14];粗脂肪含量的测定:索氏抽提法,参照GB/T5009.6—2003;糖含量的测定:蒽酮-硫酸法[15];水分含量的测定:直接干燥法,参照GB/T5009.3—2003。
1.2.7色差的测定
用CR-400型色彩色差计测定色差。
1.2.8统计分析
2 结果与分析
2.1最佳大孔吸附树脂的确定
不同大孔吸附树脂对红花籽水解蛋白的吸附性能见图1。
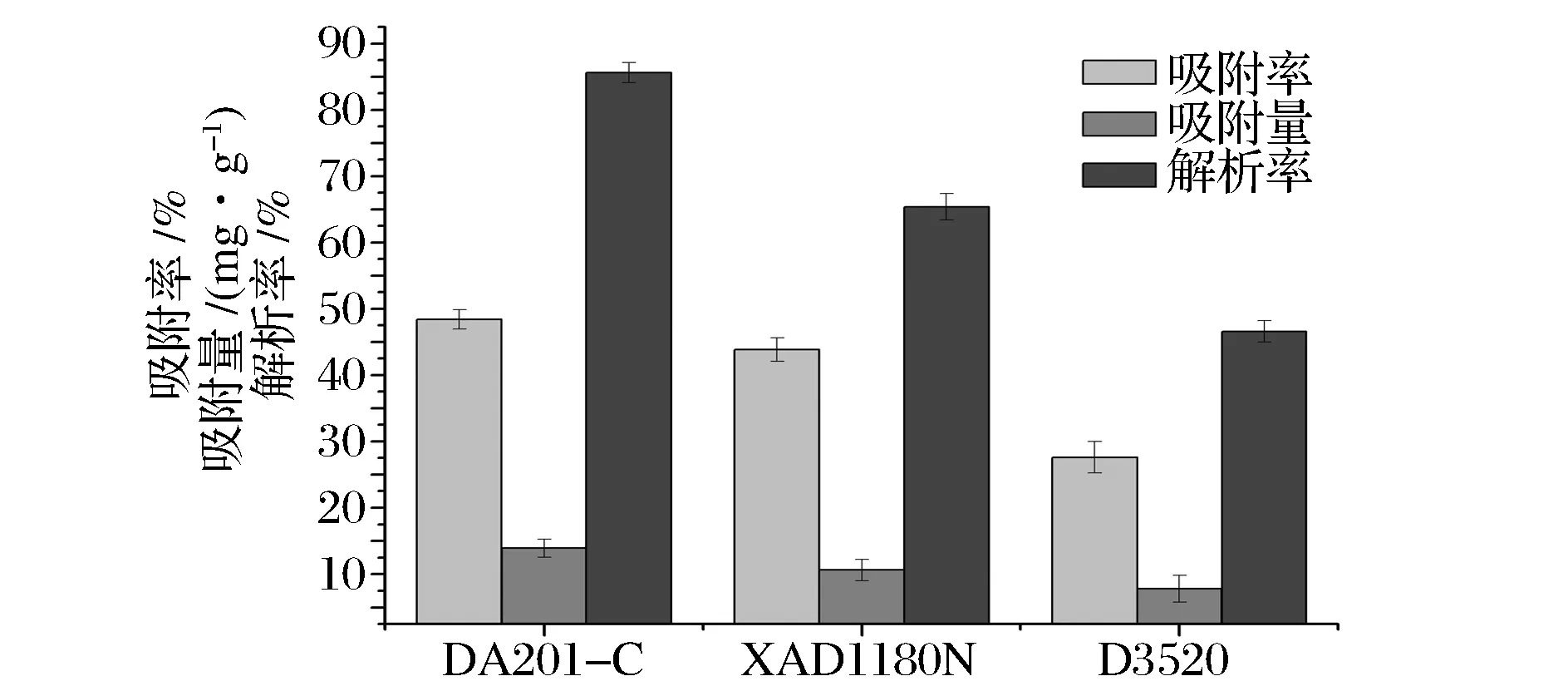
图1 不同大孔吸附树脂对红花籽水解蛋白的吸附性能Fig.1 Effect of different macroporous adsorption resins on adsorption performance of safflower seeds protein hydrolysate
由图1可知,DA201-C树脂对红花籽水解蛋白的吸附性能最好,吸附率为48.39%,吸附量为13.9 mg/g,解吸率为85.60%,而D3520和XAD1180N树脂对红花籽水解蛋白的吸附率和解析率相对较低,表明DA201-C大孔吸附树脂对红花籽水解蛋白不仅具有较强的吸附能力,而且容易洗脱,适用于红花籽水解蛋白的分离精制。
大孔树脂的吸附性能主要取决于树脂的极性和空间结构(孔径、比表面积等)。大孔吸附树脂的吸附主要为物理吸附,吸附树脂的比表面积决定了其饱和吸附量,随着比表面积的增加,表面张力也在增大,吸附量提高,对吸附有利[11]。DA201-C大孔吸附树脂的比表面积最大,所以DA201-C大孔吸附树脂为纯化红花籽水解蛋白的最佳树脂。这与杨万根[16]等学者试验时筛选的最佳树脂结果类似。
2.2DA201-C大孔吸附树脂的静态吸附过程
图2是DA201-C大孔吸附树脂的静态吸附动力学曲线。
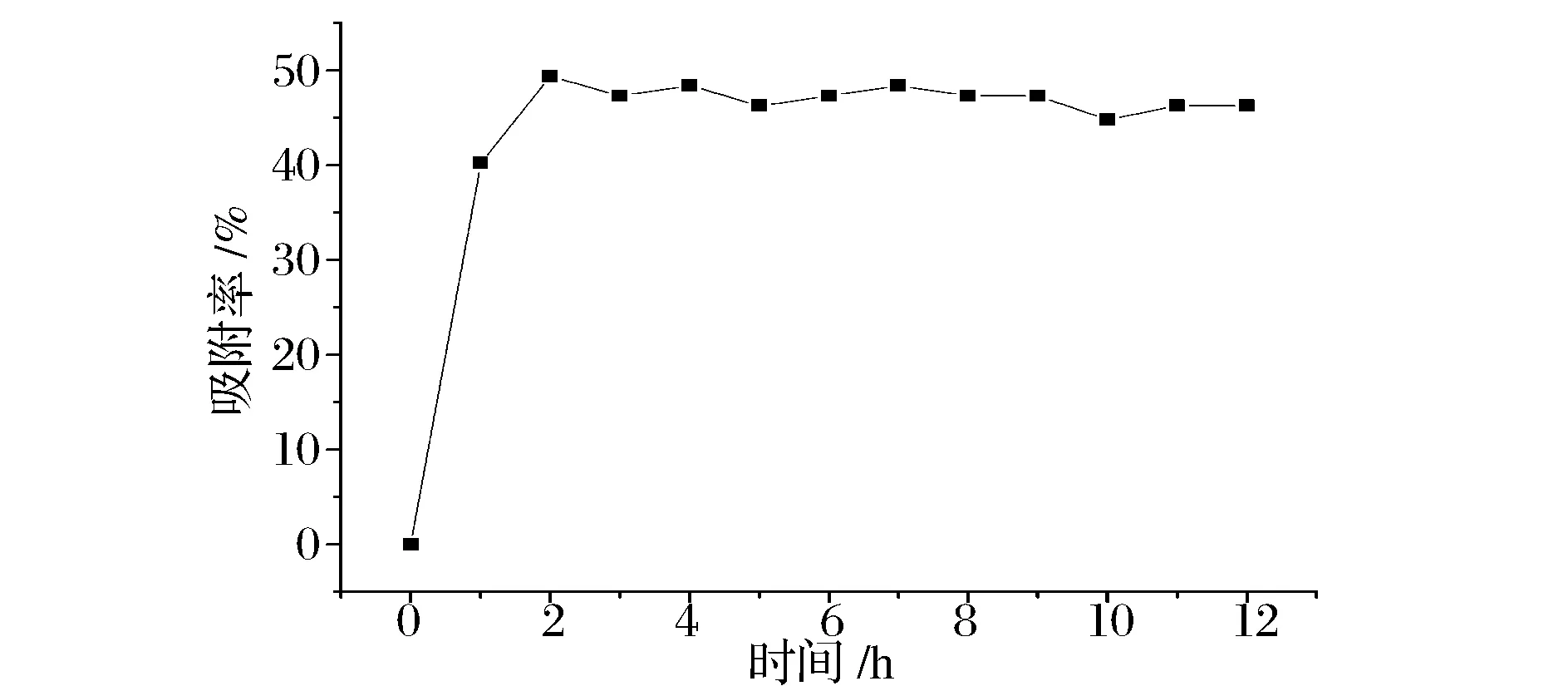
图2 DA201-C大孔吸附树脂的静态吸附动力学曲线 Fig.2 Static adsorption kinetics curve of DA201-C type macroporous adsorption resin
吸附速度是树脂吸附性能的重要参考指标,由图2可见,DA201-C大孔吸附树脂对红花籽水解蛋白的吸附属于快速平衡型,吸附率在0~1 h较快,1 h时吸附率达到40.24%,2 h时达到吸附平衡,此时吸附率为48.39%。DA201-C大孔吸附树脂是由偶极矩很小的单体聚合制得,不带任何功能基,孔表的疏水性较强[17]。在红花籽水酶法制油过程中,随着酶解的进行,红花籽水解蛋白逐渐被水解,更多疏水性氨基酸暴露,在吸附过程中,通过疏水相互作用从水相转移到树脂的疏水表面上。
王旭苹等[18]利用大孔树脂纯化酒花多酚,SP850树脂对酒花多酚的吸附量在0~2 h内,随时间延长而增大,之后吸附量趋于平衡,表明SP850树脂对酒花多酚能快速吸附平衡,与本研究结果类似。
2.3DA201-C大孔吸附树脂解吸剂的确定
根据相似相溶原理,对非极性大孔吸附树脂,解吸剂极性越小,其解吸能力越强[19]。本试验选用水-乙醇作为解吸剂,将已吸附了红花籽水解蛋白达到饱和的DA201-C大孔吸附树脂在25 ℃下分别用65%、70%、75%、80%、85%、90%乙醇解吸12 h,其解吸率见图3。
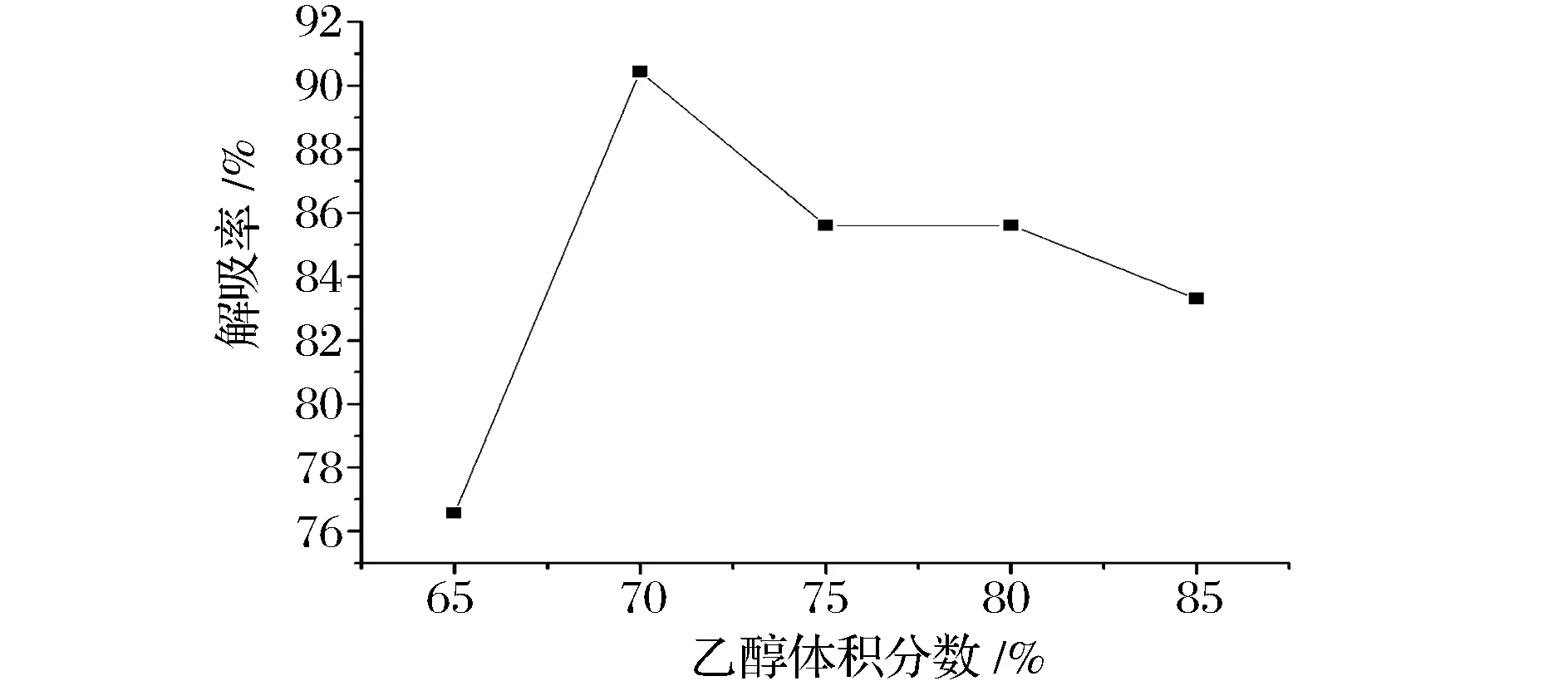
图3 乙醇浓度对DA201-C树脂解吸率的影响Fig.3 Effect of different ethanol concentration on desorption rate of DA201-C type macroporous adsorption resin
从图3可以看出,一定浓度的乙醇溶液利于树脂解吸,随着乙醇浓度的增加,树脂的解吸率显著提高,当乙醇浓度为70%时,DA201-C树脂解吸率最高,为90.44%;继续增加乙醇浓度时,树脂解吸率反而下降,当乙醇体积分数达到90%时,溶液出现浑浊并且分层现象,这可能与红花籽水解蛋白中存在一部分相对分子质量较大的肽有关,这部分物质在乙醇体积分数较大时溶解性较差,使得解吸剂与吸附的红花籽水解蛋白的相互作用受到影响,因此选择70%乙醇为解吸剂。
过振宇等[13]在大孔吸附树脂吸附分离家蝇抗菌肽的研究中,选用乙醇-水体系进行洗脱,随着乙醇浓度的增加,解吸率上升,75%乙醇溶液解吸率最高为74.79%。安晓婷等[20]利用大孔树脂纯化蓝莓果渣多酚,选用了乙醇-水体系进行洗脱时,60%乙醇解吸率达到最高。
2.4纯化前后红花籽水解蛋白组成成分分析
表2是红花籽水解蛋白经过DA201-C树脂处理前后的组成成分。

表2 纯化前后红花籽水解蛋白组成成分比较 %
由表2可知,红花籽水解蛋白在DA201-C树脂吸附下,蛋白质含量70.1%提高到了91.2%,纯度较之前提高了30.10%;脂肪含量由5.9%降低至0.5%,降低了91.53%;糖含量由6.7%降低至0.3%,降低了95.52%。可见,DA201-C树脂可显著降低其脂肪和糖含量,提高红花籽水解蛋白的纯度。
马寒冰等[21]采用DA201-C大孔吸附树脂纯化豆粕蛋白酶解液中的大豆多肽,纯化后大豆多肽含量提高了70.35%,糖含量降低了70.80%,盐含量降低了93.93%,说明DA201-C大孔吸附树脂能去除豆粕蛋白酶解液中大部分无机盐及糖类。章绍兵等[22]采用DA201-C大孔吸附树脂纯化水酶法提取的麦胚水解蛋白,可溶性总糖含量由33.72%降至10.95%,蛋白质含量由43.82%增加到76.64%,纯化效果明显。
2.5纯化前后红花籽水解蛋白色差分析
表3是红花籽水解蛋白经过DA201-C树脂处理前后的色差比较。

表3 纯化前后红花籽水解蛋白色差比较
由表3可知,经DA201-C树脂纯化后,L*值由75.48提高到了84.26,提高了11.63%;b*值由17.98降低至14.22,降低了20.91%。纯化前红花籽水解蛋白颜色较暗,且比较偏黄;而经DA201-C树脂纯化后的水解蛋白颜色变亮,黄色明显变浅,脱色效果明显。
3 结论
(1)比较了DA201-C、XAD1180N、D35203三种大孔吸附树脂对红花籽水解蛋白的静态吸附性能,结果表明,DA201-C树脂对水解蛋白吸附率与解吸率最高,因此DA201-C为纯化红花籽水解蛋白最佳的树脂。
(2)DA201-C静态吸附动力学曲线表明,DA201-C树脂对水解蛋白的吸附平衡时间为2 h,吸附率为48.39%;静态解吸以70%乙醇效果最佳,解吸率为90.44%。
(3)经DA201-C树脂纯化后的红花籽水解蛋白,蛋白质含量提高了30.10%,脂肪含量降低了91.53%,糖含量降低了95.52%,色差L*值提高了11.63%,b*值降低了20.91%。
(4)在后续研究中,可对红花籽水解蛋白进行动态吸附试验,并对其进行功能性质检测(起泡性、乳化性、溶解性和抗氧化性等),将其生产成功能性饮料、咀嚼片和速溶冲剂等。
[1]李杨,冯红霞,王欢,等.超声波辅助水酶法提取红花籽油的工艺研究[J].中国粮油学报,2014,29(7):63-67.
[2]杨玉霞,吴卫,郑有良,等.不同品种(系)红花籽粕营养品质分析[J].中国粮油学报,2008,23(4):174-178.
[3]宋玉卿,于殿宇,王瑾,等.水酶法提取榛子油工艺条件研究[J].食品科学,2008,29(8):261-264.
[4]吴少辉,刘光明.蛋白质分离纯化方法研究进展[J].中国药业,2012,21(1):1-3.
[5]李琼,陈恺,陈燕勤,等.大孔吸附树脂分离纯化核桃青皮总多酚[J].食品与机械,2015,31(1):175-180.
[6]程云辉,曾知音,伍桃英,等.大孔吸附树脂分离纯化麦胚蛋白酶解物中的抗氧化寡肽[J].食品与机械,2011,27(1):19-21.
[7]FU Bo-qiang,LIU Jie,LI Huan,et al.The application of macroporous resins in the separation of licorice flavonoids and glycyrrhizic acid[J].Journal of Chromatography A,2005,1 089:18-24.
[8]一种红花籽油的水相酶解提取方法[P].中国.102732372,2012-10-17.
[9]王雪.扁杏仁水解蛋白的抗氧化活性、理化性质及组成分析[D].锦州:渤海大学,2012.
[10]邓慧玲,郑炯,阚建全.大孔树脂DA201-C对猪血红蛋白ACE抑制肽吸附性能的研究[J].食品科学,2013,34(12):27-31.
[11]王英瑶,王璋,栾霞.利用大孔吸附树脂纯化花生水解蛋白[J].中国油脂,2010,35(12):24-27.
[12]李琼,陈恺,陈燕勤,等.大孔吸附树脂分离纯化核桃青皮总多酚[J].食品与机械,2015,31(1):175-180.
[13]过振宇.大孔吸附树脂吸附分离家蝇抗菌肽[D].无锡:江南大学,2008.
[14]罗芳.Folin-酚试剂法蛋白质定量测定[J].黔南民族师范学院学报,2005(3):46-47(72).
[15]李强,唐微,石园园,等.蒽酮-硫酸法和3,5-二硝基水杨酸法测定杜仲水提液多糖含量[J].食品工业科技,2010,31(10):370-371(374).
[16]杨万根,张煜,许时婴,等.大孔吸附树脂对蛋清蛋白水解物的吸附特性研究[J].食品与机械,2007,23(2):62-65.
[17]范文,阮长青,王鹤霖.DA201-C大孔吸附树脂对腐乳多肽脱盐作用的研究[J].中国粮油学报,2011,26(8):105-108.
[18]王旭苹,杨磊,杨小兰,等.大孔树脂纯化酒花多酚及其组成分析[J].食品科学,2013,34(22):15-20.
[19]苏细妹,黄晓敏,黄俊生.大孔树脂纯化山竹果壳废弃物色素的研究[J].中国调味品,2013,38(1):108-112.
[20]安晓婷,周涛,李春阳,等.大孔树脂纯化蓝莓果渣多酚及其组成分析[J].食品科学,2013,34(20):1-6.
[21]马寒冰,廖永红,徐曼.DA201-C大孔吸附树脂纯化大豆多肽条件优化[J].中国调味品,2014,39(9):43-48.
[22]章绍兵,刘向军,朱志方,等.水酶法提取麦胚水解蛋白的纯化及功能特性研究[J].河南工业大学学报,2012,33(5):6-10.
The refinement of safflower seeds protein hydrolysates
ZHAO Li, WANG Jia, LI Jun, ZHU Dan-shi,WANG Sheng-nan,WANG Bo, HE Yutang, MA Tao, LIU He*
(School of Food Science and Technology, Bohai University; Food Safety Key Lab of Liaoning Province;National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products; Jinzhou 121013, China)
In this paper, the macroporous adsorption resins DA201-C、XAD1180N and D3520 were chosen for purifying protein hydrolysates extracted by aqueous-enzymatic extraction of safflower seeds oil. The chemical composition of purified safflower seeds protein hydrolysates was studied. The results of static adsorption performance indicated that DA201-C showed higher adsorption rate and desorption rate. The adsorption equilibrium time of protein hydrolysates was 2 h, and the adsorption ration was 48.39%. The best desorption solvent was 70%ethanol, and the desorption rate was 90.44%. After purification by DA201-C, the protein content in safflower seeds protein hydrolysates increased with 30.10%, fat content decreased 91.53%, sugar content decreased 95.52%,L*increased with 11.63%,b*decreased 20.91%.
safflower seeds protein hydrolysates; macroporous adsorption resin; purification
10.13995/j.cnki.11-1802/ts.201601018
硕士研究生(刘贺教授为通讯作者,E-mail:liuhe2069@163.com)。
辽宁省高等学校优秀人才支持计划(No.LR2014034);国家自然科学基金面上项目(No.31471621);国家自然科学基金青年基金项目(No.31201385)
2015-07-10,改回日期:2015-09-18

