耐高温酿酒酵母菌株的选育
卜文静, 段秋虹, 杜金宇,王 毅,隋继学
(1.河南牧业经济学院能源与动力工程系,河南 郑州 450011; 2.郑州科技学院, 河南 郑州 450062; 3.河南农业大学机电工程学院,河南 郑州 450002)
耐高温酿酒酵母菌株的选育
卜文静1, 段秋虹2, 杜金宇1,王 毅3,隋继学1
(1.河南牧业经济学院能源与动力工程系,河南 郑州 450011; 2.郑州科技学院, 河南 郑州 450062; 3.河南农业大学机电工程学院,河南 郑州 450002)
以酿酒酵母L为研究对象,通过紫外诱变、高温驯化处理的方法,选育出1株耐高温酿酒酵母L-9a。研究结果表明:处理a在38 ℃条件下,L-9a生物量为106 mg,乙醇产率为53.02%,平均产量为1.71 mL·100 mL-1,残还原糖含量平均为0.76 g·100 mL-1,解决了同步糖化发酵中糖化和发酵温度不一致的问题。
生物乙醇;生物质;酿酒酵母;耐高温酵母
随着全球环境的恶化及能源危机的加剧,越来越多的国家开始关注能源问题。乙醇作为一种清洁的可再生能源,可用作液体燃料替代或部分替代汽油,不但可减少汽油的用量,还可减少环境污染[1-2]。纤维素类废弃物等转化为燃料乙醇已成为解决世界能源危机的一条理想途径,由于其不消耗粮食,不与粮争地,受到世界各国政府支持和科研工作者的广泛关注[3-4]。虽然很多微生物可应用于生产乙醇,但酿酒酵母仍然是首选菌株[5],它的发酵能力已经被证明比细菌更强,且更加耐乙醇和木质纤维素在水解中出现的抑制剂[6]。20世纪70 年代,一些学者在研究纤维素发酵产乙醇的过程中,为了防止糖积累和终产物抑制,进而提高纤维素酶的催化水解效率, 提出了同步糖化发酵(Simultaneous Saccharification and Fermentation, SSF)模式,受到了广泛重视[7]。然而,SSF 中一个最重要的问题就是最佳酶解温度(45~ 50 ℃)和乙醇发酵温度(25~35 ℃)不协调[8],这使得酵母菌的发酵与纤维素的酶解难以同步进行,因此选育耐高温酵母菌是解决这一问题的关键[9]。酿酒酵母对生活条件的变化有较强的适应能力,并且随着外界环境的变化,其群体能迅速产生变异,这为耐高温酵母的选育提供了可能[10]。田沈等[11]经高温驯化得到一株麦芽糖假丝酵母菌株Y8,该菌株在46 ℃下进行纤维乙醇的同步糖化发酵,最终乙醇质量浓度为13.93 g·L-1。徐大鹏等[12]筛选出1株耐高温酵母,在41 ℃、初始糖质量浓度93 g·L-1的条件下,乙醇产率为93%。KWON等[13]利用IssatchenkiaorientalisIPE100 在42 ℃条件下进行甜高粱秆固态发酵,乙醇转化率达到理论值的90.9%;发酵玉米秸秆蒸汽爆破水解液时,乙醇产量可以达到理论产值的93.8%[14]。刘秀颖等[15]通过化学诱变和遗传重组方法获得的重组酿酒酵母T44-2,40 ℃和43 ℃发酵时,乙醇产量分别达到91.2 g·L-1和69.2 g·L-1。使用耐高温酵母不仅能降低水电的消耗,充分利用已有设备,而且可以降低染菌机率、缩短发酵周期、提高发酵率[9],这将对提高发酵性能和降低生产成本具有重要意义。因此,本研究以酿酒酵母L为出发菌株,选育出1株耐高温且发酵性能强的酵母菌株。
1 材料与方法
1.1酵母菌种
酿酒酵母(Saccharomycescerevisae)由沈阳农业大学农业生物环境与能源工程试验室提供,该酵母最适生长温度为30 ℃,最适发酵温度为32 ℃。
1.2培养基及其相关溶液
1.2.1 YPD液体培养基 20 g·L-1葡萄糖,5 g·L-1酵母提取物,1 g·L-1KH2PO4,0.3 g·L-1NH4Cl,2 g·L-1MgSO4·7H2O。
1.2.2 YPD固体培养基 20 g·L-1葡萄糖,20 g·L-1琼脂,5 g·L-1蛋白胨,5 g·L-1MgSO4·7H2O。
1.2.3 葡萄糖驯化培养基 50 g·L-1葡萄糖糖,5 g·L-1酵母提取物,1 g·L-1KH2PO4,0.3 g· L-1NH4Cl,2 g·L-1MgSO4·7H2O。
1.2.4 发酵培养基 50 g·L-1葡萄糖,5 g·L-1蛋白胨,5 g·L-1酵母提取物,1 g·L-1KH2PO4,0.3 g·L-1NH4Cl,2 g·L-1MgSO4·7H2O,pH值5.0,于121 ℃灭菌30 min,备用。
0.9%的NaCl溶液,2%的二水合柠檬酸钠次甲基蓝溶液:0.01 g的次甲基蓝、2 g的二水合柠檬酸三钠,加蒸馏水,定容至100 mL。
1.3诱变与筛选
1.3.1 菌体前期处理 在50 mL液体培养基中接入活化斜面上的酵母L,在30 ℃条件下振荡培养至对数生长期。取10 mL细胞培养液,3 500 r·min-1条件下离心10 min后,弃上清液,用10 mL无菌水离心洗涤2次去除杂质后,再用生理盐水将其制成2×107个·mL-1的细胞悬液备用。
1.3.2 紫外诱变 取上述处理后得到的细胞菌悬液,分别倒入预先灭菌的直径90 mm的8个培养皿中,每皿5 mL,分别照射10、20、30、40、50、60、70、80 s,每组做3个平行试验,依次盖上皿盖,测定出紫外照射时间与酵母细胞致死率之间的关系,确定适当照射时间。在获得照射时间的基础上,用无菌吸管吸取1 mL菌悬液用生理盐水稀释至10倍,取2.5 mL涂于YPD固体培养基平板上,诱变后的培养皿放于30 ℃的电热恒温培养箱中暗培养3 d,备用。
1.3.3 筛选 挑取紫外诱变后生长良好,且直径较大的菌落,接种于YPD固体斜面培养基上,30 ℃下培养24 h,用于酵母的复筛。
将活化的初筛菌种接种于YPD液体培养基中,培养24 h,达到2×108个·mL-1的菌体浓度。在发酵培养基中,按10%接种量接种,32 ℃、180 r·min-1进行发酵,以出发菌株L为对照菌株,每株设3个重复,60 h后对发酵液进行分析[16-17](乙醇产量、残还原糖含量、糖醇转化率),筛选出性能较为优良的菌株。
1.4高温驯化处理
将筛选出的优势菌株接种于YPD固体培养基上,分别放在32、36、38、40 ℃的恒温培养箱中隔离培养24 h,观察其生长状况,以生物量和乙醇产率为指标来进行评价[18]。在38 ℃时,乙醇产率至少在50%的菌株将进行渐进式(a处理)和热冲击式(b处理)2种驯化处理[19]。
以渐进式驯化耐高温酵母菌株在驯化培养基中进行,共分为2个阶段:第1个阶段是从38 ℃至44 ℃每隔24 h进行1步,共进行6步;第2个阶段是从44 ℃至46 ℃每隔12 h进行1步,共进行4步。
以热冲击式驯化耐高温酵母需要进行3个周期。把酿酒酵母暴露在50 ℃的高温中30 min,然后在38 ℃保持15 min,如此进行3次循环。
将驯化后得到的酿酒酵母接种于YPD固体培养基上,分别把它们放在36、38、40 ℃下隔离培养24 h,观察其生长情况。将生长良好的菌株以10%接种量接种于发酵培养基中,通过测定在38 ℃和40 ℃下的生物量和乙醇产率,从a处理和b处理中挑选出优势菌株,制成种子液,保存以备用。
1.5目的菌株与出发菌株发酵能力及产乙醇能力比较
在a处理和b处理中分别选择出来在40 ℃时生长且产乙醇的菌株在发酵培养基中单独培养,利用排水法[20-21]测量在38 ℃36 h之内酵母发酵时的产气量来测定其发酵力,发酵结束后测定发酵液中的乙醇产量及残还原糖含量。
2 结果与分析
2.1紫外诱变育种
2.1.1 紫外诱变杀菌曲线的绘制 微生物紫外诱变的最佳照射时间是当微生物的致死率在70%~75%时。将处于对数生长期的酵母细胞用紫外线照射,以照射时间(10、20、30、40、50、60、70、80、90、100 s)为横坐标,致死率为纵坐标,绘制酿酒酵母L诱变时间与致死率之间的关系曲线(图1)。
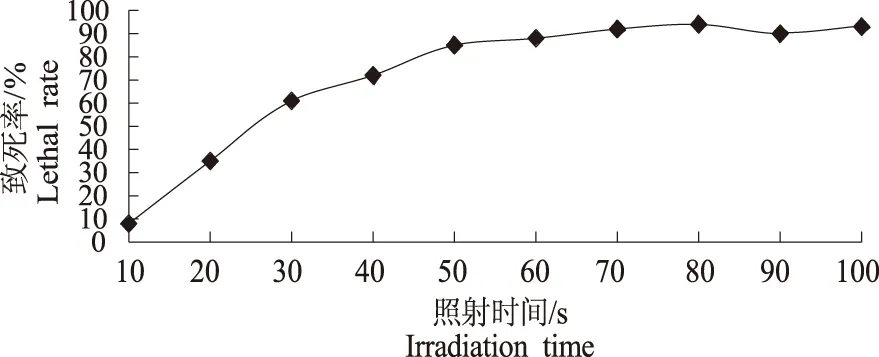
图1 紫外照射时间与酵母L致死率曲线图Fig.1 Curve of irradiation time by UV and death ratio of yeast L
由图1可以看出,紫外线照射时间越长,酵母细胞致死率越大。当酵母细胞照射40 s时,致死率72.3%,因此本试验采用对酵母L进行紫外照射40 s。照射后的酵母作适当稀释后涂布平皿,放在30 ℃的电热恒温培养箱中暗培养3 d后,共有单菌落75株。
2.1.2 初筛 紫外诱变后的75株单菌落,其中有15株生长良好且直径较大,因此把它们作为复筛出发菌株。
2.1.3 摇瓶复筛 将初筛得到的15株酵母菌株活化后,以10%的接种量接入发酵培养基。在32 ℃、180 r·min-1条件下进行乙醇发酵,以酿酒酵母L作为对照,每株3个重复,取平均值,60 h后对发酵液进行乙醇产量、残还原糖含量、糖醇转化率分析(表1)。
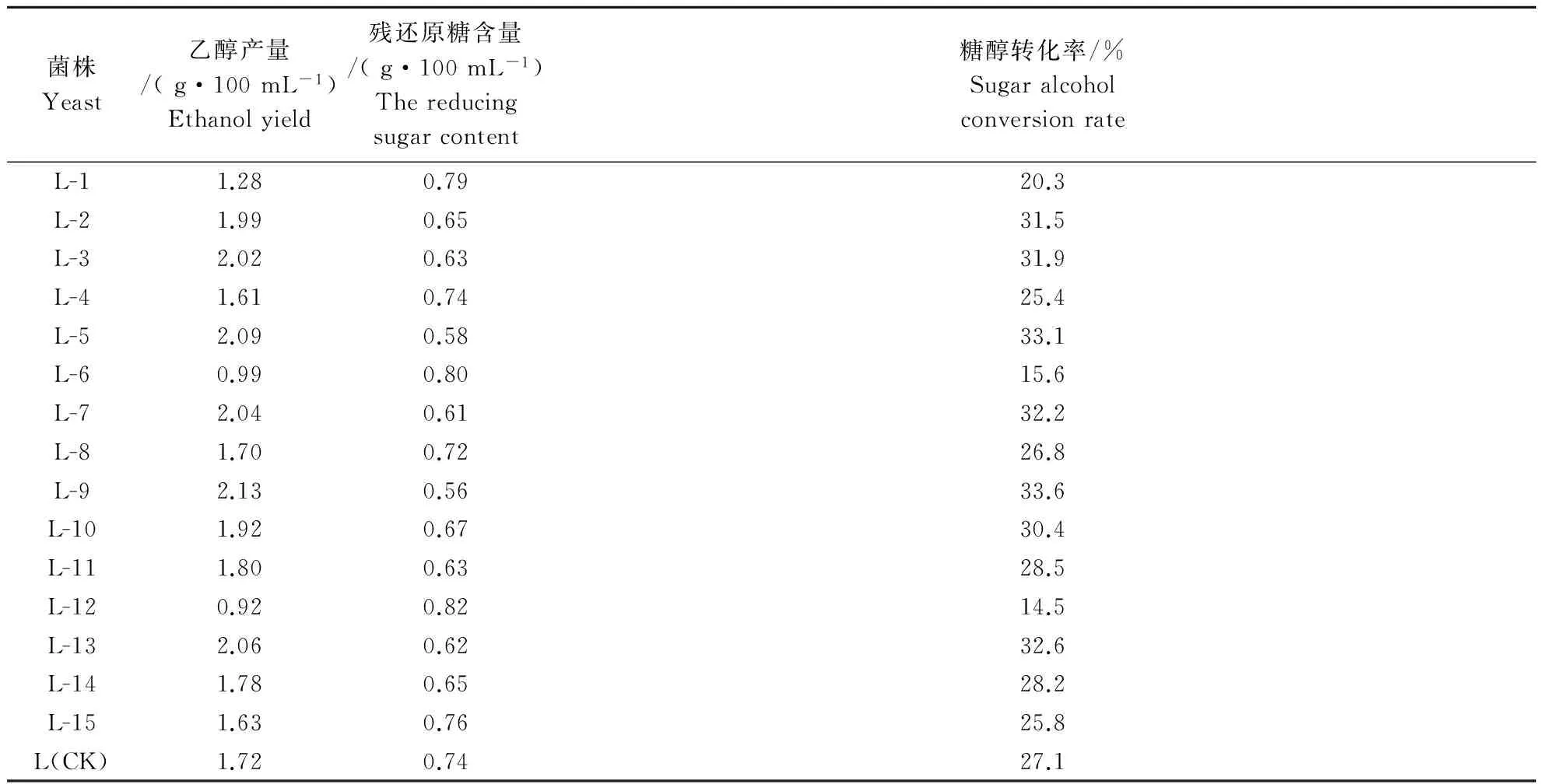
表1 菌株发酵摇瓶复筛结果Table1 Results of flask-shaking fermentation by recreening
2.2耐高温酵母选育
2.2.1 高温驯化前筛选 从复筛试验结果可知,菌株L-2、L-3、L-5、L-7、L-9、L-10、L-11、L-13和L-14(共9株),发酵产乙醇能力较强,残还原糖含量较低,糖醇转化率也较高。它们分别接种于32、36、38、40 ℃下YPD固体培养基中培养,24 h后,观察其生长情况(表2)。

表2 在培养皿中复筛酵母的生长情况Table 2 Growth on petri dishes for yeasts submitted to thermal acclimatization
注:+:生长,±:弱生长,-:不生长。
Note: + : growth, ±:weak growth, -: don’t grow.
从表2可以看出,所有菌株都能在32 ℃下生长,菌株L-3、L-5、L-7、L-9、L-10、L-13和L-14能在36 ℃下生长,菌株L-3、L-5、L-7、L-9、L-10和L-13能在38 ℃下生长,没有菌株能在40 ℃下生长。生长在38 ℃下培养基中的菌株被接种于发酵培养基中,分别测量在36、38、40 ℃下发酵48 h后生物量和乙醇产率,如图2所示。
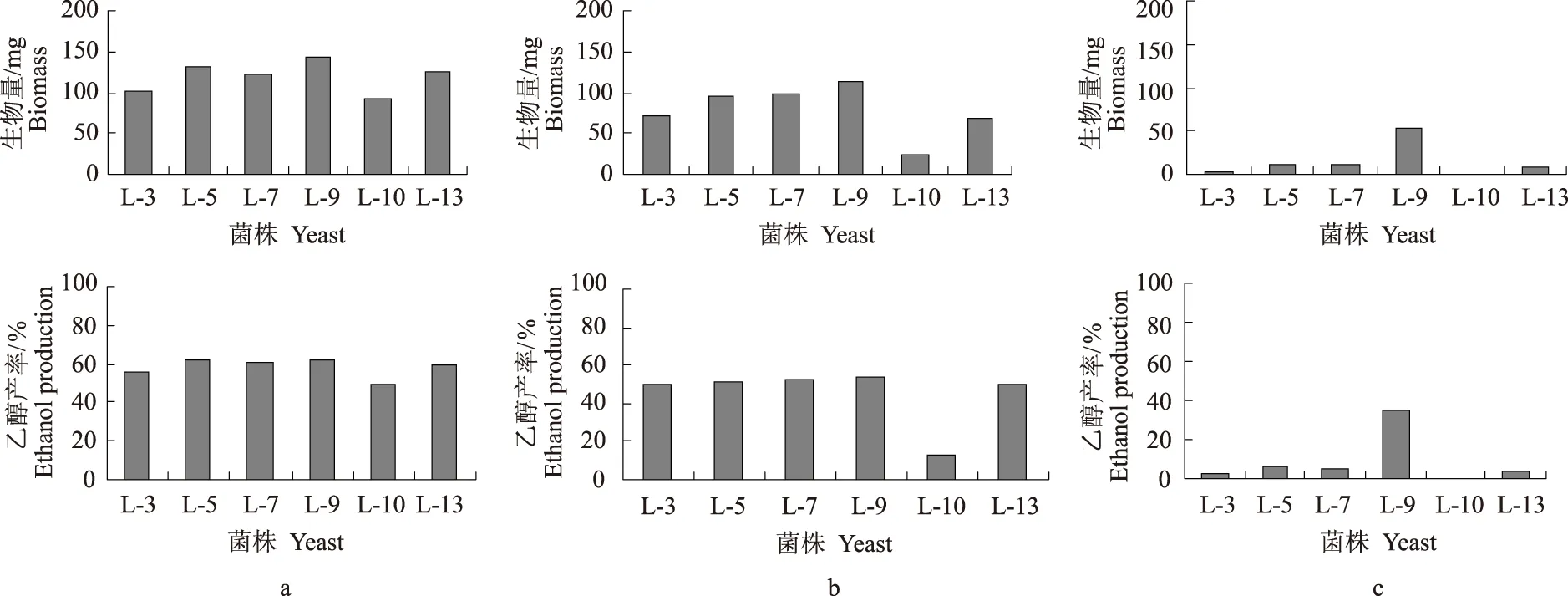
a:在36 ℃下生物量和乙醇产率,b:在38 ℃下生物量和乙醇产率,c:在40 ℃下生物量和乙醇产率。a:Biomass and ethanol production at 36 ℃, b:Biomass and ethanol production at 38 ℃, c:Biomass and ethanol production at 40 ℃.
在36 ℃时,所有菌株都有相似的生物量(90~145 mg)和乙醇产率(49%~62%)。在38 ℃时,各菌株被分为3组:(1)菌株L-5、L-7和L-9生物量为95~115 mg,乙醇产率约为51%;(2)菌株L-3和L-13生物量大约为70 mg,乙醇产率约为50%;(3)菌株L-10,生物量为25 mg,乙醇产率为12.25%。它们之间的差异可能是因为在紫外诱变过程中改变了其基因组成[22]。在40 ℃时,只有菌株L-9生物量达到50 mg左右,乙醇产率大约为35%,其余菌株几乎都不能生长。因此,菌株L-3、L-5、L-7、L-9和L-13可以通过高温驯化处理来提高它们产乙醇的能力。
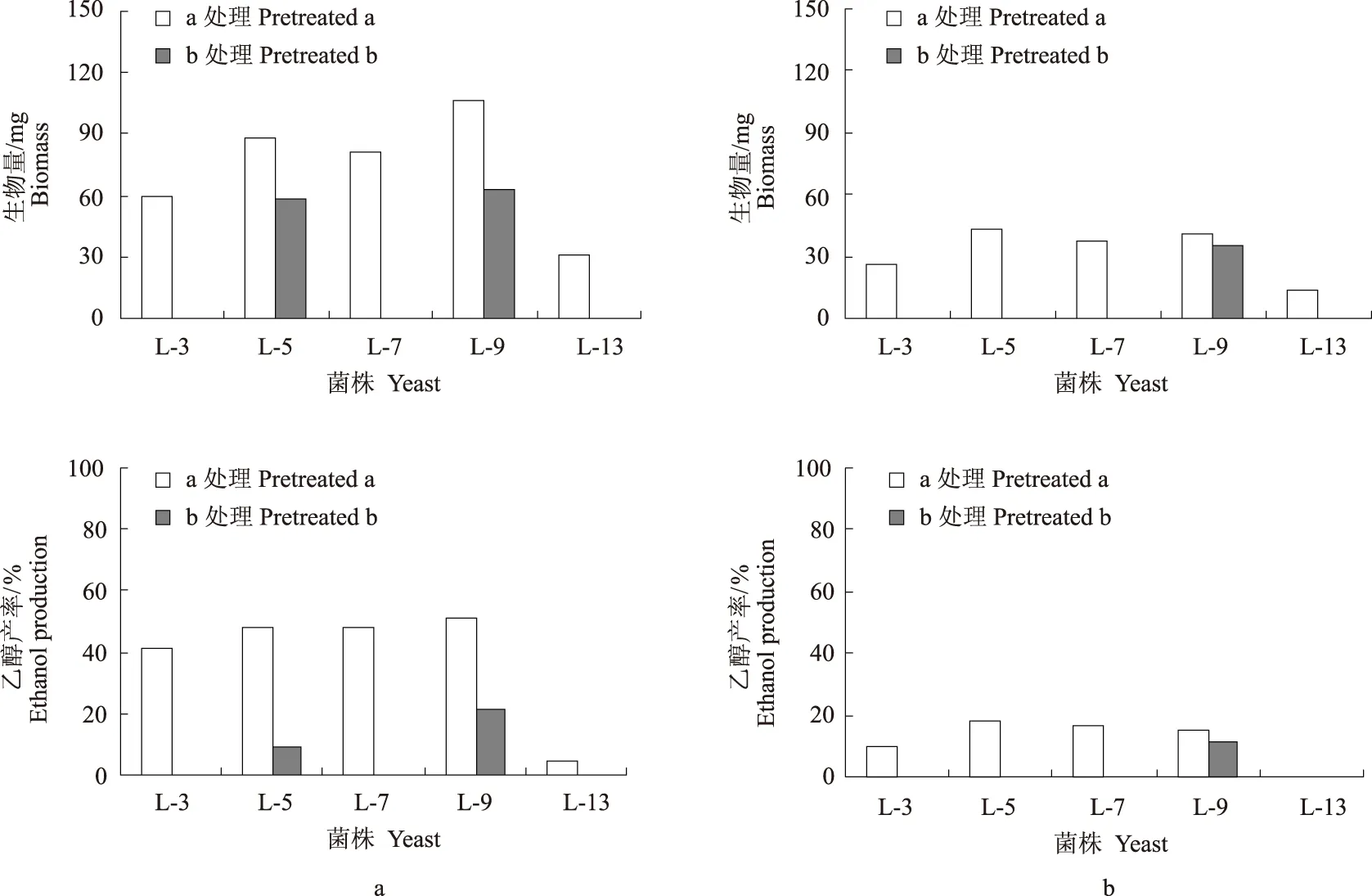
2.2.2 高温驯化处理 在38 ℃下,乙醇产率超过50%的菌株L-3、L-5、L-7、L-9和L-13以相同的接种量接入驯化培养基中进行a处理和b处理2个不同的热处理过程。处理后,它们分别接种于YPD固体培养基中,放置于36、38、40 ℃下隔离培养,观察其生长情况,结果见表3。
在36 ℃下,2种热处理的菌株L-3、L-5、L-7、L-9和L-13都能生长;在38 ℃下,经过a处理的菌株L-3、L-5、L-7和L-9和b处理的菌株L-3和L-9能生长;在40 ℃下,经过a处理的菌株L-3、L-5和L-9能生长、L-7能弱生长,经过b处理的5株菌株均不能生长。把经过2种热处理后的5株菌株以10%的接种量接种于发酵培养基中,分别放置于38 ℃和40 ℃下发酵48 h后,测得其生物量和乙醇产率,结果见图3所示。

表3 在培养皿中不同热处理驯化的酵母生长状况Table 3 Growth on petri dishes for yeasts submitted to thermal acclimatization
注:+:生长,±:弱生长,-:不生长。
Note: +:growth,±:weak growth,-:don’t grow.
在38 ℃时,经过a处理得到的结果:发酵48 h后,菌株L-5、L-7和L-9的生物量为81~106 mg,乙醇产率约为50%;菌株L-3和L-13的生物量分别为60 mg和31 mg,乙醇产率分别为41.23%和4.68%。经过b处理后,仅有L-5和L-9能生长和产乙醇,但乙醇产率较低。在40 ℃时,各菌株生长都比38 ℃时的弱,产乙醇能力也很低。所有经过a处理的各菌株都能生长,但平均生物量仅为32.4 mg,乙醇产率从0~18.56%。经过b处理的菌株仅L-9能生长,乙醇产率仅为11.21%。由试验可得,经过a处理的菌株L-9a在38 ℃下,生物量较高,为106 mg,乙醇产率也较高,为53.02%,可作为目的菌株。
2.3菌株L-9a和菌株L的发酵力及产乙醇能力比较
由图4可以看出,菌株L-9a与出发菌株L的发酵能力相当,但大量产气的时间比出发菌株L提前8 h,为后期发酵试验缩短了时间。
a:在38 ℃下生物量和乙醇产率,b:在40 ℃下生物量和乙醇产率。 a:Biomass and ethanol production at 38 ℃, b:Biomass and ethanol production at 40 ℃.
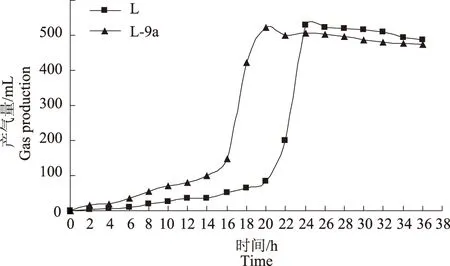
图4 菌株L-9a和菌株L发酵力测定结果Fig.4 Results of yeast L-9a and L fermentation power
由表4可以看出,菌株L-9a乙醇产量平均为1.71 mL·100 mL-1,残还原糖含量平均为0.76 g·100 mL-1,与菌株L(乙醇产量1.72 mL·100 mL-1,残还原糖含量0.74 g·100 mL-1)相比基本一致,但菌株L-9a的发酵温度为38 ℃,与菌株L发酵温度30 ℃相比,有利于解决同步糖化发酵中糖化和发酵温度不一致的问题。

表4 菌株L-9a与菌株L摇瓶试验结果Table 4 Results of flask-shaking fermentation by recreening
3 结 论
本研究首先对出发菌株L进行紫外诱变,然后采用渐进式和热冲击式对诱变菌株进行高温驯化处理,并分别将驯化后的菌株放在36、38、40 ℃下隔离培养24 h,观察其生长情况。将生长良好的菌株以10%接种量接种于发酵培养基中,通过测定在38 ℃和40 ℃下的生物量和乙醇产率,选育出1株耐高温酿酒酵母L-9a,并测定其发酵能力。结果表明:(1)经过a处理的菌株L-9a在38 ℃下,生物量较高,为106 mg,乙醇产率也较高,为53.02%,可作为目的菌株。(2)菌株L-9a乙醇产量平均为1.71 mL·100 mL-1,残还原糖含量平均为0.76 g·100 mL-1,与菌株L相比基本一致,但菌株L-9a的发酵温度为38 ℃,与菌株L发酵温度30 ℃相比,有利于解决同步糖化发酵中糖化和发酵温度不一致的问题。(3)与原始菌株L相比,经处理得到的菌株L-9a,在同步糖化发酵中,有较高的乙醇产量。利用这株菌株,在同步糖化发酵过程中,使转化预处理木质纤维素变成乙醇的温度与酶水解最优温度更接近。
[1] ZALDIVAR J, NIELSEN J,OLSSON L. Fuel ethanol production from lignocellulose: A challenge for metabolicengineering and process integration[J]. Applied Microbiology Biotechnology, 2001, 56(1):17-34.
[2] KHESHGI H S,PRINCE R C,MARLAND G.The potential of biomass fuels in the context of global climate change: Focus on transportation fuels[J].Review of Energy Environment, 2000, 25 (9):199-244.
[3] 李盛贤,贾树彪,顾立文.利用纤维素原料生产燃料酒精的研究进展[J]. 酿酒, 2005, 32 (2 ):13-16.
[4] 郑超,马晓建.纤维乙醇度废水厌氧发酵工艺研究[J].河南农业科学, 2014, 43(2):151-154.
[5] BAI F W,ANDERSON W A,MOO Y M.Ethanol fermentation technologies from sugar and starch feedstocks[J].Biotechnol Adv, 2008,26: 89-105.
[7] ALKASRAWI M, ERIKSSON T, BORJESSON J, et al. The effect of tween-20 on simultaneous saccharification and fermentation of softwood to ethanol[J]. Enzyme and Microb Technol, 2003, 33(1): 71-78.
[8] EDGARDO A, CAROLINA P, MANUEL R, et al. Selection of thermotolerant yeast strainsSaccharomycescerevisiaefor bioethanol production[J]. Enzyme and Microb Technol, 2008, 43(2):120-123.
[9] 刘建军,姜鲁燕,赵祥颖.高产酒精酵母菌种的选育[J]. 酿酒, 2003, 30(1):57-59.
[10] 毛志群,张伟,谭健新,等.燃料乙醇用高产酒精酵母菌株的筛选及鉴定[J]. 酿酒, 2003, 30(3): 35-37.
[11] 田沈,任普鲜, 周桂雄,等.一株酵母菌高温驯化与同步糖化发酵研究[J]. 太阳能学报, 2011, 32(3): 374-378.
[12] 徐大鹏,李云杰,张栩,等.耐高温酵母菌的筛选及特性[J]. 生物加工过程, 2011, 9(3):17-21.
[13] KWON Y J, WANG F, LIU C Z. Deep-bed solid state fermentation of sweet sorghum stalk to ethanol by thermotolerantIssatchenkiaorientalisIPE 100[J]. Bioresource Technology, 2011, 102(24): 11262-11265.
[14] ISONO N, HAYAKAWA H, USAMI A, et al. A comparative study of ethanol production byIssatchenkiaorientalisstrains under stress conditions[J].Journal of Bioscience and Bioengineering, 2012, 113(1): 76-78.
[15] 刘秀颖,何秀萍,卢莹,等.基于基因组DNA 诱变的遗传重组改造乙醇工业酵母的耐热性及发酵性能[J]. 生物工程学报, 2011, 27(7): 1049-1056.
[16] 华子安,田亚平,金其荣. 选育耐高温酒精酵母的研究[J]. 酿酒, 2003, 30(3):37-39.
[17] 何川,章登政,张俊,等.重铬酸钾-DNS比色法测定发酵液中乙醇含量[J]. 生命科学研究, 2013, 17(1):1-5.
[18] 路鹏,江滔,李国.木质纤维素乙醇发酵研究中的关键点及解决方案[J]. 农业工程学报, 2006, 22(9):237-241.
[19] ARAQUE E,PARRA C,RODRIGUEZ M et al.Selection of thermotolerant yeast strainsSaccharomycescerevisiaefor bioethanol production[J].J Enzyme and Microbial Technology,2008.43:120-123.
[20] 郭刚,张丽玲,章忠泰.浅析大曲发酵力的测定[J]. 酿酒, 2011, 38(2):80-81.
[21] 曹斌辉,刘长虹,黄松伟,等.酵母发酵力测定新方法的探讨[J]. 粮食加工, 2010, 35(5):76-78.
[22] 金承涛,曾云中,吴雪昌,等.耐热酵母菌株HU-TY-1的耐热机理初探[J].浙江大学学报(理学版), 2001, 28(6):676-681.
(责任编辑:蒋国良)
BreedingofthermotolerantyeaststrainsSaccharomycescerevisiaeforbioethanolproduction
BU Wenjing1, DUAN Qiuhong2, DU Jinyu1, WANG Yi3, SUI Jixue1
(1.Department of Energy and Power Engineering,Henan University of Animal Husbandry and Economy,Zhengzhou 450011,China;2.Zhengzhou Institute of Science and Technology,Zhengzhou 450062,China; 3.College of Mechanical and Electrical Engineering,Henan Agricultural University,Zhengzhou 450002,China)
SaccharomycescerevisiaeL as staring strain was acclimatized and screened with UV mutation and high temperature treatment. A thermotolerant yeast strainsSaccharomycescerevisiaeL-9a was obtained.The results show that through high temperature Treatment A under the condition of 38 ℃,the biomass of L-9a was 106mg,ethanol yield was 53.02%,the average yield was 1.71 mL·100 mL-1and residual reducing sugar content was 0.76 g·100 mL-1. The temperature inconsistency problem of saccharification and fermentation in SSF was solved.
bioethanol; biomass;Saccharomycescerevisiae;thermotolerant yeast
TS261.1
:A
2015-09-12
河南省科技攻关项目(152102210319);郑州市科技攻关项目(141PPTGG411)
卜文静(1985-),女,河南义马人,助教,硕士,从事生物质能、太阳能等新能源应用技术的研究。
杜金宇(1976-),男,河南南阳人,讲师,博士。
1000-2340(2016)02-0235-06

