SdhaSdha基因敲低对小鼠肝细胞BNL CL.2细胞增殖、细胞周期和凋亡的影响
李 欣,曹焕玲,赵亚伟,郭银汉,王庆阳(.北京中医药大学中药学院,北京 0009;.军事医学科学院基础医学研究所免疫学研究室,北京 00850)
Sdha
Sdha基因敲低对小鼠肝细胞BNL CL.2细胞增殖、细胞周期和凋亡的影响
李 欣1,曹焕玲2,赵亚伟2,郭银汉1,王庆阳2
(1.北京中医药大学中药学院,北京 100029;2.军事医学科学院基础医学研究所免疫学研究室,北京 100850)
目的 探讨琥珀酸脱氢酶复合物亚单位A(SDHA)对小鼠肝细胞BNL CL.2细胞增殖、细胞周期和凋亡的影响。方法 用慢病毒载体介导的shRNA敲低BNL CL.2细胞中sdha基因的表达。流式细胞仪检测慢病毒的感染效率;实时荧光定量PCR和Western蛋白印迹法分别检测sdha mRNA和SDHA蛋白表达水平;细胞计数法检测细胞增殖;流式细胞术检测细胞凋亡和细胞周期。结果 无相关shRNA对照组和sdha shRNA组慢病毒的感染效率均>80%。与无相关shRNA对照组相比,感染sdha shRNA慢病毒载体的BNL CL.2细胞sdha mRNA水平降低20倍左右(P<0.01),蛋白表达水平降低10倍左右(P<0.01);细胞增殖速度减慢,为无相关shRNA对照组的70%左右(P<0.05);细胞周期发生改变,G0/G1期细胞百分率是无相关shRNA对照组的1.17倍(P<0.01),G2/M期细胞百分率为1.37倍(P<0.01),S期细胞百分率为73.8% (P<0.01);但细胞凋亡率无明显差异。结论 降低SDHA表达对小鼠肝细胞BNL CL.2细胞增殖有明显的抑制作用,其抑制作用与细胞周期阻滞相关,与细胞凋亡无明显关系。
琥珀酸脱氢酶复合物亚单位A;BNL CL.2细胞;细胞增殖;细胞周期;细胞凋亡
琥珀酸脱氢酶复合物亚单位A(succinate dehydrogenase complex subunit A,SDHA)是组成异源四聚体琥珀酸脱氢酶的亚基,位于线粒体内膜上,参与三羧酸循环和线粒体呼吸链的电子传递,在细胞能量代谢中发挥重要作用[1]。肿瘤的形成往往跟代谢紊乱有密切关系。琥珀酸脱氢酶家族成员SDHA,SDHB,SDHC和SDHD均被认为能抑制肿瘤发生[2-5],早期的研究表明,SDHA基因的突变与一种被称为雷吉综合征(Leigh Syndrome)的线粒体呼吸链缺陷病有关[6]。其突变是副神经节瘤以及胃肠道间质性肿瘤中的标志之一。关于SDHA的肿瘤抑制作用曾经存在争议,因为在某些肿瘤中SDHA的突变或表达降低不像其他琥珀酸脱氢酶亚基频繁。近年来,在野生型胃肠间质细胞瘤(wildtype GIST)、嗜铬细胞瘤(Paraganglioma)以及原发性肝细胞癌中也发现了SDHA基因的缺陷或表达异常[2,7-8]。2011年,Burnichon[2]在副神经节瘤里发现SDHA突变,提出SDHA是肿瘤抑制因子的说法。2012年,Italiano等[7]发现,在非KIT或PDGFRA突变的胃肠道间质瘤中,存在与SDHA的功能缺失相关的基因突变;2014年Shimizu等[8]发现,56%的肝细胞癌患者肝细胞中存在SDHA表达下调。这些发现证实SDHA突变或缺失与肿瘤发生密切相关。然而SDHA表达下调后如何促进肿瘤生成却鲜见报道。早在20世纪30年代,研究者们就认为细胞代谢模式由有氧代谢转变为糖酵解的过程是正常细胞向肿瘤发生恶性转化的诱因之一[9-10]。有报道认为,琥珀酸脱氢酶家族成员发挥抑瘤效应与阻止细胞代谢模式由有氧代谢向糖酵解转变有关[11]。该观点得到一些实验数据的支持,如Guzy等[12]发现,SDHB表达缺失能够激活活性氧依赖的HIF-α活化,从而使细胞适应低氧环境而促进肿瘤发生。然而在这一过程中发挥主导作用的是SDHB而非SDHA,提示SDHA通过其他机制发挥抑瘤效应。因此,研究SDHA在正常组织细胞中如何作用对于揭示SDHA在肿瘤组织中表达下调的机制以及促进细胞恶性转化的机制具有重要意义。
肝作为人体重要的能量代谢器官,其线粒体功能正常对于维持肝正常的生理功能及肝细胞的生长发育尤为重要,但SDHA在肝细胞中发挥什么作用尚未见报道。小鼠胎肝来源的肝细胞BNL CL.2细胞,相对于肝癌细胞,通常作为“非恶性”细胞用来进行肝细胞相关功能的研究。本研究采用“loss of function”的研究思路,以小鼠胎肝来源的细胞BNL CL.2为模型细胞,通过以慢病毒为载体介导的shRNA干扰技术敲低sdha的表达,探讨其对BNL CL.2细胞增殖、周期和凋亡的影响,初步揭示sdha缺失对促进肿瘤发生的作用机制。
1 材料与方法
1.1细胞、试剂和主要仪器
小鼠肝细胞BNL CL.2细胞由军事医学科学院基础医学研究所分子免疫学研究室保存,在含有10%胎牛血清(兰州百灵生物技术有限公司)的DMEM培养基(美国HyClone公司)中常规培养。
Sdha shRNA由上海吉凯基因化学技术有限公司合成(表1),病毒感染增强剂也由该公司提供;寡核苷酸引物由北京天一辉远生物科技有限公司合成(表2);RNA提取试剂Trizol,美国Ambion公司;逆转录试剂盒和荧光定量PCR试剂盒,美国Thermo公司;RIPA裂解液,北京天根生物公司;抗SDHA山羊多克隆抗体,美国Santa Cruze公司;抗β肌动蛋白抗体、辣根过氧化物酶标记的兔抗山羊抗体及山羊抗小鼠抗体,北京中杉金桥公司;Annexin Ⅴ-PE/7AAD细胞凋亡检测试剂盒,美国BD Pharmingen公司;细胞周期检测试剂盒,天津三箭公司;RNA酶A,美国Sigma公司。光学显微镜,日本Nikon公司;细胞计数板,上海化科实验器材有限公司;紫外分光光度计,北京普析通用仪器有限责任公司;7500 Fast Real-time PCR仪及SDS-PAGE蛋白电泳仪及蛋白转印系统,美国Bio-Rad公司;FACS Calibur型流式细胞仪,美国BD公司。
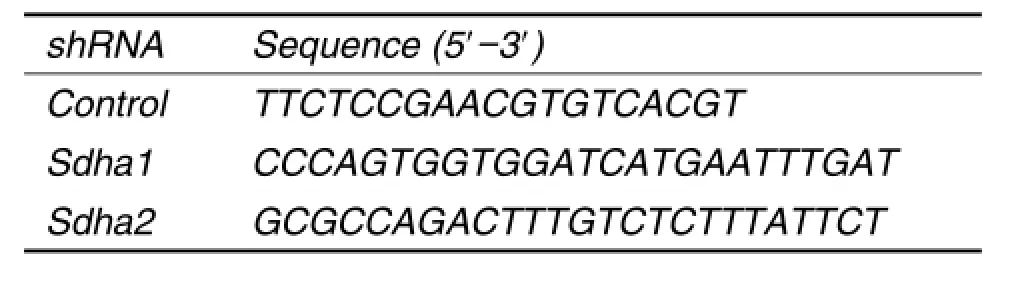
Tab.1 shRNA sequences targeting mouse succinate dehydrogenase complex subunit A(sdha)
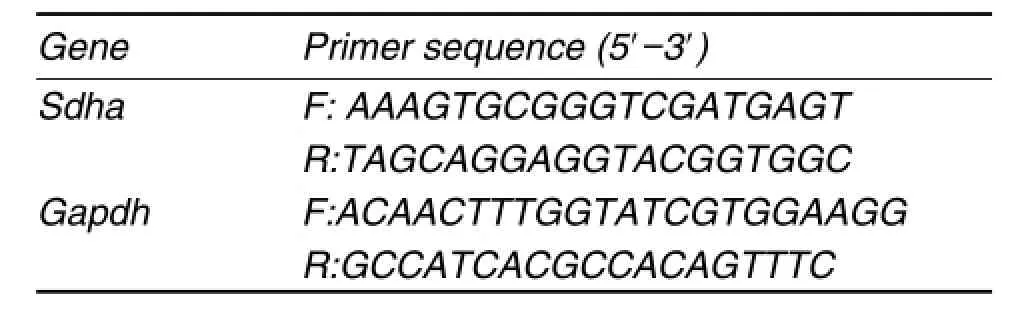
Tab.2 Primers for quantitative real-time PCR
1.2细胞分组及慢病毒感染
细胞分为3组,无关shRNA对照组(sh-control,感染含无关shRNA序列慢病毒),sdha shRNA慢病毒1(sh-sdha1)和sdha shRNA慢病毒2(shsdha2)组(分别包含靶向sdha不同的核苷酸序列的shRNA)。将BNL CL.2细胞(1×108L-1)以每孔500 μL接种于24孔板中,待细胞密度达70%~80%时,吸出培养基,并用生理盐水洗1次。将滴度为1×1011TU·L-1的sh-control,sh-sdha1或sh-sdha2 各5 μL分别加入到200 μL病毒感染增强剂中,充分混匀后加入到孔中,将24孔板放入湿盒内,在细胞培养箱中培养。24 h后,吸去含病毒的感染增强剂,加入500 μL DMEM培养基,继续培养。
1.3流式细胞仪检测慢病毒感染效率
慢病毒感染细胞4 d后,将各组细胞分别消化,用PBS洗涤2遍,流式细胞仪检测细胞GFP的表达,GFP阳性细胞即为成功感染病毒的细胞。
1.4RT-PCR检测sdha基因的表达
细胞感染慢病毒7 d后,吸出培养基,并用生理盐水洗一遍,三组细胞,每孔1 mL Trizol收集细胞,提取细胞总RNA,紫外分光光度计检测A260 nm/A280 nm,计算RNA的浓度和纯度。取总RNA 1 μg,按照逆转录操作说明书逆转录得到cDNA。取2 μL cDNA加入到20 μL扩增体系中,用PCR仪进行扩增,条件为95℃预变性3 min,95℃变性10 s,55℃退火15 s,共40个循环。基因相对表达用2- Ct法计算,以gapdh作为内参基因。
1.5Western蛋白印迹法检测SDHA的表达
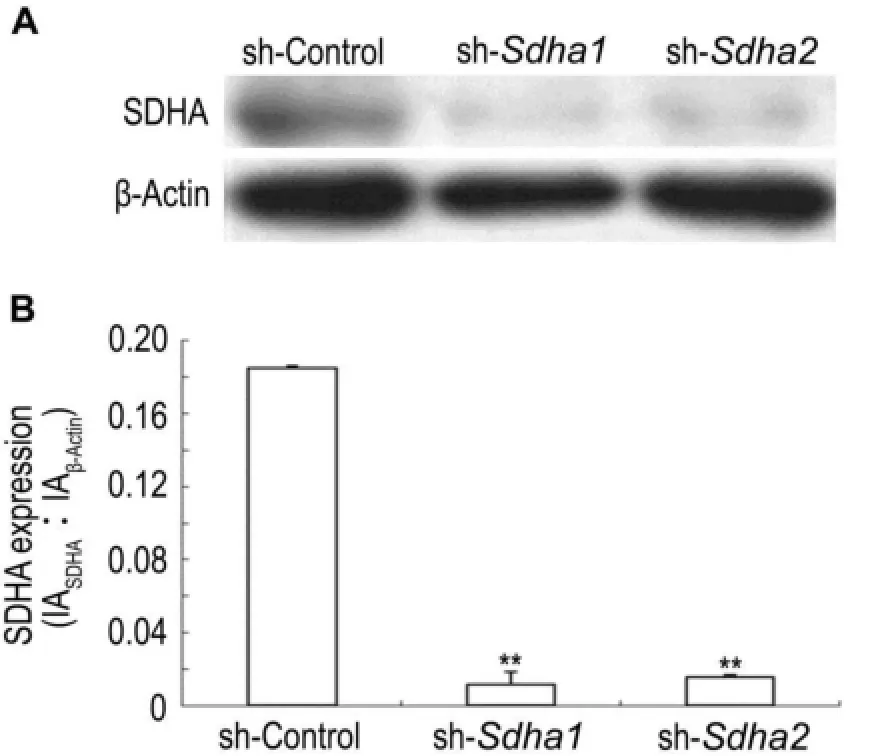
细胞感染慢病毒7 d后,将细胞培养板置于冰上,吸出培养基,用预冷的生理盐水洗1遍,3组细胞每孔各加80 μL RIPA细胞裂解液,迅速用细胞刮刮下,转移到EP管内,冰上裂解15 min后,16 000×g,4℃离心15 min,弃沉淀,将上清转移到另一EP管中。用紫外分光光度计测量样品吸光度值,确定蛋白浓度,进行蛋白质定量,上样进行SDS-PAGE电泳,转膜封闭后,膜与抗SDHA抗体或抗β肌动蛋白抗体于4℃孵育过夜(一抗以1∶1000比例稀释),次日与二抗(二抗以1∶2500比例稀释)室温孵育1 h,最后暗室显影后扫描。扫描条带用Gelpro计算条带积分吸光度值(integrated absorbance,IA),SDHA蛋白水平以IASDHA/IAβ肌动蛋表示。
1.6细胞计数,绘制生长曲线
细胞感染慢病毒后第4天,将各组细胞分别消化,用DMEM培养基重悬,于24孔板内每孔接种6×104细胞,24 h后细胞计数,连续计数3 d,绘制细胞生长曲线,对计数均值进行方差分析。
1.7流式细胞仪检测BNL CL.2细胞周期和凋亡
细胞感染慢病毒后第7天,胰酶消化,收集1× 106细胞,PBS洗涤2次,加入75%乙醇1 mL,4℃固定过夜。第2天,离心收集细胞后,弃乙醇,并用PBS洗涤1遍。用PBS将RNA酶稀释至1 g·L-1,每个样品中加100 μL,轻轻混匀,37℃消化1 h。用PBS将PI稀释至40 mg·L-1,每个样品中加100 μL,轻轻混匀,4℃避光染色1 h,流式细胞仪测定G0/G1,S和G2/M期细胞百分率。
感染慢病毒7 d后,收集1×106细胞,用PBS洗涤2次,每个样品用200 μL结合缓冲液重悬,各加入1 μL AnnexinⅤ-PE和2 μL 7AAD,轻轻混匀,4℃避光染色30 min,再用流式细胞仪进行磷酯酰丝氨酸外翻分析检测细胞凋亡。AnnexinⅤ阳性、7-AAD阴性细胞为早期凋亡细胞;AnnexinⅤ和7-AAD双阳性细胞为晚期凋亡细胞;细胞凋亡率为二者之和。
1.8统计学分析
2 结果
2.1慢病毒感染效率
流式细胞仪检测结果(图1)显示,sh-control,sh-sdha1或sh-sdha2各5 μL(1×1011TU·L-1)感染BNL CL.2细胞4 d后,细胞表达GFP阳性率均>80%,表明>80%的细胞成功感染了慢病毒。
2.2Sdha shRNA慢病毒对sdha基因表达水平的影响
感染7 d后,sh-sdha1或sh-sdha2组细胞sdha基因表达水平比sh-control组低20倍左右(P<0.01)(图2),表明该shRNA慢病毒有效降低了sdha基因的表达。靶向sdha的2种不同shRNA均可有效降低sdha基因的表达(图2)。
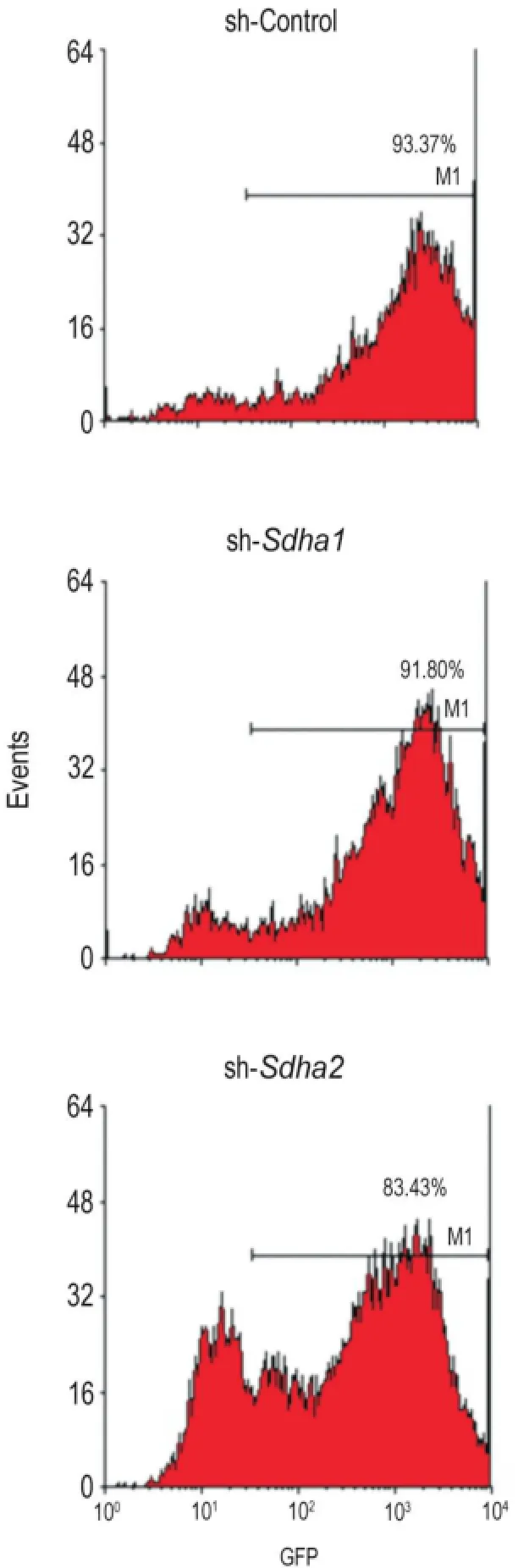
Fig.1 Infection efficiency of BNL CL.2 cells infected with lentiviral vectors.BNL CL.2 cells were infected with 5 μL sh-control lentivirus(sh-control),sh-sdha1 or sh-sdha2 lentivirus for 4 d,the viral titer was 1×1011TU·L-1.The GFP positive cells were detected by flow cytometry.
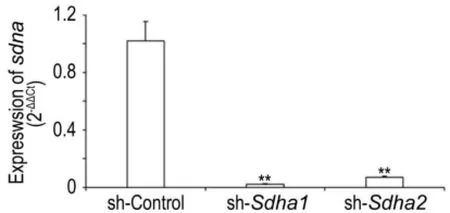
Fig.2 Relative expression level of sdha mRNA in BNL CL.2 cells transfected with lentiviral vectors by RT-PCR.BNL CL.2 cells were infected with sh-control lentivirus,sh-sdha1 or sh-sdha2 for 7 d.Total RNAs were detected by RTPCR analysis.Relative RNA expression of sdha was normalized by gapdh.,n=3.**P<0.01,compared with sh-control group.
2.3Sdha shRNA慢病毒对SDHA蛋白表达的影响
图3结果表明,sdha shRNA慢病毒感染BNL CL.2细胞7 d后,细胞内SDHA蛋白表达水平降低。sh-Sdha1或sh-sdha2组细胞SDHA蛋白水平比sh-control组低10倍左右(P<0.01)。
2.4Sdha shRNA慢病毒对BNL CL.2细胞增殖的影响
细胞计数及生长曲线结果(图4)表明,慢病毒感染后第5天和第6天(即细胞计数第1天和第2天),sh-sdha1或sh-sdha2组与sh-control组细胞数目相比并无明显差异,慢病毒感染后第7天(细胞计数第3天),sh-sdha1或sh-sdha2组细胞数目比对照组减少(P<0.05),表明敲低sdha基因的表达,BNL CL.2细胞系的增殖受到抑制。

Fig.4 Effect of shRNA lentiviral vector of sdha gene on growth curve of BNL CL.2 cell.See Fig.1 for the cell treatment.The cell number of each group was determined under microscope by manual counting.,n=3.*P<0.05,**P<0.01,compared with sh-control group.
2.5Sdha shRNA慢病毒对BNL CL.2细胞周期的影响
感染7 d后,流式细胞仪进行细胞周期分析。由图5可看出,与sh-control组相比,sh-sdha1或sh-sdha2组细胞G0/GI期细胞比例分别下降(7.05± 0.27)%(P<0.01)和(7.67±0.14)%(P<0.01),G2/M期细胞比例分别下降(4.80±0.23)%(P<0.01)和(7.14±0.73)%(P<0.05),S期细胞比例分别增加(12.17±0.67)%(P<0.01)和(14.82±0.97)%(P<0.01),表明敲低sdha基因能诱导细胞S期阻滞,从而抑制细胞增殖。

Fig.5 Effect of shRNA lentiviral vector of sdha gene on BNL CL.2 cell cycle distribution detected by flow cytometry.See Fig.2 for the cell treatment.Cells of each group were stained with propidium iodide and followed by flow cytometry analysis.
2.6Sdha shRNA慢病毒对BNL CL.2细胞凋亡的影响
由图6可看出,sh-sdha1或sh-sdha2组细胞与sh-control组相比,细胞凋亡率并无明显差异,shcontrol组细胞凋亡率为(2.66±1.06)%,sh-sdha1 或sh-sdha2组细胞凋亡率分别为(2.52±0.99)%和(2.49±0.17)%,表明敲低sdha基因并不诱导细胞凋亡。
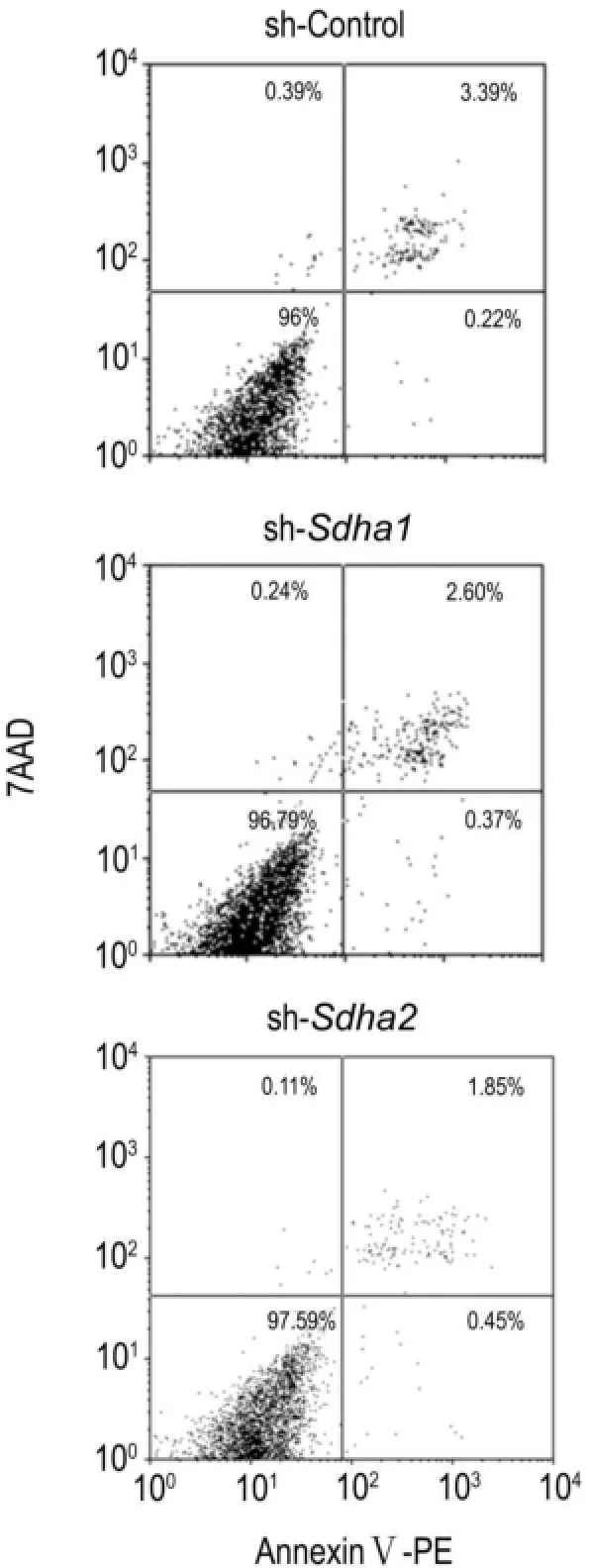
Fig.6 Effect of shRNA lentiviral vector of sdha gene on apoptosis of BNL CL.2 cells detected by flow cytometry.See Fig.2 for the cell treatment.Cells of each group were stained with AnnexinⅤ-PE and 7-AAD,and followed by flow cytometry analysis.
3 讨论
本研究在BNL CL.2中,使用慢病毒介导的方法敲低sdha基因表达7 d后,敲低组的细胞数量与无关shRNA对照组相比明显减少。进一步实验发现,sdha基因敲低导致细胞发生S期阻滞进而延缓细胞增殖,而对细胞凋亡无影响。同时发现,sdha敲低对细胞的凋亡并无影响。本研究结果提示,sdha基因敲低后导致BNL CL.2细胞周期阻滞,增殖减缓,使细胞更容易适应低能量代谢而避免凋亡,可能是细胞发生恶性转化的机制之一。在本研究中,由于肿瘤细胞异质性的原因,并没有比较BNL CL.2细胞与小鼠来源的肝细胞癌细胞系之间sdha mRNA和蛋白水平的差异。在后续的研究中,将会用DEN诱导的小鼠原发性肝细胞癌模型,对小鼠癌组织、癌旁组织以及正常肝组织SDHA的表达水平进行检测。另外,筛选sdha基因稳定敲低的BNL CL.2细胞克隆,对肝细胞代谢以及细胞恶性转化等指标进行检测,也会为揭示相关机制及肝细胞癌的预防和治疗提供新的理论基础。
[1]Horsefield R,Yankovskaya V,Sexton G,Whittingham W,Shiomi K,Omura S,et al.Structural and computational analysis of the quinone-binding site of complexⅡ(succinate-ubiquinone oxidoreductase):amechanismofelectrontransferandproton conduction during ubiquinone reduction[J].J Biol Chem,2006,281(11):7309-7316.
[2]Burnichon N, Brière JJ,Libé R, Vescovo L,Rivière J,Tissier F,et al.SDHA is a tumor suppressor gene causing paraganglioma[J].Hum Mol Genet,2010,19(15):3011-3020.
[3]Baysal BE,Ferrell RE,Willett-Brozick JE,Lawrence EC,Myssiorek D,Bosch A,et al.Mutations in SDHD,a mitochondrial complexⅡgene,in hereditary paraganglioma[J].Scinence,2000,287 (5454):848-851.
[4]Niemann S,Müller U.Mutations in SDHC cause autosomal dominant paraganglioma,type 3[J]. Nat Genet,2000,26(3):268-270.
[5]Astuti D,Latif F,Dallol A,Dahia PL,Douglas F,George E,et al.Gene mutations in the succinate dehydrogenase subunit SDHB cause susceptibility tofamilialpheochromocytomaandtofamilial paraganglioma[J].Am J Hum Genet,2001,69 (1):49-54.
[6]Burgeois M,Goutieres F,Chretien D,Rustin P,Munnich A,Aicardi J.Deficiency in complexⅡ of the respiratory chain,presenting as a leukodystrophy in two sisters with Leigh syndrome[J].Brain Dev,1992,14(6):404-408.
[7]Italiano A,Chen CL,Sung YS,Singer S,DeMatteo RP,LaQuaglia MP,et al.SDHA loss of functionmutations in a subset of young adult wild-type gastrointestinal stromal tumors[J].BMC Cancer,2012,12:408.
[8]Shimizu T,Inoue K,Hachiya H,Shibuya N,Shimoda M,Kubota K.Frequent alteration of the protein synthesis of enzymes for glucose metabolism in hepatocellular carcinomas[J].J Gastroenterol,2014,49(9):1324-1332.
[9]Warburg O,Wind F,Negelein E.The metabolism of tumors in the body[J].J Gen Physiol,1927,8 (6):519-530.
[10] Warburg O.Ontheorigin of cancer cells[J]. Science,1956,123(3191):309-314.
[11]Yang M,Soga T,Pollard PJ.Oncometabolites:linking altered metabolism with cancer[J].J Clin Invest,2013,123:3652-3658.
[12]Guzy RD, Sharma B, Bell E, Chandel NS,Schumacker PT.Loss of the SdhB,but Not the SdhA,subunit of complexⅡtriggers reactive oxygen species-dependent hypoxia-inducible factor activation and tumorigenesis[J].Mol Cell Biol,2008,28:718-731.
Effect of succinate dehydrogenase complex subunit A gene
knockdown on cell proliferation,cell cycle and apoptosis of mouse hepatic cell line BNL CL.2 cells
LI Xin1,CAO Huan-ling2,ZHAO Ya-wei2,GUO Yin-han1,WANG Qing-yang2
(1.Chinese Medicine College,Beijing University of Chinese Medicine,Beijing 100029,China;
2.Department of Molecular Immunology,Institute of Basic Medical Sciences,Academy of Military Medical Sciences,Beijing 100850,China)
OBJECTIVETo investigate the effect of succinate dehydrogenase complex subunit A (sdha)gene on cell proliferation,cell cycle and apoptosis of mouse hepatic cell line BNL CL.2 cells. METHODS The BNL CL.2 cells were transfected by two kinds of sdha-shRNA lentivirus to knockdown sdha gene.The infection efficiency of BNL CL.2 cells infected with lentiviral vectors was analyzed by flow cytometry.The expression of sdha gene and SDHA protein was detected by real-time PCR and Western blotting,respectively.The effect of sdha gene on cell proliferation of BNL CL.2 cells was examined by growth curve,while cell cycle and apoptosis were analyzed by flow cytometry.RESULTS The infection efficiency of BNL CL.2 cells in sh-control group and in sdha-shRNA group was above 80%.Compared with sh-control group,the expression of sdha gene in BNL CL.2 cells infected with sdha-shRNA lentivirus was decreased by about 20 times(P<0.01),the expression of SDHA protein was decreased by about 10 times(P<0.01),and the growth rate was about 70%that of sh-control group(P<0.05).The cells were arrested in S phase,and the percentage of cells in S phase was 0.74 times that of sh-control group(P<0.01).The percentage of cells in G0/GIphase was 1.17 times that of sh-control group(P<0.01).The percentage of cells in G2/M was 1.37 times that of sh-control group(P<0.01).But there was no obvious difference in the apoptosis rate.CONCLUSION The reduced expression of SDHA protein can inhibit the proliferation of mouse hepatic cells,and the inhibitory mechanism may be cell cycle arrest.There is possibly no relationship between inhibition and cell apoptosis.
succinate dehydrogenase complex subunit A;BNL CL.2 cells;cell proliferation;cell cycle;apoptosis
The project supported by National Science and Technology Major Project of Original New drug Research of China(2013ZX09103003)
GUO Yin-han,E-mail:guoyinhan@163.com;WANG Qing-yang,E-mail:tansun0532@163.com
R363
A
1000-3002(2016)02-0107-06
10.3867/j.issn.1000-3002.2016.02.004
2015-08-11接受日期:2016-01-20)
(本文编辑:贺云霞)
国家科技重大专项(2013ZX09103003)
李 欣,女,硕士研究生,主要从事免疫学信号转导通路的研究。
郭银汉,E-mail:guoyinhan@163.com,Tel:(010)52165901;王庆阳,E-mail:tansun0532@163.com,Tel:(010)66930383

