利用原代肝细胞模型检测细胞内磷酸化组蛋白H2AX表达筛选遗传毒物的方法验证
孟 涛,苗盼盼,纪玉青,牛 勇,宾 萍,戴宇飞,郑玉新(中国疾病预防控制中心职业卫生与中毒控制所,化学污染与健康安全重点实验室,北京100050)
利用原代肝细胞模型检测细胞内磷酸化组蛋白H2AX表达筛选遗传毒物的方法验证
孟 涛,苗盼盼,纪玉青,牛 勇,宾 萍,戴宇飞,郑玉新
(中国疾病预防控制中心职业卫生与中毒控制所,化学污染与健康安全重点实验室,北京100050)
目的 验证以原代小鼠肝细胞为受试细胞,以细胞内磷酸化组蛋白H2AX(γH2AX)表达改变为检测指标的体外检测化学物遗传毒性的实验方法。方法 采用改良的两步胶原酶灌注法分离获取小鼠肝细胞,并运用三明治法体外培养肝细胞。选择4种已知的遗传毒物平阳霉素、苯并芘、苯乙烯和氧化苯乙烯及2种非遗传毒物硫唑嘌呤和环孢素A作为受试物,用受试物0~40 μmol·L-1处理原代培养肝细胞0~24 h,CCK-8法检测细胞毒性,并用流式细胞术检测γH2AX的表达水平。结果 利用所建立的方法筛选上述4种遗传毒物均获得阳性结果,2种非遗传毒物均呈阴性反应。直接遗传毒物平阳霉素和氧化苯乙烯作用3 h,间接遗传毒物苯并芘和苯乙烯作用6 h时,γH2AX表达量最高(P<0.01)。4种遗传毒物处理组在最适时间点(直接遗传毒物:3 h;间接遗传毒物:6 h)及最适作用浓度(10 μmol·L-1)诱发细胞γH2AX的表达水平依次为25.7,18.4,12.4和14.2(平均荧光强度),分别为DMSO溶剂对照组的18,12,8和10倍(P<0.01),且γH2AX的表达水平与遗传毒物浓度呈显著正相关(P<0.01)。非遗传毒物硫唑嘌呤和环孢素A处理组与DMSO溶剂和空白对照组相比,γH2AX的水平均无明显变化。结论 利用原代肝细胞模型检测γH2AX表达水平可在无S9的情况下有效区分遗传毒物与非遗传毒物和直接遗传毒性与间接遗传毒性。γH2AX表达水平可作为鉴别遗传毒物与非遗传毒物的有效参考指标。
遗传毒物;肝细胞;原代培养;组蛋白类;流式细胞术
近年来,与环境致癌物相关的肿瘤发生率呈上升趋势。化学致癌物根据其作用机制可分为遗传毒性和非遗传毒性两大类,且大多数致癌物都是遗传毒物。随着环境中新化学物质数量的激增,人们将会接触到更多具有潜在遗传毒性的化学物,以动物为基础的传统毒理学评价方法面临着严峻挑战,加之动物3R原则的推行,建立相对快速、简单、可靠的体外评价化学物潜在遗传毒性的方法成为当前毒理学发展的重要方向。由于多数遗传毒物均以前致突变剂或前致癌剂的形式存在,需要经细胞色素P450酶代谢活化后才能造成DNA损伤,最后呈现致突变或致癌作用。研究表明,在靶细胞中加入S9组分最常用于检测化学物的潜在遗传毒性[1-2],但该体系灵敏性和特异性较低,存在假阴性和假阳性的结果。随着肝细胞分离和培养技术的发展,研究者已成功将原代培养的肝细胞模型用于体外化学物遗传毒性的筛选[3-4]。肝细胞内含有丰富的代谢酶,且大部分外源化学物质在细胞内可被代谢酶活化,并在不需添加S9组分的情况下,结合遗传毒性检测方法可直接检出化学物的遗传毒性。目前,已建立了200多种检测遗传毒性的实验方法,且还在不断发展中,其中DNA是遗传学检测的有效终点之一。遗传毒物能直接或间接导致各种形式的DNA损伤,包括DNA单链断裂(DNA single-stranded breaks,SSB)、DNA双链断裂(DNA doublestranded breaks,DSB)、DNA加合物形成、链内/链间交联和碱基置换等。其中DNA链的断裂尤其是DSB被认为是最严重的DNA损伤方式之一。目前,磷酸化组蛋白H2AX(γH2AX)与DSB之间的关系逐渐引起研究者的重视。当细胞中发生DSB时,H2AX会被迅速磷酸化,随后γH2AX在DSB损伤的修复过程中发挥重要作用,并可募集其他DNA损伤修复蛋白到达损伤位点,对DSB进行修复[5-6]。进一步研究证实,γH2AX的形成和消失与DSB形成和修复存在对应关系[7-8]。因此,γH2AX可作为一种灵敏检测DSB的有效指标。目前,各实验室检测γH2AX的方法并非一致,而流式细胞术具有操作简单、快速的特点,已被用于γH2AX的检测[9-10]。
本研究在已有文献的基础上,首先采用改良的两步胶原酶灌流法分离获取小鼠肝细胞,并进行三明治法体外培养肝细胞,建立稳定的原代肝细胞模型。运用此模型,结合细胞毒性实验,建立多聚甲醛固定FITC标记γH2AX的流式检测法,并用4种已知遗传毒物平阳霉素(bleomycin,BLM)、苯并芘〔benzo (a)pyrene,B(a)p〕、苯乙烯(styrene)和氧化苯乙烯(styrene-7,8-oxide,SO)及2种非遗传毒物硫唑嘌呤(azathioprine,Aza)和环孢素A(ciclosporin A,CsA)作为受试物,对所建立的方法进行验证,为遗传毒性体外筛选方法的建立及其科学性和有效性验证提供实验依据。
1 材料与方法
1.1实验动物
15只SPF级BALB/c雄性小鼠,8~10周龄,体质量为18~30 g,由北京维通利华实验动物技术有限公司提供〔许可证号:SCXK(京)2012-0001〕。
1.2主要试剂和仪器
DMEM培养基、WEM培养基、胎牛血清(fetal bovine serum,FBS)、胰酶、Ⅳ型胶原和谷氨酰胺(美国Gibco公司);Ⅰ型鼠尾胶原、Matrigel胶和ITS预混液(美国BD公司);胰岛素、地塞米松、Percoll分离液、维生素C、BLM、B(a)p、苯乙烯、SO、Aza、CsA、二甲亚砜(DMSO)、依地酸二钠(Na2EDTA)、牛血清白蛋白(bovine serum albumin,BSA)、HEPES、MCDI和Triton X-100(美国Sigma公司);FITC标记的兔抗鼠γH2AX抗体和同型抗体(美国CST公司);细胞毒性检测试剂盒(碧云天生物技术公司);其余均为国产生化试剂。20 G静脉留置针和细胞筛(美国BD公司);二氧化碳培养箱(美国Thermo公司);倒置显微镜(日本Olympus公司);低温离心机(美国Sigma公司);流式细胞仪(美国BD公司);酶标仪(美国Bio-Rad公司);BT01-100蠕动泵(保定格兰蠕动泵有限公司);智能恒温水浴锅(北京市长风仪器仪表公司)。
1.3肝细胞的分离和原代培养
采用改良的两步胶原酶消化法分离获取小鼠肝细胞[11]。①行下腔静脉插管,以10 mL·min-1输注预温(40°C)灌注液I(mmol·L-1:NaCl 142,KCl 6.7,Na2HPO4·12H2O 0.7,EDTA·Na20.5,HEPES 10,pH为7.4)5 min;②接着以10 mL·min-1输注预温(40°C)含0.04%胶原酶Ⅳ的灌注液Ⅱ(mmol·L-1:NaCl 66.7,KCl 6.7,CaCl24.76,Na2HPO4·12H2O 0.7,HEPES 10,pH值为7.6),待肝表面出现龟状裂纹后停止灌注,摘取肝并立即转至装有冷DMEM/10%FBS培养皿内,后续步骤均在冰上进行;③轻划肝包膜,夹住肝蒂轻晃,肝细胞像泥沙一样散落下来,行筛网过滤后得到细胞悬液;④将此悬液于4°C,50×g离心5 min后收集细胞,加入30%Percoll液,同样条件离心10 min,弃上层液体,加入DMEM/5%FBS接种液,轻轻混匀即可。将肝细胞悬液(5×108L-1)接种于包被Ⅰ型胶原的培养板内,于37°C,5%CO2环境中培养。2 h后弃未贴壁的细胞,PBS洗涤2次,更换WEM无血清培养液(终浓度含1×ITS预混液,1×青链霉素混合液,1×谷氨酰胺,地塞米松10 nmol·L-1)。24 h后将更换预冷、含Matrigel基质0.25 g·L-1的无血清培养液,形成三明治法培养,培养24 h即可用于后续染毒。
1.4CCK-8法检测细胞存活率
将肝细胞按每孔5×104细胞接种于96孔板并进行三明治法培养,于夹层培养第2天开始进行染毒。6种受试物设置6个浓度(0.2,1,5,10,20和40 μmol·L-1)对细胞染毒处理,同时设置空白及DMSO溶剂对照组。置于37°C,5%CO2培养箱中培养21 h后,每孔内加入CCK-8染液10 μL,混匀继续培养3 h后,在450 nm处测定每孔的吸光度值(absorbance,A),计算肝细胞与不同浓度受试物共培养后的相对细胞存活率。细胞存活率(%)=(实验组A-空白组A)/(溶剂对照组A-空白组A)× 100%。每个毒物设3个平行孔,且该实验独立实施5次。选择细胞存活率>80%的毒物剂量进行后续实验。
1.5流式细胞术检测受试物作用不同时间对H2AX表达的影响
将肝细胞按每孔1×106细胞接种于6孔板,三明治法体外培养24 h后,分别加入BLM、B(a)p、苯乙烯、SO、Aza和CsA 10 μmol·L-1培养0.5,1,3,6,12和24 h染毒。实验设置空白对照和DMSO溶剂对照组。染毒结束后,胰酶消化,600×g离心5min收集细胞,PBS洗涤,缓慢加入预冷2%多聚甲醛1 mL,4°C静置30 min;离心弃上清,PBS洗涤,加入10%FBS(以含0.2%TritonX-100的PBS稀释)200 μL室温封闭30 min;离心收集细胞,加入FITC标记的兔抗小鼠γH2AX抗体及同型抗体(1∶100)50 μL(以含0.1%BSA和0.2%TritonX-100的PBS稀释),室温孵育60 min,PBS洗涤,制成350 μL PBS细胞悬液,进行流式细胞术检测细胞内γH2AX荧光强度值,该实验独立重复5次,计算平均荧光强度值并直接进行比较。选择每种受试物γH2AX表达最高的时间点,进行后续浓度-效应的研究。
1.6流式细胞术检测受试物不同浓度对 H2AX表达的影响
将肝细胞按每孔1×106细胞接种于6孔板,夹层体外培养24 h后,用受试物BLM和SO处理3 h,B(a)p、苯乙烯、Aza和CsA处理6 h,且各受试物处理浓度设为0.05,0.1,0.2,1,5和10 μmol·L-1。实验同时设空白对照和DMSO溶剂对照组。染毒结束,细胞经胰酶消化、多聚甲醛固定、FBS封闭及FITC标记的兔抗小鼠γH2AX抗体孵育后,制成PBS细胞悬液,进行流式细胞术检测细胞内γH2AX荧光强度值,该实验独立重复5次,计算平均荧光强度值并直接进行比较。
1.7统计学分析
用SPSS19.0软件进行统计分析,细胞存活率和γH2AX含量(平均荧光强度值)均属于正态分布,实验结果数据以表示,两样本均数比较采用独立样本t检验,并用Pearson相关分析探讨毒物浓度与γH2AX表达的关系,P<0.05为差异有统计学意义。
2 结果
2.1受试物不同浓度对细胞存活率的影响
由表1可见,在6种受试物处理组中,随着染毒浓度的增加,受试物的细胞毒性逐渐增强,而细胞相对存活率逐渐降低。不同受试物在10 μmol·L-1染毒浓度下对肝细胞均显示了相对较低的细胞毒性,导致15%~20%细胞死亡,细胞存活率均>80%;当各受试物浓度增加到20 μmol·L-1时,会导致约>30%的细胞死亡;而空白对照和DMSO对照组无明显改变。选择染毒24 h细胞相对存活率>80%的作用浓度进行后续化学物遗传毒性的检测。

Tab.1 Effect of chemicals on cell viability by CCK-8 assays
2.2受试物作用不同时间对细胞内 H2AX表达水平的影响
由表2可见,4种遗传毒物均能引起γH2AX的表达升高,不同的遗传毒物诱导肝细胞γH2AX表达的时间规律并不相同,随着染毒时间的延长其γH2AX水平呈先升后降的趋势。BLM和SO处理组作用0.5 h时,γH2AX表达量明显高于DMSO对照组,其值分别约为DMSO对照组的4和3倍(P<0.05);作用3 h时,γH2AX表达量最高,分别约为DMSO对照组的18和10倍(P<0.01);作用6 h时,γH2AX表达量开始降低,分别约为DMSO对照组的7和4倍(P<0.01);作用24 h时,γH2AX表达量逐渐接近或回复到DMSO对照组水平,分别约为DMSO对照组的2和1倍。B(a)p和苯乙烯处理组作用1 h时,γH2AX表达量明显高于DMSO对照组,其值约为DMSO对照组的2倍(P<0.05);作用6 h时,γH2AX表达量最高,分别约为DMSO对照组的12和8倍(P<0.01);作用12 h时,γH2AX表达量开始降低,分别约为DMSO对照组的5和2倍(P<0.05);作用24 h时,γH2AX表达量逐渐接近或回复到DMSO对照组水平,分别约为DMSO对照组的2和1倍。2种非遗传毒物Aza和CsA处理组与DMSO对照组相比,γH2AX表达量在24 h内无明显改变。在后续实验中选择BLM和SO作用3 h,B(a)p、苯乙烯、Aza和CsA作用6 h。
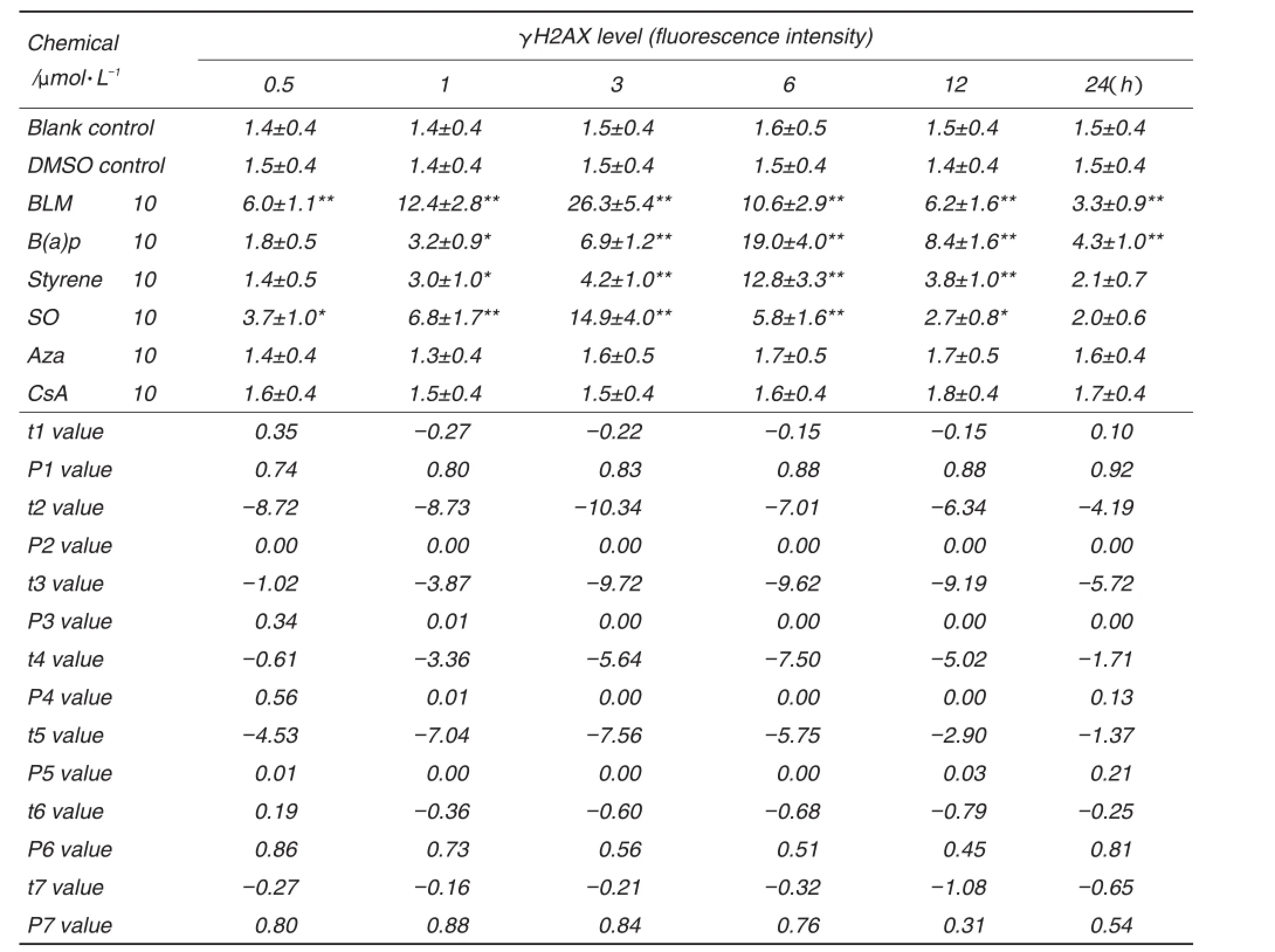
Tab.2 Effect of exposure time of chemicals on H2AX level
2.3受试物不同浓度对细胞内 H2AX表达水平的影响
与空白对照和DMSO溶剂对照组相比,4种遗传毒物BLM、B(a)p、苯乙烯和SO组均呈阳性反应;肝细胞内γH2AX表达量均增加并呈浓度效应关系,确定产生遗传毒性的最低有效浓度分别为0.1,0.2,0.2和0.2 μmol·L-1;当作用浓度达到10 μmol·L-1时,γH2AX表达量分别约为DMSO溶剂对照组的18,12,8和10倍(P<0.01)。2种非遗传毒物Aza和CsA组随着染毒剂量的增加细胞内γH2AX表达量未见明显变化。因此,γH2AX表达水平可作为评价化学物遗传毒性的有效标记(表3)。
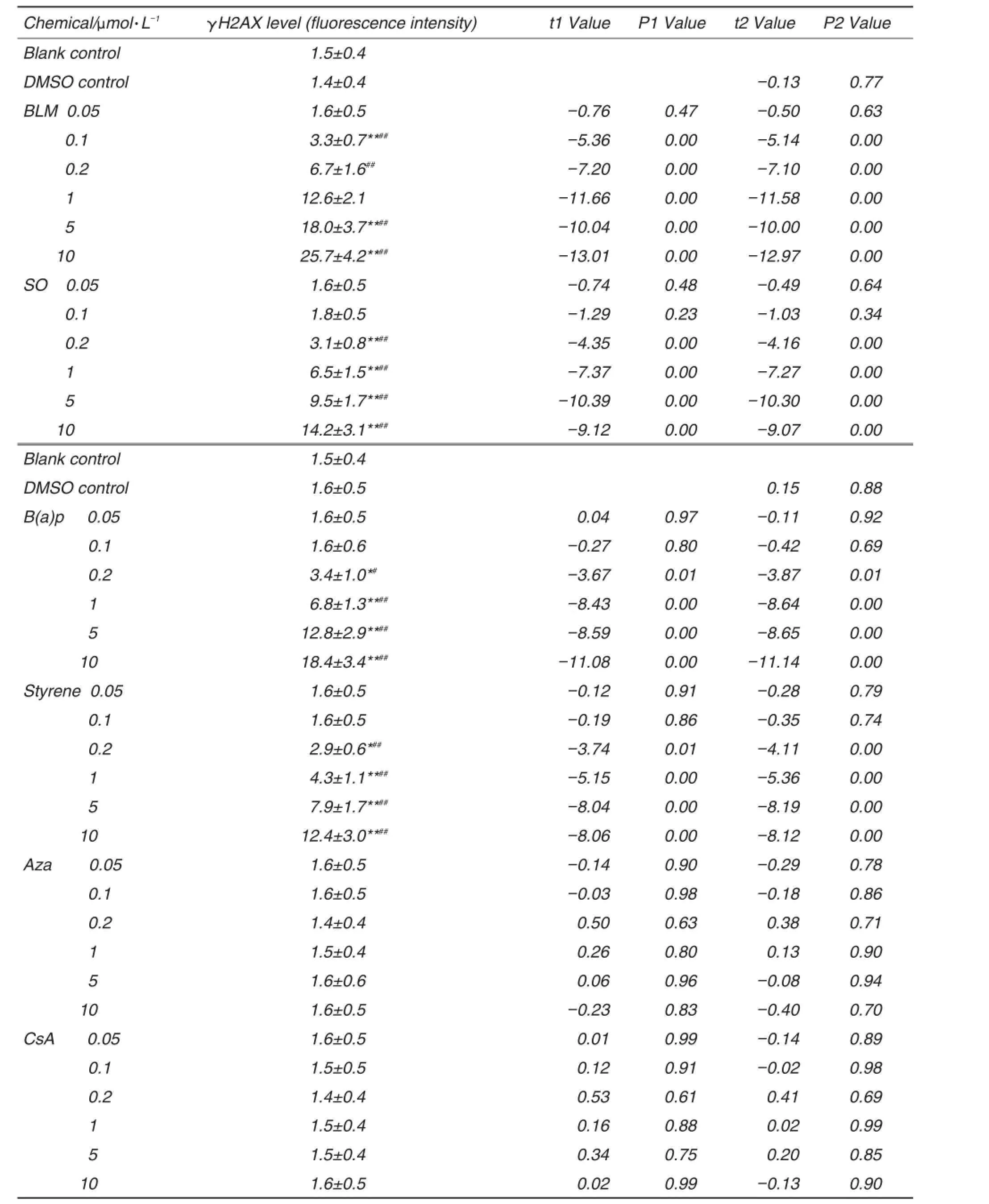
Tab.3 Effect of different concentrations of chemicals on H2AX level
经Pearson相关分析进一步探讨了受试化学物染毒浓度与γH2AX表达之间的关系。统计结果发现,4种遗传毒物BLM在0.1~10 μmol·L-1,B(a)p、苯乙烯和SO在0.2~10 μmol·L-1范围内染毒浓度与γH2AX水平均呈显著的正相关(P<0.01),且它们之间的拟合关系均符合直线方程,方程式分别为Y=1.9875X+6.7928,Y=1.362X+4.5895,Y= 0.9483X+3.0294和Y=1.024X+4.2118,各组对应的相关系数分别为0.906,0.916,0.913和0.894。
3 讨论
为了更好地控制环境中化学致癌物,尤其是防止接触遗传毒物,预防肿瘤的发生,快速且准确地体外检测环境中的致癌物成为当前研究的重点。体外研究模型的科学性和合理性直接影响研究结果的可靠性,建立理想的研究模型有助于更好地研究化学致癌物的毒性效应及其机制。因此,选择合适的靶细胞模型对于化学物潜在遗传毒性的筛选至关重要,尤其是对需要经过代谢后产生遗传毒性的化学物。本课题组前期通过改良的两步胶原酶灌流法,建立了有效和稳定的原代肝细胞模型,从而为后续化学物遗传毒性的体外筛选提供了稳定的实验系统。该模型与以往文献报道的原代细胞检测模型相比,共同之处为代谢酶种类丰富,酶活力高及活性下降慢,与体内代谢情况的一致性较好,灵敏度高,不易导致化合物漏检;不同之处为该模型可在相对较长时间(7 d)维持高水平的代谢酶活性,从而可延长化学物的处理时间[3-4]。本研究通过测定细胞内γH2AX水平变化,间接反映化学物对细胞遗传物质DSB及修复,且首次利用原代肝细胞模型结合γH2AX指标进行遗传毒物的筛选,并用4种阳性受试物和2种阴性受试物初步验证该筛选法具有较好的灵敏性、特异性及准确性。与公认的检测遗传毒性的方法(彗星实验)相比,该筛选法可较早地并在低浓度下检出阳性受试物的遗传毒性,即该筛选法具有较好的灵敏性,且与彗星实验具有较好的一致性。
研究发现,电离辐射、遗传毒物如顺铂和喜树碱可诱导γH2AX的表达,且γH2AX的形成与消失与DSB的形成与修复存在对应关系[7-8,12-13]。因此,γH2AX已被认为是一种灵敏检测DSB的准确、特异性的指标,已被用于电离辐射、多种化合物诱导的DSB形成和修复的研究中。目前,检测γH2AX的方法主要包括免疫荧光、免疫印迹和流式细胞术,这3种方法在检测范围、检测指标、检测便捷程度及样品用量等方面均有差异。由于流式细胞仪目前已广泛应用于科研和临床中,其操作简单快速。因此,使用流式细胞术检测γH2AX具有较好的应用前景。然而,不同实验室γH2AX的流式检测方法并不完全一致,不同的固定液和荧光标记均会影响检测结果[9-10,14],且不利于不同实验室间检测结果的比较。已有文献报道,在使用FITC单标法时固定剂多聚甲醛的剂量反应优于乙醇[14],在实验中选择2%多聚甲醛的固定方式进行流式检测,并对浓度反应结果进行直线拟合,相关系数约0.9,提示多聚甲醛固定方式获得的γH2AX浓度效应的直线趋势较好。因此,应用多聚甲醛固定的单标法进行流式检测是适用于γH2AX表达与化学物暴露相关性研究的测定方法。
本研究观察了不同遗传毒物BLM、B(a)p、苯乙烯和SO在24 h时间段内的6个时间点(0.5,1,3,6,12和24 h)γH2AX的表达情况,其含量均呈先升后降趋势,但同时显示不同类型的遗传毒物诱导γH2AX表达的时间并不相同,BLM和SO作用3 h 时γH2AX含量最高,而B(a)p和苯乙烯作用6 h时γH2AX含量最高。因此,本研究可根据γH2AX的峰值时间有效区别化学物具有直接遗传毒性还是需代谢活化后具有间接遗传毒性。另外,结果显示,该法可较早(染毒0.5 h)检出直接遗传毒物的γH2AX含量变化,而相对较晚(染毒1 h)检出代谢后具有遗传毒性化学物的γH2AX含量变化,这些均可能是由于遗传毒物本身的特性引起,BLM和SO具有直接遗传毒性,其中BLM属于拟X射线的致突变剂,可直接导致DNA链断裂,而SO为苯乙烯的活性中间代谢产物,具有亲核性,进入细胞内与DNA共价结合,可直接导致DNA损伤,通过本研究进一步验证SO为苯乙烯的关键遗传毒性代谢产物。而B(a)p和苯乙烯具有间接遗传毒性,需要经过细胞色素P450酶家族成员的代谢活化后才具有损伤DNA的能力,这与BLM和SO不同。各遗传毒物诱导的γH2AX水平达到峰值后,随后逐渐下降,原因可能是:①化学物或活性代谢产物在细胞内水解而失去活性,不会继续导致DNA损伤;②随着遗传毒物所致DSB的重新连接修复,γH2AX在磷酸酶2A的作用下发生去磷酸化[15],即γH2AX水平开始衰减,处理组γH2AX水平在短时间内快速增加,达到峰值后进入快速衰减然后转变为缓慢衰减。这一结果与DNA损伤及修复的时间动力学的基本知识一致[16],即DNA损伤早期为快速修复,晚期为缓慢修复。在24 h内苯乙烯和SO γH2AX水平回复到对照组水平,而BLM和B(a)p接近DMSO溶剂对照组水平,由于观察时间有限,未得到BLM和B(a)p的γH2AX水平衰减的完整曲线。另有研究发现,B(a)p处理FL细胞和HeLa细胞均可诱导γH2AX的表达,且具有较好的浓度效应和时间效应关系,即随着浓度的增加或时间的延长,γH2AX水平呈上升趋势[17],这与本研究结果不同,提示在检测遗传毒性时还需要考虑靶细胞的代谢能力。由于不同的遗传毒物诱导γH2AX的形成及变化过程不同,尤其是需要经过代谢的遗传毒物,因此需要选择合适的时间点检测γH2AX表达。此外,与DMSO溶剂对照组相比,4种遗传毒物在24 h内可见明显的先升后降的变化,而2种非遗传毒物未见明显的变化,初步提示该法具有较高的灵敏性和特异性。由于化合物种类繁多,还需选择其他化合物做进一步的方法验证。
根据γH2AX形成的时间效应关系,确定4种遗传毒物γH2AX的最佳的作用时间,然后观察各毒物不同浓度在对应时间内γH2AX的表达情况。实验结果发现,BLM 0.1 μmol·L-1与Bap、苯乙烯及SO 0.2 μmol·L-1处理组γH2AX水平较DMSO对照组显著增加,提示该法具有较好的灵敏性,在较低浓度即可检出受试物的遗传毒性;4种遗传毒物均可显著诱导γH2AX的表达,且具有明显的剂量依赖性,最高浓度10 μmol·L-1作用后γH2AX表达最多(荧光强度最强),且此浓度对应的细胞存活率>80%,细胞死亡率仅在15%~20%之间。不同浓度2种非遗传毒物作用6 h,γH2AX的表达与DMSO对照组相比无明显变化,提示该法具有较好的特异性。为降低细胞毒性对遗传毒性实验结果的影响,本研究将CCK-8法与γH2AX流式法相结合,在保证较高的细胞存活率的基础上检测受试物的遗传毒性,能更真实反映受试物的毒性特点。此外,Banáth等[18]研究发现,γH2AX形成的强度与细胞的死亡率也有一定关系,即γH2AX焦点形成越强,细胞的死亡率越高。另外,我们也用流式细胞术检测了各遗传毒物20 μmol·L-1诱导γH2AX的表达水平,此时细胞存活率基本<70%(数据略),与Banáth等得出的结果是一致的,推测γH2AX表达既能较好地反映细胞内DNA损伤程度,也能很好地反映细胞的存活情况。此外,本研究通过Pearson相关分析探讨了染毒浓度与γH2AX表达之间的关系,二者具有较好的线性关系,且各毒物相关系数均约在0.9。
综上所述,当原代培养的肝细胞暴露于化学物中,采用流式细胞术检测细胞内γH2AX含量的变化,通过γH2AX水平能反映出化学物诱发的DSB及修复情况,可在不添加S9情况下来区分遗传毒物与非遗传毒物,并根据γH2AX含量峰值出现时间来区分化学物直接具有遗传毒性作用还是经代谢活化后间接具有遗传毒性作用。本研究结果显示,4种不同的遗传毒物均能诱发细胞内γH2AX表达升高,而非遗传毒物未引起γH2AX明显改变,提示γH2AX指标可作为确定化学物是否具有遗传毒性的参考指标;具有直接遗传毒性的化学物γH2AX含量的峰值时间接近3 h,经代谢后才具有遗传毒性的化学物其峰值时间接近6 h,提示γH2AX峰值出现时间可作为确定遗传毒物属于直接的还是间接的。这些数据也进一步证实了利用原代肝细胞模型检测细胞内γH2AX表达的改变来进行初步、快速筛选潜在遗传毒物是可行的。然而,本研究目前无法根据γH2AX水平的变化制定出判断化学物遗传毒性强弱的判定标准,相关研究还有待进一步探索。
[1]Mcgregor DB,Edwards I,Riach CG,Cattanach P,Martin R,Mitchell A,et al.Studies of an S9-based metabolic activation system used in the mouse lymphoma L5178Y cell mutation assay[J]. Mutagenesis,1988,3(6):485-490.
[2]Majeska JB,Matheson DW.Development of an optimal S9 activation mixture for the L5178Y TK+/-mouse lymphoma mutation assay[J].Environ Mol Mutagen,1990,16(4):311-319.
[3]Fahrig R,Rupp M,Steinkamp-Zucht A,Bader A. Use of primary rat and human hepatocyte sandwich cultures for activation of indirect carcinogens:monitoring of DNA strand breaks and gene mutations in co-cultured cells[J].Toxicol In Vitro,1998,12(4):431-444.
[4]Sheen LY,Wu CC,Lii CK,Tsai SJ.Effect of diallyl sulfide and diallyl disulfide,the active principles of garlic,on the aflatoxin B1-induced DNA damage in primary rat hepatocytes[J].Toxicol Lett,2001,122(1):45-52.
[5]Fernandez-Capetillo O,Celeste A,Nussenzweig A. Focusing on foci:H2AX and the recruitment of DNA-damage response factors[J].Cell Cycle,2003,2(5):426-427.
[6]Kinner A,Wu W,Staudt C,Iliakis G.Gamma-H2AX in recognition and signaling of DNA doublestrand breaks in the context of chromatin[J].Nucleic Acids Res,2008,36(17):5678-5694.
[7]Takahashi A,Ohnishi T.Does gammaH2AX foci formation depend on the presence of DNA double strand breaks?[J].Cancer Lett,2005,229(2):171-179.
[8]Kuo LJ,Yang LX.Gamma-H2AX-a novel biomarker for DNA double-strand breaks[J].In Vivo,2008,22(3):305-309.
[9]Darzynkiewicz Z,Traganos F,Zhao H,Halicka HD,Skommer J,Wlodkowic D.Analysis of individual molecular events of DNA damage response by flow-and image-assisted cytometry[J].Methods Cell Biol,2011,103:115-147.
[10] Huang X,Darzynkiewicz Z.Cytometric assessment of histone H2AX phosphorylation:a reporter of DNA damage[J].Methods Mol Biol,2006,314:73-80.
[11]Li WC,Ralphs KL,Tosh D.Isolation and culture of adult mouse hepatocytes[J].Methods Mol Biol,2010,633:185-196.
[12]Paull TT,Rogakou EP,Yamazaki V,Kirchgessner CU,Gellert M,Bonner WM.A critical role for histone H2AX in recruitment of repair factors to nuclear foci after DNA damage[J].Curr Biol,2000,10 (15):886-895.
[13]Zhao J,Wang Q,Li J,Si TB,Pei SY,Guo Z,et al. Comparativestudyofphosphorylatedhistone H2AX expressions in the cervical cancer patients of pre-and post-neoadjuvant chemotherapy[J]. Eur J Gynaecol Oncol,2015,36(3):318-322.
[14]Sun ZJ,Fan YG,Shi DW,Tian LL,Zhao YC,Wang JX.Methodological study on the doseeffects relationship between ionizing radiation and γ-H2AX by flow cytometry[J].Chin J Ind Med(中国工业医学杂志),2008,21(6):364-367.
[15]Chowdhury D,Keogh MC,Ishii H,Peterson CL,Buratowski S,Lieberman J.γ-H2AX Dephosphorylation by protein phosphatase 2a facilitates DNA double-strand break repair[J].Mol Cell,2005,20 (5):801-809.
[16]Svetlova MP,Solovjeva LV,Tomilin NV.Mechanism of elimination of phosphorylated histone H2AX from chromatin after repair of DNA double-strand breaks[J].Mutat Res,2010,685(1-2):54-60.
[17]Yan C,Lu J,Zhang G,Gan T,Zeng Q,Shao Z,et al.Benzo[a]pyrene induces complex H2AX phosphorylationpatternsbymultiplekinases including ATM,ATR,and DNA-PK[J].Toxicol in Vitro,2011,25(1):91-99.
[18]Banáth JP,Olive PL.Expression of phosphorylated histone H2AX as a surrogate of cell killing by drugs that create DNA double-strand breaks[J]. Cancer Res,2003,63(15):4347-4350.
Method validation of phosphorylated histone H2AX level detection using primary cultured hepatocytes in genotoxic agent screening
MENG Tao,MIAO Pan-pan,JI Yu-qing,NIU Yong,BIN Ping,DAI Yu-fei,ZHENG Yu-xin
(Key Laboratory of Chemical Safety and Health,National Institute of Occupational Health and Poison
Control,Chinese Center for Disease Prevention and Control,Beijing 100050,China)
OBJECTIVE To establish an in vitro test method and to evaluate the genotoxicity of chemicals using primary cultured mouse hepatocytes and the changes in phosphorylated histone H2AX(γH2AX)expression levels to provide a more reliable marker of the identification of genotoxicity. METHODS Hepatocytes were isolated from BALB/c mice by an improved two-step collagenase digestion method and then cultured in sandwich configuration.The primary cultured hepatocytes were treated with various concentrations of four known genotoxic agents bleomycin(BLM),benzo(a)pyrene〔B (a)p〕,styrene and styrene-7,8-oxide(SO)within the range of 40 μmol·L-1and two non-genotoxic agents azathioprine(Aza)and ciclosporin A(CsA)at different time points within 24 h.The cytotoxicity induced by these toxicants was assessed by CCK-8 assay.Then,the changes in γH2AX expressionlevels in treated cells were determined by flow cytometry.RESULTS The four genotoxic agents could be detected and two non-genotoxic agents could not be detected by this method.The γH2AX expression level was the highest when hepatocytes were exposed to BLM and SO for 3 h,or B(a)p and styrene for 6 h(P<0.01).The production of γH2AX was 25.67,18.36,12.43 and 14.25 for the four types of genotoxic agents,respectively,and was approximately 19,13,9 and 11 times that of the vehicle control group(P<0.01)at the optimum time point and concentration.There was a significant positive correlation between the indicated concentrations of genotoxic chemicals and γH2AX expression levels(P<0.01).In addition,the production of γH2AX indicated no marked increase in two non-genotoxic agents such as Aza and CsA in comparison with the control group.CONCLUSION This test method can effectively distinguish genotoxic agents from non-genotoxic agents,and direct genotoxic agents from indirect genotoxic agents in the absence of S9.γH2AX might be a reliable marker for the identification of the potential genotoxicity of chemicals.
genotoxic agents;hepatocytes;primary culture;histones;flow cytometry
The project supported by National Key Technology Research and Development Program of China (2014BAI12B02);Youth Science Foundation of National Institute of Occupational Health and Poison Control of China CDC(2014YS02);and Youth Science Foundation of National Institute of Occupational Health and Poison Control of China CDC(2015YS01)
ZHENG Yu-xin,Tel:(010)83132593,E-mail:zhengyx@chinacdc.cn
R394.6,R965.1
A
1000-3002(2016)02-0135-09
10.3867/j.issn.1000-3002.2016.02.008
2015-08-22接受日期:2015-11-20)(本文编辑:乔 虹)
十二五国家科技支撑计划资助项目(2014-BAI12B02);中国疾病预防控制中心职业卫生与中毒控制所青年科技基金资助项目(2014YS02);中国疾病预防控制中心职业卫生与中毒控制所青年科技基金资助项目(2015YS01)
孟 涛,女,博士,助理研究员,主要从事化学物致病生物标志物及其机制研究,E-mail:taotao198307@163.com
郑玉新,E-mail:zhengyx@chinacdc.cn,Tel:(010)83132593

