聚L-半胱氨酸修饰电极对食品中香兰素的测定
迟玉峰,曲有乐,石 婧
(1.浙江海洋学院食品与医药学院,浙江舟山 316022;2.浙江海力生制药有限公司,浙江舟山 316021;3.舟山市食品药品检验检测研究院,浙江舟山 316021)
聚L-半胱氨酸修饰电极对食品中香兰素的测定
迟玉峰1,2,曲有乐1,石婧3
(1.浙江海洋学院食品与医药学院,浙江舟山316022;2.浙江海力生制药有限公司,浙江舟山316021;3.舟山市食品药品检验检测研究院,浙江舟山316021)
用循环伏安法制备聚L-半胱氨酸修饰电极并研究了香兰素在聚L-半胱氨酸修饰电极上的电化学行为,建立了一种测定香兰素的新方法。实验结果表明:在pH=2.2磷酸盐缓冲溶液中,香兰素检测线性范围为1.2×10-5~1.2×10-4 mol/L;检出限为8.0×10-7 mol/L。同时该修饰电极具有良好的灵敏度、选择性和稳定性,可用于食品中香兰素的检测,结果满意,有较广的应用前景。
化学修饰电极;香兰素;聚L-半胱氨酸;循环伏安法
香兰素又名香草醛、香草酚(学名3-甲氧基-4-羟基苯甲醛)有香草的特殊气味[1],主要用于食品添加剂[2],是全球产量最大、应用范围最广的香料之一,广泛运用在各种需要增加奶香气息的调香食品中,饮料、冰激凌、糖果、焙烤食品、明胶和布丁、口香糖、巧克力、糖浆等。有“食品香料之王”的美誉[3]。按照我国现行《食品安全国家标准食品添加剂使用标准》(GB2760-2014)中的规定,香兰素可以作为食品添加剂使用并有相应的限度要求,但是标准要求对0~6个月婴幼儿配方食品、巴氏杀菌乳、灭菌乳、发酵乳、稀奶油等部分食品不得添加任何食用香料。对于市场上可能出现的违法添加香兰素的情况,选择便捷,稳定性好,灵敏度高的检测方法尤其重要。目前,有关香兰素(VNL)含量测定的方法主要有高效液相色谱法[4]、分光光度法[5]、气相色谱法[6]和微分脉冲溶出伏安法[7-15]等。本实验采用了循环伏安法来进行研究。
本工作研究了聚L-半胱氨酸修饰电极的制备及香兰素在此修饰电极上的电化学行为,建立了循环伏安法测定香兰素的新方法。可用于糖果等食品中香兰素的测定,结果满意。本修饰电极制备简便,具有良好的选择性、稳定性、高灵敏度和较宽的线性范围,应用前景良好。
1 材料与方法
1.1仪器与试剂
CHI660C型电化学分析系统(上海辰华仪器有限公司);KQ-300DB型数控超声波清洗器(昆山市超声仪器有限公司);电化学实验三电极系统:玻碳电极为工作电极,Ag/AgCl电极为参比电极,铂丝电极为对电极。
香兰素(上海市阿拉丁试剂有限公司)配制成8.0×10-5mol/L溶液避光保存;L-半胱氨酸(天津市科密欧化学试剂开发中心)配制成2.0×10-4mol/L的溶液;磷酸盐缓冲溶液体系(PBS,pH 2.2~8.0)。试液均为分析纯;实验用水均二次蒸馏水。
1.2聚L-半胱氨酸修饰电极的制备
将玻碳电极(Φ=3.8mm)在湿润的金相砂纸(粒度为1 000)上磨光,用中性三氧化二铝(30 nm)悬浮液抛光成镜面,依次用硝酸(1:2,V/V)、无水乙醇、二次蒸馏水超声清洗(2 min/次,每次清洗后需用二次水冲洗再放入另一个清洗瓶中),
用二次蒸馏水清洗干净后,放入10.00 mL PBS(pH=4.0),1.00 mL(2.0×10-4mol/L)L-半胱氨酸及9.00 mL H2O配成的溶液中(聚合前要摇匀),以玻碳电极作为工作电极,Ag/AgCl电极作为参比电极,铂丝电极作为对电极,在0.0~1.0 V电位范围内,以0.08 V/s扫描速率循环扫描20段,取出,并用二次水冲淋电极表面,即制得聚L-半胱氨酸修饰电极。
1.3实验方法
在50 mL电解池中,依次加入pH=2.2的磷酸盐缓冲溶液10.00 mL、0.20 mL香兰素、9.80 mL二次蒸馏水。以聚L-半胱氨酸修饰电极作为工作电极,Ag/AgCl电极作为参比电极,铂丝电极作为对电极,搅拌1 min,在0.2~1.0 V电位范围内,以0.10 V/s扫描速率循环扫描2段,并记录峰电位和峰电流。
2 结果分析

图1 聚合液pH的影响Fig.1 Effect of Polymer solution pH
2.1电化学聚合条件的选择
在研究聚合底液中浓度对测定的影响时,发现浓度对其电化学行为影响并不大。当L-半胱氨酸加入体积为1.00 mL(2.0×10-4mol/L)时,响应电流达到最大。
2.1.1最佳聚合pH的选择
聚合溶液的pH值会影响修饰电极的性能,设定其余参数不变,仅改变溶液的pH值,测得聚合液在pH= 4.0的情况下,香兰素在修饰电极上的响应电流达到最大。结果如图1。所以选择pH=4.0的缓冲溶液为底液。
2.1.2最佳聚合段数的选择
聚合物修饰电极膜的厚度与聚合底液浓度及扫描段数均有一定的关系。聚合液浓度越大时,膜越厚。设定上述聚合液浓度,仅改变扫描段数,研究发现聚合20段时,修饰电极对香兰素的响应电流达到最大。结果如图2。因此选择聚合段数为20段。
2.1.3最佳聚合电位的选择
限定低电位为-0.2 V,仅改变高电位进行研究。结果表明:当高电位为1.0 V时,香兰素在修饰电极上氧化峰的响应电流达到最大,如图3所示。
限定高电位为1.0 V,仅改变低电位进行研究。结果表明,当低电位为0.0 V时,香兰素在修饰电极上氧化峰的响应电流达到最大,如图4所示。
所以,本实验选择聚合电位范围为:0.0~1.0 V。
2.1.4最佳聚合扫描速率的选择
扫描速率对修饰电极的响应电流有较大的影响。限定其它聚合参数,仅改变扫描速率进行实验。结果表明:当扫描速率0.08 V/s时,所制备的修饰电极对香兰素的响应电流达到最大,结果如图5。所以选择扫描速率为0.08 V/s。
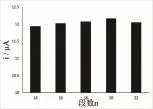
图2 扫描段数的影响Fig.2 Effect of scan segment

图3 高电位的影响Fig.3 Effect of high potential

图4 低电位的影响Fig.4 Effect of low potential

图5 扫描速率的影响Fig.5 Effect of scan rate
2.2聚L-半胱氨酸修饰电极的聚合循环伏安曲线
图6为L-半胱氨酸在最佳聚合条件下聚合过程的循环伏安图。由图可知:随扫描段数的增加,峰电位不变,峰电流增加,但增加幅度逐渐减小,最后趋向稳定。证明了L-半胱氨酸在电极表面发生了聚合反应。
2.3测定香兰素的最佳条件
在浓度为2.00×10-4mol/L,pH=4.0,扫描段数为20段,扫描速率为0.08 V/ s,电位范围为0.00~1.0 V的聚合条件下进行试验,比较不同的pH、段数、高低电位及扫描速率对香兰素在聚L-赖氨酸修饰电极上的响应电流值的影响。
2.3.1最佳测定pH的选择
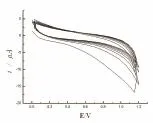
图6 聚L-半胱氨酸聚合过程的循环伏安曲线Fig.6 CVs of Poly-L-cysteine polymerization process
实验表明:在pH为2.2~8.0之间,Epa与pH呈线性关系,回归方程为:E=1.01-0.048 pH,r=0.995 6(如图9),说明了香兰素的氧化还原过程有质子参与。当pH=2.2时,响应电流最大(如图7所示),所以选择2.2为测定液pH值。
2.3.2最佳测定电位的选择
改变低电位进行实验,设定高电位为1.4 V。结果表明:当低电位为0.2 V时,香兰素在修饰电极上的响应电流最大(如图10所示)。

图7 测试液pH的影响Fig.7 Effect of the test solution pH
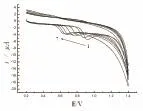
图8 香兰素在聚L-赖氨酸修饰电极上的pH变化的CV曲线(1-7为pH为2.2,3,4,5,6,7,8)Fig.8 Vanillin at the surface of poly-L-lysine amino acid modified electrode for different pH(the pH of 1-7:2.2,3,4,5,6,7,8)
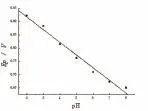
图9 8.0×10-5 mol/L香兰素在聚L-半胱氨酸修饰电极上的峰电位与pH的关系曲线Fig.9 EffectofpHonpeak potentialsfor8.0×10-5mol/LVanillin onthesurfaceofpoly-L-lysine aminoacidmodifiedelectrode
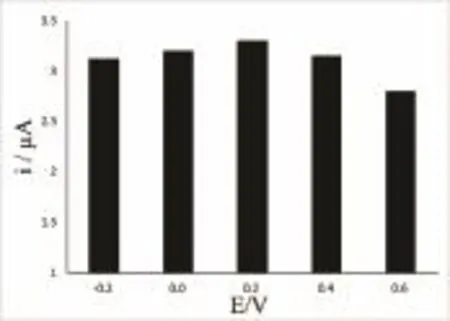
图10 低电位的影响Fig.10 Effect of low potential
改变高电位进行实验,设定低电位为0.2 V。结果表明:当高电位1.0 V时,香兰素在修饰电极上的响应电流最大(如图11所示)。
所以本实验选择的电位范围为:0.2~1.0 V。
2.3.3最佳测定扫描速率的选择
改变扫描速率进行实验,结果表明,氧化峰电流与扫描速率的大小呈线性关系(图12),其线性回归方程为ipa=1.62×10-6-1.25×10-5v,r=0.996 7,说明香兰素在修饰电极上的电极过程为吸附过程。随扫描速率的增加,峰电流增加(图13)。在扫描速度为0.10 V/s时,峰形最好,故本实验选用扫描速率为0.10 V/s。
2.3.4最佳测定搅拌时间的选择
由于香兰素吸附在电极表面,搅拌时间对峰电流有较大影响。改变搅拌时间t,对8.0×10-5mol/L的香兰素进行测定。结果表明:峰电流的大小,随搅拌时间的增大,先增大后减小,在60 s时的氧化峰的数值达到最大(如图14所示)。因此选择60 s为最佳搅拌时间。
2.4工作曲线和稳定性
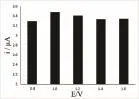
图11 高电位的影响Fig.11 Effect of high potential
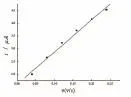
图12 扫描速率与氧化峰电流的关系曲线Fig.12 The relationship curves of the scan rate and the oxidation peak current
在最佳的实验条件下,用循环伏安法对香兰素进行测定(循环伏安曲线如图15),香兰素在1.2×10-5~1.2×10-4mol/L的浓度范围内与氧化峰电流有良好的线性关系(如图16),其线性方程分别为:ipa(A)= 6.231×10-7+0.043 C,相关系数为:R1=0.998 9,检出限:8.0×10-7mol/L。
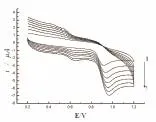
图13 扫描速率与氧化峰电流的关系曲线(1-7为扫描速率0.04,0.08,0.12,0.16,0.20,0.24,0.28 v/s)Fig.13 The relationship curves of the scan rate and the oxidation peak current(the scan rate of 1-7:0.04,0.08,0.12,0.16,0.20,0.24,0.28 v/s)

图14 搅拌时间的影响Fig.14 Effect of churning time

图15 最佳实验条件下聚L-半胱氨酸在浓度香兰素中的循环伏安曲线Fig.15 CVs of poly-L-cysteine in the concentration of 1.2×10-5-1.2×10-4mol/L vanillin under the optimum conditions
2.5干扰实验
在上述实验条件下,允许相对误差在±5%范围,对于8.0×10-5mol/L的香兰素,用浓度为香兰素浓度60倍的Na+,K+,柠檬酸,Cu2+,维生素(B6、B12),Ca2+,Mg2+,Zn2+,不干扰测定;60倍的Fe3+和蔗糖对于测定有一定的干扰性,但影响并不大。
2.6回收率的测定
取10.00 g的添加有香兰素的奶糖研碎,用15 mL无水乙醇溶解,溶解后转入布式漏斗中抽滤,再加15 mL无水乙醇清洗滤渣,最后转移至50 mL容量瓶中,加水定容至刻度线,摇匀备用。取6 mL,进行回收率测定,平行实验3次,结果见表1。

图16 香兰素的浓度与氧化峰电流的关系曲线Fig.16 The relationship curves of vanillin concentration and oxidation peak current
3 结论
经实验测定,最佳聚合条件为:浓度为2.00×10-4mol/L,pH=4.0,扫描段数为20段,扫描速率为0.08 V/s,电位范围为0.00~1.0 V。在此条件下,可制得最佳聚L-半胱氨酸修饰电极。最佳测定条件为:pH=2.2,电位范围0.20~1.0 V,扫描速率为0.10 V/s,搅拌时间为60 s;在此条件下,用聚L-半胱氨酸修饰电极可准确地测量食品中香兰素的含量。

表1 样品中香兰素的测定结果(次数n=6)Tab.1 The determination results of vanillin in the sample(n=6)
[1]宋小平,韩长日.香料与食品添加剂制造技术[M].北京:科学技术文献出版社,2000.
[2]OHASHI M,OMAE H,HASHIDA M,et al.Determination of vanillin and related flavor compounds in cocoa drink by capillary electrophoresis[J].Journal of Chromatography A,2007,1 138(1/2):262-267.
[3]李士炼.香兰素的生物转化与提取工艺研究[D].天津:天津科技大学,2005.
[4]ŠTĚRBOVÁ D,MATĚJÍCEK D,VLCEK J,et al.Combined microwave assisted isolation and solid phase purification procedures prior to the chromatographic determination of phenolic compounds in plant materials[J].Anal Chim Acta,2004,513(2):435-444.
[5]张国文,倪永年.多元校正-光度法同时测定食品中的香兰素和乙基麦芽酚[J].分析科学学报,2005,21(1):20-23.
[6]LOPEZ R,AZNAR M,CACHO J,et al.Determination of minor and trace volatile compounds in wine by solid phase extraction and gas chromatography with mass spectrometric detection[J].Journal of Chromatography A,2002,966(1/2):167-177.
[7]邱萍,倪永年.微分脉冲溶出伏安法测定食品中的香兰素[J].南昌大学学报:理科版,2002,26(2):124-127.
[8]李建平,吉庆刚.香兰素亚硝基化合物极谱波特征及应用[J].桂林工学院学报,1998,18(1):69-72.
[9]刘根,赵庆侠,孙登明.化学修饰电极循环伏安法测定药物和果蔬中抗坏血酸[J].淮北师范大学学报:自然科学版,2013,34(1):22-27.
[10]陈立新,李心恬,方红,等.离子液体修饰碳糊电极测定食品中香草醛[J].现代食品科技,2013,29(3):629-632.
[11]吕昱,杜海军,纪少凡,等.香兰素在电活化玻碳电极上的电化学行为及其伏安法测定[J].分析科学学报,2013,29(4):543-546.
[12]马心英,陈美凤,李方珍.聚缬氨酸修饰电极伏安法测定曲酸[J].食品与发酵工业,2014,40(1):207-211.
[13]王丽然,李书国.碳纳米管修饰电极法测定蔬菜中的亚硝酸盐[J].食品工业,2014,35(4):215-218.
[14]孙章华,陈美凤,尹明静,等.聚甘氨酸修饰电极测定食品中的诱惑红[J].食品与发酵工业,2014,40(12):185-189.
[15]TIMOTHEOU-POTAMIA M,CALOKERINOS A C.Chemiluminometric determination of vanillin in commercial vanillin products[J].Talanta,2007,71:208-212.
Poly(L-Cysteine)Modified Electrode for Determination of Vanillin in Food
CHI Yu-feng1,2,QU You-le1,SHI Jing3
(1.Food and Pharmaceutic School of Zhejiang Ocean University,Zhoushan316022;2.Zhejiang Hailisheng Pharmaceutical Co Ltd,Zhoushan316021;3.Zhoushan Institute for Food and Drug Control,Zhoushan 316021,China)
The poly(L-Cysteine)modified electrodes were prepared using cyclic voltammetry.The electrochemical behavior of vanillin on the poly(L-Cysteine)modified electrodes was studied.A new method to determine vanillin was established.The study results showed that in phosphate buffer solution pH=2.2,the linear range for the determination of vanillin was from 1.2×10-5to 1.2×10-4mol/L and the limit of detection was 8.0 ×10-7mol/L.Meanwhile the modified electrodes demonstrated excellent sensitivity,selectivity and stability.The medthod was applied to the determination of vanillin in chocolates with satisfactory results and will have a wider application prospect.
chemically modified electrode;Vanillin;L-Cysteine;cyclic voltammetry
O657.14
A
1008-830X(2016)02-0127-05
2015-12-20
国家自然科学基金(21276240/B06037)
迟玉峰(1977-),男,浙江舟山人,工程师,研究方向:药物分析.E-mail:zj_hls_chi@163.com
曲有乐(1960-),男,教授.E-mail:youle1960@163.com

