新疆药桑叶中1-脱氧野尻霉素定性及定量分析
孙莲,朱卫敏,何悦,李晓艳
(新疆医科大学 药学院 化学教研室,新疆 乌鲁木齐 830054)
·基础研究·
新疆药桑叶中1-脱氧野尻霉素定性及定量分析
孙莲*,朱卫敏,何悦,李晓艳
(新疆医科大学 药学院 化学教研室,新疆 乌鲁木齐 830054)
目的:建立新疆药桑叶中1-脱氧野尻霉素(DNJ)的TLC定性鉴别及HPLC定量分析方法。方法:以正丁醇-冰醋酸-水(4.5∶1.2∶1.2)为展开剂,在高效硅胶G薄层色谱板上展开,氯-联甲苯胺为显色剂。采用YMC-pack ODS-A色谱柱(250 mm×4.6 mm,5 μm),以甲醇(A)-0.1%醋酸水溶液(B)为流动相,等度洗脱(65%A,35%B),检测波长为263 nm,流速为1.0 mL·min-1。结果:新疆药桑叶中的DNJ在白光下检视,出现明显斑点,Rf值为0.41。DNJ的平均回收率为99.5%(RSD=1.3%),测得不同产地药桑叶中DNJ的含量为0.79~3.42 mg·g-1。结论:建立的方法简便、可行、灵敏、专属性强,重复性好,可用于新疆药桑叶的质量控制。
药桑叶;1-脱氧野尻霉素;薄层鉴别;高效液相色谱法
桑叶为桑科(Moraceae) 植物桑MorusalbaL.的干燥叶,异名铁扇子,始载于《神农本草经》,桑叶味甘、苦,性寒,归肺、肝经,具有疏散风热、清肺润燥的功能[1]。现代药理研究证明,桑叶具有明显的降血糖作用[2-4],其中的多羟基生物碱类是主要的降血糖成分之一,1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)为桑叶中多羟基生物碱的一种特征性成分,是一种糖苷酶抑制剂[5-7]。新疆药桑MorusnigraLinn主产于南疆的和田、喀什、阿克苏等地区,是新疆具有的一个独特的桑品种,也
具有极大的药用价值。目前,还无新疆药桑叶的质量标准,现行的桑叶质量标准中只有芦丁的定性及定量研究,缺乏专属性成分的定性及定量分析。我们对新疆药桑叶中的黄酮类、γ-氨基丁酸等有效成分进行了定性定量分析,并对药桑叶中的黄酮类及多糖进行抗氧化及降血糖活性的研究[8-9]。本实验采用薄层色谱法对药桑叶中的专属性成分DNJ进行定性鉴别,采用高效液相色谱法对其进行含量测定[10-13],为新疆药桑叶质量标准的建立提供科学依据。
1 仪器与试药
1.1 仪器
Agilent1220高效液相色谱仪(Agilent,美国);LINOMAT 5半自动点样仪(CAMAG),REPROSTAR 3薄层色谱数码成像系统(CAMAG)。
1.2材料
1-脱氧野尻霉素(DNJ,成都曼思特生物科技有限公司,批号:MUST-15022702),氯-联甲苯胺(上海源叶生物科技有限公司,批号:119-93-7),芴甲氧羰酰氯(FMOC-Cl,SIGMA-ALDAICH,批号:28920-43-6),甘氨酸(天津光复精细化工研究所,批号:20120319),硼砂、硼酸、乙腈、甲醇、冰醋酸为优级纯;碘化钾、次氯酸、冰乙酸、无水乙醇、正丁醇、甲醇、乙酸乙酯、三氯甲烷均为分析纯,硅胶H色谱板、硅胶G色谱板、高效硅胶G色谱板、硅胶GF254色谱板、高效硅胶GF254色谱板(青岛海洋化工分厂)。
10批药桑叶采自于新疆南疆不同地区(喀什市、和田市、库尔勒市、阿克苏市、和田县、疏勒县、阿克苏沙雅县、喀什莎车县、和田洛浦县、库尔勒恰尔巴格乡),经新疆医科大学药学院帕丽达·阿不力孜教授鉴定为桑科植物药桑的叶。
2 方法
2.1 薄层鉴别
2.1.1 溶液的配制
2.1.1.1 供试品溶液的制备 精密称取过40目筛的干燥药桑叶粉2.0 g,置于100 mL的锥形瓶中,加入0.05 mol·L-1HCl溶液40 mL,超声提取20 min,离心分离10 min,抽滤,滤液浓缩至5 mL,用0.05 mol·L-1的HCl溶液定容至10 mL容量瓶中,摇匀,得薄层色谱用供试品溶液。
2.1.1.2 对照品溶液的制备 精密称取DNJ对照品5.97 mg于5 mL容量瓶中,用0.05 mol·L-1的HCl溶液定容至刻度,得1.19 mg·mL-1的DNJ对照品储备液。再精密量取0.84 mL 的DNJ对照品储备液,用0.05 mol·L-1的HCl溶液定容至10 mL容量瓶中,得0.1 mg·mL-1的DNJ对照品溶液。
2.1.1.3 显色剂的配制 ①1%三氯化铝溶液:称取1 g的三氯化铝,置于100 mL的容量瓶中,用95%乙醇定容至刻度,得1%三氯化铝溶液。②0.2%的茚三酮溶液:称取0.2 g茚三酮,溶于5 mL冰乙酸和95 mL正丁醇中,摇匀,可得0.2%的茚三酮溶液。③氯-联甲苯胺溶液:准确称取32.0 mg的氯-联甲苯胺,溶于3 mL的冰醋酸中,用水稀释到50 mL,用时与0.4%碘化钾溶液混合(1∶1,V/V)。
2.1.2 展开系统的选择 分别吸取DNJ对照品溶液6 μL及药桑叶样品1 μL,点于高效硅胶G色谱板上,分别置于三氯甲烷-甲醇-水(5∶4.5∶1)、正丁醇-冰醋酸-水(4∶1∶1)、乙酸乙酯-无水乙醇(2∶8)及正丁醇-冰醋酸-水(4.5∶1.2∶1.2)等不同展开剂中展开,取出,自然晾干,喷以氯-联甲苯胺显色,白光下检视。
2.1.3 不同显色方法的选择 分别吸取DNJ对照品溶液6 μL及桑叶样品1 μL,点于高效硅胶G色谱板上,以正丁醇-冰乙酸-水(4.5∶1.2∶1.2)为展开剂展开,取出,自然晾干,分别喷以1%三氯化铝溶液、0.2%茚三酮溶液、氯-联甲苯胺溶液显色剂显色,白光下检视,考察不同显色剂的显色效果。
2.1.4 不同薄层色谱板的选择 分别吸取DNJ对照品溶液6 μL及药桑叶样品1 μL,点于高效硅胶G色谱板、硅胶G色谱板、硅胶H色谱板、硅胶GF254色谱板、高效硅胶GF254色谱板等不同薄层色谱板上,以正丁醇-冰乙酸-水(4.5∶1.2∶1.2)为展开剂展开,取出,自然晾干,喷以氯-联甲苯胺显色,白光下检视。
2.1.5 不同点样量的选择 分别吸取DNJ对照品溶液2、4、6 μL及样品溶液1、2、4 μL,点在高效硅胶G色谱板上,以正丁醇-冰乙酸-水(4.5∶1.2∶1.2)为展开剂展开,喷以氯-联甲苯胺溶液显色,白光下检视。
2.1.6 验证性实验 分别吸取新疆不同地区药桑叶样品1 μL及DNJ对照品溶液6 μL点于同一块高效硅胶G色谱板上,以正丁醇-冰乙酸-水(4.5∶1.2∶1.2)为展开剂展开,取出,自然晾干,喷以氯-联甲苯胺显色,白光下检视。
2.2 HPLC测定药桑叶中DNJ的含量
2.2.1色谱条件 YMC-pack ODS-A色谱柱(250 mm×4.6 mm,5 μm),流动相:甲醇(A)-0.1%醋酸水溶液(B);等度洗脱(0~30 min,65%A,35%B);流速:1.0 mL·min-1;柱温:室温;进样量:20 μL,检测波长:263 nm。
2.2.2 溶液的配制
2.2.2.1 供试品溶液的制备 精密称取药桑叶粉末2.000 0 g,置于100 mL的锥形瓶中,加入0.05 mol·L-1HCl溶液40 mL,超声提取两次,每次20 min,4 000 r·min-1下离心分离10 min,抽滤,滤液浓缩至5 mL,用0.05 mol·L-1的HCl溶液定容至25 mL容量瓶中,得供试品溶液,用时过0.22 μm的微孔滤膜。
2.2.2.2 对照品溶液的制备 精密称取DNJ对照品5.97 mg,置于5 mL的容量瓶中,用0.05 mol·L-1的HCl溶液定容至刻度,得1.19 mg·mL-1的DNJ对照品储备液。
2.2.3 DNJ对照品溶液的衍生化 将50 μL的硼酸盐缓冲液(pH=8.5)与50 μL的DNJ对照溶液混合,向其中加入5 mmol·L-1FMOC-Cl乙腈溶液100 μL,混匀,20 ℃水浴中加热20 min,再加入 0.1 mol·L-1甘氨酸溶液50 μL,终止反应,将其转移到5 mL容量瓶中,用0.1%醋酸溶液定容至刻度,摇匀,过0.22 μm微孔滤膜。
2.2.4 方法学考察
2.2.4.1精密度试验 分别配制高、中、低3个浓度DNJ对照品溶液各3份,按上述色谱条件测定其峰面积的RSD。
2.2.4.2 稳定性试验 取同一供试品溶液,分别在0、2、4、6、12、24 h进样,按选定的色谱条件测定含量的RSD。
2.2.4.3 重复性试验 取喀什地区药桑叶样品6份,按2.2.2.1项制备供试品溶液,并按2.2.3项下衍生化,分别进样10 μL,计算峰面积的RSD。
2.2.4.4 加样回收率试验 精密称取已知含量的同批样品2.0 g,共9份,分别按样品量的80%、100%、120%加入对照品溶液,按2.2.2.1项制备供试品溶液,并按2.2.3项下衍生化后,在上述色谱条件下测定,计算回收率。
2.2.4.5 线性关系的考察及检测限 分别吸取2.0、2.5、7.5、12.5、25、30 μL 的DNJ对照品储备液(1.19 mg· mL-1)于6个5 mL的容量瓶中,按2.2.3项下衍生化后,用0.05 mol·L-1的HCl溶液定容至刻度,摇匀,测定峰面积,以对照品的浓度(X)为横坐标,峰面积(Y)为纵坐标,进行回归分析。将1.19 mg·mL-1的DNJ对照品储备液逐级稀释后,在上述选定的色谱条件下进行测定,按3倍信噪比计算
检测下限。
2.2.5 样品含量测定 精密称取10批不同产地的药桑叶样品2.000 0 g,各3份,按2.2.2.1项下方法制备供试品溶液,并按2.2.3项下的方法将其衍生化,在上述色谱条件下,分别进样20 μL,记录峰面积,带入回归方程计算含量。
3 结果与讨论
3.1 薄层鉴别
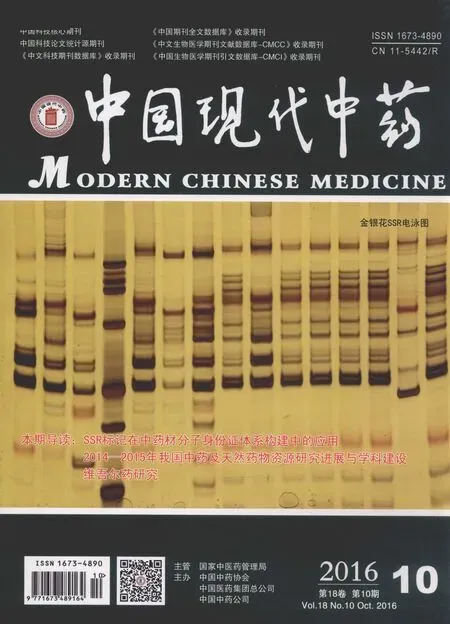
3.1.1 展开系统的选择 以不同的展开剂展开后的结果见图1,可以看出,以三氯甲烷-甲醇-水(5∶4.5∶1)为展开剂时,样品中的斑点分离的不好,点的清晰度不够;以乙酸乙酯-无水乙醇(2∶8)为展开剂时,有明显的拖尾现象;以正丁醇-冰乙酸-水(4∶1∶1)为展开剂时,对照品DNJ的斑点模糊;只有以正丁醇-冰乙酸-水(4.5∶1.2∶1.2)为展开剂时,斑点圆整,各个斑点的分离效果较好,DNJ的Rf值为0.41,故本实验选用正丁醇-冰乙酸-水(4.5∶1.2∶1.2)为展开剂。
注:A.三氯甲烷-甲醇-水(5∶4.5∶1);B.乙酸乙酯-无水乙醇(2∶8); C.正丁醇-冰醋酸-水(4∶1∶1);D.正丁醇-冰醋酸-水(4.5∶1.2∶1.2); 1.DNJ对照品溶液;2.样品。图1 药桑叶薄层鉴别不同展开剂的考察
3.1.2 不同显色方法的选择 实验结果表明,以三氯化铝溶液为显色剂时,薄层色谱板上几乎无斑点;以0.2%茚三酮溶液为显色剂时,样品处有斑点出现,但为药桑叶中的氨基酸,DNJ对照品处无斑点;以氯-联甲苯胺溶液为显色剂时,显色效果较明显,样品的分离情况也较好,故选择氯-联甲苯胺溶液为显色剂。
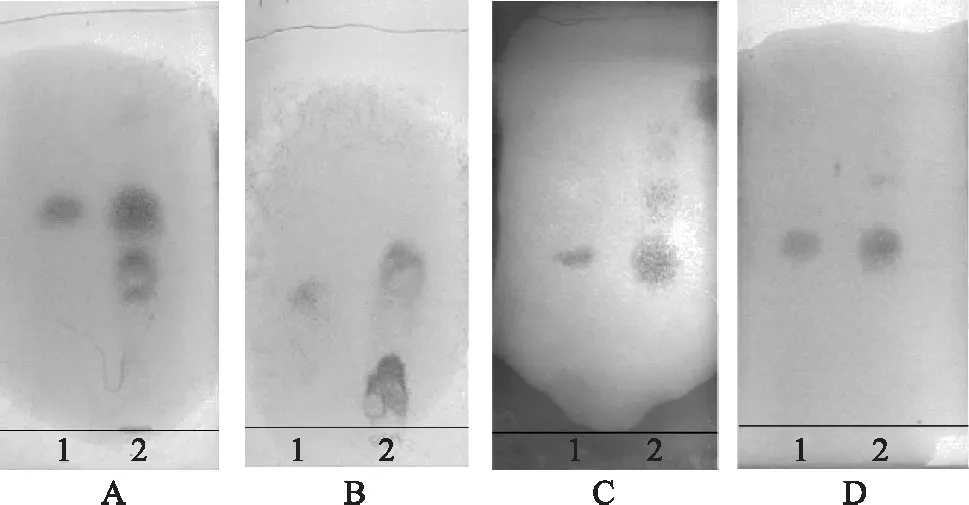
3.1.3 不同薄层色谱板的选择 以正丁醇-冰乙酸-水(4.5∶1.2∶1.2)为展开剂,分别在高效硅胶G色谱板、硅胶G色谱板、硅胶H色谱板、硅胶GF254色谱板及高效硅胶GF254色谱板等不同薄层色谱板上展开的结果见图2。
注:A.硅胶GF254色谱板;B.高效硅胶GF254色谱板;C.硅胶G色谱板;D.硅胶H色谱板; E.高效硅胶G色谱板;1.DNJ对照品溶液;2.样品。图2 药桑叶薄层鉴别不同薄层色谱板的考察
由图2可知,硅胶GF254色谱板所分离的斑点清晰度不够,且分离效果不好;高效硅胶GF254色谱板上,对照品与样品所得到DNJ斑点的Rf值有偏差;硅胶H色谱板得到的斑点不清晰;硅胶G色谱板与高效硅胶G色谱板分离效果都较好,相比较之下,高效硅胶G色谱板上斑点的分离度及清晰度都较优,故本实验选择高效硅胶G色谱板为薄层色谱板。
3.1.4 不同点样量的选择 不同点样量的结果表明,DNJ对照品的最佳点样量为6 μL,样品最佳点样量为1 μL。
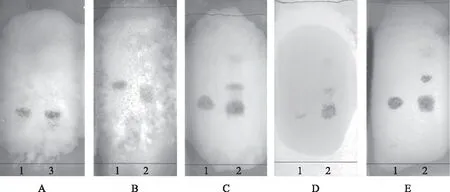
3.1.5 验证性实验 验证性实验的结果见图3。结果表明,白光下,10批药桑叶供试品薄层色谱中,在与对照品DNJ相应的位置上,均能出现Rf值相同的灰蓝色斑点,且分离度好、斑点清晰,可作为药桑叶定性鉴别指标。
注:1.DNJ对照品;2.喀什市样品;3.和田市样品;4.库尔勒市样品;5.阿克苏市样品;6.和田县样品;7.疏勒县样品;8.阿克苏沙雅县样品;9.喀什莎车县样品;10.和田洛浦县样品;11.库尔勒恰尔巴格乡样品。图3 药桑叶薄层鉴别验证性实验
3.2 HPLC测定桑叶中DNJ的含量
3.2.1 色谱条件 在上述色谱条件下的色谱图如图4所示。
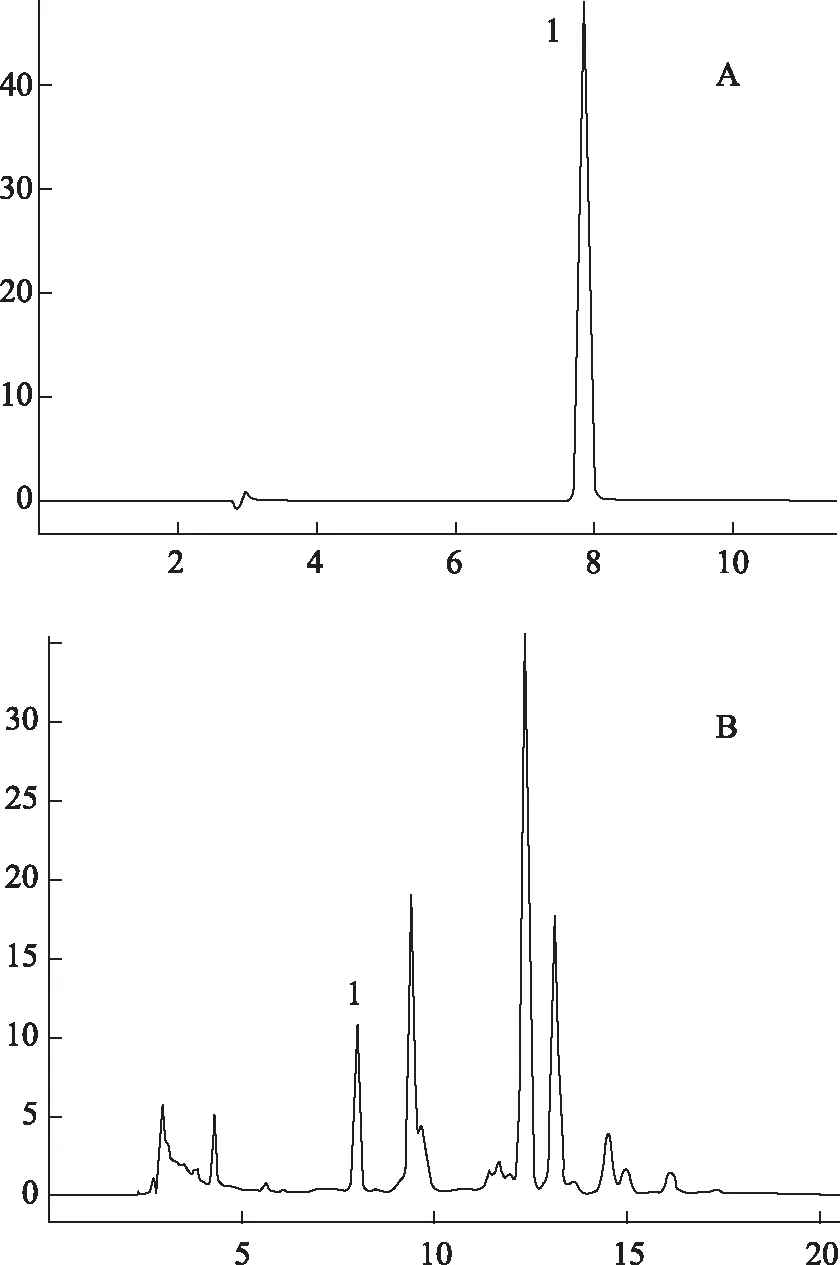
注:A.1-脱氧野尻霉素对照品;B.样品;1.DNJ。图4 药桑叶及对照品HPLC图
3.2.2 方法学考察
3.2.2.1 精密度及稳定性试验结果 精密度的测定结果为:峰面积的RSD值均<2.0%。稳定性试验结果:DNJ衍生产物含量的RSD=1.2%,说明供试品在24 h内稳定。
3.2.2.2 重复性试验 结果表明样品中DNJ衍生产物峰面积的RSD=1.4%。
3.2.2.3 回收率试验 加样回收试验的结果见表1。
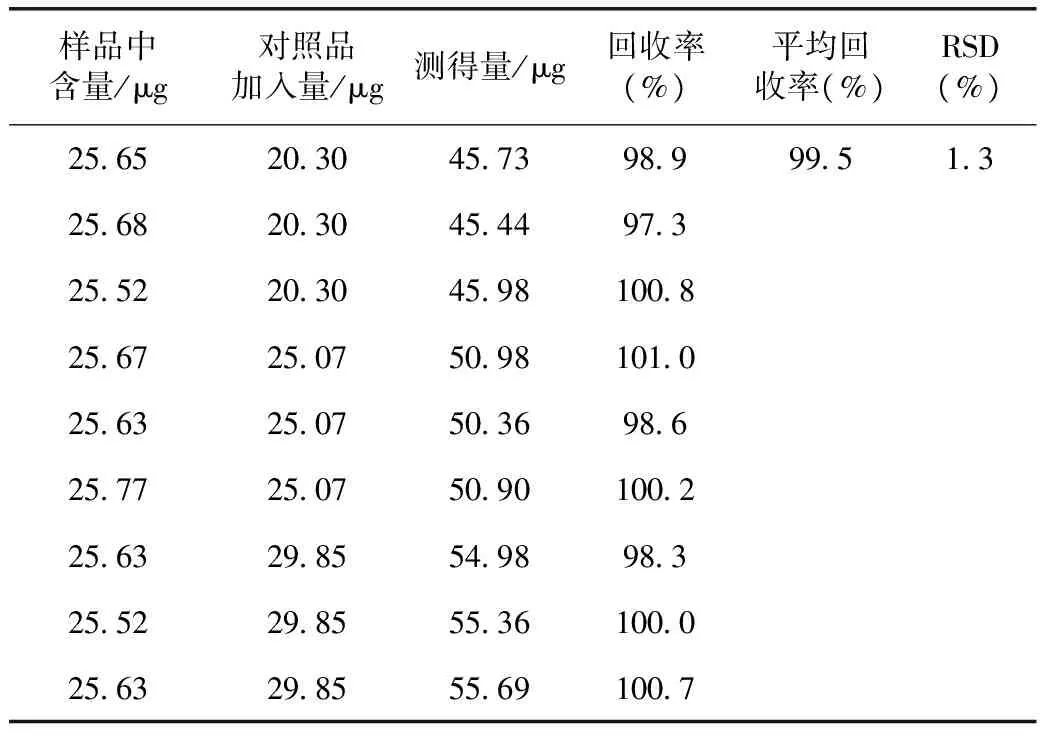
表1 药桑叶中1-脱氧野尻霉素回收率试验结果
3.2.2.4 线性关系的考察及检测限 将测得峰面积(Y)与浓度(X)经回归处理后,得标准曲线为Y=59.97X-5.792 7,r=0.999 6,线性范围为0.478~7.164 μg·mL-1。测得DNJ的检测下限为0.06 mg·L-1。
3.2.3 样品含量测定 10批样品中DNJ的含量测定结果见表2。
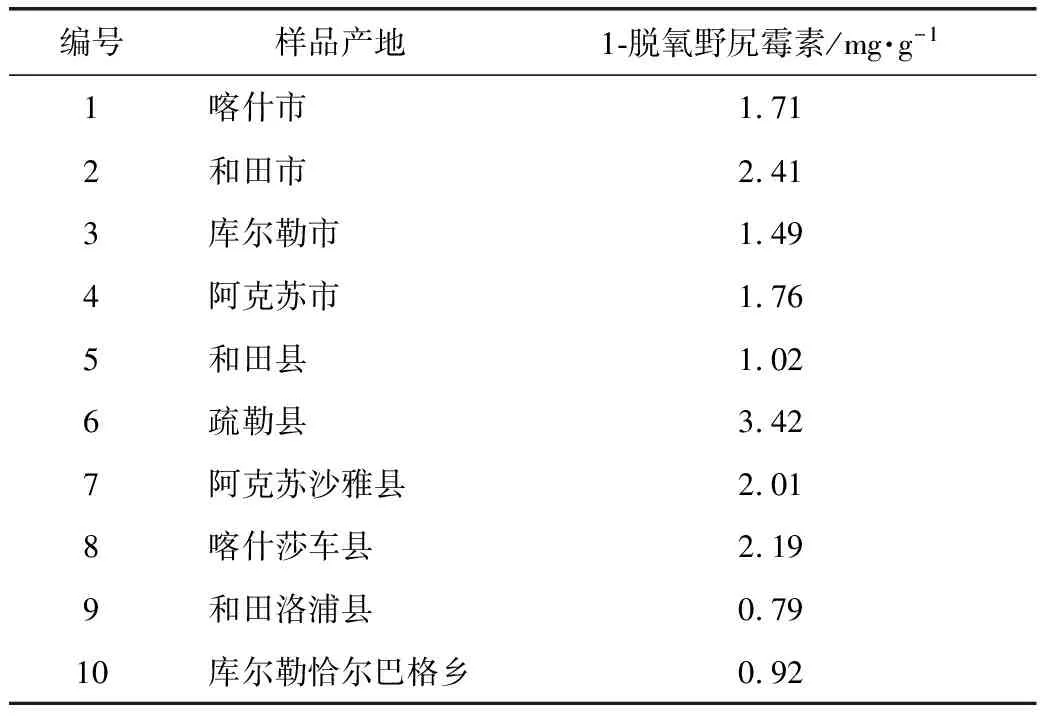
表2 10批药桑叶样品中1-脱氧野尻霉素的含量测定结果
测得10批药桑叶中DNJ的含量有差异,疏勒县的药桑叶中DNJ的含量最高,可达3.42 mg·g-1,而和田洛浦的最低,为0.79 mg·g-1,由此可见,有必要对药桑叶的质量进行控制。
本实验选择了不同浓度的盐酸溶液(0.01、0.03、0.05、0.07、0.1 mol·L-1)为提取溶剂,试验了不同的超声提取时间(10、20、30、40、50 min)及提取次数(1、2、3次)对DNJ提取效果的影响,选择的最佳提取条件是:0.01 mol·L-1盐酸溶液为提取溶剂,超声提取2次,每次20 min。
实验建立的方法简便、可行、灵敏、专属性强,重复性好,可用于新疆药桑叶的质量控制。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2015:297-298.
[2] 孟庆海,殷秋忆,郭静,等.4种不同桑叶提取物降血糖作用的筛选[J].中成药,2014,36(6):1288-1291.
[3] 吕欢,罗明睇,方飞,等.桑叶提取物抑制α-葡萄糖苷酶活性体系的优化及动力学研究[J].中药新药与临床药理,2012,23(1):42-44.
[4] 欧阳臻,陈钧.桑叶的化学成分及其药理作用研究进展[J].江苏大学学报(自然科学版),2003,24(6):76-77.
[5] 李有贵,储一宁,钟石,等.59份野生桑桑叶中的DNJ含量及粗提物对甜糖苷酶的抑制活性[J].蚕业科学,2010,36(5):0729-0737.
[6] 曹旭,欧阳臻,赵明,等.桑叶总生物碱中的1-脱氧野尻霉素在大鼠体内的药物动力学研究[J].中药新药与临床药理,2012,23(4):449-452.
[7] 颜继忠,雷伟,李行诺,等.桑叶中降血糖组分1-脱氧野尻霉素的富集与纯化研究[J].浙江工业大学学报,2013,41(3):241-243.
[8] 孙莲,李玲,阿布都许库尔·吐尔逊,等.药桑叶中黄酮类物质的薄层色谱鉴别、活性筛选及含量测定的研究[J].化学研究与应用,2015,27(3):268-273.
[9] 孙莲,于小蓉,孟磊.新疆药桑叶多糖的分离纯化及结构研究[J].化学研究与应用,2014,26(8):1282-1286.
[10] 刘凡,李平平,廖森泰,等.98份不同桑树品种资源的桑叶总生物碱及1-脱氧野尻霉素含量测定[J].蚕业科学,2012,38(2):0185-0191.
[11] 尚磊,欧阳臻,赵明,等.HPLC-MS-MS分析桑叶总生物碱组成及含量[J].中国实验方剂学杂志,2014,21(2):20.
[12] 李凡,裘雅渔,钱文春,等.桑叶中总生物碱和1-脱氧野尻霉素的含量考察[J].中国药学杂志,2008,43(3):176-179.
[13] 刘韦錾,赵骏,曾森,等.桑叶总生物碱中l-脱氧野尻霉素测定及方法学考察[J]. 天津中医药,2010,27(2):172-173.
QualitativeandQuantitativeAnalysisof1-DeoxynojirimycininMorusnigraLeavesofXinjiang
SUN Lian*,ZHU Weimin,HE Yue,LI Xiaoyan
(DepartmentofChemistryofPharmacyCollegeofXinjiangMedicalUniversity,Urumqi830011,China)
Objective:To establish a TLC identification and a HPLC quantitative analysis methods of 1-deoxynojirimycin (DNJ) inMorusnigraleaves of Xinjiang.Methods:DNJ was developed on efficient silica gel G plate using n-butanol-acetic acid-water (4.5∶1.2∶1.2) as a developing system,chloro-o-toluidine was used as a chromogenic reagent.The content determination was performed on a YMC pack ODS column (250 mm×4.6 mm,5 μm) with methanol-0.1% acetic acid solution as the mobile phase,isocratic elution(65%A,35%B),detection wavelength was 263 nm,and the flow rate was 1.0 mL · min-1.Results:Obvious spots of DNJ appeared under natural light,its Rf = 0.41,the average recovery of DNJ of HPLC was 99.5%(RSD=1.3%),and the content of DNJ from different area’sM.nigraleaves were 0.79 ~ 3.42 mg·g-1.Conclusion:The established method is simple,practical,sensitive,specific and reproducible,which can be used as a quality control ofM.nigraleaves.
Morusnigraleaves;1-deoxynojirimycin (DNJ);TLC;HPLC
10.13313/j.issn.1673-4890.2016.10.011
2016-01-18)
*
孙莲,教授,研究方向:药物分析;E-mail:sl_yxy@126.com